纳米花固定化蔗糖酶的研究
崔诗琦, 姜晓冬, 王世杰, 王红英, 钱斯日古楞
(大连工业大学生物工程学院, 大连 116034)
蔗糖酶(Sucrase)被广泛应用于食品和化工行业,是最常用的生物酶类之一[1]。蔗糖酶可将蔗糖水解成葡萄糖和果糖[2],产生的果糖甜度高,不易结晶,因此非结晶糖浆生产过程中使用蔗糖酶是其最重要的应用之一[3-4]。但蔗糖酶存在使用中容易失活,稳定性较差,难以回收等缺点[5]。
固定化技术[6]采用物理或化学手段,将酶固定在载体上,保持酶活性的同时,提高酶的稳定性和回收利用率[7]。纳米花固定化酶技术属于共价偶联法,是最近研究的热门领域[8]。无机杂化纳米花可以增加酶蛋白质的结构刚性,提高酶的稳定性,形成的特殊花瓣结构有利于酶的活性表现,因此,能够明显提高酶的活性[9-14]。Hua等[15]报道了一种脂肪酶杂化纳米花,其催化活性是游离脂肪酶的25倍;值得注意的是,经过20次循环使用后,脂肪酶杂化纳米花仍可用于催化反应,转化率达到90%。Ge等[16]发现,由 Cu2+与有机成分自组装构成的单酶-金属离子杂化纳米花固定化酶的活性和稳定性等均比以前明显提高。
1 材料与方法
1.1 材料
1.1.1 材料与试剂
蔗糖酶(8.13 U/mg)由大连工业大学生物工程实验室提供;3,5-二硝基水杨酸(分析纯)购自国药集团化学试剂有限公司;葡萄糖(分析纯)购自北京奥博星生物技术有限责任公司;四水合氯化锰(分析纯)购自西陇科学股份有限公司;其他试剂均为国产分析纯。
1.1.2 主要仪器
热场发射扫描电镜(日本电子,JSM-7800F);透射电镜(日本电子株式会社,JEM-2100);傅里叶红外光谱仪(美国PerkinElmer公司);X射线衍射仪(日本岛津,XRD-7000S);分光光度计(计梅特勒-托利多仪器)。
1.2 方法
1.2.1 蔗糖酶活力测定
葡萄糖标准曲线的绘制,以葡萄糖为标准物,采用3,5-二硝基水杨酸(DNS)法;回归方程式:Y=2.427 7X-0.062 6,R2=0.980 9。
将1 mL待测酶溶液与10 mL 10%的蔗糖溶液(pH 6.0的磷酸缓冲液配制)混合,在30 ℃水浴中准确反应10 min,得到水解液;量取0.5 mL水解液和1.5 mL DNS试剂与1.5 mL去离子水混合,在沸水中反应5 min以上;冷却后用去离子水定容至25 mL,并在540 nm处测定其吸光值;未加水解液的做空白对照[17]。
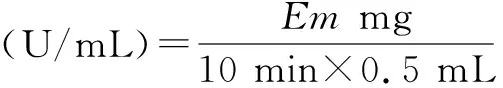
其中,Em为标准曲线对应540 nm吸光值上读出的葡萄糖质量,单位为mg。
酶活定义:在pH 6.0、30 ℃条件下,每分钟水解产生1 μmol还原糖的酶量为一个酶活力单位(U/mL)。
1.2.2 Sucrase@Mn3(PO4)2制备
将一定量的酶液用60 mmol/L PBS溶液(pH 7.4)溶解,与一定量的0.5 mg/mL MnCl2溶液混匀后在一定温度条件下静置反应;反应液在6 000 r/min条件下离心10 min;弃上清液,沉淀用去离子水冲洗3次,冷冻干燥后获得粉末状固定化酶[18]。
1.2.3 Sucrase@Mn3(PO4)2制备条件优化
(1)最适酶添加量。固定化酶制备中设定0.25、0.75、1、2、3 mL蔗糖酶溶液(0.1 mg/mL)添加量,分别与10 mL 0.01g/mL的MnCl2溶液和18 mL 10 mmol/L PBS缓冲液(pH 7.4)混合,并用去离子水定容至31 mL,在20 ℃条件下静置反应3 h,制备固定化酶;通过酶活比较,确定制备固定化酶的最适酶添加量。(2)最适PBS浓度。PBS溶液(pH 7.4)浓度分别设定为5、10、15、20、25 mmol/L,与1 mL蔗糖酶溶液(0.1 mg/mL)与10 mL 0.01g/mL 的MnCl2溶液混合,20 ℃条件下静置反应3 h,制备固定化酶;通过酶活比较,确定制备固定化酶的最适PBS浓度。(3)最适Mn2+质量浓度。Mn2+质量浓度分别设定为0.73、1.46、2.2、2.93、3.67 g/mL,与1 mL蔗糖酶溶液(0.1 mg/mL)和18 mL 10 mmol/L PBS缓冲液(pH 7.4)混合,20 ℃条件下静置反应3 h,制备固定化酶;通过酶活比较,确定制备固定化酶的最适Mn2+质量浓度。(4)最适pH值条件。PBS缓冲液(10 mmol/L)的pH值分别设定为5.4、6.4、7.4、8.4及9.4,与1 mL蔗糖酶溶液(0.1 mg/mL)和1.46 g/mL Mn2+溶液混合,20 ℃条件下静置反应3 h,制备固定化酶;通过酶活比较,确定制备固定化酶的最适pH值。(5)最适反应温度。将1 mL蔗糖酶(0.1 mg/mL)与1.46 g/mL Mn2+溶液、18 mL PBS缓冲液(pH 7.4、10 mmol/L)混合,分别在15、20、25、30和35 ℃温度下静置反应3 h,制备固定化酶;通过酶活比较,确定制备固定化酶的最适反应温度。(6)最适反应时间。将1 mL蔗糖酶(0.1 mg/mL)与1.46 g/mL Mn2+溶液、18 mL PBS缓冲液(pH 7.4、10 mmol/L)混合,在20 ℃条件下分别静置反应0.5、1、3、6、9 h,制备固定化酶;通过酶活比较,确定制备固定化酶的最适反应时间。
1.2.4 Sucrase@Mn3(PO4)2的形态及结构表征
采用SEM技术、TEM技术、红外光谱技术、X衍射技术和EDS能级色谱技术对制备的固定化酶形貌特征、成分特征、结构特征等进行表征。
1.2.5 Sucrase@Mn3(PO4)2的酶学性质
(1)温度变化对酶活的影响。固定化酶的活力分别在20、30、40、50和60 ℃条件下测定,通过比较酶活力,分析反应温度变化对酶活的影响,确定固定化酶的最适反应温度。(2)酸碱变化对酶活的影响。固定化酶的活力分别在pH 4、5、5.6、6、6.6、7、8条件下测定,通过比较酶活力,分析环境酸碱变化对酶活的影响,确定固定化酶的最适反应pH值。(3)固定化酶的热稳定性。将固定化酶分别在25、35、45、55和65 ℃条件下保温2 h,冷却后在30 ℃条件下测定酶活,比较酶活力,确定固定化酶的温度稳定性。(4)固定化酶的酸碱稳定性。将固定化酶分别在pH 4~11 BR缓冲液中4 ℃放置2 h,在30 ℃、pH 5条件下测定酶活,比较酶活力,确定固定化酶的酸碱稳定性。(5)固定化酶的重复利用率。将固定化酶在30 ℃、pH 5条件下重复测定酶活,比较和分析酶活变化,确定固定化酶的重复利用率。固定化酶的回收,采用6 000 r/min离心10 min与去离子水冲洗3次的方法。(6)固定化酶的储存稳定性。将固定化酶在4 ℃条件下保存28 d;期间每隔7 d测定1次酶活,比较和分析酶活变化,确定固定化酶的储存稳定性。
2 结果与分析
2.1 Sucrase@Mn3(PO4)2制备条件的优化
2.1.1 酶的添加量对固定化酶制备的影响
蔗糖酶添加量对Sucrase@Mn3(PO4)2制备的影响如图1所示。在添加设定范围内,当酶的添加量为1 mL(0.1 mg/mL)时,固定化酶活力达最高值;随后酶活力急剧下降,这是由于酶质量浓度增大,形成的纳米花结构紧密、花瓣收紧,不利于酶蛋白与底物接触反应。因此制备纳米花固定化蔗糖酶的最适酶添加量选定为1 mL。

图1 酶的添加量对固定化酶活力的影响Figure 1 Effect of enzyme addition on the activity of immobilized enzyme
2.1.2 PBS浓度对固定化酶制备的影响
PBS浓度对Sucrase@Mn3(PO4)2制备的影响如图2所示。PBS浓度在5~10 mmol/L范围内,固定化酶的活力随PBS浓度的增加而提高;当PBS浓度为10 mmol/L时酶活力达最高值,随后其活力缓慢下降,因此制备纳米花固定化蔗糖酶的最适PBS浓度选定为10 mmol/L。

图2 PBS浓度对固定化酶活力的影响Figure 2 Effect of PBS concentration on the activity of immobilized enzyme
2.1.3 Mn2+质量浓度对固定化酶制备的影响
Mn2+质量浓度对Sucrase@Mn3(PO4)2制备的影响如图3所示。Mn2+质量浓度为1.46 mg/mL时,固定化酶活力达最高值,随后活力持续下降,因此制备纳米花固定化蔗糖酶Mn2+的最佳添加质量浓度选定为1.46 mg/mL。

图3 Mn2+质量浓度对固定化酶活力的影响Figure 3 Effect of Mn2+ mass concentration on the activity of immobilized enzyme
2.1.4 pH值对固定化酶制备的影响
pH值的变化对Sucrase@Mn3(PO4)2制备的影响如图4所示。制备环境pH值由弱酸性变为中性时酶活力持续提高,到达pH 7.4时固定化酶活力达最高值,随后下降,最后选定pH 7.4为制备纳米花固定化蔗糖酶的最适pH值。
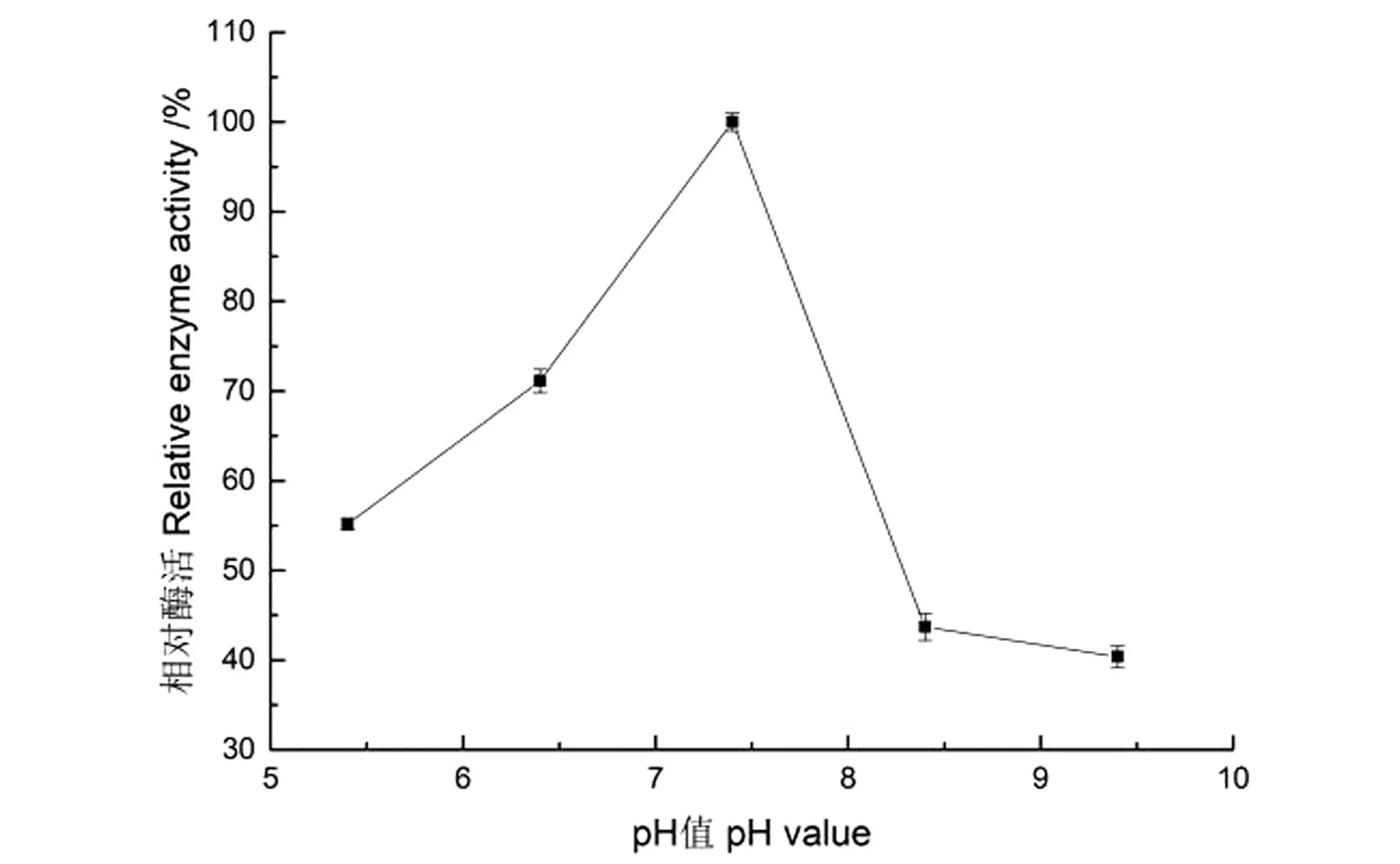
图4 pH值的变化对固定化酶活力的影响Figure 4 Effect of pH change on the activity of immobilized enzymes
2.1.5 反应温度对固定化酶制备的影响
反应温度对Sucrase@Mn3(PO4)2制备的影响如图5所示。随反应温度的提高,固定化酶活力提升,20 ℃时酶活力达最高值,随后其活力持续下降,因此,20 ℃为制备纳米花固定化蔗糖酶的最适反应温度。
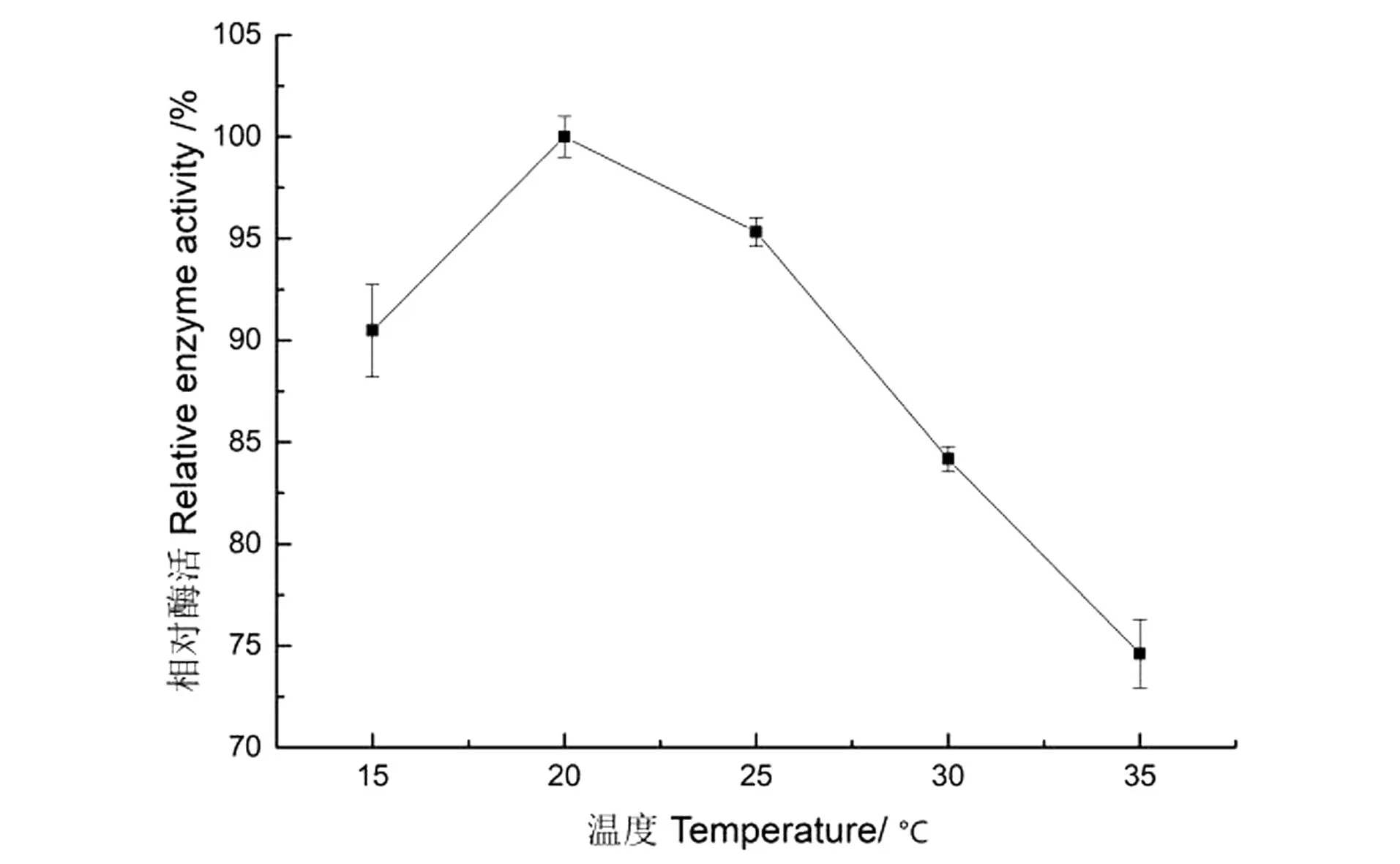
图5 反应温度对固定化酶活力的影响Figure 5 Effect of reaction temperature on the activity of immobilized enzyme
2.1.6 反应时间对固定化酶制备的影响
反应时间对Sucrase@Mn3(PO4)2制备的影响如图6所示。反应时间为1 h时,固定化蔗糖酶的活力达到最高值,此后随着制备时间的增加,其活力逐渐下降,因此选择反应时间1 h为制备固定化酶的最适反应时间。

图6 反应时间对固定化酶活力的影响Figure 6 Effect of reaction time on the activity of immobilized enzyme
2.2 Sucrase@Mn3(PO4)2的形态结构
2.2.1 微观形貌表征
通过 SEM技术和TEM技术对Sucrase@Mn3(PO4)2的形态结构进行表征,结果如图7所示。Sucrase@Mn3(PO4)2具有多级结构,构成的花瓣间紧密附着,结构均匀,分散性良好。以上结构特征增加了酶与底物的接触面积,并且对酶起支撑和保护作用,有利于酶活表现。

(a)2 000倍SEM图;(b)10 000倍SEM图;(c)3 000倍TEM图;(d)25 000倍TEM图。图7 Sucrase@Mn3(PO4)2的SEM图和TEM图Figure 7 SEM and TEM images of Sucrase@Mn3(PO4)2
2.2.2 EDS特征

图8 Sucrase@Mn3(PO4)2能级色谱图Figure 8 Sucrase @ Mn 3 (PO4) 2 energy level chromatogram
2.2.3 FT-IR吸收特征

图9 Sucrase@Mn3(PO4)2、Mn3(PO4)2和Sucrase的FT-IR光谱图Figure 9 The FT-IR spectrum of Sucrase @ Mn3 (PO4) 2, Mn3 (PO4) 2, and Sucrase
2.2.4 XRD分析
为探究固定化是否对纳米花晶型产生影响,利用XRD对Sucrase@Mn3(PO4)2晶体结构进行分析,结果如图10所示。Sucrase@Mn3(PO4)2与Mn3(PO4)2的标准卡片(JCPDS 03-0426)在2θ为25.94°、29.66°、34.33°等处的衍射峰相对应,强度也大致相同,表明固定化后纳米花晶体结构未发生变化,保持原有结晶度[20]。
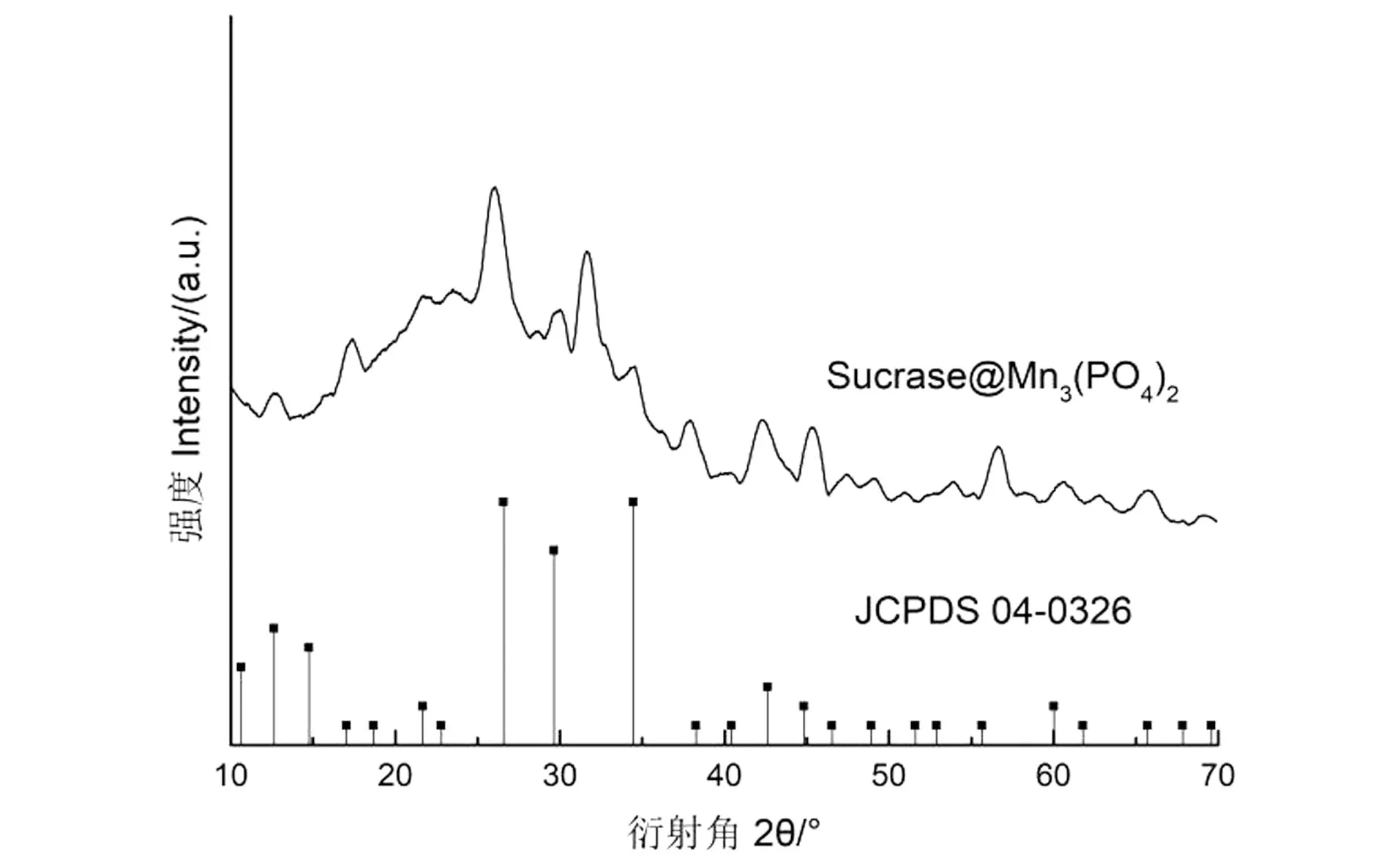
图10 Sucrase@Mn3(PO4)2的X衍射图Figure 10 The X diffraction pattern of Sucrase @ Mn3 (PO4) 2
2.3 Sucrase@Mn3(PO4)2的酶学性质
2.3.1 最适反应温度
反应温度对酶活的影响见图11。Sucrase@Mn3(PO4)2的活性在30 ℃时达到最高值,且比游离酶的提高5 ℃;随后其活力持续下降,但反应温度60 ℃时,固定化酶的活力仍保持其最高活力的近50%;因此确定30 ℃为Sucrase@Mn3(PO4)2的最适反应温度。
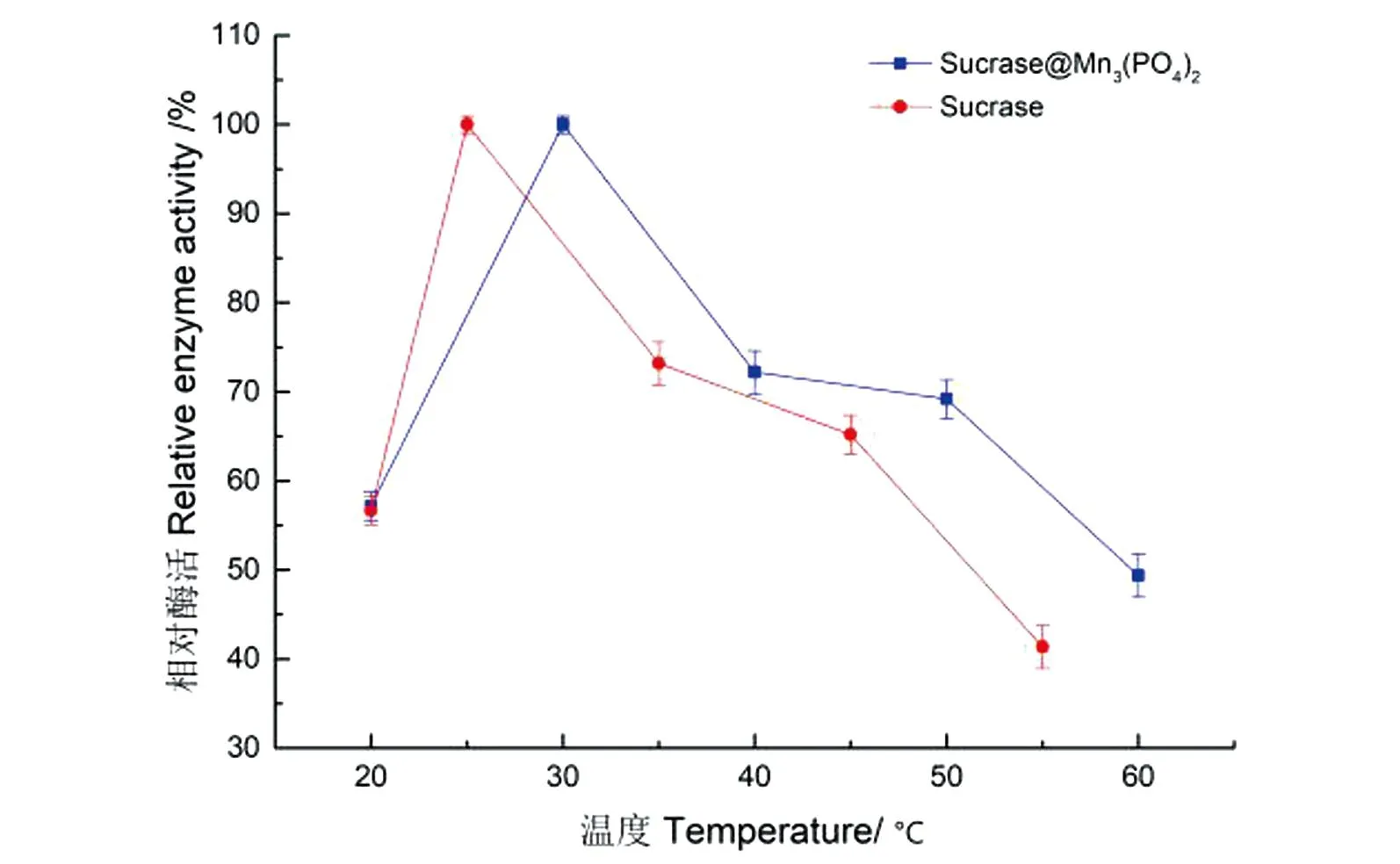
图11 固定化酶和游离酶的最适反应温度Figure 11 Optimal reaction temperature for the immobilized and free enzymes
2.3.2 最适反应pH值
反应pH值对酶活的影响如图12所示。纳米花Sucrase@Mn3(PO4)2的活性在pH 5时达到最高值,这比其游离酶的最适pH 6向酸性方向移位;在测定酸性条件下固定化酶均保持较高活性;最终确定pH 5为Sucrase@Mn3(PO4)2的最适反应pH值。

图12 固定化酶和游离酶的最适反应pH值Figure 12 Optimal reaction pH for immobilized and free enzymes
2.3.3 固定化酶的耐热稳定性
Sucrase@Mn3(PO4)2温度稳定性测定如图13所示。在测定25~65 ℃范围内,固定化酶和游离酶活力均有下降,但固定化酶的活力下降比游离酶的缓慢,且保持相对较高活力,表明纳米花固定化蔗糖酶表现出良好的热稳定性。

图13 固定化酶和游离酶的耐热稳定性Figure 13 Thermal stability of immobilized and free enzymes
2.3.4 固定化酶的酸碱稳定性
固定化酶的酸碱稳定性测定结果如图14所示。Sucrase@Mn3(PO4)2的活性在测定pH 4~11范围内均保持其最高活力的60%以上,说明Sucrase@Mn3(PO4)2表现出良好的酸碱稳定性;同时发现,蔗糖酶被纳米花固定化时其pH稳定性比其游离酶的提高一倍左右。

图14 固定化酶和游离酶的酸碱稳定性Figure 14 Acid-base stability of the immobilized and free enzymes
2.3.5 固定化酶的重复利用率
Sucrase@Mn3(PO4)2重复利用率结果如图15所示。固定化酶随利用次数的增加而其活力下降,但重复利用7次时其残余活力仍保持其初始活力的近40.38%,说明Sucrase@Mn3(PO4)2表现出较好的重复利用率。
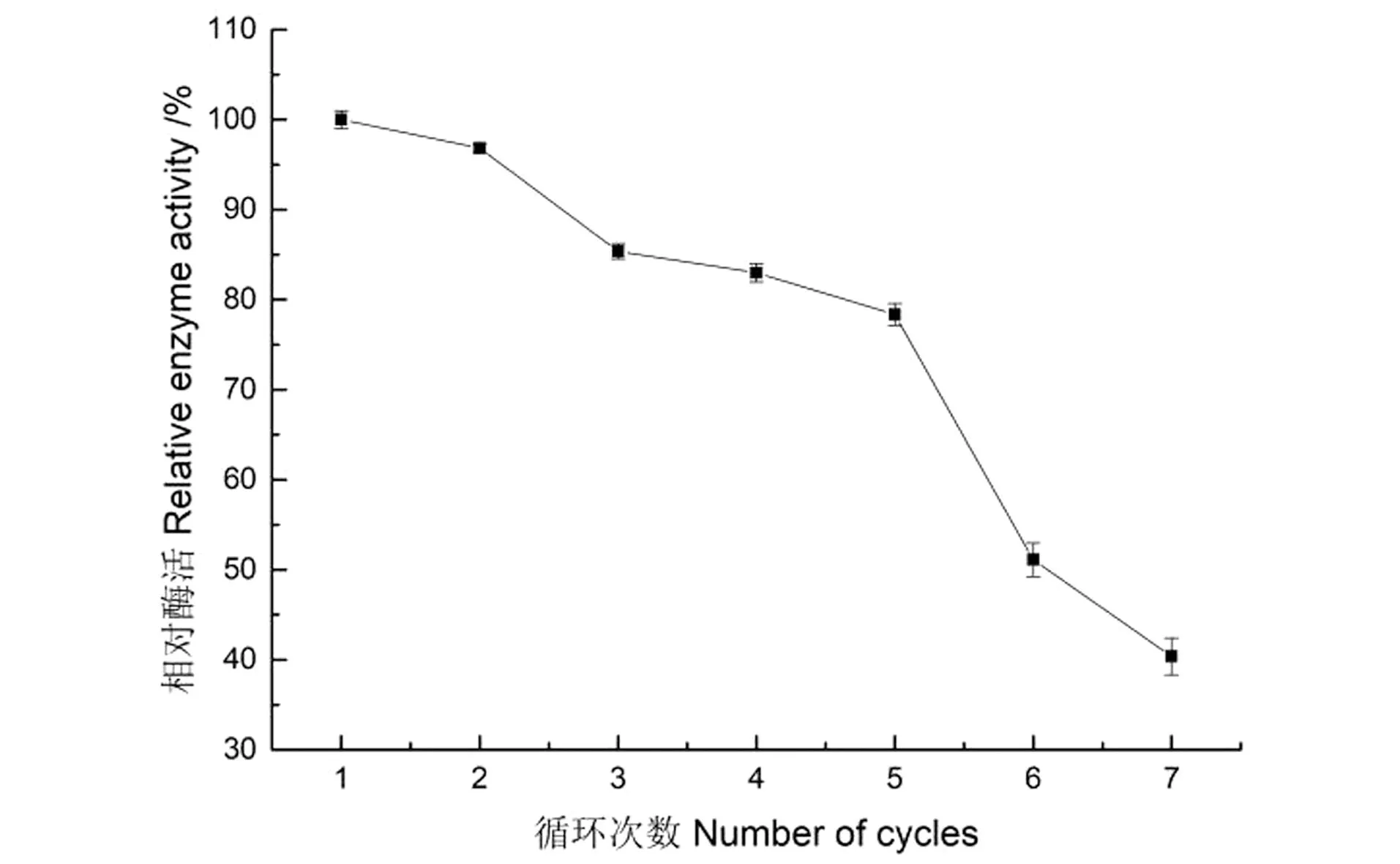
图15 固定化酶的重复利用率Figure 15 Reuse rate of immobilized enzyme
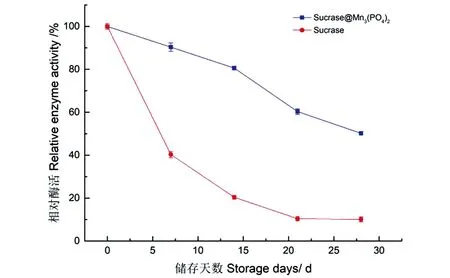
图16 固定化酶和游离酶的储存稳定性Figure 16 Storage stability of immobilized and free enzymes
2.3.6 固定化酶的储存稳定性
在4 ℃储存过程中,Sucrase@Mn3(PO4)2的酶活随储存时间的延长而下降,但活力下降速度要比其游离酶缓慢,在28 d时固定化酶的活力仍保持其初活力的50%以上,说明Sucrase@Mn3(PO4)2表现出良好的储存稳定性。
3 讨论
酶在工业化应用中表现出难以回收利用和稳定性差等缺点。纳米花固定化酶具有展开的花瓣结构,酶在花瓣上均匀分散分布,以上结构特征增加了比表面积,有利于酶与底物的接触,加强酶的空间构型,提高酶的催化活力及重复利用率等[21]。徐沁蕊[22]在固定化纤维二糖差向异构酶的研究中发现,酶质量浓度为0.10 mg/mL,Co2+浓度为1.6 mmol/L时制备的纳米花固定化酶的活力比其自由酶的提高了1.49倍;朱衡等[23]利用羧基载体LX-1000IDA对脂肪酶进行固定化,并重复利用4次时其活力仍保持最初活力的50%以上;彭开敏等[24]利用猪肝酯酶与磷酸钙制备的纳米花固定花酶重复利用6次后其活力仍保持最初活力的10%以上。本研究利用锰离子、磷酸根离子与蔗糖酶制备的纳米花固定化酶,其酶活力比游离酶的提高2.49倍;重复利用7次时,其活力仍保持最初活力的40%以上,这一结果与以上纳米花固定化酶研究结果一致。
尽管本研究成功制备了有机-无机杂化纳米花固定化蔗糖酶,且表现出较好的酶活性和重复利用率,但其热稳定性、酸碱稳定性等酶学性质仍有进一步提升的空间。未来需要对其他金属离子诱导组装[25]的蔗糖酶纳米花制备进行研究,并通过酶学性质、结构特性的比较,进一步解析固定化蔗糖酶纳米花形成的机制,从而强化蔗糖酶纳米花的酶学性质,提高蔗糖酶的使用性能。同时,未来可以针对蔗糖酶进行酶分子改造[26],提高其相关催化性能,强化纳米花酶的固定化率,提高酶活力等。
综上所述,本文利用锰离子、磷酸根离子与蔗糖酶制备的有机-无机杂化纳米花固定化酶,不仅制备成本低,过程绿色、高效,而且制备的固定化酶表现出较好的稳定性和重复利用率,拓展了蔗糖酶的应用范围,为工业化大规模应用提供参考。
4 结论
本研究通过向含有蔗糖酶的磷酸盐缓冲溶液中滴加锰离子制备得到纳米花固定化酶Sucrase@Mn3(PO4)2。最佳制备条件:在pH 7.4条件下,向浓度为10 mmol/L 的PBS缓冲液中添加1 mL 0.1mg/mL蔗糖酶、1.46 g/mL Mn2+溶液, 20 ℃条件下充分混匀后静置反应1 h,制备的Sucrase@Mn3(PO4)2酶活性最高。通过SEM技术、TEM技术、红外光谱技术、X衍射和EDS能级色谱技术进行测定和分析发现,纳米花固定化酶的结构为盛开的花朵状,具有多级结构,构成的花瓣间紧密附着,纳米花结构均匀,分散性良好。Sucrase@Mn3(PO4)2在其最适反应条件下,即pH 5,反应温度30 ℃,其酶活是游离酶的2.49倍。Sucrase@Mn3(PO4)2具有一定的储存稳定性,但较长时间储存过程中存在酶活下降的现象,原因有待进一步研究。该固定化蔗糖酶连续测定酶活7次时,其活力仍保持最初活力的40.38%。因此在进一步提高Sucrase@Mn3(PO4)2重复利用性及储存稳定性后,在工业应用上具有巨大潜力。

