短乳杆菌SLB1000对Ⅱ型糖尿病大鼠的控糖作用
杜静婷,蔺 楠,施俊凤
(山西农业大学食品科学与工程学院,山西 太原 030031)
继癌症和心血管疾病之后,糖尿病已成为第三大威胁人类健康的疾病。其中,Ⅱ型糖尿病占糖尿病总发病率的90%以上[1]。目前的治疗手段主要为服用二甲双胍、噻唑烷二酮类药物和胰岛素注射等[2]。研究表明,添加有益化合物和益生菌的功能性食品也可发挥重要作用,益生菌可以改善机体肠道菌群丰度、提高机体清除自由基能力、调节机体免疫因子,从而缓解糖尿病症状[3-5]。许女等[6]从山西老陈醋中筛选到可以降低血糖的植物乳杆菌173,通过调控与肝脏炎性反应、肠道黏蛋白等的相关基因表达来调控血糖。张宇等[2]研究表明,副干酪乳杆菌(Lactobacillus paracasei)TD062 可以改善小鼠的Ⅱ型糖尿病症状,降低血糖水平和脏器指数,提高葡萄糖耐受性。Son 等[7]研究发现,植物乳杆菌(Lactobacillus plantarum)KU15006可抑制α-葡萄糖苷酶活性,降低血糖指数。
短乳杆菌通常从发酵食品、植物和人体肠道中分离而来。研究表明,短乳杆菌对人体多种疾病具有很好的预防和抑制作用[8]。Noureen 等[9]分离筛选出具有抗氧化作用的短乳杆菌MG000874,可提高D-gal 诱导小鼠体内的超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)活性;Riaz 等[10]研究发现,短乳杆菌MF179529 可降低单核细胞增生及李斯特氏菌(Listeria monocytogenes)在肝脏、脾脏和肠道中的分化和定殖;Kariyawasam 等[11]研究表明,短乳杆菌KU200019 可以抑制大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)和肠炎沙门氏菌(Salmonella enteritidis)的活性。同样,某些短乳杆菌亚种也具有辅助降糖作用。Yakovlieva 等[12]发现,与单纯高糖饮食相比,在灌胃短乳杆菌15 d 后,大鼠的血糖上升更加缓慢;Abdelazez 等[13]通过研究发现,短乳杆菌KLDS 1.0727 和短乳杆菌KLDS 1.0373 可显著降低血糖过高对肝脏、胰腺及肾脏的损害。Li 等[14]发现,经短乳杆菌YM 1301 发酵后的黄精,其控制血糖的能力优于未发酵使用黄精。目前,国内益生菌株辅助降糖已成为一个新兴趋势,但国内有关短乳杆菌降糖的研究报道较少。本试验采用的短乳杆菌(Lactobacillus brevis)SLB1000 由作者分离自山西传统发酵酱萝卜,该菌株降糖效果较为明显。
肝脏及胰腺细胞受损导致胰岛素合成及分泌紊乱是导致Ⅱ型糖尿病发生的主要原因,同时氧化应激也可能导致胰岛细胞受损及外周胰岛素抵抗,从而产生高血糖症状[11,15]。因此,对患有Ⅱ型糖尿病SD大鼠实施不同剂量的短乳杆菌SLB1000灌胃术,通过研究其对大鼠体重、脏器指数、血糖、葡萄糖耐量及抗氧化水平的影响,探讨短乳杆菌SLB1000降低大鼠血糖的机制,为短乳杆菌在食品和保健品工业中的应用提供一定的理论基础。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
短乳杆菌(Lactobacillus brevis)SLB1000,保藏于中国普通微生物菌种保藏管理中心(China General Microbiological Culture Collection Center,CGMCC),保藏登记号为CGMCC NO.20340,-80 ℃条件下保存备用。
SD 大鼠(实验动物许可证号为SCXK(京)2019-0010),鼠维持饲料和高脂高糖饲料(脂肪供能比为45%,碳水化合物供能比为35%,蛋白质供能比为20%),北京斯贝福生物技术有限公司;链脲佐菌素(Streptozocin,STZ),美国Sigma 公司;总抗氧化能力(T-AOC)、丙二醛(MDA)、超氧化物歧化酶、谷胱甘肽过氧化物酶检测试剂盒,南京建成生物工程研究所;MRS 培养基,北京奥博星生物技术有限责任公司;10%水合氯醛溶液,福州飞净生物科技有限公司。
1.1.2 仪器与设备
金稳型血糖测试系统及试纸,三诺生物传感股份有限公司;BX51 型微分干涉相差显微镜,OLYMPUS公司;DHP-9272型电热恒温培养器,上海科技有限公司;DW-HL340型超低温冷冻储存箱,中科美菱低温科技有限公司;ALLEGRAX-30R型离心机,贝克曼库尔特公司。
1.2 方法
1.2.1 试验菌种的制备
挑取保存于-80 ℃的短乳杆菌SLB1000,划线接种至MRS 固体培养基中活化,以3%接种量接种至MRS 液体培养基中,32 ℃振荡培养24 h,4 ℃条件下6 000 r/min 离心5 min,沉淀菌体,弃上清,重悬于pH为7.4 的0.9%生理盐水中,调整菌体浓度分别为1×108、1×109CFU/mL。
1.2.2 高血糖模型大鼠的建立及分组
健康SD大鼠,雄性,180~200 g,置于饲养环境下适应性喂养7 d,除正常组(N)10 只喂食普通维持饲料外,其他大鼠开始喂食高糖高脂饲料,18 d 后即试验第25 天腹腔注射链脲佐菌素35 mg/kgmb,以空腹血糖>7.0 mmol/L作为造模成功的判定标准[1]。
将造模成功的SD 大鼠分成4 组:Ⅱ型糖尿病模型组(M)、短乳杆菌SLB1000低剂量(1×108CFU/mL)组(EL)、短乳杆菌SLB1000 高剂量(1×1010CFU/mL)组(EH)、阳性对照(0.01 g/mL 二甲双胍)组(P),同时设置正常组(N),每组10只,按照10 mL/kgmb给予低剂量组和高剂量组SD大鼠灌胃相应剂量的短乳杆菌SLB1000,阳性对照组灌胃相同剂量的二甲双胍溶液,Ⅱ型糖尿病模型组和正常组灌胃相同剂量的生理盐水,自由饮水饮食,连续40 d。
1.2.3 测定项目与方法
1.2.3.1 大鼠体重
自购买之日起,每5 d称量1次体重。
1.2.3.2 大鼠脏器指数
试验第75天禁食12 h后称量SD大鼠空腹体重,解剖SD大鼠取肝脏、肾脏,无菌水冲洗并擦干后称量脏器质量,按下式计算脏器指数。
式中:mK为杀检后大鼠的肾脏质量,g;mL为杀检后大鼠的肝脏质量,g;m为大鼠质量,kg。
1.2.3.3 大鼠血糖值及糖耐量
从开始喂食高脂高糖饲料之日起,每10 d 尾静脉针刺采血测空腹血糖[16]。灌胃结束后,禁食过夜,大鼠以2 g/kgmb灌胃葡萄糖溶液后分别于0、0.5、1.0、2.0 h测定血糖值,观察葡萄糖耐量(OGTT)。
1.2.3.4 血清及肝脏中抗氧化相关指标
动物血液及组织采集和处理[16]:试验结束后,SD 试验大鼠禁食不禁水12 h,腹腔注射水合氯醛溶液麻醉后,解剖SD 大鼠,于腹静脉针刺采血置于促凝血管中,4 ℃放置2 h 后,3 000 r/min 离心10 min得血清,于-80 ℃保存,进行血清中抗氧化相关指标的测定。
SD 大鼠血清及肝脏中超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶、丙二醛含量、总抗氧化能力(T-AOC)均参照相应的试剂盒说明进行测定。
1.2.4 数据处理
采用SPSS 19.0 对数据进行差异显著性分析,假定方差齐性,采用LSD 模型对数据进行方差分析,试验数据均以¯x±s表示。
2 结果与分析
2.1 短乳杆菌SLB1000对大鼠体重的影响
由图1 可以看出,在最初的5~15 d 期间,对照组(N)体重增长均低于其他组。在试验的第25天时,腹腔注射STZ,10 d 后即试验第35 天造模成功的SD 大鼠达到56 只,满足试验要求。此试验期间,对照组(N)大鼠体重稳步增长,而其他组在试验35 d后表现出不同程度的体重下降,在45 d 时降至最低。在此期间大鼠排尿量和饮水量大大增加,体型明显消瘦,推断为糖尿病引起的体重下降。45 d 时,与模型组(M)相比,高剂量组(EH)和低剂量组(EL)体重分别高12.38%和9.62%。其中模型组(M)体重下降最大,阳性对照二甲双胍处理组(P)最接近正常体重。短乳杆菌高剂量组(EH)和低剂量组(EL)介于M组与P组之间,表明灌胃短乳杆菌SLB1000在一定程度上可以缓解Ⅱ型糖尿病引起的大鼠体重下降,且灌胃的剂量越大,对体重下降的抑制能力越强。

图1 短乳杆菌SLB1000对SD大鼠体重的影响Fig.1 Effect of L.brevis SLB1000 on body weight of SD rats
2.2 短乳杆菌SLB1000对大鼠空腹血糖的影响
由图2可以看出,在试验第35天时,SD大鼠的空腹血糖值明显升高,除正常组(N)外,其余4组空腹血糖值均达到15.0 mmol/L 以上,表明造模成功。结果表明,试验55 d(造模成功20 d)开始,阳性对照二甲双胍处理组(P)、短乳杆菌SLB1000的低剂量组(EL)和高剂量组(EH)大鼠的空腹血糖与模型组(M)相比均显著下降(P<0.05)。其中,二甲双胍处理组(P)效果最好,其次是高浓度短乳杆菌处理组(EH),再次是低浓度短乳杆菌处理组(EL)。试验第55 天时,模型组(M)大鼠的空腹血糖值为19.52 mmol/L,而高剂量组(EH)和低剂量组(EL)的空腹血糖值分别为13.57 mmol/L和15.46 mmol/L,与模型组相比,分别下降了30.48%和20.80%。试验至75 d 时,除模型组(M)外,其他处理组大鼠的空腹血糖值接近正常组(N)血糖值(5.1 mmol/L),阳性对照组(P)、低剂量组(EL)、高剂量组(EH)分别为6.00、7.68、6.43 mmol/L,说明短乳杆菌SLB1000可有效调控SD大鼠机体内的空腹血糖水平。
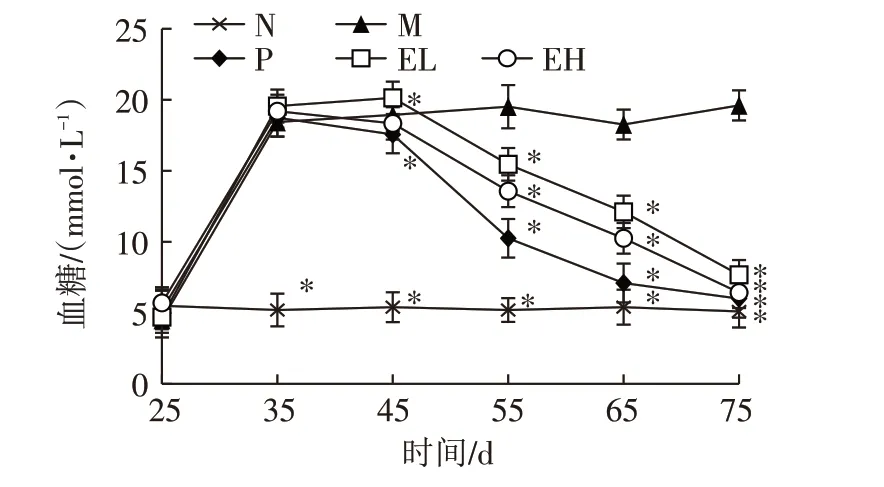
图2 短乳杆菌SLB1000对SD大鼠空腹血糖的影响Fig.2 Effect of L.brevis SLB1000 on fasting blood glucose of SD rats
2.3 短乳杆菌SLB1000对大鼠口服糖耐量的影响
口服葡萄糖耐量及空腹血糖都是衡量机体血糖调节能力的重要指标[6,17]。灌胃2 g/kgmb葡萄糖后,分别测定SD 大鼠空腹血糖及0.5、1.0、2.0 h 的血糖,观察SD大鼠对葡萄糖的代谢能力。
由表1可知,模型组(M)的SD大鼠空腹血糖值显著高于其他组(P<0.05),其中正常组(N)血糖最低,低剂量组(EL)空腹血糖值为7.22 mmol/L,略高于正常值,高剂量组(EH)空腹血糖值正常,为6.48 mmol/L,而模型组(M)则为18.94 mmol/L,说明短乳杆菌SLB1000 可有效降低SD 大鼠的空腹血糖值。2.0 h时,高剂量组(EH)、低剂量组(EL)的血糖值分别为20.23 mmol/L 和21.54 mmol/L,仍低于模型组(M),虽然高于正常临界值(16.7 mmol/L),但与模型组(M)的28.20 mmol/L 相比也显著下降。说明短乳杆菌SLB1000对血糖调节有一定益处,可作为降低血糖浓度的辅助治疗手段。

表1 SD大鼠口服葡萄糖耐量试验结果Table 1 Results of oral glucose tolerance test of SD rats单位:mmol/L
2.4 短乳杆菌SLB1000对大鼠脏器指数的影响
脏器指数为器官或组织的质量与体重的比值[18]。当脏器发生病变而导致水肿、肥大、充血时,器官或组织质量会发生变化,从而影响其脏器指数。5组SD大鼠肾脏指数和肝脏指数如图3所示。正常组(N)大鼠的肾脏指数为6.5 g/kg,而模型组(M)为10.5 g/kg,经过二甲双胍灌胃后,其数值降为8.9 g/kg(P组);而短乳杆菌SLB1000 灌胃后,其高剂量组(EH)和低剂量组(EL)分别为8.4 g/kg和9.2 g/kg,与模型组(M)相比,分别降低了20.95%和12.38%。对于肝脏来说,其模型组(M)的肝脏指数为42.0 g/kg,二甲双胍处理组(P)下降了10.24%,而短乳杆菌低剂量组(EL)和高剂量组(EH)分别为35.4 g/kg 和30.4 g/kg,分别降低了15.71%和27.62%,其效果均好于二甲双胍灌胃处理。由此可见,短乳杆菌SLB1000 对肝、肾脏器病变有抑制缓解作用。

图3 短乳杆菌SLB1000对SD大鼠脏器指数的影响Fig.3 Effect of L.brevis SLB1000 on organ index of SD rats
2.5 短乳杆菌SLB1000对抗氧化活性的影响
超氧化物歧化酶、谷胱甘肽过氧化物酶和过氧化氢酶是体内的重要酶类,能保护细胞不受过氧化物的损害[19]。大鼠血清抗氧化指标见表2。

表2 短乳杆菌SLB1000对SD大鼠血清抗氧化指标的影响Table 2 Effect of L.brevis SLB1000 on serum antioxidant index of SD rats
由表2 可以看出,与模型组(M)相比,两个剂量的短乳杆菌SLB1000 均可提高血清中SOD、GSH-Px和CAT活性,其中高剂量组(EH)较低剂量组(EL)效果更好。高剂量组(EH)大鼠血清中CAT 活性为69.16 U/mL,显著高于正常组(P<0.05)。同时试验发现,随着短乳杆菌浓度的升高,大鼠血清中SOD、GSH-Px和CAT三种酶的活性也随之升高。
机体中不饱和脂肪酸被氧化后会生成MDA,因此,MDA 水平是衡量机体脂质过氧化水平的一个重要指标。与模型组(M)相比,高剂量组(EH)和低剂量组(EL)SD 大鼠血清中的MDA 含量大大降低,且降低效果明显优于二甲双胍处理组(P),二甲双胍处理组为模型组的68.87%,而高剂量组(EH)和低剂量组(EL)SD 大鼠血清中MDA 含量仅为模型组的4.07%和3.88%。本试验中,正常组(N)与模型组(M)的总抗氧化能力之间差异不显著,P、EL、EH 组均略高于M 组。综上得出,短乳杆菌SLB1000 可提高SD大鼠血清中SOD、GSH-Px、CAT 活性,并能降低机体中MDA含量,提高SD大鼠机体的抗氧化能力。
大鼠肝脏氧化应激水平指标如表3 所示,与模型组(M)相比,短乳杆菌SLB1000 可提高SD 大鼠肝脏中SOD、GSH-Px、CAT 活性,且与菌液剂量呈正相关。短乳杆菌的高剂量组(EH)可降低肝脏中MDA含量,且效果优于二甲双胍阳性对照组(P),而低剂量短乳杆菌SLB1000 对肝脏中MDA 含量无降低作用。模型组(M)肝脏内T-AOC 水平为87.55µmol/g,而短乳杆菌SLB1000 低剂量组(EL)和短乳杆菌SLB1000 高剂量组(EH)分别为149.43 µmol/g 和170.57 µmol/g,分别为模型组(M)的1.77 倍和1.95倍,推断短乳杆菌SLB1000 可提高SD 大鼠肝脏的抗氧化能力。

表3 短乳杆菌SLB1000对SD大鼠肝脏氧化应激水平的影响Table 3 Effect of L.brevis SLB1000 on liver oxidative stress levels of SD rats
3 结论
本试验筛选所得的短乳杆菌SLB1000 有一定的降糖效果,并能改善Ⅱ型糖尿病引起的机体器官损伤。在SD 大鼠体内,不同剂量组之间表现的效果存在差异,如脏器指数及SOD、GSH-Px、CAT活性,存在剂量依赖关系,高剂量短乳杆菌SLB1000可清除更多的自由基,从而使肝肾指数趋于正常。在连续灌胃40 d后可以明显降低Ⅱ型糖尿病大鼠的血糖值,并能提高血糖耐受性。摄入短乳杆菌SLB1000 还能显著提高血清及肝脏中的SOD、GSH-Px 和CAT 酶类的活性,并降低MDA含量,同时提高肝脏中T-AOC水平。此外,菌株SLB1000还可以有效降低Ⅱ型糖尿病大鼠肝脏和肾脏的脏器指数,缓解肌体内脏器肥大的现象。由此可见,短乳杆菌SLB1000不仅对Ⅱ型糖尿病SD大鼠具有调节血糖的功效,缓解糖尿病症状,而且可以诱导大鼠体内血清和肝脏的抗氧化反应,对由糖尿病引起的肾脏和肝脏的病变程度也有一定的保护作用。

