药物Ⅰ期临床试验中受试者非药物相关三酰甘油、尿酸异常的相关因素
雷春璞,刘 龙,范荣霞,王兴河
药物临床试验是创新药物从研发向投产上市和临床应用迈进必不可少的环节,Ⅰ期临床试验主要是分析人体对新药产生的所有反应,其中,药物的安全性评价是临床试验的重要内容之一[1]。不良事件(adverse event,AE)是药物安全性评价的主要依据指标,在我国修订的《药物临床试验质量管理规范》中指出,AE包括了受试者接受试验用药品后出现的所有不良医学事件,但不限于与试验用药品存在因果关系的事件。目前,在我国新药临床试验研究中,相当数量的AE是由受试者自身条件或活动造成的事件,由于没有直接证据排除此类AE与药物的相关性,故常将其列为药物相关AE,这在很大程度上混淆了药物安全性评价结果[2],导致了AE发生率居高不下,严重影响了创新药物的研发和上市进程。血清三酰甘油(triglyceride,TG)和尿酸(uric acid,UA)是药物试验研究中安全性评价的重要指标,在我院开展的多项Ⅰ期临床试验中,均观察到了受试者血清TG、UA水平的异常,其中不乏应用安慰剂或不影响TG、UA代谢药物的受试者。近年来国内学者也有过类似的研究报道[3],但国内学者总体上对此类事件的关注度和研究深度明显不足[4],故本研究针对我院药物临床试验中受试者非药物相关TG、UA异常的因素进行了分析,旨在建立对非药物相关AE的风险预测模型。
1 资料与方法
1.1 临床资料 选取2021-02至2022-02在首都医科大学附属北京世纪坛医院开展的某国产贝伐珠单抗注射液与安维汀注射液(100 mg/瓶,由Roche公司生产),在中国健康受试者中的药代动力学和安全性、相似性的Ⅰ期临床研究中的96例受试者作为研究对象,经首都医科大学附属北京世纪坛医院伦理委员会批准[sjtky11-1x-2021(78)],回顾性分析其参与试验期间的TG、UA异常情况及相关因素。
纳入受试者为医院招募的自愿参与新药Ⅰ期临床试验的志愿者,均为男性。采用随机数字表法,分为国产贝伐珠单抗注射液组与安维汀注射液组,各48例(表1)。采用双盲法,试验研究药物均为单克隆抗体类,对TG、UA代谢无影响。试验期间针对受试者血液指标的观察期均为99 d。排除标准:入组筛选当日存在血清TG、UA水平异常或具有相关病史的受试者;观察期内依从性差、中途退出或失访的受试者。
表1 受试者参与药物试验一般情况
1.2 观察指标
1.2.1 血清TG、UA水平 于筛选入组当日(D1)、D3、D5、D15、D43、D99六个时点采集受试者的空腹外周静脉血样本,采用cobas b 221血气、电解质和生化分析系统(瑞士罗氏公司)对血清TG、UA水平进行检测,检测试剂盒均为仪器配套试剂盒,观察期内对受试者TG、UA异常情况进行分析,TG的正常值范围为0~1.7 mmol/L,UA正常值范围为155~357 μmol/L。
1.2.2 其他实验室指标及相关因素 在D1时点对受试者的血清丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、总胆红素(total bilirubin,T-Bil)、直接胆红素(direct bilirubin,D-Bil)和血浆凝血酶原时间(prothrombin time,PT)、凝血酶原活动度(prothrombin activity,PTA)、活化部分凝血活酶时间(activated partial thromboplastin time,APTT)及外周血红细胞计数(red blood cell,RBC)、血红蛋白(hemoglobin,Hb)水平进行检测,并对受试者的年龄、体质量指数(body mass index,BMI)进行记录。

2 结 果
2.1 受试者观察期内血清TG、UA水平的变化 在观察期内,有42例(43.75%)出现血清TG水平异常,有66例(68.75%)出现血清UA水平异常,重复测量数据方差分析结果显示,受试者在各监测时点血清TG、UA水平的差异均有统计学意义(P<0.05),受试者D3-D99的血清TG水平均高于D1水平,D5、D43、D99的血清UA水平均高于D1水平,差异均有统计学意义(P<0.05,表2)。
表2 受试者各监测时点血清TG、UA水平的变化
2.2 受试者血清TG、UA水平异常的相关因素分析 出现血清TG水平异常受试者在D1时点的TG、BMI水平高于血清TG水平正常的受试者,出现血清UA水平异常受试者在D1时点的UA、RBC、PT水平高于血清UA水平正常的受试者,年龄低于血清UA水平正常的受试者,差异均有统计学意义(P<0.05,表3,表4)。将上述差异有统计学意义的变量纳入Logistic多元回归模型进行分析,结果显示,受试者血清TG水平异常与D1时点的血清TG水平和BMI水平具有相关性(P<0.05,表5),受试者血清UA水平异常与D1时点的血清UA水平具有相关性(P<0.05,表6)。

表3 受试者血清TG水平异常的单因素分析

表4 受试者血清UA水平异常的单因素分析

表5 受试者血清TG水平异常的多因素分析
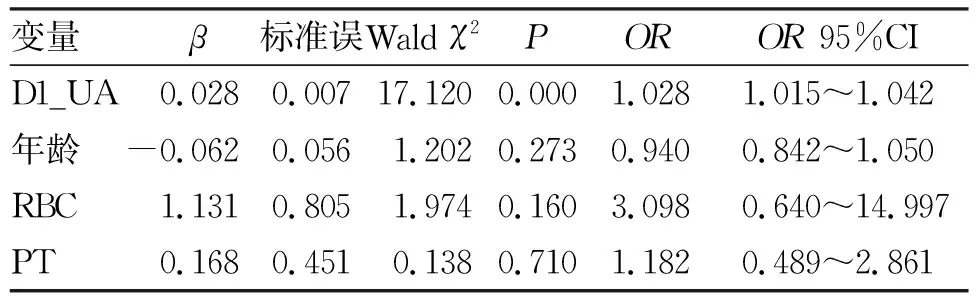
表6 受试者血清UA水平异常的多因素分析
2.3 基线血清TG、UA及BMI预测观察期TG、UA异常的价值分析 ROC曲线分析结果显示,受试者D1时点TG、BMI水平预测TG异常的AUCROC分别为0.857和0.684(P<0.05),受试者D1时点UA水平预测UA异常的AUCROC为0.845(P<0.05,表7,图1)。
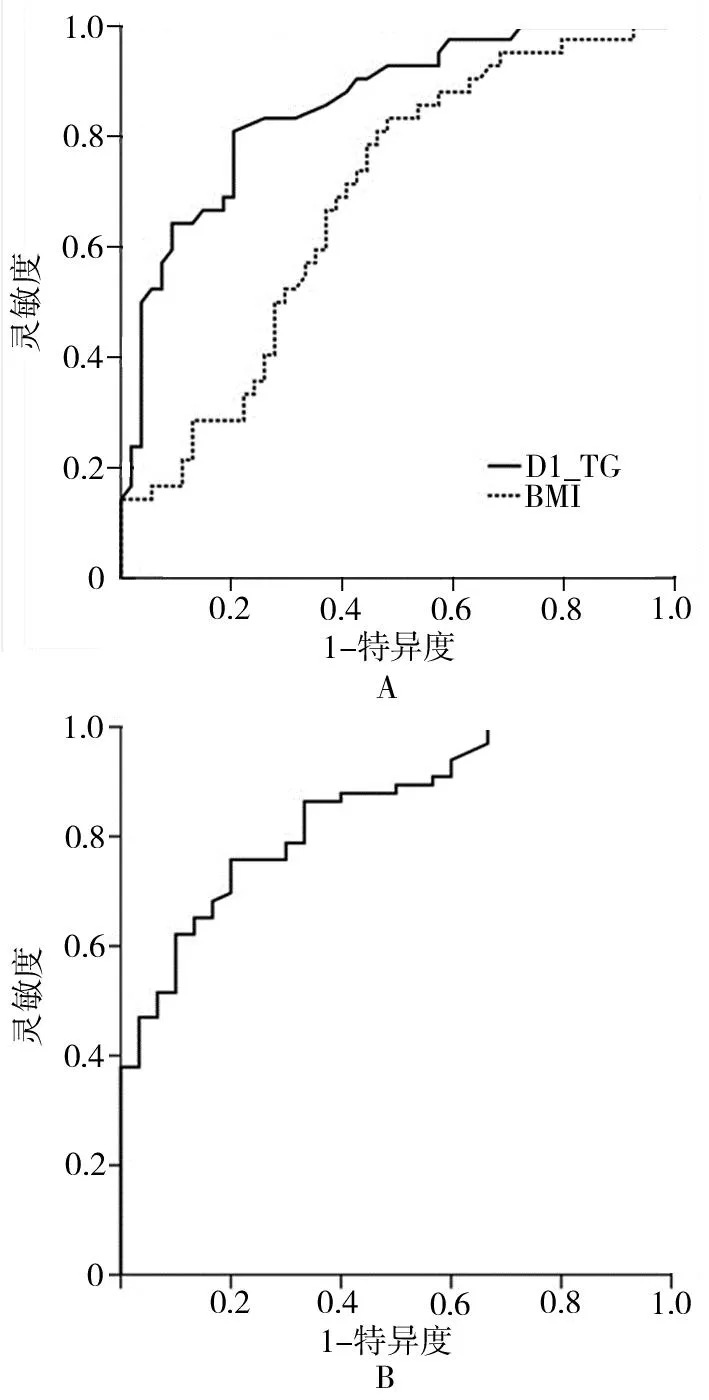
图1 基线血清TG、UA及BMI预测观察期TG、UA异常的ROC曲线注:TG.血清三酰甘油;UA.尿酸;BMI.体质量指数;ROC.受试者工作特征;A.受试者D1时点TG和BMI水平预测观察期TG异常的ROC曲线;B.受试者D1时点UA水平预测观察期UA异常的ROC曲线。
3 讨 论
本研究表明,在对TG、UA代谢无影响的新药临床试验中,受试者的血清TG、UA水平在观察期出现了明显的波动,血清TG、UA水平异常比例较高,受试者的血清TG、UA的基线水平及肥胖程度,与上述AE独立相关且对预测其发生具有价值。根据相关调查研究结果,药物试验中的AE特别是严重不良事件(serious adverse event,SAE)以男性受试者最为多见,在有关治疗用生物制品的临床试验中发生数量最多[5]。然而,在实际的研究中AE的归因是十分困难的,AE的原因可能与受试者本身疾病有关,可能是应用药物所致,也可能与其它疾病存在共病关系,或者是由上述多种因素共同引起[6,7]。由于学术界对AE归因缺乏明确的共识,且业内暂无针对AE报告的统一标准,故不同质控条件下申办者的报告准确性差异较大,导致了卫生管理和伦理学审核机构无法针对受试者的AE风险程度做出准确的判断[8]。
近年来的研究结果显示,Ⅰ期临床试验中安慰剂组和试验药物组均会出现血清TG异常,但二者发生率的差异无统计学意义,而且大多数Ⅰ期临床试验中出现的给药后血清TG升高可能并非试验药物导致的AE[9,10],Ⅰ期临床试验效应对于受试者血清TG水平的影响确实存在,其发生可能与基线TG水平等多种因素有关,与本研究结果基本一致。总之,血清TG、UA水平异常可能是在药物Ⅰ期临床试验中常见的非药物相关AE,特别是基线水平较高的受试者具有更高的发生风险,在进行药物安全性评价中应注意规避上述因素的影响。
药物Ⅰ期临床试验中受试者血清TG、UA水平波动的机制可能与参与临床试验导致的慢性心理应激有关。首先,流行病学调查和动物模型研究证实,负性心理状态可通过影响下丘脑-垂体-肾上腺轴、导致皮质醇水平升高,诱导和加重胰岛素抵抗等机制对机体的TG代谢产生影响[11]。其次,心理应激也可通过影响人体下丘脑-垂体-肾上腺轴,增加促肾上腺皮质激素的分泌,使大脑发生广泛性萎缩、细胞凋亡增多,引起核酸代谢增多, 导致血清UA水平的升高[11,12]。第三,血清TG水平的升高与血清UA水平的升高存在关联性,TG合成途径中相关因子转录的异常表达可能与UA代谢异常有关[13],而血清UA水平的升高则可能通过调节多种信号通路诱导脂质代谢紊乱[14],二者可能存在互相调节的关键调控因子,具有明确的共病关系。但是,心理应激因素并不能完全解释药物Ⅰ期临床试验中受试者出现的血清TG、UA水平异常,可能存在其他的相关因素。例如,孙雨诗等[15]报道了药物临床试验封管操作中使用肝素钠剂量也可对受试者血清TG水平产生影响,较高剂量的肝素钠应用在降低堵管率的同时,也会导致受试者血清TG水平的升高。因此,仍需进一步大样本多中心研究分析,药物临床试验中TG、UA异常等非药物相关AE的影响因素,并从多角度探讨其发生机制,从而预防和控制非药物相关AE对药物安全性评价结果的影响。
综上所述,药物Ⅰ期临床试验中受试者发生非药物相关TG、UA异常的比例较高,其发生风险与基线TG、UA水平、受试者的肥胖程度等因素有关,研究者应依据上述因素对非药物相关AE风险进行预测,尽量规避其对安全性评价准确性的影响。

