流式细胞仪样品预处理系统的设计与实现
栾永胜 ,刘佳琳 ,刘 萍 ,吴学丽 ,周 娜 ,栾传磊
(1.山东省烟台生态环境监测中心,山东 烟台 264000;2.中国科学院烟台海岸带研究所公共技术中心,山东 烟台 264000)
流式细胞仪是一种用于单个细胞多参数快速分析的先进仪器,能对处在快速直线流动状态中的单细胞或生物颗粒进行多参数、快速的定量分析和分选.检测时,样品中的悬浮颗粒在鞘液的包被下呈单行排列,依次流经检测区域.对于颗粒非荧光物质,在检测区激光束照射在颗粒上时,由于颗粒大小和内部结构等的差异发出前向角散射光(forward scatter light,FSC)和侧向角散射光(side scatter light,SSC),FSC 与被测颗粒的直径密切相关,基本上可表征颗粒的大小,而SSC 受颗粒内部结构(如细胞质折射率、细胞器等)影响重大,反映的是细胞的复杂程度.而对于颗粒荧光物质,在激光的激发下能发出不同颜色的荧光,这些荧光信号的强弱代表了细胞颗粒内含有相关荧光物质的浓度大小.这些信号通过光电转换器转变成电信号被送往计算机分析系统,通过表征这些颗粒不同性质的光信号就可将不同类型的颗粒区分开[1-2].
由于流式细胞仪的工作原理是利用激光照射到单个细胞上产生信号的变化来进行分析,所以样品的稳定性和均一性能够直接影响流式细胞仪数据获取的准确性.样品的前处理是获得理想流式细胞仪检测结果的关键步骤之一,传统的前处理方式是选用孔径是48~74 µm 的尼龙筛网在样品检测之前对样品进行过滤,但采用传统方式前处理的样品上机检测时,易出现如下问题:(1)流式细胞仪的“单细胞”分析特性要求细胞样品必须分散成单细胞状态.由于筛网难以完全去除样品中的粘连细胞,在上机检测过程中粘连细胞会造成双细胞或多细胞复合物“污染”,从而对单细胞数据的分析造成误导.(2)由于细胞样品自身的细胞多样性,容易导致在散点图中细胞分布范围太广泛,SSC-A(side scatter-area)及FSC-A(forward scatter-area)的变异系数(coefficient of variation,CV)值较大(流式细胞仪常用CV 值来表示数据的可信度.CV 值和标准偏差相关,代表的是一组数据分布的离散程度,数据越分散,CV 值越大,数据可信度越低.数值越集中,CV 值就越小,数据可信度越高).尤其在分析海洋贝类动物细胞时,由于筛网难以有效去除样品中主流细胞以外粒径较大的细胞,导致散点图中细胞“全屏分布”的现象更明显,因而降低了样品检测的准确性.为了解决上述流式细胞仪传统样品前处理方法的不足,本工作研制了一套基于微流控芯片技术的流式细胞仪样品预处理系统.微流控芯片是一种在微米尺度空间内对流体进行操控的技术,它将复杂的微通道集成于面积很小的芯片上,实现生物、化学分析的基本功能.微通道的特征尺寸与细胞尺寸相当,特征尺寸和速度很小,惯性作用可以忽略不计,但在压力驱动下可以达到很高的流速(0.1~1 m/s),惯性效应开始显现.双螺旋微通道利用压力驱动液体样品,样品粒子经过弯曲的管道,受到侧向力和迪恩涡粘性阻力的共同作用,在横截面内达到特定的平衡位置.横向受力与尺寸相关,不同尺寸的粒子通过聚集在不同的侧向位置而分离[3-5].该装置可以实现对粒径小于100 µm 的细胞或微粒的驱动和分选,无需对细胞进行标记处理,分选的细胞便于后续流式细胞仪检测.
1 系统的开发
1.1 流式细胞仪样品预处理系统的设计
所设计的流式细胞仪样品预处理系统基于微流控技术,根据不同尺寸细胞特异的迁移机制以及影响细胞聚焦平衡位置的不同因素,实现对不同尺寸细胞的高通量分选.该系统主要包含微流控分选芯片和样品驱动模块两部分(如图1 所示),其中微流控分选芯片是整个系统的核心部件.
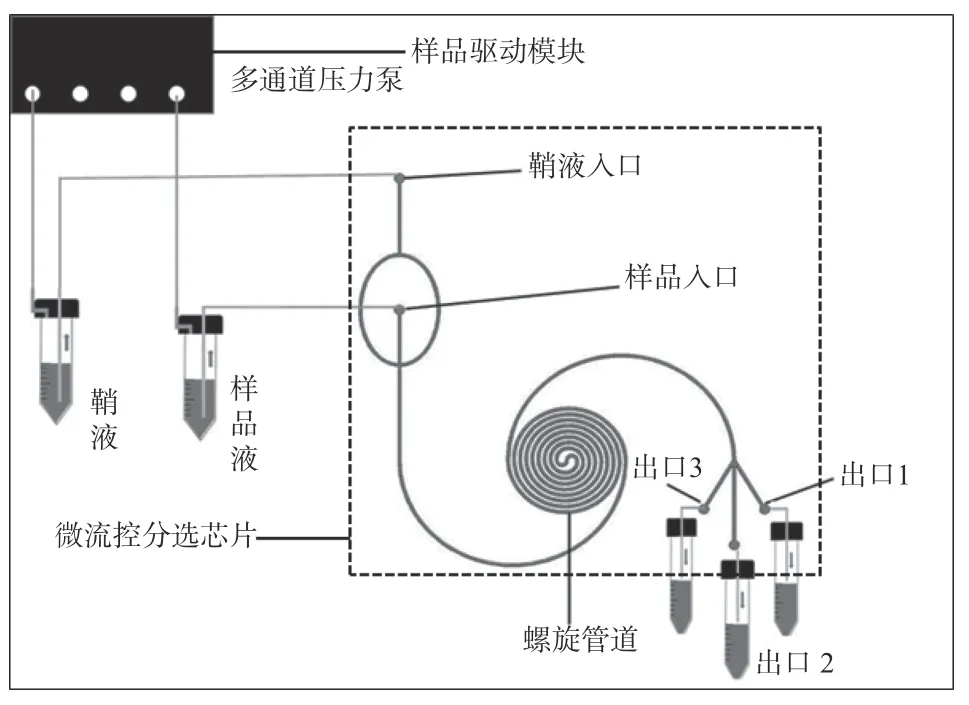
图1 流式细胞仪样品预处理系统工作示意图Fig. 1 Schematic diagram of sample pre-processing system for flow cytometer
系统整体设计如下:
(1)将所设计的芯片绘制成版图,通过软光刻技术将版图印制在涂覆有SU-8 光刻胶的硅衬底上,形成制作微流控芯片的阳膜.利用聚二甲基硅氧烷(PDMS)制作微流控芯片.
(2)搭建基于微流控技术的流式细胞仪样品预处理平台.如图1 所示,该平台主要包含微流控分选芯片和样品驱动模块.其中样品驱动模块采用多通道高精度压力泵来控制样品流速.
(3)分别选取不同粒径的聚苯乙烯微球和海洋贝类动物血细胞进行分选性能验证试验,以此验证本工作研发的预处理系统的可行性.
1.2 微流控分选芯片的设计与制作
选择双入口螺旋通道来设计微流控分选芯片,设计图如图2(a)所示.微流控分选芯片由直线管道和螺旋管道组成,采用双入口对称管道,由此可以形成双鞘液包裹样品流并使样品流聚焦在直线管道中心位置,减少样品流进入螺旋管道时的位置偏离.两个螺旋转向相反并以S 形通道相连,每个螺旋结构包含9 圈.共设有2 个入口,3 个出口.双螺旋微通横向受力与尺寸相关,不同尺寸的粒子通过聚集在不同的侧向位置而实现分离.粒径小的粒子更靠近通道内侧壁面.

图2 微流控分选芯片的(a)设计图及(b)实物图Fig. 2 (a) Design and (b) physical drawings of microfluidic sorting chip
由图2(b)微流控分选芯片实物图可见,芯片由对称管道、直线管道和螺旋管道三段构成.对称管道、直线管道和螺旋管道依次连接.对称管道的顶部中间位置连接鞘液入口,底部中间位置连接样品入口,且和直线管道连通.螺旋管道设置有三个出口,三个出口分别为内出口、外出口、中出口.通过多通道压力泵将鞘液容器中溶液注入鞘液入口,将样品液容器中溶液注入样品入口.芯片浇筑3 mm厚度,尺寸是65 mm×65 mm,与1 mm 厚度的载玻片键合.芯片管道尺寸宽300 µm,深100 µm,进口和出口孔径为1 mm.
1.3 系统的搭建
流式细胞仪样品预处理系统主要包含微流控分选芯片和样品驱动模块两部分.样品驱动模块采用多通道压力泵控制样品流速,样品的流速对惯性分选效果影响很大,通过调节压力泵的压强可以为系统提供稳定的样品驱动速度(如图3 所示).
流式细胞仪样品预处理系统工作流程如图4所示,鞘液和样品液通过压力泵以不同流速分别注入鞘液入口和样品入口,鞘液经对称管道形成双鞘液包裹样品流进入直线通道,因双鞘液流速和样品液流速不同,二者在直线管道中形成层流,使样品流聚焦在直线管道中心位置,减少样品流进入螺旋管道时的位置差异,样品进入旋转管道后,在迪恩涡流作用下,矩形截面管道中不同大小的粒子在管道内外侧的不同位置聚焦,最终实现目标细胞的分选.
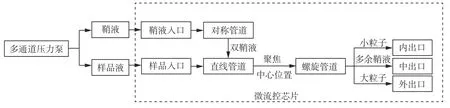
图4 流式细胞仪样品预处理系统工作流程图Fig. 4 Workflow chart of sample pre-processing system for flow cytometer
2 系统验证
2.1 聚苯乙烯微球分选验证试验
为了验证微流控芯片的分选性能以及本工作开发的预处理系统平台的可行性和合理性,进行了不同粒径尺寸的聚苯乙烯微球分选试验.相对于柔性、多分散的细胞粒子而言,刚性的聚苯乙烯微球尺寸更加均一,且不会在剪切应力作用下发生变形,因而其迁移轨迹能更好地反映出流体运动规律,进而表征芯片的聚焦、分选性能.
本试验采取3 µm 的聚苯乙烯荧光微球,模拟具有相似尺寸的双壳贝类淋巴血细胞,即小粒子.采用25 µm 的聚苯乙烯荧光微球模拟粘连细胞或大粒子杂质,即大粒子.将两种颗粒以体积比1︰1加入去离子水中,制作成混合颗粒悬浮液,使每毫升含有1×105个颗粒.取1 mL 混合颗粒悬浮液直接于流式细胞仪检测,剩余混合颗粒悬浮液进行微流控芯片的分选性能验证试验.
样品入口压强设为9×106Pa,鞘液入口压强设为4.5×107Pa,样品和鞘液分别从样品入口和鞘液入口注入通道内.内、中、外三个出口用于收集分选后的样品.小粒子聚焦于通道内侧,最终从内出口流出.大粒子聚焦于通道外侧,最终从外出口流出.多余的鞘液从中间出口流出.
将三个样品收集管中的样品分别于流式细胞仪检测,聚苯乙烯荧光微球混合样品经分选预处理后,SSC-A 和FSC-A 的CV 值明显降低,大粒子和小粒子分选效果明显(表1 所示).这表明流式细胞仪样品预处理系统对不同粒径聚苯乙烯荧光微球混合样品分选效果明显,通过分选预处理成功分选了粒径分别为3 µm 和25 µm 的聚苯乙烯荧光微球,增加了流式细胞仪检测结果的准确性.

表1 聚苯乙烯荧光微球混合样品经样品预处理分选前后的流式细胞仪分析变异系数Table 1 Coefficients of variation (CV) of mixed samples of polystyrene fluorescent microspheres before and after preprocessing by flow cytometer/%
2.2 细胞分选验证试验
太平洋牡蛎为双壳贝类,属于底栖生物、滤食性动物,相比于其他海洋生物,更容易蓄积自然界中难以降解的且易于在生物体内蓄积的污染物.其受到污染物的胁迫后能激发免疫防御反应,因而常被作为指示生物来进行海岸带环境毒理学研究.太平洋牡蛎的血液循环为开管式循环,免疫防御依靠细胞和体液成分介导,由细胞免疫和体液免疫共同组成免疫防御系统以抵御外界刺激,一般通过借助流式细胞仪完成对太平洋牡蛎淋巴血细胞的分析、分选,进而来开展海岸带环境毒理学研究.因此试验选取太平洋牡蛎为试验样本,抽取其淋巴血细胞用以验证流式细胞仪样品预处理平台的细胞分选效果.
试验所用太平洋牡蛎均购于烟大农贸市场,体长约10 cm.用注射器从外套膜腔中抽取血淋巴细胞,为防止细胞聚集,将抽取的血淋巴细胞迅速与预冷的等体积抗凝剂1︰1 混合置于50 mL 离心管中,将离心管静置30 min 后取其上清液用于后续试验.上清液经74 µm 筛绢过滤后,取1 mL 直接于流式细胞仪检测,剩余样品用于微流控芯片的细胞分选验证试验.
由于牡蛎血液循环为开管式循环,获取的淋巴液样品里除了粒径为3.5~4.5 µm 的血淋巴细胞外,还有卵细胞等大粒子杂质.因此血淋巴细胞小粒子聚焦于通道内侧,最终从内出口流出.卵细胞等大粒子聚焦于通道外侧,最终从外出口流出.多余的鞘液从中间出口流出.
将未经分选预处理的样品以及经本系统预处理的样品分别在流式细胞仪上进行检测,结果如图5 所示.由图5 可见,经分选预处理系统中内出口收集到的血淋巴细胞分析散点图相较于未经分选预处理细胞分析散点图分散更为集中,这表明本工作研发的流式细胞仪样品预处理系统对牡蛎血淋巴细胞样品分选效果明显,通过分选预处理成功去除了血淋巴细胞样品中的卵细胞等大粒子杂质,使样品粒径更加均一.

图5 (a)未经分选预处理和(b)经分选预处理的样品的细胞分析散点图Fig. 5 Scatterplots of cellular analysis of (a) unsorted pre-treated and (b) sorted pre-treated samples
3 结论
流式细胞仪作为一种常见的实验室仪器,具有强大的细胞分析分选功能,但一直以来其样品前处理方法存在不足.本工作考虑了流式细胞仪对样品“均一化”的需求,利用微流控细胞芯片技术,研制了一套流式细胞仪样品预处理系统,整个分选过程无需对细胞进行标记处理,分选的细胞便于后续流式细胞仪检测.通过聚苯乙烯微球和细胞的分选验证试验,表明了该系统可以实现对不同尺寸细胞的高通量分选,提高了细胞样品的稳定性和均一性,进而实现流式细胞仪对样品“均一化”的需求,增加了流式细胞仪检测结果的准确性.

