基因工程菌在石油污染修复中的研究进展与前景*
宫兆波 郭瑛瑛 张燕萍 杨永霞 赵增义 刘艳伟 史 斌 毕 磊 阴永光 宋茂勇
(1.中国石油新疆油田分公司实验检测研究院,克拉玛依,834000;2.新疆维吾尔自治区油气田环保节能工程研究中心,克拉玛依,834000;3.中国科学院生态环境研究中心环境纳米技术与健康效应实验室,北京,100085;4.中国石油新疆油田分公司质量安全环保处,克拉玛依,834000)
在石油开采、加工、运输和使用等环节,石油污染物会发生泄露和排放,造成环境污染问题.石油污染物种类复杂,烷烃、环烷烃和芳香烃是含量最高的组分[1].芳香烃主要包括苯系物(benzene,ethylbenzene,toluene and xylene,BTEX)和多环芳烃(polycyclic aromatic hydrocarbons,PAHs),具有高毒性和环境持久性,危害人类健康和生态系统[2−3].
相较于物理和化学修复,生物修复更为环境友好,经济成本较低,而微生物可降解大多数脂肪族和芳香化合物,是最有效的生物修复方法[3−4].不同石油组分的生物可降解程度依次为:正构烷烃>支链烷烃>支链烯烃>低分子量正烷基芳烃>单环芳烃>环烷烃>多环芳烃>沥青质[5].目前,关于烷烃和芳香化合物微生物降解过程的研究最多.但是,石油污染的微生物修复仍存在诸多问题和挑战.首先,微生物生存能力受环境影响较大,实验室条件下降解效果良好的菌株在实际环境中的活性可能下降,或者环境中污染物的浓度不能诱导代谢基因的表达[6−7];其次,石油污染物组成复杂,多数微生物只能降解特定组分,很难实现多种石油烃组分的完全降解[7−8];另外,石油污染物的亲脂性使其生物可利用性低,制约微生物的吸收和利用;最后,外源菌的引入可能影响土壤微生态平衡,且可能发生基因的水平迁移,存在生态风险.
通过分子生物学手段改造微生物代谢通路是修复石油污染的重要发展方向,构建基因工程菌(genetically engineered microorganisms,GEMs)为提高微生物的存活率、增强降解能力以及减少微生物修复的环境影响提供了解决方法.理论上,通过代谢调控可以设计出降解效率更高和环境适应能力更强的工程菌.本文概述了微生物降解石油污染物的代谢通路和遗传调控机制,综述了石油污染物降解基因工程菌的主要改造策略和应用,并展望了基因工程菌在石油污染修复的研究和发展趋势.
1 石油污染物的微生物代谢途径(Microbial metabolic pathways of petroleum hydrocarbon pollutants)
1.1 微生物降解石油污染物的主要途径
石油污染物的降解途径包括有氧和缺氧降解途径.有氧条件下,氧气作为最终电子受体和底物参与脂肪族化合物的碳链和芳香族化合物的芳环活化;在缺氧条件下,硝酸盐、硫酸盐、Mn(Ⅳ)、Fe(Ⅲ)和CO2等作为最终电子受体,参与PAHs 的生物降解[9−10].好氧降解微生物种类繁多,降解速率较快,不产生有毒副产物,因此石油污染物的微生物降解研究多集中在有氧降解[11].PAHs 分为低分子量多环芳烃(low molecular weight PAHs,LMW-PAHs)和高分子量多环芳烃(high molecular weight PAHs,HMW-PAHs).一些脂肪族化合物和LMW-PAHs 可作为微生物的唯一碳源和能源,直接被微生物利用;但是苯并[α]芘等较难降解污染物需要与其他有机物共代谢进行降解,LMW-PAHs 也可为HMWPAHs 的共代谢提供碳源和能量[12−13].一些微生物可以同时降解脂肪族化合物和芳香化合物,也有一些只能降解脂肪族化合物;某些细菌对某个化合物可能只有一种代谢通路,也可能有多种代谢通路[14].
微生物对石油污染物的主要降解途径如图1 所示.对于烷烃,微生物在单加氧酶作用下将氧原子加入烷烃末端或亚末端生成醇类化合物,其中1-烷醇在脱氢酶作用下逐步生成醛和酸,再经β-氧化进入三羧酸循环[1,15−16].另外,烷烃也可在双加氧酶作用下生成过氧化物,再逐步反应进入三羧酸循环,即Finnerty 途径[1,16].其中,烷烃羟化酶可分为降解C1—C4的甲烷单加氧酶类、降解C5—C16的非血红素铁膜整合蛋白和细胞色素P450 酶(cytochrome P450 enzyme system,CYP450)、以及降解C17及更长碳链烷烃的酶系统[17].BTEX 和PAHs 的细菌降解过程非常复杂,涉及非常多的代谢产物和酶.比如,分枝杆菌属的MyobacteriumvanbaaleniiPYR-1 是第一株分离的可降解HMW-PAHs 的菌株,蛋白质组学研究发现160 种蛋白可能参与PAHs 的降解,降解过程涉及183 个代谢产物和224 个化学反应[18].其中,环羟基化双加氧酶在芳香烃降解中发挥关键作用[2,5,17],该类酶催化两个氧原子加入PAHs 的芳环中,再发生羟基化和芳环断裂生成顺式-二氢二醇,该中间产物在脱氢酶和加氧酶等作用下继续发生芳环断裂,生成邻苯二酚、苯醌和龙胆酸盐等中间产物[19].甲苯和二甲苯则在加氧酶作用下经苯甲酸等中间产物生成邻苯二酚[15].作为常见的中间产物,邻苯二酚在邻苯二酚双加氧酶作用下发生芳环的彻底断裂,其产物通过进一步代谢进入三羧酸循环[9,19].此外,单加氧酶也可以介导单环芳烃和多环芳烃的微生物降解.

图1 石油污染物的主要微生物降解途径Fig.1 The major microbial degradation pathways for petroleum pollutants
真菌可通过细胞色素P450 酶的胞内降解途径和木质素降解酶的胞外降解途径参与石油污染物降解[20].细胞色素P450 酶是一种单加氧酶,参与芳环的断裂;木质素降解酶可将PAHs 转化为醌类化合物,然后发生加氢、脱水等反应[12,20].木质素降解酶包括木质素过氧化物酶(lignin peroxidase,LiP)、依靠锰的过氧化物酶(manganese peroxidase,MnP)和漆酶,这些酶在真菌体内合成后,分泌至胞外降解污染物.其中,LiP 和MnP 对污染物的降解需要H2O2的参与,漆酶对PAHs 的降解无需H2O2和其他辅因子的参与.
1.2 石油污染物降解相关基因
石油污染物降解的基因表达包括诱导型和组成型,以操作子单元或者独立的基因位于质粒或者染色体上,并涉及石油污染物转运、降解和调控等过程[15].位于质粒上的PAH 降解基因包括nah、ndo、dox、nag和phn,位于染色体上的PAH 降解基因包括pah、nah、phd和nid等[21].
目前发现的石油污染物降解质粒主要包括含烷烃降解基因的质粒(如OCT 质粒)、含萘和水杨酸降解基因的质粒(如NAH 质粒)以及甲苯和二甲苯降解相关的质粒(如TOL 质粒)[15].OCT 质粒的alkBFGHJKL基因簇编码烷烃降解的烷烃羟化酶、单加氧酶、外膜蛋白、醇脱氢酶和醛脱氢酶等;TOL 质粒的xylCAB基因介导甲苯生成苯甲酸的过程,而生成邻苯二酚的相关基因在质粒和染色体上均有发现;NAH 质粒是一类含有两个操纵子的高度保守质粒,其中操纵子(nahAaAbAcAdBFCED)与芳香烃(如萘、蒽和菲)转化为水杨酸的反应有关,下游操纵子(nahGTHINLOMKJ)则介导水杨酸生成乙醛和丙酮酸的过程[15].石油污染物降解菌的代谢酶和操纵子可以被特定底物或中间产物诱导,AraC/XylS、LysR、IclR 和XylR 等蛋白家族可以调控芳香化合物降解相关的基因或者操纵子的转录[19].
2 石油污染物降解微生物的基因改造策略(Construction strategies of GEMs used for degradation of petroleum pollutants)
随着对微生物降解路径和调控系统的挖掘,目前已经构建了多种可降解石油污染物的基因工程菌,主要基因改造策略包括增强宿主菌的环境适应能力、增加微生物可利用底物范围、提高微生物降解效率以及实现高选择性的底物转化途径,一些基因改造策略如图2 所示.
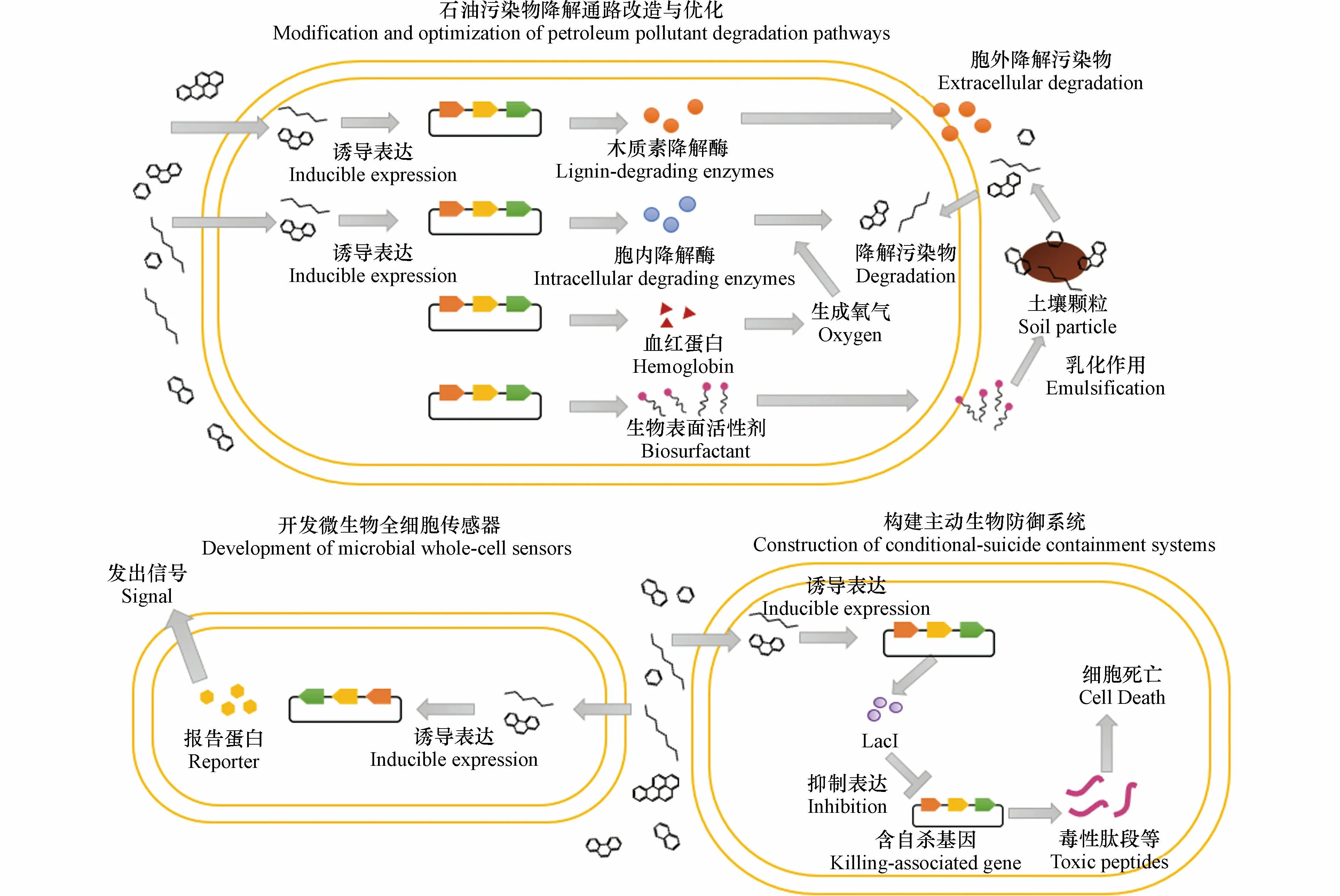
图2 石油污染物降解微生物的主要改造策略Fig.2 Major genetic modification strategies of petroleum pollutant degradation in microorganisms
2.1 宿主菌的选择与改造
污染物降解的基因工程菌多采用基因序列已知和代谢网络研究较为透彻的模式生物,如大肠杆菌和假单胞菌[22].大肠杆菌具有广泛的遗传操作工具,是合成生物学中应用最广泛的底盘生物.恶臭假单胞菌(Pseudomonasputida)的环境耐受能力强,新陈代谢多样,营养需求较低,是环境修复的模式菌株.目前已发展了该菌的合成基因回路用于启动子基因设计和降解基因表达[23−24].其中,高效降解PAHs 的PseudomonasputidaB6-2 的全基因组测序数据已发表[25],该菌株存在苯甲酸盐、儿茶酚、4-羟基苯甲酸盐和水杨酸盐降解相关的多个基因簇,而bphABC是多环芳烃降解上游通路中的唯一基因簇[26].
为实现复杂石油污染物的降解,底物类型多样的微生物和环境适应能力强的土著菌也是石油污染修复的重要宿主菌.降解PAHs 等污染物的睾丸酮丛毛单胞菌(Comamonastestosteroni)在环境中广泛存在,环境适应性强,对碳源的竞争小,但该菌缺少功能基因表达的工具[27].Tang 等在该菌中构建了穿梭系统,可用于大肠杆菌中基因回路的高效构建以及睾丸酮丛毛单胞菌的表型测试,构建杂合启动子提高基因表达强度和动态范围,植入来源于噬菌体的T7 RNA 聚合酶-PT7 启动子表达系统,并构建了T7 启动子的随机突变数据库以提供强度范围广泛的表达系统,为该菌株的基因改造提供了有效的分子工具[27].此外,研究人员构建了可在特定环境条件下进行石油污染物修复的基因工程菌,可满足不同环境场景下的石油污染修复需求.例如,在嗜冷菌PseudomonasputidaQ5 和Pseudoalteromonas haloplanktisTAC125 中引入石油污染物降解相关的质粒(如TOL 质粒)或基因(如tou),可在低至0 ℃环境中降解甲苯等芳香烃[28−30].另外,石油污染、重金属污染和放射性污染在环境中可能同时发生,复合污染问题突出[4,31].耐辐射球菌(Deinococcusradiodurans)可还原六价铬生成低毒的三价铬,在该菌中异源表达甲苯降解相关的tod和xyl基因,重组菌能在高辐射环境下降解苯、甲苯和氯苯,可用于处理核生产废物中铬和有机污染物[31−32].
2.2 降解通路关键酶的表达与改造
对降解通路关键酶的调控表达和改造是提高微生物降解能力的主要策略,可以提高宿主菌的污染物降解能力以及对污染环境的耐受能力[33].在无降解能力或降解能力弱的菌株中引入相关基因,可实现对石油污染物的降解;已有降解功能的菌株添加其他污染物降解通路,增加底物类型,实现多种污染物的同时降解.通过对石油污染物降解通路关键酶基因改造而构建的基因工程菌见表1.
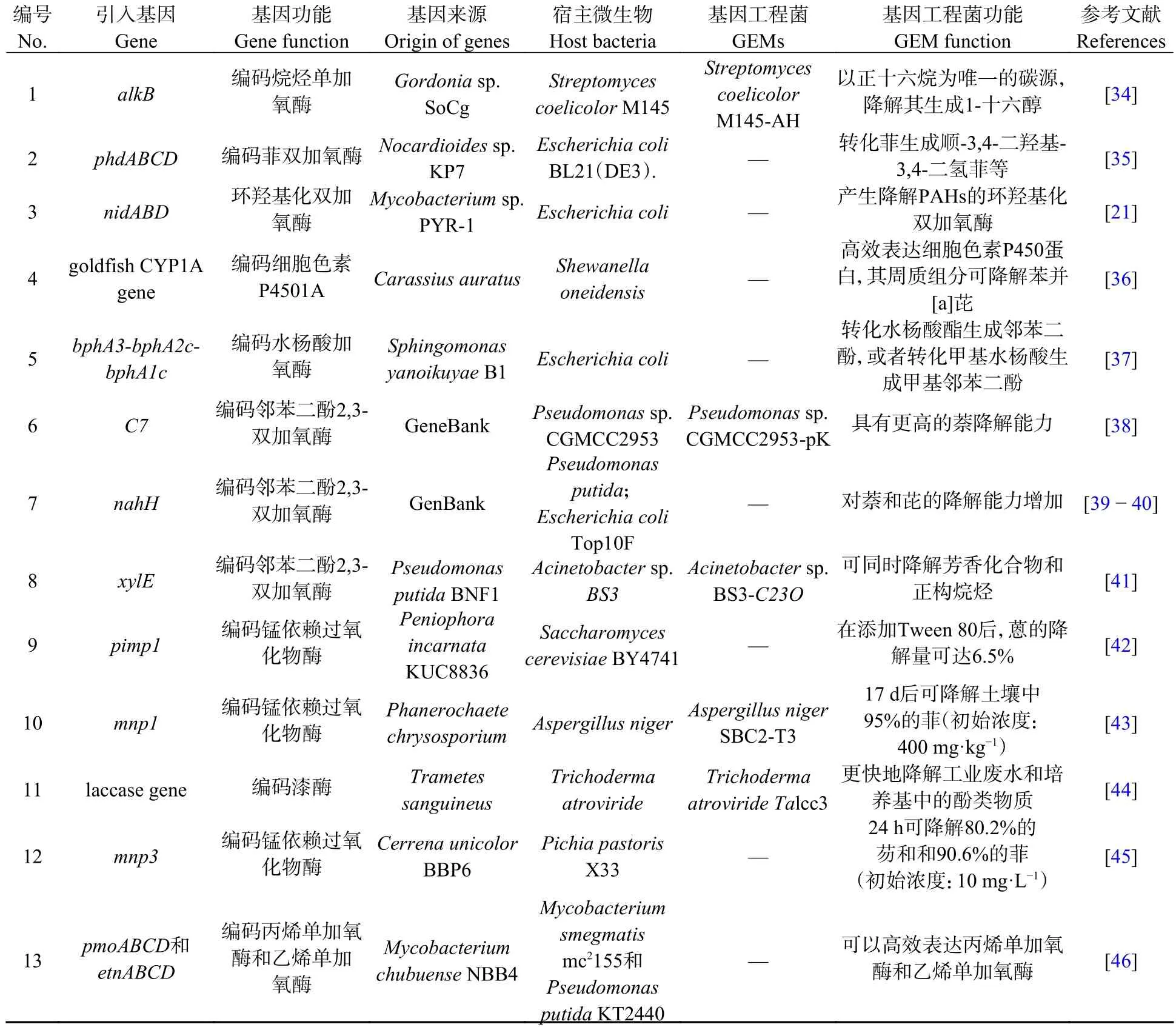
表1 构建的用于降解石油污染物的基因工程菌Table 1 Genetically engineered microorganisms(GEMs)designed for the degradation of petroleum pollutants
2.2.1 胞内降解通路关键酶
单加氧酶和双加氧酶是微生物降解石油污染物的关键酶,主要参与脂肪链断链和芳环断裂.在不能降解烷烃的天蓝色链霉菌M145 菌株,过表达编码烷烃单加氧酶的基因alkB可以实现正十六烷的快速降解[34].在烟草分枝杆菌异源表达来自楚布分枝杆菌的丙烯单加氧酶和乙烯单加氧酶的编码基因,可以降解烯烃[46].将含有编码菲双加氧酶的phdABCD基因的外源质粒导入到大肠杆菌中可有效降解菲[35].分枝杆菌PYR-1 可矿化蒽、荧蒽、芘、1-硝基芘、菲和苯并[a]芘,通过分析其蛋白质表达和组成,确定其染色体上的nidA、nidB和nidD基因编码了双加氧酶和二氢二醇脱氢酶,将编码双加氧酶的基因克隆至pBAD/ThioFusion 质粒,并在大肠杆菌中过量表达可以降解HMW PAHs[21].
石油污染物的降解过程产生许多中间代谢产物,代谢产物的生成和进一步转化反应也需酶的参与.如在水杨酸代谢通路,水杨酸加氧酶催化水杨酸生成邻苯二酚.在鞘氨醇单胞菌属的Sphingomonas yanoikuyaeB1 菌株,水杨酸加氧酶包括bphA2cA1c编码的加氧酶、bphA3编码的铁氧还蛋白和bphA4编码的铁氧还蛋白还原酶,将bphA2cA1c基因转入大肠杆菌,可使重组菌具有水杨酸加氧酶活性[37].此外,芳香烃降解进入TCA 循环的关键步骤为邻苯二酚的降解,邻苯二酚2,3-双加氧酶(catechol 2,3-dioxygenase,C23O)是催化邻苯二酚彻底开环裂解的关键酶.将编码C23O 的基因异源表达,可增加细菌的底物利用范围,提高芳香化合物的降解效率.不动杆菌属BS3 菌株可降解烷烃,但无法降解芳香烃.将恶臭假单胞菌BNF1 中编码C23O 的基因xylE在Acinetobactersp.BS3 异源表达,可实现该菌对烷烃和芳香烃(如氯酚、萘和菲)的同时降解[41].另外,将含有C23O 基因的泛宿主性质粒(pRK415)引入假单胞菌CGMCC2953,重组菌株CGMCC2953-pK 完全降解菲(0.1%)的时间缩短一半[47];将NAH7 质粒中编码C23O 的基因nahH,通过pUC18 质粒转入恶臭假单胞菌和大肠杆菌可有效降解菲和芘,且恶臭假单胞菌重组菌株的降解能力较天然降解菌株有显著提高[39−40].
2.2.2 木质素降解酶
真菌分泌到胞外的木质素降解酶可降解多种污染物[20].将编码木质素降解酶的基因异源表达,可以提高其他菌株对石油污染物的降解能力.例如,将肉色隔孢伏革菌KUC8836 编码MnP 的基因pimp1在无法降解蒽的酿酒酵母BY4741 中异源表达,可以实现蒽的降解(降解量6.5%)[42];将黄孢原毛平革菌中编码MnP 的基因mnp1表达在黑曲霉中,可提高该菌对PAHs 的降解能力,在17 d 后可降解土壤中95%的菲(初始浓度:400 mg·kg−1)[43];将朱红栓菌的漆酶基因异源表达在深绿木霉,也可有效去除工业废水中的酚类物质,并降解菲和苯并[a]芘[44].
采用过表达、基因编辑和定向进化等手段,构建稳定生产高活性木质素降解酶的基因工程菌,再从微生物体内提纯酶应用于石油污染修复是一种经济可行的修复策略.相较于LiP 和MnP,漆酶降解过程无需H2O2参与,在石油污染的酶修复中有更大优势[48].已有研究通过定向进化获得了可用于蒽降解的漆酶,如将嗜热菌丝体的漆酶基因转入到酿酒酵母,其漆酶表达提高了8 倍,酶活提高170 倍[49−50].
2.2.3 降解通路的理性设计与关键酶的整合
微生物代谢途径的进化较慢,现有的代谢途径可能无法满足实际修复需求,可通过理性设计降解通路和整合关键酶改变微生物的代谢途径.间位和邻位裂解途径分别是甲基芳烃(如甲苯、二甲苯和甲酚)和氯代芳烃(如氯苯和氯酚)的主要降解途径,但这两类污染物降解也可通过另一种途径发生一些反应[51].因此,当这两类污染物同时存在时,这两种降解途径都被激活,影响降解效率和细菌生长[51].研究将来自3 种细菌的编码降解关键酶的基因进行整合,包括TOL 质粒上编码甲苯酸酯双加氧酶和环己基甲酸二羟基酯脱氢酶的基因、NAH 质粒上编码水杨酸羟化酶以及真养产碱杆菌编码4-甲基-2-烯内酯异构酶的基因,从而在假单胞菌B13 菌株中构建了新的邻位裂解途径,实现了甲基芳烃和氯化芳烃在不发生间位降解途径下的邻位裂解[51].该重组菌株可在复杂的底泥环境中存活,并显著降解3-氯苯甲酸盐和4-甲苯甲酸盐[52].
2.3 通过引入血红蛋白合成途径提高好氧菌活性与降解能力
氧气含量和可利用性是土壤和水体等环境中制约微生物生存和修复效率的关键问题.通过将透明颤菌血红蛋白(Vitreoscillahemoglobin,VHb)编码基因vgb异源表达到降解菌中,生成的VHb 蛋白可传递氧气分子给氧化酶和加氧酶,可有效解决修复过程中氧气含量不足和利用效率低的问题[53].已有研究将vgb基因在铜绿色假单胞菌中表达,重组菌在氧含量正常或偏低情况下降解苯甲酸的速率均显著高于野生型[54−55].苯、甲苯和二甲苯为碳源时,重组菌的生长速率更快;以甲苯为唯一碳源时,重组菌中代谢产物3-甲基邻苯二酚的累积更明显,表明氧化酶对苯环裂解更快速[56].
2.4 全细胞的代谢网络改造与优化
石油污染物降解的代谢通路复杂,对单一关键酶或者通路的改造可能影响其他代谢过程,因此,需要对石油污染物降解相关的代谢通路进行深入研究,并开展全细胞的代谢网络改造与优化.例如,谷氨酸棒状杆菌具有芳香烃降解相关的转运、代谢通路和调控通路等,能以苯甲酸、苯酚、苯甲醇和萘等芳香烃为碳源[57].在有氧条件下,芳香烃通过不同的周边通路代谢生成邻苯二酚和庚二酸盐等中间产物,进而发生芳环裂解,进入中心碳代谢途径.所以,中心碳代谢通路的调控影响芳香烃的降解,比如,敲除果糖-1,6-双磷酸盐酶的fbp基因导致菌株无法在芳香烃上生存[57].同时,谷氨酸棒状杆菌是生产多种氨基酸和维生素的重要工程菌,三羧酸循环与氨基酸(如谷氨酸和天门冬氨酸)的合成有关,而芳香烃降解的中间产物可进入三羧酸循环,并增加这些氨基酸的生成量[58].目前,针对石油污染物降解微生物的全细胞代谢工程改造研究很少.3,4-二羟基苯甲酸是PAHs 降解的中间产物[59].有研究对PseudomonasputidaKT2440 进行多方面的代谢工程改造,使其在以葡萄糖为碳源的条件下,产生大量3,4-二羟基苯甲酸[60].该工作首先开发了具有不同表达强度的组成型启动子,用于微调基因的表达;其次,采用过表达限速酶、去除负向调节因子、加强前体供应以及减少途径竞争等策略促进3,4-二羟基苯甲酸的生产;然后,进一步筛选出高产的基因工程菌株[60].该工作为以PAHs 为碳源的微生物的代谢工程改造提供了研究思路.
另外,群体感应系统被认为是石油污染物降解的重要调控通路.在敲除铜绿色假单胞菌CGMCC1 菌株的群体感应rhl基因后,C23O 酶活性和细菌降解芳香烃的能力显著下降,编码C23O 酶的基因nahH和转录活化子nahR的转录水平也受影响,而该抑制作用在添加N-丁酰同源内酯(rhlQS 系统的信号分子)后有所缓解[61].赤杆菌科的CroceicoccusnaphthovoransPQ-2 中群体感应系统与PAHs 降解基因(ahdA1e,xylE和xylG)和调控基因ardR成正相关[62].对NCBI 基因数据库进行搜索,发现超过11%的微生物(78 种)同时具有环羟基化双加氧酶和群体感应系统AHL/AI 信号分子合成酶的基因,并从多种环境介质中筛选出6 种鞘氨醇菌和4 种根瘤菌,为石油污染物降解微生物的代谢改造提供了支持[63].
3 基因工程菌用于微生物菌群和植物强化修复石油污染(Application of GEMs for microbial consortium and plant-microbe remediation of petroleum hydrocarbon pollution)
石油污染物降解基因工程菌的构建多采用单个降解菌株,但是单一菌株在实际环境中难以达到良好修复效果[4,62].另外,在单一菌株上过量表达质粒上的基因会增加细胞代谢负担,质粒的兼容性和稳定性也是影响降解效果的重要因素[22,36].相较于单一菌株修复,微生物菌群修复和植物-微生物联合修复可以丰富污染物的代谢途径,增加可利用底物类型,并提高微生物对环境胁迫的耐受能力,通过优化微生物菌群结构以及植物和微生物的搭配,可以获得良好代谢互补性,以及增强微生物环境适应能力和污染物降解能力[64−66].因此,将基因工程菌结合微生物菌群、微生物-植物联合修复技术是石油污染修复的重要发展方向.
3.1 微生物菌群强化修复石油污染
微生物菌群对环境的适应能力更强,在复杂石油污染物的生物降解中更具潜力.有研究将黄孢原毛平革菌编码LiP 和MnP 的基因分别在黑曲霉中表达并构建了两种基因工程菌,将其与从原油污染土壤中分离出的4 种真菌和5 种细菌一起用于土壤修复,该菌群可产生LiP、MnP、漆酶、过氧化物酶和双加氧酶[67].在接种两周后,土壤中菲、芘和苯并[α]芘(初始浓度均为333 mg·kg−1)的降解率为92%、64%和65%,降解效率高于未加GEMs 的菌群和已报道的其他微生物菌群[67].将Mycobacterium vanbaaleniiPYR-1 编码菲双加氧酶的基因(nidA和nidB)和AlcanivoraxborkumensisSK2 电子传递链相关的基因(fdr和fdx)在大肠杆菌中表达,得到重组菌株HY1;将PseudomonasaeruginosaPH1 编码邻苯二酚1,2-双加氧酶的基因加强表达得到重组菌株PH2.这两种菌的联合降解能力显著优于野生降解菌株PH1[64].也有研究将芳环裂解、水杨酸合成和邻苯二酚代谢途径分别引入到大肠杆菌BL21 菌株,得到重组菌株M1、M2 和M3,该菌群可协同参与菲的降解,21 d 降解效率达到90.66%(初始浓度:100 mg·L−1)[68].
鼠李糖脂等生物表面活性剂可提高疏水性石油污染物的生物利用性[69−71].采用微生物原位持续产生表面活性剂是提高污染物生物可利用性和降解菌降解效率的一个有效措施.Pseudomonas aeruginosa可产生鼠李糖脂,但该菌具有一定的致病性,将编码鼠李糖脂合成的rhlABRI基因转入没有致病性的PseudomonasputidaKT2440 的染色体中可得到重组菌KT2440-rhlABRI,该菌虽然不能降解芘,但是可在天然土壤中存活,30 d 后重组菌和野生菌添加组芘的降解效率分别为79%和43%,即重组菌稳定产生的鼠李糖脂提高了芘的溶解,进而促进其他微生物对芘的降解活性[38].另外,将产鼠李糖脂的Pseudomonasputida和上述大肠杆菌重组菌株(M1、M2 和M3)组成降解菌群,菲(初始浓度:100 mg·L−1)的7 d 降解率从61.15%提高到73.86%[68,72].
3.2 细菌与植物联合修复用于石油污染物的降解
促进植物生长的细菌可以促进植物的生长、增强植物耐受胁迫的能力并提高污染物的生物可利用性,基因改造的根际菌和植物内生菌已用于石油污染修复研究[66].将洋葱伯克氏菌G4 的甲苯降解质粒pTOM 引入到羽扇豆内生菌L.S.2.4 得到重组菌株VM1330,在根际添加该重组菌可以更好地保护植物,提高甲苯的降解量,并降低甲苯的蒸腾量进而减轻甲苯的植物毒害作用[73].另外,将越南伯克氏菌BU61 中甲苯降解相关的pTOM-TCE 质粒转入到柳树的根际菌Burkholderiasp.HU001 和根内生菌Pseudomonassp.HU002,可以促进植株地上部分的生物量,显著降低甲苯向大气的挥发,并且不影响柳树对Cd 的吸收[66].将PseudomonasputidaG7 的pNAH 质粒转入植物根系组织和根际的共生菌PseudomonasputidaVM1441 中,接种该重组菌后,植物和重组菌对萘的降解效率比单独植物修复提高40%,并可提高种子发芽率和植物蒸腾作用,减少萘对植物的毒害作用[74].
4 微生物全细胞传感器用于监测石油污染物(Application of microbial whole-cell sensors for monitoring petroleum hydrocarbon pollution)
微生物全细胞传感器是一种简单和经济的检测手段,可评估污染物的生物可利用性,并反映细菌活性和环境污染物毒性.一种微生物全细胞传感器是将含启动子、调控基因和报告基因的质粒转入到宿主菌,另一种是将报告基因融入到宿主菌的基因组中,在代谢基因的上游表达或者替代这些代谢基因[75].在特定污染物存在下,特异调控蛋白被激活并调控下游的报告基因发出信号,该信号强度与污染物的浓度存在相关关系,可用于污染物的检测和定量分析[76].报告基因主要是细菌荧光素酶基因(lux)、绿色荧光蛋白基因(gfp)和萤火虫荧光素酶基因(luc).
1990年,第一个用于检测萘的微生物全细胞传感器被成功构建[77].荧光假单胞菌(Pseudomonas fluorescens)5R 是从人工制气厂环境中分离出的菌株,其中降解萘的基因位于pKAl 质粒,其与NAH7 质粒有同源性.将含有费氏弧菌(vibriofischeri)的lux基因的质粒转入到P.fluorescens5R,通过转座子的转座作用,得到含有lux基因的萘代谢质粒pUTK21.然后,在含有萘或水杨酸环境中筛选含有该质粒的5RL 菌株,该菌株可累积水杨酸但不能完全矿化萘,表明lux插在了编码水杨酸羟化酶nahG基因的位置;进而,将pUTK21 通过结合方式转移到PseudomonasfluorescensHK9 获得HK44 重组菌株,此菌株不能降解萘但是可以降解水杨酸.该菌可以快速响应(15 min)萘暴露,并反映萘浓度的动态变化,可用于实时监测萘的降解活性[77].该菌株是首次应用在美国场地修复的基因工程菌[78].目前,已开发10 余种基于模式菌(如大肠杆菌)和烷烃降解菌(如假单胞菌和不动杆菌)的微生物全细胞传感器用于烷烃检测[75,79].例如,将调控烷烃降解酶基因表达的调控基因alkS、启动子PalkB和哈维氏弧菌(Vibrioharveyi)的luxAB基因的融合表达质粒转入大肠杆菌DH5α,该传感器可以用于烷烃检测,但不响应环烷烃和芳烃,其中辛烷的最低检出浓度为24.5 nmol·L−1[79].目前,石油污染物的全细胞传感器多采用基于质粒的报告系统,存在基因水平转移的风险.也有研究在不动杆菌属的ADP1 菌株的染色体上引入可被水杨酸特异性诱导的报告基因luxCDABE,获得的重组菌株AcinetobacterADPWH_lux可以响应低至0.5–1 μmol·L−1水杨酸[80].由于水杨酸是萘的重要代谢产物,将萘降解的基因nahAD引入该重组菌,可以使该菌有效降解萘,并用于快速检测天然水体和土壤中的萘[81].
面对复合污染问题,目前已经开发了多种微生物全细胞传感器用于不同污染物的同时响应.如在Pseudomonasputida引入phnS-luxCDABE和merR-egfp,可同时响应菲(0—60 mg·kg−1)和汞(0—0.24 mg·kg−1)[82].基于PseudomonasputidaN1 的菲生物传感器BMB-PL(含nah-luxCDABE的pCMPL 质粒)和基于Escherichiacoli的汞生物传感器BMB-ME1(含merR-pmerT-egfp的pGEX-ME 质粒),可用于同时测定土壤中生物可利用的菲和汞含量[83].另外,构建的大肠杆菌DH5α 2296-gfp(含pPROBE-Tbut-RBS-gfp-npt质粒)和DH5α 2301-cfp(含pPROBE-phn-RBS-cfp-npt质粒)可以分别响应BTEX 和PAHs,可用于定量1—100 μmol·L−1浓度范围的苯系物和多环芳烃,诱导时间为30 min[84].另外,基于AcinetobacterbaylyiADP1 菌株开发的生物传感器能同时检测烷烃和烷烃的中间产物,可用于监测天然烷烃的降解和外源烷烃的生物合成过程[85].
5 构建自毁程序减少降解工程菌的生态风险(Construction of conditional-suicide containment systems to reduce ecological risks from engineered microorganisms)
作为外来菌种,降解菌可能与土著菌群竞争,进而影响生态系统平衡;降解菌的基因也可能发生水平转移,造成基因污染.因此,微生物用于环境修复受到严格控制,一些地区禁止基因工程菌或者非土著菌用于生物强化修复.目前,用于降低工程菌环境风险的措施包括物理性遏制、自毁遏制、营养性遏制和语义性遏制[86].物理性遏制是将基因工程菌封闭或固定在生物反应器,但该措施仍存在一定风险;自毁遏制通常是将自杀基因及其调控通路引入到工程菌中,在特定化学或物理条件下诱导自杀基因的表达;营养性遏制是指通过敲除基因构建营养缺陷型菌株,使菌株无法在缺乏某营养物质下存活;语义性遏制是通过设计新的核苷酸、密码子或聚合酶等来阻止工程菌和天然菌株间的遗传信息共享[86].
目前,构建具有自杀控制功能的基因工程菌是降低降解菌环境风险的常用方法[87].多篇研究构建了针对石油烃的主动生物防御系统,使细菌在芳香烃污染物浓度低时启动细胞自杀程序,以减少外源菌的环境风险[88−91].在该系统中,将xylS、lacI和Pm启动子融合表达,芳香烃及其衍生物降解产生的苯甲酸等中间产物可作为XylS 蛋白的效应子来诱导Pm启动子和下游lacI基因的表达,进而生成LacI 蛋白质,而LacI 蛋白遏制自杀基因的表达;当这些污染物浓度不足以诱导Pm和下游LacI 表达时,自杀基因的表达不受抑制,因而导致细胞死亡[88].目前,该系统采用的自杀基因包括大肠杆菌编码毒性多肽的基因gef[88,89]、φX174 噬菌体编码裂解蛋白E 的基因[90]和亲和素链霉菌编码链霉亲和素的基因stv[91].另外,将XylS 替换为XylSthr45 可以改变效应子的特异性和亲和性,从而可用于更多污染物降解过程的控制[88].但是,这些基因工程菌在土壤中死亡速率仍较慢,且基因突变会导致一些菌株存活.在工程菌中引入多个自杀系统,即通过多种靶点和调控通路进一步降低工程菌的环境风险[86].例如,研究者将gef自杀系统引入天冬氨酸-β-半醛脱氢酶基因asd缺失的突变菌株中,并在染色体上融合表达Pm启动子和asd基因,采用双重自杀防御系统加快细菌死亡速率并减少突变体逃逸[89].
6 结论与展望(Conclusion and prospect)
微生物修复是一种经济可行的石油污染修复手段,但实验室分离和筛选的高效降解菌株在外界环境中的存活率和降解效果常不尽如人意.而且,面对越来越复杂的环境污染问题,微生物通过自然选择进化出的降解途径难以满足环境修复需求.因此,通过多种基因工程策略来改造微生物,可提高微生物的污染物降解能力和环境适应能力,并为环境修复提供有效解决思路.目前,基因工程菌在环境中的应用非常有限,以下几方面工作的开展将推动基因工程菌在环境修复中的应用.
(1)提高降解菌的降解能力和环境适应能力是微生物修复的关键,目前研究主要围绕污染物降解通路和关键酶进行改造,欠缺全细胞的代谢网络改造与优化.未来发展需结合基因组学、蛋白组学、转录组学和代谢组学等组学技术,继续发现功能基因、降解关键酶、调控蛋白和降解途径,寻找和开发更好的遗传操作工具,采用系统生物学和合成生物学思路从底盘选择、路径设计和代谢优化等方面对降解微生物进行代谢改造.
(2)在基因工程菌的实际应用中,基因工程菌的环境安全性是最受人们关注的问题.目前,通过在降解微生物中引入识别元件和报告元件可监测基因工程菌的存活状况和污染物的降解效果,而构建自毁程序可避免工程菌的过度繁殖和减少基因的水平转移.未来,需结合更多物理性遏制、自毁遏制、营养性遏制和语义性遏制等手段降低基因工程菌的潜在环境风险.
(3)构建基因工程菌用于降解酶和生物表面活性剂的规模生产,也是环境修复的重要发展方向.石油污染物的生物降解受限于污染物的生物可利用性、微生物活性和代谢酶活性等因素.生物表面活性剂可提高石油污染物的生物可利用性,酶修复则在更宽的pH 和温度范围下保证酶的活性和降解效果,二者的环境迁移性强且环境友好.构建稳定生产高活性降解酶和生物表面活性剂的基因工程菌将为石油污染的环境修复提供有效策略.
近些年,基因工程菌的构建已经从单个基因编辑发展为对整个微生物基因组和全细胞代谢网络的改造.但是,合成生物学在环境修复中的应用处于初始阶段,随着合成生物学和系统生物学在微生物环境修复中更广泛的应用,以及更多环境管理与风险评估工作的开展,基因工程菌在环境修复中展现良好的应用潜力.

