吉兰-巴雷综合征患者前驱感染与脑脊液蛋白-细胞分离现象的关系
王子豪?宋进?胡铭?张国荣?单方振?邢春叶?宋艳?乔保俊?王玉忠

【摘要】 目的 比較不同前驱感染阳性的吉兰-巴雷综合征(GBS)患者脑脊液蛋白-细胞分离现象以及蛋白水平差异,探讨前驱感染与GBS患者脑脊液蛋白升高的关系。方法 收集198例GBS患者的临床资料以及脑脊液分析结果,使用ELISA对患者血清进行14种感染性病原体血清学检测,分析不同前驱感染的GBS患者中脑脊液蛋白-细胞分离的比例及蛋白水平的差异。结果 55.1%(109/198)的GBS患者感染性病原体血清学阳性,主要为空肠弯曲菌23.7%(47/198)、甲型流感病毒20.7%(41/198)、乙型流感病毒15.2%(30/198),其中18.7%(37/198)的患者2种或以上病原体血清学阳性。73.7%(146/198)的患者存在脑脊液蛋白-细胞分离现象。在单一病原体血清学阳性患者中,空肠弯曲菌感染阳性患者的脑脊液蛋白-细胞分离现象为83.3%(25/30),甲型流感病毒感染阳性患者为100%(18/18),乙型流感病毒感染阳性患者为6/7,甲型肝炎病毒感染阳性患者为4/5,登革热病毒感染阳性患者为4/5,肺炎支原体感染阳性患者为4/4;EB病毒感染阳性、单纯疱疹病毒感染阳性、水痘带状疱疹病毒感染阳性患者各1例,均出现脑脊液蛋白-细胞分离现象;2种或以上病原体感染的患者中62.2%(23/37)出现脑脊液蛋白-细胞分离现象;无前驱感染者中66.3%(59/89)出现脑脊液蛋白-细胞分离现象。脑脊液蛋白-细胞分离现象在无前驱感染以及有不同类型前驱感染患者中的总阳性率比较差异有统计学意义(P = 0.007),但脑脊液蛋白水平比较差异无统计学意义(P >
0.05)。结论 GBS患者中脑脊液蛋白-细胞分离现象与前驱感染的类型有关,其中甲型流感病毒感染患者发生脑脊液蛋白-细胞分离现象的比例最高。
【关键词】 吉兰-巴雷综合征;前驱感染;脑脊液蛋白-细胞分离现象
Association between antecedent infection and albuminocytologic dissociation in cerebrospinal fluid of patients with Guillain-Barré syndrome Wang Zihao△, Song Jin, Hu Ming, Zhang Guorong, Shan Fangzhen, Xing Chunye, Song Yan, Qiao Baojun, Wang Yuzhong.△Qilu Medical College, Shandong University, Ji nan 250012, China
Corresponding author, Wang Yuzhong, E-mail: wangyuzhong_ni@163.com
【Abstract】 Objective To analyze the albuminocytologic dissociation in cerebrospinal fluid (CSF) and differences in CSF protein levels in Guillain-Barré syndrome (GBS)patients with various types of antecedent infections and investigate the correlation between antecedent infections and increased CSF protein levels in GBS patients. Methods Clinical data and CSF analysis results of 198 GBS patients were collected. Enzyme-linked immunosorbent assay (ELISA) was employed to detect 14 types of infectious pathogens in the serum of GBS patients. The proportion of albuminocytologic dissociation and the differences in CSF protein levels were analyzed in GBS patients with different antecedent infections. Results In total, 55.1% (109/198) of GBS patients had serological positivity for infectious pathogens, 23.7% (47/198) for Campylobacter jejuni, 20.7% (41/198) for Influenza A virus, 15.2% (30/198) for Influenza B virus. Among them, 18.7% (37/198) of GBS patients had serological positivity for two or more pathogens. In total, 73.7% (146/198) of GBS patients had albuminocytologic dissociation in CSF. Among single pathogen-positive patients, 83.3% (25/30) of Campylobacter jejuni positive patients showed albuminocytologic dissociation in CSF, 100% (18/18) of Influenza A virus patients, 6/7 of influenza B virus patients, 4/5 of Hepatitis A virus patients, 4/5 of Dengue virus patients, 4/4 of Mycoplasma pneumoniae patients, 1/1 of Epstein-Barr virus patients, 1/1 of herpes simplex virus patients, and 1/1 of Varicella-zoster virus patients had albuminocytologic dissociation in CSF. Among patients infected with two or more pathogens, 62.2% (23/37) showed albuminocytologic dissociation in CSF, while 66.3% (59/89) of GSB patients without antecedent infection had albuminocytologic dissociation in CSF. The positive rates of albuminocytologic dissociation in CSF exhibited significant differences among patients without and with various types of antecedent infections (P = 0.007), whereas no significant difference was noted in CSF protein levels (P > 0.05). Conclusion The albuminocytologic dissociation in CSF of GBS patients is correlated with the type of antecedent infection. The highest proportion of albuminocytologic dissociation in CSF is observed in patients with Influenza A virus infections.
【Key words】 Guillain-Barré syndrome; Antecedent infection; Albuminocytologic dissociation in cerebrospinal fluid
吉兰-巴雷综合征(GBS)是神经科最常见的自身免疫性周圍神经病,临床常表现为进行性加重的肢体无力,严重者可累及呼吸肌而危及生命[1-2]。脑脊液蛋白-细胞分离(细胞数正常而蛋白水平升高)是GBS患者的典型表现,可作为诊断GBS的关键依据[3-4]。以往的研究显示,病原体侵入人体后,抗原提呈细胞识别抗原并活化致病性T淋巴细胞,后者分泌一系列炎症因子破坏血脑屏障;一些蛋白因子,如IgG或IgM等可穿过受损的血脑屏障渗漏到脑脊液中,导致蛋白水平升高,这可能是GBS中脑脊液蛋白-细胞分离的原因[5-6]。
目前已经确定的与GBS发病相关的病原体包括空肠弯曲菌、巨细胞病毒、肺炎支原体、Epstein-Barr(EB)病毒、甲型流感病毒、乙型流感病毒、流感嗜血杆菌等[7-8]。不同感染性病原体引发的血脑屏障破坏程度及其对GBS患者脑脊液蛋白-细胞分离是否存在不同程度的影响,目前尚无相关报道。本课题组的前期研究表明,山东鲁西南地区53%(80/150)GBS患者前驱感染病原体以空肠弯曲菌、甲型流感病毒、乙型流感病毒和甲型肝炎病毒最常见[7]。本研究在前期研究的基础上扩大样本量进一步探讨了该地区的GBS患者前驱感染与脑脊液蛋白-细胞分离现象的关系,为进一步阐明该病的发病机制提供依据。
对象与方法
一、研究对象
本课题组于2013年10月启动了一项前瞻性研究,旨在明确山东省鲁西南地区GBS患者的前驱感染谱,截至2019年12月共纳入在济宁医学院附属医院就诊的226例符合2010版《中国吉兰-巴雷综合征诊治指南》中的GBS诊断标准的患者[7]。在患者明确诊断后、治疗前采集其外周静脉血,分离血浆并分装储存于-80℃冰箱。226例患者中有28例因未行腰椎穿刺而没被纳入本研究,最终纳入198例患者。本研究获得济宁医学院附属医院医学伦理委员会的批准(批件号:2013B017、2016-科-B006)。
二、研究方法
1.临床资料的收集
收集患者的临床资料,包括年龄、性别、入院时GBS残疾评分(GBS-DS)、高峰期GBS-DS、1年后GBS-DS,入院时医学研究理事会(MRC)评分、高峰期MRC评分、1年后MRC评分、从发病到高峰期的时间间隔、从发病到腰椎穿刺的时间间隔、脑脊液蛋白水平(参考值0.15~0.45 g/L)、脑脊液细胞数(<8×106/L)、电生理分型(Hadden标准)、高峰期腱反射、是否进行机械通气、是否存在感觉障碍、颅神经受累、疼痛等症状[9]。
2.血清学检测
选取14种感染病原体进行血清学检测,包括空肠弯曲菌、甲型流感病毒、乙型流感病毒、肺炎支原体、巨细胞病毒、甲型肝炎病毒、登革热病毒、EB病毒、单纯带状疱疹病毒、水痘-带状疱疹病毒、寨卡病毒、戊型肝炎病毒、流感嗜血杆菌、风疹病毒。14种病原体的ELISA操作步骤参照文献[10]进行。
三、统计学处理
采用GraphPad Prism 8.0.2进行数据分析。非正态分布的计量资料采用M(P25,P75)表示,组间比较采用秩和检验;计数资料采用例(%)表示,组间比较采用χ 2检验或Fisher确切概率法,两两比较用Bonferroni法。α=0.05,两两比较α=0.05/相互比较次数。
结 果
一、临床资料
198例GBS患者的临床资料见表1。
二、GBS患者前驱感染谱
55.1%(109/198)患者前驱感染病原体血清学检查阳性,其中空肠弯曲菌感染率为23.7%(47/198)、甲型流感病毒感染率为20.7%(41/198)、乙型流感病毒感染率为15.2%(30/198)、肺炎支原体感染率为20.7%(41/198)、甲型肝炎病毒感染率为5.1%(10/198)、登革热病毒感染率为4.5%(9/198)、单纯疱疹病毒感染率为4%(7/198)、巨细胞病毒感染率为2%(4/198)、EB病毒感染率为2%(4/198)、水痘-带状疱疹病毒感染率为2%(2/198),其中18.7%(37/198)的患者在GBS发病前感染的病原体≥2种。
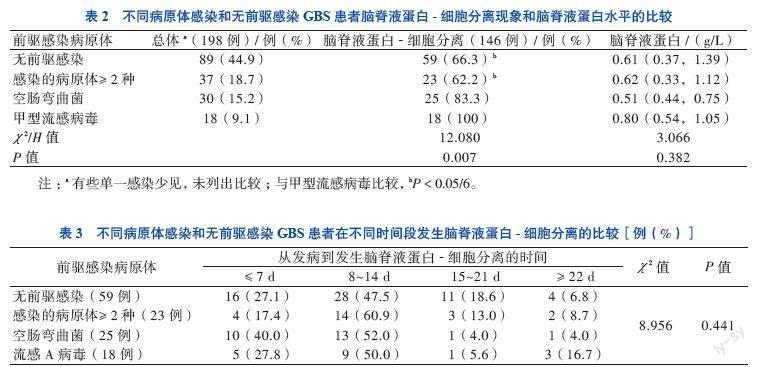
三、不同类型前驱感染的GBS患者脑脊液蛋白-细胞分离阳性率及蛋白水平的差异
在单一感染阳性患者中,甲型流感病毒感染阳性患者脑脊液蛋白-细胞分离阳性率为100%(18/18),空肠弯曲菌感染阳性患者为83.3%(25/30),感染的病原体≥2种患者为62.2%(23/37),无前驱感染的患者为66.3%(59/89)。有前驱感染和无前驱感染患者的脑脊液蛋白-细胞分离阳性率比较差异有统计学意义(χ 2=12.081,P =
0.007)。有前驱感染和无前驱感染患者的脑脊液蛋白水平比较差异无统计学意义(P > 0.05),见表2。感染不同病原体的患者和无前驱感染的患者在不同时间段发生脑脊液蛋白-细胞分离的构成比差异无统计学意义(χ 2 = 8.956,P = 0.441),见表3。
讨 论
本研究显示,55.1%的GBS患者有前驱感染,空肠弯曲菌、甲型流感病毒和乙型流感病毒是本组中国鲁西南地区GBS患者前驱感染的常见病原体。其中,空肠弯曲菌感染患者的比例与英国和荷兰报告的相似,但低于孟加拉国和90年代中国北方地区研究中的空肠弯曲菌感染比例[11-14]。由于空肠弯曲菌前驱感染与区域内卫生状况密切相关,其感染比例的下降反映了我国经济社会的快速发展、公民健康水平和居住环境的改善。目前已经证实,不同类型的病原体经分子模拟机制诱导机体产生针对不同靶抗原的自身免疫性抗体是导致GBS患者临床异质性的原因,例如,空肠弯曲菌胞壁上携带的脂多糖与人类周围神经轴索上表达的神经节苷脂(例如GM1和GD1a)存在结构相似性,即分子模拟,该种病原体感染人体后可诱导抗GM1、GD1a IgG抗体的产生,从而导致急性运动轴索型神经病的发生[15]。此外,巨细胞病毒感染可导致抗GM2抗体的产生而与脱髓鞘型GBS发病相关,肺炎支原体感染与抗半乳糖脑苷抗体则与儿童GBS有关[7, 16]。
本研究中的198例GBS患者脑脊液蛋白-细胞分离阳性率为73.7%,与荷兰的研究结果类似[14]。血脑屏障是一种物理屏障,以往的研究者认为GBS患者脑脊液中蛋白水平的升高是由于血脑屏障受损所致,并取决于其受损的程度[17-18]。在正常情况下,人体内的免疫球蛋白和炎症因子等大分子物質不允许通过血脑屏障,血脑屏障的破坏导致自身免疫性抗体和促炎细胞因子自血液系统进入周围神经系统,所以血脑屏障的损坏程度与急性期GBS的恶化密切相关[19]。在GBS的早期,患者脑脊液蛋白-细胞分离阳性率相对低,随着病程的进展,阳性率上升,对GBS患者的随访研究显示,脑脊液中蛋白含量越高,提示血脑屏障破坏的程度越高,患者的临床症状更严重[21-22]。一般认为,病原体浸入机体后激活宿主的自身免疫系统,树突状细胞首先通过捕获外源性病原体携带的抗原并激活致病性T淋巴细胞而破坏血脑屏障,同时这些树突状细胞可以产生干扰素和肿瘤坏死因子,诱导并促进B细胞的增殖分化,产生自身免疫性抗体(如抗神经节苷脂抗体),这些自身免疫性抗体可以通过受损的血脑屏障攻击髓鞘或轴索[23-24]。此外,有研究表明,当机体感染病毒时,病毒可以通过血液进入神经系统,在内皮细胞或星形胶质细胞中直接进行复制,破坏血脑屏障[25]。此外,病原体侵入人体后可以结合纤溶酶溶解细胞之间的紧密连接而加重血脑屏障破坏程度[25]。本研究中甲型流感病毒感染相关的GBS患者的脑脊液蛋白-细胞分离阳性率最高(100%),这提示甲型流感病毒更容易引发GBS患者血脑屏障的破坏。值得注意的是,本研究未显示不同类型的前驱感染患者脑脊液中的蛋白水平存在差异,这有待于更大样本量的研究再进一步证实。
综上所述,大部分GBS患者存在脑脊液蛋白-细胞分离现象,不同类型的前驱感染患者脑脊液蛋白-细胞分离阳性率存在差异,其中甲型流感病毒感染患者的阳性率最高。不同地域、环境、卫生会造成GBS感染性病原体谱的差异。本研究仅选取了中国北方局部鲁西南地区的198例GBS患者进行分析,后续仍应进行更大样本量的多中心研究。
参 考 文 献
[1] Sheikh K A. Guillain-barré syndrome[J]. Continuum Lifelong Learn Neurol, 2020, 26(5): 1184-1204.
[2] Shahrizaila N, Lehmann H C, Kuwabara S. Guillain-barré syndrome[J]. Lancet, 2021, 397(10280): 1214-1228.
[3] K?l?? B, Güng?r S, ?zg?r B. Clinical, electrophysiological findings and evaluation of prognosis of patients with Guillain-Barré syndrome[J]. Turk J Pediatr, 2019, 61(2): 200-208.
[4] Leonhard S E, Mandarakas M R, Gondim F A A, et al. Diagnosis and management of Guillain-Barré syndrome in ten steps[J]. Nat Rev Neurol, 2019, 15(11): 671-683.
[5] Bourque P R, Brooks J, Warman-Chardon J, et al. Cerebrospinal fluid total protein in Guillain-Barré syndrome variants: correlations with clinical category, severity, and electrophysiology[J]. J Neurol, 2020, 267(3): 746-751.
[6] Jawaid W, Sana R, Umer S R, et al. Relationship between cerebrospinal fluid protein level and electrophysiologic abnormalities in the acute inflammatory demyelinating polyradiculoneuropathy variant of Guillain-Barré syndrome[J]. Ger Med Sci, 2021, 19: Doc12.
[7] Hao Y, Wang W, Jacobs B C, et al. Antecedent infections in Guillain-Barré syndrome: a single-center, prospective study[J]. Ann Clin Transl Neurol, 2019, 6(12): 2510-2517.
[8] Leonhard S E, van der Eijk A A, Andersen H, et al. An international perspective on preceding infections in guillain-barré syndrome: the IGOS-1000 cohort[J]. Neurology, 2022, 99(12): e1299-e1313.
[9] Hadden R D, Cornblath D R, Hughes R A, et al. Electrophysiological classification of Guillain-Barré syndrome: clinical associations and outcome. Plasma Exchange/Sandoglobulin Guillain-Barré Syndrome Trial Group[J]. Ann Neurol, 1998, 44(5): 780-788.
[10] Wang Y, Shi Q, Lv H, et al. IgG-degrading enzyme of Streptococcus pyogenes (IdeS) prevents disease progression and facilitates improvement in a rabbit model of Guillain-Barré syndrome[J]. Exp Neurol, 2017, 291: 134-140.
[11] Rees J H, Soudain S E, Gregson N A, et al. Campylobacter jejuni infection and Guillain-Barré syndrome[J]. N Engl J Med, 1995, 333(21): 1374-1379.
[12] 曾剑睿, 宋进, 张国荣, 等. 吉兰-巴雷综合征急性期疼痛的发生率及其临床意义——附中国鲁西南地区单中心226例分析[J]. 新医学, 2022, 53(3): 177-181.
Zeng J R, Song J, Zhang G R, et al. Incidence and clinical significance of acute pain in patients with Guillain-Barré syndrome in Southwestern Shandong Province of China: 226 cases of a single-center study[J]. J New Med, 2022, 53(3): 177-181.
[13] Islam Z, Jacobs B C, van Belkum A, et al. Axonal variant of Guillain-Barre syndrome associated with campylobacter infection in Bangladesh[J]. Neurology, 2010, 74(7): 581-587.
[14] Ho T W, Mishu B, Li C Y, et al. Guillain-Barré syndrome in Northern China. Relationship to Campylobacter jejuni infection and anti-glycolipid antibodies[J]. Brain, 1995, 118 ( Pt 3): 597-605.
[15] Laman J D, Huizinga R, Boons G J, et al. Guillain-Barré syndrome: expanding the concept of molecular mimicry[J]. Trends Immunol, 2022, 43(4): 296-308.
[16] Meyer Sauteur P M, Huizinga R, Tio-Gillen A P, et al. Mycoplasma pneumoniae triggering the Guillain-Barré syndrome: a case-control study[J]. Ann Neurol, 2016, 80(4): 566-580.
[17] Segurado O G, Krüger H, Mertens H G. Clinical significance of serum and CSF findings in the Guillain-Barré syndrome and related disorders[J]. J Neurol, 1986, 233(4): 202-208.
[18] Tian J, Shi R, Liu T, et al. Brain infection by hepatitis E virus probably via damage of the blood-brain barrier due to alterations of tight junction proteins[J]. Front Cell Infect Microbiol, 2019, 9: 52.
[19] Stubbs E B Jr. Targeting the blood-nerve barrier for the management of immune-mediated peripheral neuropathies[J]. Exp Neurol, 2020, 331: 113385.
[20] Rasmussen M K, Mestre H, Nedergaard M. Fluid transport in the brain[J]. Physiol Rev, 2022, 102(2): 1025-1151.
[21] Gonzalez-Quevedo A, Carriera R F, OFarrill Z L, et al. An appraisal of blood-cerebrospinal fluid barrier dysfunction during the course of Guillain Barré syndrome[J]. Neurol India, 2009, 57(3): 288-294.
[22] 王胜会, 张丽丽, 乔保俊, 等. Guillain-Barré综合征患者脑脊液蛋白水平与疾病严重性及预后的关系[J]. 临床神经病学杂志, 2019, 32(3): 171-175.
Wang S H, Zhang L L, Qiao B J, et al. Association of protein levels in cerebrospinal fluid with the disease severity and prognosis of patients with Guillain-Barré syndrome[J]. J Clin Neurol, 2019, 32(3): 171-175.
[23] Ebrahim Soltani Z, Rahmani F, Rezaei N. Autoimmunity and cytokines in Guillain-Barré syndrome revisited: review of pathomechanisms with an eye on therapeutic options[J]. Eur Cytokine Netw, 2019, 30(1): 1-14.
[24] Huizinga R, van Rijs W, Bajramovic J J, et al. Sialylation of Campylobacter jejuni endotoxin promotes dendritic cell-mediated B cell responses through CD14-dependent production of IFN-β and TNF-Α[J]. J Immunol, 2013, 191(11): 5636-5645.
[25] Chaves A J, Vergara-Alert J, Busquets N, et al. Neuroinvasion of the highly pathogenic influenza virus H7N1 is caused by disruption of the blood brain barrier in an avian model[J]. PLoS One, 2014, 9(12): e115138.
(收稿日期:2023-08-05)
(本文編辑:洪悦民)

