火焰原子吸收光谱测定葡萄糖酸锌口服液中锌含量
许锦帆,朱信宇,杨科,杨尔文,赵之翰,陈秋同,李泓毅,程晋凯,孙一骏,王京,3,陈朗星,2,唐安娜,2,*
1 南开大学化学学院,天津 300071
2 南开大学分析科学研究中心,天津市生物传感与分子识别重点实验室,天津 300071
3 南开大学化学国家级实验教学示范中心,天津 300071
1 自主实验选题
南开大学实验教学中心积极鼓励本科生开展自主实验,培养学生在基础仪器分析实验教学的基础上进行深度学习;提高学生的创新性意识、自主能动性和积极性;培养学生将理论知识与实际应用相结合,解决生活中一些实际问题的能力[1]。学生组成实验小组,根据兴趣进行实验选题,设计实验内容,在教师指导下完成实验。实验选题可面向基础性研究,或聚焦创新性,或贴近生活实际。
锌是人体必需的微量元素之一,在人体生长发育过程中起着极其重要的作用。锌有帮助生长发育、智力发育、提高人体免疫力、促进食欲的作用。儿童和青少年生长发育速度较快,对锌营养的需求量较高,但往往因为饮食搭配不合理,造成锌摄入量不足。
葡萄糖酸锌为有机锌补剂,对胃黏膜刺激小,在体内易被人体吸收,且溶解性好,被广泛应用于保健品、医药和食品中。葡萄糖酸锌口服液是生活中常见的补锌类非处方药,用于治疗因缺锌引起的营养不良、厌食症、口腔溃疡、儿童生长发育迟缓等疾病[2]。
原子吸收光谱法(Atomic Absorption Spectrometry,AAS)是基于待测元素气态基态原子对共振辐射吸收而建立的元素定量分析方法,具有选择性好、灵敏度高和重现性好等优点。
通过本科生自主实验,原子吸收实验组同学建立了火焰原子吸收光谱法测定葡萄糖酸锌口服液中锌含量的分析方法。采用标准曲线法和标准加入法测定其中锌的含量,并对实验结果进行分析讨论。本实验测定葡萄糖酸锌口服液中锌含量,选题贴近生活,解决实际问题,可激发学生对化学的兴趣。同时运用仪器分析基础课程中“原子吸收光谱”的知识,加深学生对标准曲线法、标准加入法、检出限、灵敏度、线性范围等概念的理解(图1)。

图1 自主实验设计思维导图
2 自主实验设计
2.1 仪器与试剂
HITACHI ZA3000原子吸收分光光度计;Zn空心阴极灯;吸量管;移液器;容量瓶;10 μg·mL−1Zn标准储备液;葡萄糖酸锌口服液;浓硝酸。
2.2 仪器工作条件选择
狭缝宽度1.3 nm;助燃气压力160 kPa,流量15.0 L·min−1;乙炔流量1.8 L·min−1;火焰测量高度7.5 mm;波长213.9 nm,灯电流5.0 mA。
2.3 锌标准系列的制备
采用了预实验的方法寻找线性范围,即先在包含未知样浓度(参考值)的范围内取相隔距离较大的几个点,完成测试后作图并拟合相关系数。为了进一步增加实验的准确性,使绘制标准曲线所用样品的浓度尽可能接近未知样的浓度,在预实验中线性关系良好的范围内进一步缩小浓度范围,取点配制溶液、测试、绘制标准曲线,最终得到了用于实际样品测试的标准曲线。
按表1配制方法用移液管在50 mL容量瓶中加入含锌10 μg·mL−1的高标溶液并加入两滴浓硝酸溶液,配制标准样并以此绘制标准曲线。

表1 配制标准样所用的试剂用量
2.4 葡萄糖酸锌口服液样品的稀释
采用逐级稀释方法稀释葡萄糖酸锌口服液样品:在50 mL容量瓶中加入2滴浓硝酸溶液,加入约5 mL超纯水稀释,取合适体积的样品,以5倍、10倍和10倍的稀释倍率将其逐级稀释500倍,定容摇匀,备用[3,4]。
2.5 未知液(增量系列)的配制
按表2配制方法采用标准加入法配制未知样,用移液管取2.50 mL稀释50倍的样品溶液加入50 mL容量瓶完成1000倍的稀释,再加入不同体积的标准溶液及两滴浓硝酸,配制未知样及增量系列并以此绘制标准加入曲线。

表2 配制未知样所用的试剂用量
2.6 数据的测量
(1) 在仪器最佳工作条件下,以空白溶液调吸光度等于0,按浓度由低到高检测标准系列及增量系列,记录吸光度值,用于制作标准曲线及标准加入曲线,求出未知液中锌含量。
(2) 在同样条件下,连续测定6次Zn的空白溶液(标1),用于计算该方法的检出限。
(3) 在同样条件下,连续测定6次Zn未知液1,用于计算该方法的相对标准偏差[5]。
3 实验结果
3.1 标准曲线法
各标准溶液的浓度和吸光度如表3所示,作标准曲线如图2。

表3 各标准溶液的吸光度值
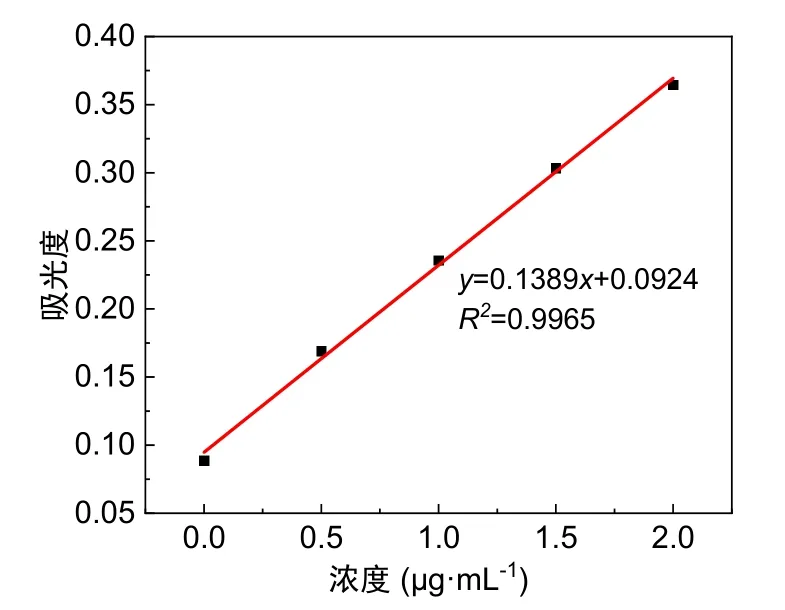
图2 标准加入法测定Zn含量

图2 标准曲线法测定Zn含量
(1) 未知样浓度。
标准曲线方程为:y= 0.1451x+ 0.01733,在0.00–3.00 μg·mL−1范围内呈良好的线性关系。稀释500倍后的未知样吸光度为0.1855,由标准曲线求出样品浓度为579.50 μg·mL−1。
(2) 特征浓度。
由1.00 μg·mL−1Zn标准溶液的吸光度值求特征浓度[6]c0:
(3) 方法相对标准偏差(RSD)。
由未知样的6次测量结果求出RSD值为0.43%。
(4) 灵敏度S。
灵敏度即标准曲线的斜率,S= 0.1451。
(5) 检出限DL。
3.2 标准加入法
各组加入Zn浓度及吸光度如表4所示,作标准加入法吸光度曲线(图3)。

表4 各未知溶液的吸光度值
(1) 未知样浓度。
标准加入曲线方程为:y= 0.1389x+ 0.0924,在0.00–2.00 μg·mL−1范围内呈良好的线性关系。用外推法求出样品浓度为665.23 μg·mL−1。
(2) 方法相对标准偏差(RSD)。
由未知1的6次测量结果求出RSD值为0.12%。
(3) 灵敏度S。
灵敏度即曲线的斜率,S= 0.1389。
4 深入讨论
4.1 标准曲线法和标准加入法的分析比较
采用标准曲线法在绘制好标准工作曲线后,可以直接从标准曲线上读出含量,尤其适用于大量样品的分析,但该方法存在基体干扰。在绘制标准曲线时,一般使用的是待测组分的标准样品(或已知准确含量的样品),但是实际样品的组成千差万别,也必将由于基体不同影响测定的准确度。标准加入法可以消除基体干扰,克服基体复杂时待测样品与标准溶液组成不相同带来的影响。对于基体组成未知的实际样品测定,一般标准加入法得到的结果会更为准确。
4.2 对稀释过程中相对误差的讨论
在实验中对样品稀释500倍时,可采用两种稀释方法:使用50 mL容量瓶进行逐级稀释,或直接使用1000 mL容量瓶进行一次稀释。在稀释过程中,影响稀释相对误差的主要因素有:稀释步骤的选取、移取待稀释样品的过程以及稀释容器本身的定容体积。假设欲将一浓度为C的样品经一次或多次稀释后稀释至Cx浓度,则Cx的计算公式为:
式中,V1i为各次被稀释样品的量入体积,V2i为各次样品的定容体积,n为稀释次数,则稀释所带来的误差完全由量器和定容的最大相对误差决定。若忽略稀释过程中认为恒定的个人误差,稀释浓度Cx相对误差的计算便可转化为一系列量器相对误差的计算。根据最大相对误差的计算法则及Cx的计算公式,可以导出其最大相对误差的计算公式为:
式中,|δ|是稀释之后样品浓度的最大相对误差;是各移液管的容量最大相对误差;|δ2n|是各容量瓶的容量最大相对误差。
因此,当将一样品的浓度稀释至定值时,稀释的步骤越少,被稀释样品的取样量和定容体积越大,那么稀释以后样品浓度的最大相对误差就会相应减小[3]。由此可以看出,在理想条件下一次稀释由于涉及的移液和定容操作少,稀释浓度的相对误差比逐级稀释小。但上述讨论所作的假设是个人误差在两种稀释方法中恒定。实际上,考虑到1000 mL的容量瓶比50 mL的容量瓶更难混合均匀等实际因素,且标液的配制体积过大,所以并不可取。
5 结语
在本实验中,我们使用标准曲线法和标准加入法测定了葡萄糖酸锌口服液中锌的含量。由于所用的样品为未知样,相较于仪器分析实验中所提供的提前配制或已经经过多次检测的样品具有更大的不确定性,且测试方法相关的参数未知。因此需要自行摸索仪器工作参数、样品的稀释倍数、线性范围、标准加入法的加入体积等,建立一套分析方法。在完成仪器分析的理论课学习后,同学们对检出限、灵敏度、线性范围等概念缺乏直观和深入的认识。本实验通过自行摸索条件,建立分析方法,进而完成对未知样品的测试并对实验结果进行分析探讨。该自主实验的开展,有利于基础阶段教学型实验向研究型实验的过渡,有助于培养学生应用分析技术解决生活中实际问题的能力。

