激活转录因子4与哺乳动物雷帕霉素靶蛋白复合物1互作调控奶牛乳蛋白合成的研究进展
程凤琦 卜登攀 徐连彬
(1.青岛农业大学动物科技学院,青岛 266109;2.中国农业科学院北京畜牧兽医研究所,动物营养学国家重点实验室,北京 100193)
《中国奶业质量报告(2021)》指出,到2025年我国奶业将实现全面振兴,基本实现现代化;奶源基地、乳品质量和产业竞争力整体水平进入世界先进行列[1]。蛋白质饲料资源供应不足是限制我国畜牧业发展的重要因素之一。据我国海关统计,近些年我国饲用蛋白质饲料对外依存度长期保持在80%以上,且需求及进口价格一直呈上涨趋势[2]。奶牛业是我国优先发展的畜牧业,经过改革开放以来的规模扩张和调整提高2个发展阶段,已具备向现代化转型、向世界一流迈进的产业基础,但我国奶牛生产效率仍然有提升空间,饲粮氮利用效率仅为发达国家的75%左右[3],进一步加剧了蛋白质饲料资源的供需矛盾并造成了巨大的环保压力。因此,我国奶业肩负着推动碳达峰、碳中和目标的责任与使命。实际生产中,低蛋白质饲粮基础上补饲特定氨基酸(amino acid,AA)可提高奶牛的饲粮氮转化效率,但指导其应用的理论基础尚不清晰。已有研究表明,所有AA补充时可激活哺乳动物雷帕霉素靶蛋白复合物1(mammalian target of rapamycin complex 1,mTORC1)通路促进乳蛋白的合成,而AA缺乏可通过激活转录因子4(activating transcription factor 4,ATF4)抑制mTORC1的活性,提示ATF4与mTORC1之间的互作为研究限制性AA在低蛋白质饲粮条件下调控乳蛋白合成的机制提供了重要切入点。本文就此相关内容进行了综述,以期为完善奶牛限制性AA理论和指导低蛋白质饲粮的配制提供一定参考。
1 低蛋白质饲粮添加AA促进奶牛乳蛋白合成
与生长动物相比,泌乳奶牛的饲粮氮转化效率偏低。Hristov等[4]根据846个生产试验数据所做的荟萃分析表明,奶牛饲喂17.8%蛋白质水平的牧草型饲粮时,饲粮氮利用效率仅为25%。相比发达国家,这一问题在我国奶牛养殖业中尤为严重。白雪利等[5]在调查中原地区25个奶牛场后发现,饲粮蛋白质水平为15%时,饲粮氮利用效率仅为26%,造成了饲料资源的大量浪费。影响泌乳奶牛氮利用效率的营养因素包括营养水平、养分构成和能氮平衡[6],其中饲粮蛋白质水平的影响不容忽视。大量研究表明,低蛋白质饲粮可有效促进氮的利用。Liu等[7]研究发现,与高蛋白质饲粮相比,泌乳高峰期奶牛饲喂低蛋白质饲粮有较高的牛奶蛋白质效率和总蛋白质效率。AA是蛋白质的重要组成部分,也是哺乳动物上皮细胞增殖和酪蛋白质合成的调节因子[8-9]。一系列奶牛饲喂和灌注试验表明,适度降低饲粮蛋白质水平的基础上添加特定AA可在维持生产性能的前提下提高摄入氮向乳蛋白的转化,从而节约蛋白质饲料资源[10-11]。Haque等[12]发现证明,降低饲粮蛋白质摄入并向十二指肠直接灌注一定比例的组氨酸(histidine,His)、赖氨酸(lysine,Lys)、蛋氨酸(methionine,Met)和亮氨酸(leucine,Leu)可显著提高泌乳奶牛饲粮氮转化效率。Lee等[13]发现,在降低饲粮蛋白质水平的同时,补饲过瘤胃Met没有降低奶牛的产奶量和乳蛋白产量。以上结果提示,“低蛋白质加AA”饲喂策略促进饲粮氮的转化,但指导其进一步生产应用的理论基础急需阐明。
2 mTORC1
哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是一种非典型的丝氨酸(serine,Ser)/苏氨酸(threonine,Thr)蛋白激酶,属于磷脂酰肌醇-3-激酶相关蛋白激酶(phosphatidylin-ositol-3-kinase-related protein kinase,PIKK)家族,可对营养水平和生长信号做出反应。mTOR包括mTORC1和哺乳动物雷帕霉素靶蛋白复合物2(mammalian target of rapamycin complex 2,mTORC2)这2种不同蛋白质复合物。其中mTORC1可整合来自AA、细胞应激、能量状态和生长因子等信号,通过促进合成代谢和抑制分解代谢调节细胞的生长与分化[14]。如图1所示[15],mTORC1由mTOR、哺乳动物雷帕霉素靶蛋白调节相关蛋白(Raptor)、40 ku富含脯氨酸的蛋白激酶B底物(proline-rich Akt substrate of 40 ku,PRAS40)、含有DEP结构域的哺乳动物雷帕霉素靶蛋白相互作用蛋白(DEP domain containing mTOR interacting protein,Deptor)和哺乳动物致死性SEC13蛋白8(mammalian lethal with SEC13 protein 8,mLST8)组成。AA是一类调节mTORC1信号通路的信号分子,具体表现为通过抑制其下游真核起始因子4E结合蛋白1(eukaryotic initiation factor 4E binding protein 1,4E-BP1)活性控制翻译起始效率,通过刺激真核延伸因子-2(eukaryotic elongation factor-2,eEF-2)蛋白磷酸化水平增加翻译延伸效率,通过激活核糖体蛋白S6激酶1(ribosomal protein S6 kinase,S6K1)增强核糖体生物活性[16]。前人研究发现,饲粮蛋白质水平和吸收后AA供给变化影响乳腺mTORC1信号通路和乳蛋白的合成[17-18]。Duan等[19]研究发现,补充Met可能激活mTORC1信号通路,进一步增加奶牛乳腺上皮细胞(cow mammary epithelial cells,CMECs)中L型氨基酸转运蛋白1(L-type amino acid transporter 1,LAT1)及其相关蛋白4F2重链(4F2 heavy chain,4F2hc)的表达,从而影响乳蛋白的合成。剥夺所有AA或去除Leu或异亮氨酸(isoleucine,Ile)分别影响牛乳腺组织中S6K1蛋白磷酸化和酪蛋白合成[20]。eEF-2也被认为受mTOR控制,经AA激活后,哺乳动物mTORC1的靶标磷酸化eEF-2,最终刺激mRNA翻译起始和伸长[21],因此eEF-2是乳蛋白合成的一个重要限制因素[22]。例如培养基中去除所有必需氨基酸(essential amino acid,EAA)增加了牛乳腺组织中eEF-2的磷酸化水平[20]。此外,4E-BP1在Thr37/46位点的磷酸化被认为是翻译起始率的一个指标[23]。4E-BP1的磷酸化还对多种AA有反应,例如Ile、Thr和Leu等[24]。进一步的分析发现,mTORC1及其下游S6K1和4E-BP1的磷酸化水平与乳蛋白合成速率存在显著正相关[25]。以上结果提示,mTORC1是乳蛋白合成的一个重要调控靶点。

Amino acids:氨基酸;GDP:二磷酸鸟苷 guanosine diphosphate;GTP:三磷酸鸟苷 guanosine triphosphate;mTORC1:雷帕霉素靶蛋白质复合物1 mammalian target of rapamycin complex 1;mTOR:哺乳动物雷帕霉素靶蛋白 mammalian target of rapamycin;RagA/B、RagC/D:Rag异二聚体的激活形式 Rag heterodimers activation form;Raptor:哺乳动物雷帕霉素靶蛋白调节相关蛋白 mammalian target of rapamycin regulatory related protein;Deptor:有DEP结构域的哺乳动物雷帕霉素靶蛋白相互作用蛋白 DEP domain containing mTOR interacting protein;mLST8:哺乳动物致死性SEC13蛋白8 mammalian lethal with SEC13 protein 8;PRAS40:40 ku富含脯氨酸的蛋白激酶B底物 proline-rich Akt substrate of 40 ku;4E-BP:真核起始因子4E结合蛋白 eukaryotic initiation factor 4E binding protein 1;ULK1:UNC-51样激酶1 UNC-51 like kinase 1;TFEB1:脂蛋白质1 lipoprotein 1;LIPIN1:磷脂酸磷酸酶lipin1 phosphatidic acid phosphatase lipin1;HIF1α:缺氧诱导因子1α hypoxia-inducible factor 1α;ATF4:激活转录因子4 activating transcription factor 4;Protein synthesis:蛋白质合成;Lipid metabolism:脂质代谢;Cellular proliferation:细胞增殖;Autophagy:自噬。
3 ATF4
哺乳动物拥有超过50种碱性亮氨酸拉链[basic (region-leucine) zipper,bZIP]蛋白,其中包括ATF4[26]。在ATF4中,bZIP结构域外的序列约占蛋白质的82%,其包含ATF4的大部分已知翻译后修饰位点,参与调节ATF4的稳定性、定位和激活基因转录等生物过程[27-31]。ATF4及靶基因的构成如图2所示[32]。ATF4可通过调节目的基因的表达促使细胞适应特定的外部刺激[33],该过程称为整合应激反应(integrated stress response,ISR),由AA缺乏诱导的一般性调控阻遏蛋白激酶2(general control nonderepressible kinase 2,GCN2)和内质网应激诱导的蛋白激酶R样内质网激酶(protein kinase R-like endoplasmic reticulum kinase,PERK)介导[34]。ATF4参与调节炎症反应[35]、胰岛素分泌[36]、自噬[37-38]和内质网应激[39-40]等重要生物过程。近年来关于ATF4调控乳蛋白合成的报道日益增多。GCN2对真核起始因子2α(eukaryotic initiation factor 2α,eIF2α)磷酸化促进ATF4的选择性翻译诱导基因表达,使机体适应AA缺乏从而使体内AA恢复平衡[41]。Torrence等[42]通过NanoString数字基因定量技术发现ATF4的几十个靶基因涉及AA合成、一碳代谢和AA转运功能等。Park等[32]同样证实大量ATF4靶基因参与AA转运系统,例如阳离子AA转运蛋白——溶质载体家族7成员α1(solute carrier family 7 member α1,SLC7α1,又称CAT1)、支链AA转运蛋白——溶质载体家族7成员α5(solute carrier family 7 member α5,SLC7α5,又称LAT1)以及多种AA转运蛋白质的伴侣——溶质载体家族3成员α5(solute carrier family 3 member α2,SLC3α2)。Edick等[43]研究证明在CMECs中,联合缺乏精氨酸(arginine,Arg)、Leu和Lys或者Arg单独缺乏1、4、8和24 h情况下,ATF4的下游适应AA缺乏的特异性靶基因天冬酰胺合成酶(asparagine synthetase,ASNS)和SLC7α1表达上调。以上结果表明,ATF4是AA转运、合成及蛋白质合成的一个重要调控靶点。
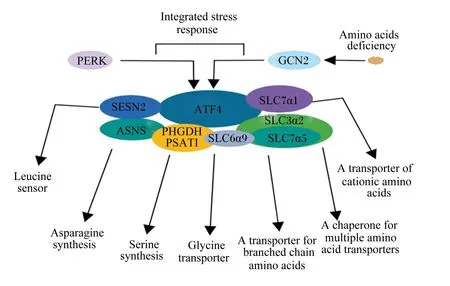
Integrated stress response:整合应激反应;Amino acids deficiency:氨基酸缺乏;PERK:蛋白激酶R样内质网激酶 protein kinase R-like endoplasmic reticulum kinase;GCN2:一般性调控阻遏蛋白激酶2 general control nonderepressible kinase 2;SESN2:Sestrin 2;ASNS:天冬酰胺合成酶 asparagine synthetase;PHGDH PSATI:磷酸甘油酸脱氢酶 phosphoglycerate dehydrogenase;SLC6α9:溶质载体族6成员α9 solute carrier family 6 member α9;SLC7α5:溶质载体家族7成员α5 solute carrier family 7 member α5;SLC3α2:溶质载体家族3成员α2 solute carrier family 3 member α2;SLC7α1:溶质载体家族7成员α1 solute carrier family 7 member α1;Leucine sensor:亮氨酸传感器;Asparagine synthesis:天冬酰胺的合成;Serine synthesis:丝氨酸合成;Glycine transporter:甘氨酸转运体;A transporter for branched chain amino acids:支链氨基酸的转运体;A chaperone for multiple amino acid transporters:多种氨基酸转运体的伴侣;A transporter of cationic amino acids:阳离子氨基酸的转运体。
4 ATF4与mTORC1互作调控蛋白质合成
4.1 AA缺乏介导ATF4抑制mTORC1
低蛋白质饲粮补饲AA技术的一个重要特征是减少奶牛饲粮蛋白质和AA的摄入。当蛋白质缺乏或AA不平衡时,可以激活哺乳动物的AA响应信号通路,该过程包括空载转运RNA(transfer RNA,tRNA)激活的GCN2、eIF2α磷酸化和ATF4表达改变等一系列级联反应,最终导致mTORC1的活性下降并抑制蛋白质的翻译过程[44]。ATF4与mTORC1互作调控蛋白质合成途径如图3所示[45]。最近的研究进一步明确了ATF4对mTORC1的调控作用,敲除ATF4基因的小鼠胚胎成纤维细胞(mouse embryonic fibroblasts,MEFs),mTORC1对Leu的缺乏表现出持续的激活状态[46]。Yu等[47]证实在CMECs中,葡萄糖通过ATF4-Sestrin 2(SESN2)-腺苷酸激活蛋白质激酶(AMP-activated protein kinase,AMPK)-mTORC1途径促进细胞生长和酪蛋白合成。Condon等[44]利用全基因组CRISPR筛选发现,激活ATF4抑制了mTORC1信号通路进而中断线粒体功能;并发现在寡霉素诱导下,ATF4介导的发育调控以及DNA损伤响应1(regulated in development and DNA damage 1,REDD1)或SESN2的表达上调抑制mTORC1活性。同样,Jang等[46]研究证明,在二甲双胍诱导下,ATF4介导的REDD1和SESN2表达上调在mTORC1抑制中起着重要作用。在AA缺乏的细胞中,ATF4翻译增多并通过抑制整体蛋白质合成速度,从而缓解AA缺乏对细胞产生的影响[48]。SESN2是一种高度保守的蛋白质,可在多种应激条件下诱导表达,抑制mTORC1活性是SESN2的关键下游功能[49-50]。关于AA缺乏下ATF4调控mTORC1的作用途径,Luo等[45]研究发现ATF4诱导的SESN2负调控CMECs中AA介导的mTORC1通路和随后的酪蛋白质合成。Liu等[51]进一步证实SESN2可以通过AMPK-mTORC1信号传导抑制mTORC1途径。目前Luo等[45]已证实CMECs中AA剥夺通过ATF4诱导SESN2的表达进而抑制mTORC1通路,并随后通过SH3结构域结合蛋白4(SH3 domain-binding protein 4,SH3BP4)抑制酪蛋白合成。Chen等[52]也发现谷氨酰胺(glutamine,Glu)触发一般AA控制(the general amino acid control,GAAC)途径增加ATF4水平,从而上调如SLC7α5等AA转运蛋白,增加AA摄取并提高细胞内AA水平,重新激活mTORC1并抑制自噬。鉴于mTORC1对蛋白质合成的影响,以上结果证实,ATF4蛋白介导AA缺乏抑制mTORC1,进而抑制乳蛋白的合成。
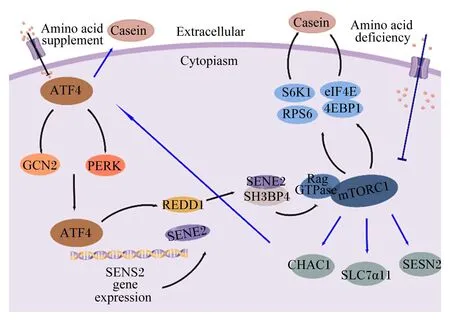
Amino acid supplement:氨基酸补充剂;Amino acid deficiency:氨基酸缺乏;Extracellular:细胞外;Cytopiasm:细胞质;Casein:酪蛋白;ATF4:激活转录因子4 activating transcription factor 4;GCN2:一般性调控阻遏蛋白质激酶2;PERK:蛋白激酶R样内质网激酶 protein kinase R-like endoplasmic reticulum kinase;SENS2 gene expression:SENS2基因表达;REDD1:发育调控以及DNA损伤响应1 regulated in development and DNA damage 1;SH3BP4:SH3结构域结合蛋白质4 SH3 domain-binding protein 4;S6K1:核糖体蛋白S6激酶1 ribosomal protein S6 kinase;eIF4E:真核起始因子4E eukaryotic initiation factor 4E;RPS6:核糖体蛋白S6 ribosomal protein S6;4E-BP1:真核起始因子4E结合蛋白1 eukaryotic initiation factor 4E binding protein 1;Rag GTPase:Rag鸟苷三磷酸酶 Rag guanosine triphosphatase;CHAC1:ChaC谷胱甘肽特异性γ-谷氨酰环转移酶1 ChaC glutathione specific gamma-glutamylcyclotransferase 1;SLC7α11:溶质载体家族7成员α11 solute carrier family 7 member α11;SESN2:Sestrin 2。
4.2 补充AA通过mTORC1调控ATF4相关靶基因
低蛋白质饲粮补饲AA技术的关键是筛选适宜的AA添加种类。以往研究表明,补充AA可通过mTORC1通路调控乳蛋白合成,最新的研究证实ATF4蛋白在其中发挥重要作用。Park等[32]研究发现,抑制mTORC1影响了HEK-293T细胞中ATF4相关靶基因的表达;富集分析发现这些基因参与AA代谢、AA转运和tRNA氨酰基转移酶活性,后者与乳蛋白合成密切相关,证实了ATF4蛋白部分介导了AA补充下mTORC1对乳蛋白合成的调控作用。Adams[53]研究发现,ATF4可调节哺乳动物细胞中mTORC1信号通路与AA摄取、AA合成、tRNA生成的结合,进而影响翻译效率与蛋白质的合成。进一步分析表明,mTOR可在2种水平上控制ATF4的表达。在转录水平上,mTOR抑制主要通过增加降解过程来减少ATF4 mRNA的表达丰度并影响其稳定性;而在翻译水平上,mTOR则通过上游开放阅读框(upstream open reading frame,uORF)依赖的方式控制ATF4的翻译,且该过程不依赖eIF2α的磷酸化[32]。4E-BP1同样介导了mTOR调控的ATF4翻译抑制[54]。此外,Chen等[52]发现Glu缺乏影响一般AA控制途径,从而促进ATF4表达上调,但补充Glu后通过SLC7α5阻断ATF4表达上调。Luo等[45]研究发现,在AA补充的CMECs中,mTORC1与酪蛋白合成的相关蛋白质表达增加,但ATF4诱导的SESN2及SH3BP4相关蛋白质表达下降。Leu剥夺抑制了MEFs中mTORC1的活性,但ATF4的缺乏消除了该种抑制作用,提示ATF4可直接或通过mTORC1间接感知AA的供给变化[42]。以上结果表明,“AA供给-mTORC1激活-ATF4靶基因-蛋白质翻译”是低蛋白质饲粮下补饲AA调控乳蛋白合成的一条重要途径,由于ATF4与mTORC1互作为近年提出,目前相关模型大多为医学模型,在反刍动物上应用较少,但因其在平衡AA供给和乳蛋白合成方面的重要作用,因此关键AA的筛选及其差异作用机制还需进一步研究。
5 小 结
低蛋白质饲粮添加AA技术包含蛋白质减少和AA补充2方面。ATF4蛋白质可介导AA缺乏对mTORC1的抑制作用,进而降低乳蛋白的合成;反之,AA补充可激活mTORC1磷酸化,并通过调控ATF4相关靶基因的表达影响乳蛋白合成,提示ATF4与mTORC1互作在平衡AA供给与乳蛋白合成时发挥重要作用。然而,不同单一AA及多种AA配比组合对ATF4-mTORC1互作的差异化影响还需进一步研究,相关结果可为生产中低蛋白质饲粮的配制提供重要理论依据。
——雷帕霉素

