SOX9活化Wnt/β-catenin信号通路对食管鳞状细胞癌细胞增殖的影响
张之钰,王良海,徐贵璇,李 锋,陈 红
食管癌病死率位居全球恶性肿瘤的第6位[1]。我国是食管癌高发地区,其中约90%为食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC)[2]。食管癌的发生是由环境因素(如吸烟、饮酒、饮食等)和遗传因素(如甲基化、表观遗传学改变等)等多因素、多途径相互作用的复杂过程[3-5]。近年来癌症在诊断和治疗等方面虽发展飞速,但食管癌的5年生存率仍不足30%[6]。因此,揭示食管癌发生、发展的分子机制对探寻其有效的治疗靶点十分必要。
SOX9是SRY-type HMG box(Sex determining region Y-related high-mobility-group box)基因家族成员之一,主要参与早期胚胎发育的调控[7]。最近有研究表明SOX9与胃腺癌[8]、肝细胞癌[9]、结直肠癌[10]等消化道肿瘤的进展密切相关。在食管癌中,SOX9被证实呈高表达[11-12]。本团队前期研究发现,SOX9与miR-203a、YAP和linc-ROR共同参与ESCC的发生、发展[13-15]。然而,SOX9调节ESCC进展的分子机制尚未完全阐明,本实验通过探讨SOX9过表达对ESCC细胞增殖能力和相关通路的影响,旨为进一步明确ESCC发生、发展机制及靶向治疗提供理论基础和实验依据。
1 材料与方法
1.1 临床资料收集2015~2021年首都医科大学附属北京朝阳医院和石河子大学医学院第一附属医院存档的188例ESCC手术切除标本和134例癌旁正常组织,患者年龄34~78岁,中位年龄59.5岁。患者术前均未接受任何放、化疗。标本均经两位高年资病理医师复阅。本实验经我院伦理委员会批准,患者均知情同意。
1.2 细胞和主要试剂人类ESCC细胞系Eca109、TE-1由我院医学研究中心保留并传代。Total RNA Kit I购自OMEGA公司,SuperQuickRT MasterMix(for Real-Time PCR)、UltraSYBR Mixture购自北京康为世纪公司,胎牛血清和RPMI Medium 1640培养液购自美国GBICO公司,Lipofectamine 2000 Regent购自美国Invitrogen公司,CCK-8购自日本同仁公司,RIPA真核细胞裂解液、PMSF、PVDF膜购自北京Solarbio公司,ECL高敏化学发光检测试剂盒购自美国Thermo公司,SOX9(AB5535)抗体购自Millipores公司,β-catenin(sc-7963)抗体购自Santa公司,LGK974购自MCE公司,免疫组化试剂盒购自北京中杉金桥公司,siRNA和过表达SOX9的慢病毒由上海吉玛制药公司设计与构建,qRT-PCR相关引物由上海生工公司合成。
1.3 方法
1.3.1组织芯片制备 设计组织芯片排版,使用组织芯片蜡块制备仪制作空白受体蜡块,孔径设定为2 mm,HE染色切片由病理医师重新判读,在显微镜下标记肿瘤区域和癌旁正常组织各2处,用穿刺针将标记区域组织取出按照排版顺序和方向依次填入空白受体蜡块上提前打好的孔中。将制备好的组织芯片蜡块于42 ℃烤30 min,室温冷却后再烤10 min,直至组织与蜡块充分融合。
1.3.2免疫组化 采用免疫组化EnVision法检测SOX9蛋白表达。将石蜡组织芯片4 μm厚切片置于防脱玻片上烤片60 min,脱蜡,水化,用EDTA高压抗原热修复,内源性过氧化物酶灭活封闭,添加一抗SOX9(稀释比1 ∶600)4 ℃冰箱孵育过夜,PBS冲洗后加适量酶标抗兔IgG聚合物37 ℃孵育30 min,PBS缓冲液震洗,DAB显色2 min,清水冲洗后苏木精复染,脱水,封片。
结果判读:SOX9免疫组化结果由两位高年资病理医师独立阅读,高倍镜下观察切片,阳性染色评分标准以着色强度和着色细胞数综合判断:(1)按阳性细胞染色强度评分:未着色为0分,淡棕黄色为1分,棕黄色为2分,棕褐色为3分;(2)按阳性细胞百分比评分:无阳性细胞为0分,阳性细胞数≤25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分。将两项得分结果相乘作为最终评分:<4分为低表达,≥4分为高表达。
1.3.3细胞培养和转染 细胞系Eca109、TE-1均常规培养于含10%胎牛血清的RPMI 1640培养液中,37 ℃、5%CO2培养细胞。将状态良好处于对数生长期的Eca109、TE-1细胞接种于6孔板中继续培养,当细胞生长融合为50%~60%时,参照Lipofectamine 2000转染试剂说明书,给TE-1细胞分别转染siSOX9和siNC;在严格遵守慢病毒操作手册前提下,将Eca109细胞转染过表达SOX9和Vector病毒。siSOX9序列:正义链5′-GGAGACUUCUGAACGAGAGTT-3′,反义链3′-CUCUCGUUCAGAAGUCUCCTT-5′。
1.3.4全转录组芯片HTA2.0(Affymetrix) 本团队提供Eca109-Vector和Eca109-SOX9细胞样品,由北京康普森生物公司进行全转录组芯片检测。使用Expression Console(version 1.4.1,Affymetrix)软件处理原始数据文件,提取原始探针信号值,使用RMA算法对原始探针信号值进行背景校正和标准化。然后使用Transcriptome Analysis Console(version 3.0,Affymetrix)软件对不同分组进行差异分析和可变剪接分析,统计学检验使用单因素方差分析结果的显著性。
1.3.5qRT-PCR 使用Total RNA Kit I试剂盒提取细胞总RNA,提取RNA后用RNA琼脂糖电泳检测RNA的完整性,电泳结果为出现28S、18S条带,且28S条带的亮度约为18S条带的2倍,则认定RNA样品合格;随后用酶标仪检测RNA样品OD260 nm/280 nm,数值位于1.8~2.0为合格样品。参照反转录试剂盒说明书将RNA反转录为cDNA,用cDNA为模板进行PCR扩增。PCR反应条件:预变性95 ℃ 600 s,1个循环;变性95 ℃ 15 s,退火/延伸60 ℃ 60 s,40个循环。所用引物序列见表1。

表1 引物序列
1.3.6CCK-8 将5 000个细胞接种于96孔板中,每组5个复孔,根据实验设计使用不同浓度(0、0.25、0.5、1、2 μmol/L)LGK974处理细胞,将孔板置于培养箱(37 ℃、5%CO2)中分别培养0、1、2、3天,根据时间点取出孔板利用酶标仪在450 nm条件下检测OD值并记录。
1.3.7Western blot法 收集细胞,加入按RIPA ∶PMSF=100 ∶1比例配制的裂解液,离心后吸取上清液,用Nano Drop分光光度计检测蛋白样品的纯度和浓度,通过加入细胞裂解液使各管样品浓度一致,用10%SDS聚丙烯酰胺凝胶电泳分离,加入一抗SOX9(稀释比1 ∶1 000)、β-catenin(稀释比1 ∶200)和β-actin(稀释比1 ∶10 000)4 ℃孵育过夜,二抗(稀释比1 ∶10 000)室温孵育2 h,按照发光试剂说明书步骤在暗室中曝光。用Image J软件对结果进行灰度值分析。
1.4 随访患者术后定期电话随访,开始时间为手术之日,平均每6个月随访1次,以患者死亡时间为截止时间,中途失访者将最后1次随访时间纳入生存分析,随访截至2023年3月。
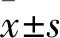
2 结果
2.1 ESCC和癌旁正常组织中SOX9的表达免疫组化结果显示,SOX9蛋白表达主要位于癌细胞胞核(图1A)。188例ESCC中111例(111/188,59%)呈SOX9蛋白高表达,134例癌旁正常组织中22例(22/134,16.4%)呈SOX9高表达。SOX9在ESCC组织(4.58±3.04)中的表达显著高于癌旁正常组织(1.56±2.08,P<0.001,图1B)。
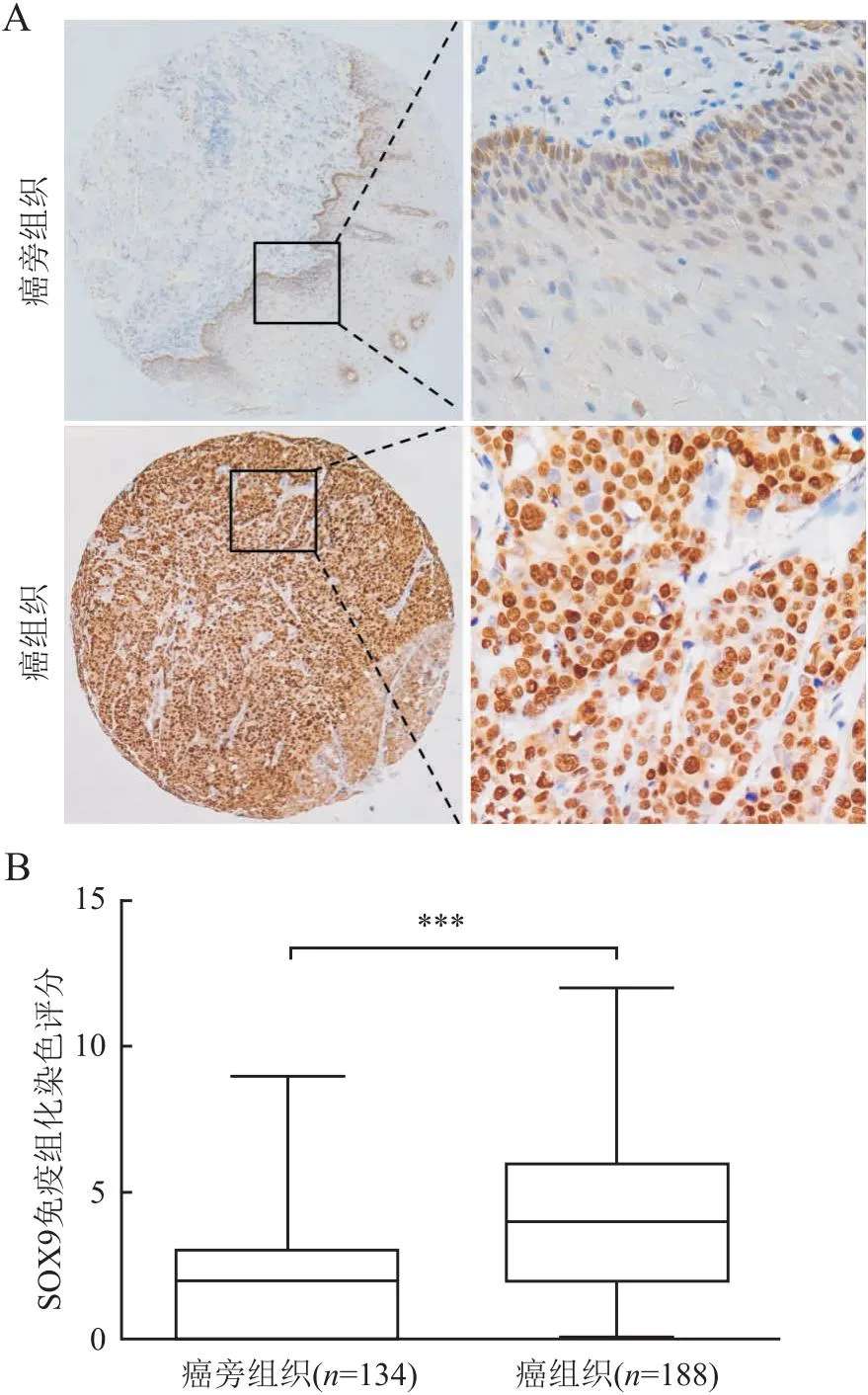
图1 A. 食管鳞状细胞癌组织和癌旁正常组织中SOX9的表达,EnVision法;B.食管鳞状细胞癌和癌旁正常组织中SOX9的表达评分,***P<0.001
2.2 SOX9表达与ESCC临床病理特征的相关性SOX9表达与ESCC患者性别、年龄和TNM分期均无关,与肿瘤分化程度和浸润深度有关(P<0.05,表2)。其中,SOX9蛋白在低分化组中的高表达率(83.3%,20/24)明显高于高分化组(51.8%,28/54)和中分化(57.3%,63/110)组。

表2 SOX9表达与食管鳞状细胞癌临床病理特征的关系
2.3 SOX9表达与ESCC患者预后的关系188例中58例患者获得随访,随访1~96个月,中位生存期35.2个月。Kaplan-Meier曲线显示SOX9高表达患者的生存率明显低于SOX9低表达患者,两组间差异有统计学意义(P<0.05,图2)。
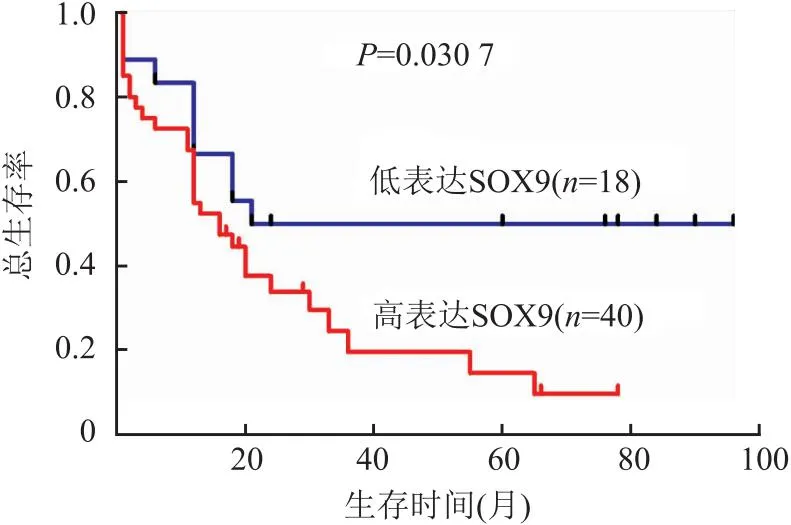
图2 SOX9表达与食管鳞状细胞癌患者总生存率的关系
2.4 SOX9对Wnt/β-catenin信号通路的影响全转录芯片检测发现,Eca109-SOX9中Wnt/β-catenin通路的关键分子WNT5A、AXIN2和FZD7的表达显著高于Eca109-Vector(图3A)。干扰TE-1中SOX9表达后,qRT-PCR检测显示,WNT5A(0.77±0.068)、AXIN2(0.81±0.023)和FZD7(0.83±0.047)的mRNA表达显著低于对照组(P均<0.01,图3B)。Western blot法检测结果显示,过表达SOX9后活化/非磷酸化β-catenin蛋白表达水平比对照组明显增高,干扰SOX9后活化/非磷酸化β-catenin的蛋白表达水平明显降低(图3C)。
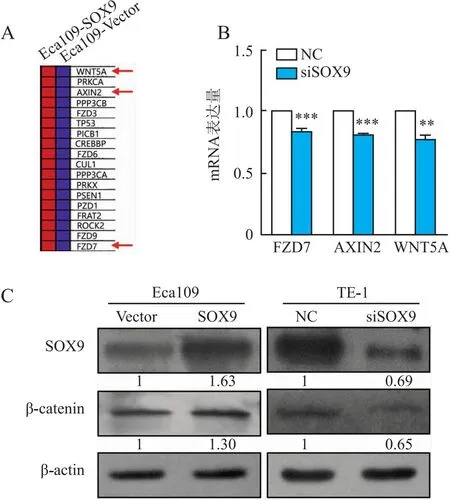
图3 SOX9对Wnt/β-catenin信号通路的影响:A.热图显示Eca109-Vector与Eca109-SOX9中Wnt信号通路相关分子的表达差异;B.qRT-PCR分析干扰TE-1中SOX9的表达,Wnt/β-catenin通路中关键分子WNT5A、AXIN2和FZD7 mRNA的表达,**P<0.01,***P<0.001;C.SOX9蛋白和活化/非磷酸化β-catenin蛋白在Eca109-Vector、Eca109-SOX9和TE-1-NC、TE-1-siSOX9中的表达
2.5 LGK974对ESCC细胞增殖的影响用不同浓度(0、0.25、0.5、1、2 μmol/L)LGK974处理高表达SOX9的细胞系(TE-1、Eca109-SOX9),CCK-8结果显示,LGK974抑制TE-1(P<0.05,图4A)、Eca109-SOX9(P<0.05,图4B)细胞的增殖能力。

图4 不同浓度LGK974处理后TE-1(A)、Eca109-SOX9(B)细胞增殖能力的变化,***P<0.001
2.6 SOX9调节LGK974对ESCC细胞增殖的影响用1 μmol/L LGK974分别处理Eca109-Vector、Eca109-SOX9细胞,CCK-8结果显示LGK974对低表达SOX9的Eca109-Vector细胞增殖能力无影响,却能显著降低Eca109-SOX9的增殖能力(P<0.001,图5)。
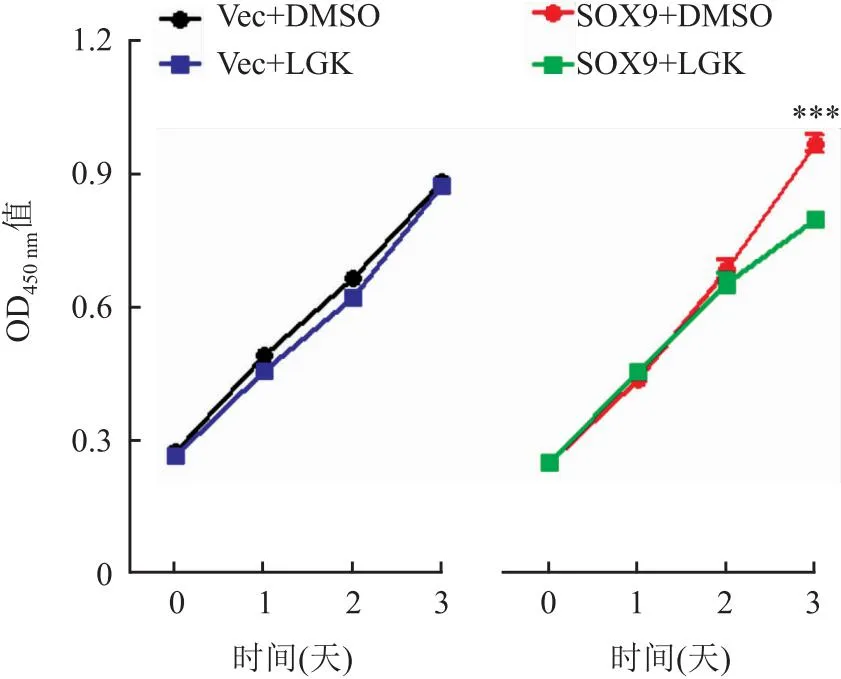
图5 SOX9表达对LGK974抑制ESCC细胞增殖能力的影响,***P<0.001
2.7 LGK974对SOX9蛋白表达的影响用不同浓度(0、0.25、0.5、1、2 μmol/L)LGK974处理高表达SOX9的细胞系TE-1(图6),Western blot法检测结果显示SOX9蛋白表达不受LGK974调节。

图6 Western blot法检测LGK974对SOX9蛋白表达的影响
3 讨论
本实验采用免疫组化法检测ESCC组织中SOX9的表达,结果发现SOX9在ESCC组织中的表达显著高于癌旁正常组织(P<0.001),并且高表达SOX9患者的总生存率明显低于低表达者(P<0.05),这与SOX9在胰腺癌[16]、前列腺癌[17]、肝癌[18]和非小细胞肺癌[19]等肿瘤中的作用一致。此外,SOX9蛋白表达与ESCC患者性别、年龄和TNM分期无关,而与肿瘤分化程度和浸润深度有关(P<0.05),表明随着疾病恶性程度的增加,SOX9蛋白高表达的患者增多,提示SOX9可能是一项对诊断和预后有重要指导意义的指标。
前期研究发现SOX9在Eca109中低表达,在TE-1中高表达[14],因此本实验在Eca109中构建过表达模型,在TE-1中构建沉默模型。通过对全转录组芯片检测结果进行生物信息学分析发现,过表达SOX9的Eca109-SOX9细胞中WNT5A、AXIN2和FZD7表达显著高于对照组。WNT5A是Wnt蛋白家族重要成员之一,主要介导激活非经典Wnt信号通路,目前已证实WNT5A参与多种肿瘤的发生、发展,但其在不同肿瘤中所扮演的角色可能完全相反[20]。AXIN2是Wnt/β-catenin信号通路中的重要调节因子,参与细胞增殖、分化、迁移、凋亡等多种生物学功能[21]。FZD7是Wnt/β-catenin信号通路的重要受体,已被证实可促进肿瘤生长、转移、肿瘤干细胞特性维持和耐药等[22]。这就提示SOX9可能调节Wnt/β-catenin信号通路,这与在肝癌[23]、非小细胞肺癌[24]、结直肠癌[25]中的研究结果一致。本实验干扰TE-1细胞中SOX9的表达后,用qRT-PCR检测WNT5A、AXIN2和FZD7,结果提示干扰组mRNA表达水平显著低于对照组,且差异有统计学意义。进一步检测发现,在Eca109中过表达SOX9,活化/非磷酸化β-catenin蛋白表达水平比对照组明显增高,干扰TE-1中SOX9的表达后β-catenin蛋白表达水平显著降低。上述结果证实了SOX9可能活化Wnt/β-catenin信号通路。
众所周知,小分子化合物LGK974是Wnt特异性酰基转移酶Porcupine抑制剂,通过阻止Wnt配体的十六烷酰化,阻断Wnt的包膜外运输,进而抑制β-catenin过度生成,最终抑制细胞的过度生长。有研究证明LGK974在多种肿瘤进展中具有抑制作用[26],但在ESCC中的相关研究证据较少。临床上食管癌患者的主要治疗方法为手术切除和化疗,治疗效果不尽人意,因此靶向药物的研发将是ESCC治疗的重点和热点。本实验设计检测不同浓度LGK974对高表达SOX9 ESCC细胞TE-1、Eca109-SOX9和Eca109-Vector细胞增殖能力的影响,来进一步验证SOX9能否通过Wnt信号通路对ESCC增殖产生影响,并验证LGK974作为ESCC治疗的潜在价值。结果显示LGK974可显著抑制高表达SOX9细胞的增殖能力,却对低表达SOX9的Eca109细胞无影响,这提示LGK974对细胞增殖能力的抑制作用可能需要SOX9的介导。为验证SOX9表达是否受LGK974影响,本实验用LGK974处理内源性高表达SOX9的细胞系TE-1,结果显示SOX9蛋白表达不受LGK974调节。本实验证实了SOX9能通过Wnt信号通路抑制ESCC的增殖,并为LGK974作为一种治疗高表达SOX9 ESCC患者的靶向药物提供了证据。
综上所述,SOX9在ESCC组织中表达上调,与肿瘤分化程度和浸润深度相关,同时SOX9高表达与ESCC患者的不良预后明显相关。SOX9可通过Wnt/β-catenin通路促进ESCC细胞的增殖,提示SOX9可能参与ESCC的发生、发展,有望成为ESCC预后的生物学标志物和治疗靶点。但由于本实验只分析了SOX9通过Wnt/β-catenin通路对ESCC细胞增殖能力的影响,两者对ESCC其它生物学行为的作用还需进一步研究。

