ZnMnCr-LDHs的制备及其对磷酸盐吸附性能研究
刘 畅,李 阳,张晓静,崔宝玉,崔节虎
(郑州航空工业管理学院,河南 郑州 450046)
0 引 言
近年来,磷肥的大量投入使用导致水体中存在过量的磷酸盐,成为水富营养化的主要原因之一[1]。过量的磷元素会导致水系自净功能过载,形成水体富营养化,致使藻类过度生长,破坏水质,对生态系统及人类健康造成多种危害[2]。2020 年我国生态环境部将总磷、化学需氧量和高锰酸钾指数并称为三大水环境污染指标,因此总磷的降低受到越来越多的关注[3]。针对磷酸根去除,常见的方法包括吸附法、活性污泥法、化学沉淀法等[4]。其中,吸附法因其高效、简单等优点备受学者青睐[5]。吸附法中最主要的材料就是吸附剂,吸附剂的种类繁多,如活性炭、聚丙烯酰胺、木质素等,不同的吸附剂对污染物拥有不一样的效果。但随着水污染问题的加剧,普通吸附剂已经无法满足污染物种类和数量上的需求,因此,具有出色性能且制备简单的水滑石类化合物(LDHs)引起了学者的关注。
水滑石类化合物(LDHs)是一种新型的层片状结构无机功能材料,具有可交换性[6]。由于其强大的离子交换能力、较大的比表面积、高效的分散性、记忆效应、热稳定性以及独特的纳米结构等优点,LDHs 材料在废水处理方面具有广阔的应用前景[7]。
层状双金属氢氧化物(LDHs)纳米材料的制备方法主要有共沉淀法[8]、离子交换法[9]、水热合成法[10]等。其中,水热法是较为常用的制备方法之一,可制备出结晶度较好、晶体纯度高、形貌可控的LDHs 材料[11]。此外,通过控制反应时间、温度以及添加引导试剂等反应参数,可以获得不同形态和尺寸的LDHs 材料。目前对LDHs 纳米材料的制备和吸附性能研究较少,因此,寻找一种可行方法来控制LDHs 材料的微观形貌对提高其吸附磷的能力至关重要[12][13]。
本研究以水热法制备三元ZnMnCr-LDHs纳米材料,对三种金属元素的摩尔比例进行探究,并利用SEM、XRD 等表征手段对吸附剂进行结构形貌分析,通过各种模型对实验数据进行拟合,分析LDHs 纳米材料对磷酸盐的吸附机理。
1 实验部分
1.1 主要仪器与试剂
扫描电子显微镜(日本电子株式会社);U-4100型紫外可见吸收光谱仪(日本高新);IS5 型傅里叶变换红外光谱仪(费尔伯精密仪器);X-射线衍射分析仪(德国布鲁克);Zeta 电位分析仪(郑州长城科工贸)。
硝酸锌、钼酸铵(天津科密欧);四水合硝酸锰、硝酸铬(分析纯,上海阿拉丁);三乙醇胺(分析纯,天津恒兴);磷酸二氢钾(分析纯,天津致远);酒石酸锑钾(分析纯,天津风船)。
1.2 材料制备
采用水热合成法制备。控制三种金属盐总摩尔数为0.01 mol,按一定比例称取于烧杯中,搅拌溶液均匀后,逐滴加入1 mL 的三乙醇胺,继续搅拌至混合物均匀后转移至反应釜内衬中。置反应釜于110 ℃的鼓风干燥箱中反应2h。完成后将生成物重复洗涤,60 ℃恒温干燥后研磨过筛,即得到ZnMnCr-LDHs 纳米材料的粉末。按上述方法,改变ZnMnCr 比例为3∶1∶1、3∶1∶2、3∶1∶3,分别命名为ZnMnCr-LDHs-1、 ZnMnCr-LDHs-2、 ZnMnCr-LDHs-3。
1.3 吸附实验
称取一定量三种ZnMnCr-LDHs 纳米材料加入双层石英管中,加入20 mL 一定浓度磷酸盐溶液,搅拌一定时间,离心后将上清液转移至比色管中。在比色管中加入去离子水定容,并滴加显色剂。待显色剂充分反应15 分钟后,在720 nm 处使用紫外分光光度计测定溶液的吸光度。同理通过改变吸附剂投加量、pH、反应时间、反应温度去测定吸附后溶液中磷酸盐含量和去除率。磷酸盐的吸附量Qe和去除率η可通过以下公式计算:
式中:C0、Ce分别为磷酸盐的初始浓度和剩余浓度mg/L;V为磷酸盐液体体积L;m为吸附剂用量g。
吸附动力学。在条件为pH 5、100 mg/L 初始浓度、吸附剂投加量为15 mg 的情况下,可以在5 分钟—120 分钟内分别取样并测定吸光度。通过测定的吸光度数据,可以计算出材料对磷酸盐的吸附量。通过以下模型公式对数据进行拟合。
式中:Qt为t 时磷酸盐吸附量mg/g;t为吸附时长min;k1,k2为准一级和准二级动力学方程常数。
吸附热力学。在pH 为5,磷酸盐溶液的初始浓度为100 mg/L,投加量为15 mg,吸附时间为90 min的条件下,设定温度为15℃—35℃,测定吸光度,可以计算出材料对磷酸盐的吸附量。由以下公式可以计算出吸附过程的焓变△H、自由能△G和熵变△S。
式中:T为反应的温度K;R为理想气体状态常数;K0为常数;x为溶液中磷酸盐的摩尔分数。
吸附等温线。在pH 为5,吸附时间为90 min,投加量为15 mg 条件下,分别在不同的磷质量浓度条件下测定吸光度,计算材料对磷酸盐的吸附量。采用以下模型公式对数据进行拟合。
式中:Qm为吸附剂的最大吸附量mg/g;KL、KF为Langmuir 和Freundlich 吸附常数;n为吸附常数。
2 结果与讨论
2.1 扫描电子显微镜(SEM)表征
图1(a)—(c)是不同比例的ZnMnCr-LDHs 纳米材料的SEM 图。图1a 中可以看出ZnMnCr-LDHs-1 颗粒与颗粒之间分散度较高,表面有较多的小孔。图1b 中的ZnMnCr-LDHs-2 颗粒较图1(a)有所堆叠,状态较为紧密。图1c 中的ZnMnCr-LDHs-3 较图1(b)呈现更为紧密的状态。在一定程度上,结晶度图1(c)>图1(b)>图1(a)。

图1 ZnMnCr-LDHs的SEM图
2.2 X射线衍射(XRD)表征
从图2中可以看出,纳米材料均显示出典型的水滑石结构特征峰,ZnMnCr-LDHs-1 的2θ 值为9.47°、19.52°、33.17°、59.34°处分别对应(003)(006)(012)(110)晶面的衍射峰,存在典型的LDHs 特征峰。ZnMnCr-LDHs-2 材料在2θ 为9.65°、19.61°、33.29°、59.32°处分别对应(003)(006)(012)(110)晶面的衍射峰,存在典型的LDHs 特征峰[14]。ZnMnCr-LDHs-3材料在2θ 为9.63°、19.67°、33.31°、59.51°处分别对应(003)(006)(012)(110)晶面的衍射峰,存在典型的LDHs 特征峰。3 个ZnMnCr-LDHs 均显示出含有典型的金属振动峰,并且硝酸盐基团被证明成功插层到吸附剂的层间。

图2 ZnMnCr-LDHs的XRD图
2.3 红外光谱(FT-IR)表征
图3 为ZnMnCr-LDHs-1、ZnMnCr-LDHs-2 和ZnMnCr-LDHs-3 纳米材料的红外光谱图。571—573 cm-1处的吸收峰可能是M—O(M 为Zn、Cr、Mn)的拉伸振动,证明金属阳离子的成功进入而导致的晶格振动[15];LDHs 材料上NO3-的不对称伸缩振动对应的是1384 cm-1处的吸收峰,强烈的吸收峰证明了LDHs材料中阴离子的存在[16]。

图3 ZnMnCr-LDHs的FT-IR图
材料上-OH 的弯曲振动对应1618—1623 cm-1处的吸收峰,与层间水分子和-OH 的弯曲振动有关,证明该材料存在层间结晶水[17];而LDHs 材料上-OH 的伸缩振动,由3416—3424 cm-1处的吸收峰所对应[18]。以上的红外结果表明,3 种ZnMnCr-LDHs 均显示出含有典型的金属振动峰,并且硝酸盐基团被证明成功插层到吸附剂的层间。
2.4 Zeta电位分析
图4 可以看出ZnMnCr-LDH 的零电荷点(PZC)分别为5.97、5.87、6.21。在pH≥6时,粒子都带有负电荷,说明材料吸附过程主要由层间阴离子交换为主,且ZnMnCr-LDH 通过脱质子产生了负表面电荷,影响了静电相互作用,导致去除能力的下降。当pH<6 时,ZnMnCr-LDHs 粒子都带有正电荷,说明材料除了层间阴离子交换,还存在有表面吸附,且ZnMnCr-LDH具有较高的pHpzc,通过强静电吸引在3—6 的pH 范围内保持稳定吸附。pH 在3—10 的范围内Zeta 电位基本都处于(±30)—(±35)之间,说明了悬浊物不太稳定,在水处理过程中,废水与材料容易发生分离[19],证明了材料具有一定的循环性能。

图4 ZnMnCr-LDHs的Zeta电位图
2.5 吸附性能
2.5.1 溶液pH和投加量对吸附性能的影响
测得磷酸盐溶液原始pH 为5.42,将pH 调节至3—9,常温下吸附60 min 后,分别测定吸光度,并计算材料平衡吸附量。由图5(a)可知,pH 对于三种ZnMnCr-LDHs 纳米材料均有一定的影响,在pH 范围为3—6 时,材料对于磷酸盐去除率都稳定在99%以上。磷酸盐去除率在pH>6 时,随着pH 增大而降低,可能是溶液中OH-的数量随着pH 值的增加而不断增加,导致与磷酸盐竞争吸附位点,从而降低了去除效率[20。综上所述,吸附实验所用的磷酸盐溶液均采用原始pH值。

图5 pH(a)和吸附剂投加量(b)对吸附效果影响
由图5(b)可以看出,当投加量为5 mg 时,吸附剂上的吸附位点不足,且被完全占据,导致吸附率较低。当投加量为5—15 mg 时,位点被弥补,使吸附率逐渐提升,15 mg投加量之后吸附率基本上趋于平衡,可能是经过快速吸附后位点已达到饱和,过剩使位点利用率降低[21]。根据上述分析,吸附实验所投加的ZnMnCr-LDHs纳米材料为15 mg。
2.5.2 磷酸盐的初始浓度和吸附时间对吸附性能的影响
图6(a)为磷酸盐初始浓度对ZnMnCr-LDHs 纳米材料吸附效果的影响。随着设定的磷酸盐初始浓度增加,三种材料的吸附量均呈增加趋势,材料吸附量分别由0 增加至715.2 mg/g、714.8 mg/g、714.7 mg/g,这可能是因为高的浓度梯度所产生的传质驱动力克服了阻力,磷酸盐和吸附剂间的接触概率增加,从而使更多磷酸盐被吸附剂所吸附[22]。
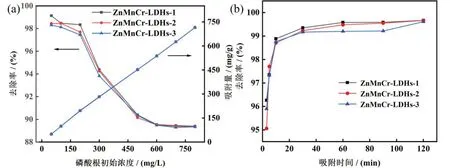
图6 磷酸盐初始浓度(a)和吸附时间(b)对吸附效果影响
图6(b)为吸附时间对ZnMnCr-LDHs 纳米材料对磷酸盐吸附性能的影响。去除率在0—10 min内飞速攀升至99%左右;纳米材料的吸附效果在40 min后基本达到平衡,ZnMnCr-LDHs 纳米材料的平衡吸附量分别为132.89 mg/g、132.89 mg/g、132.81 mg/g。在吸附初期,高浓度的磷酸盐离子与水滑石表面形成较大差异,传递驱动力受浓度梯度影响而较高,因此吸附速率快。但吸附一定时间后,大部分吸附剂的吸附位点被磷酸盐离子占据,吸附剂表面传递驱动力降低,吸附逐渐达到平衡状态。
2.5.3 温度对吸附性能的影响
如图7 所示,在15°C—35°C 区间,ZnMnCr-LDHs的去除率随温度增高而增加的幅度不大。由于温度增加对去除率影响并不大,且增加温度要增加额外消耗,因此后续实验都选择在室温下进行。
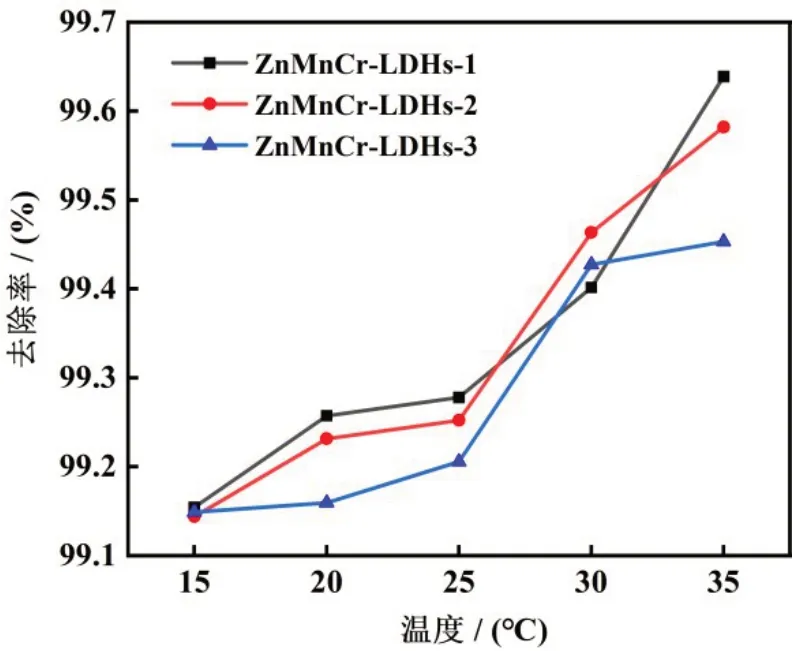
图7 温度对吸附效果的影响
2.5.4 吸附动力学和热力学
根据表1 的数据,我们发现准一级和准二级动力学模型的拟合决定系数(R2)都较高。但用准二级动力学模型来描述ZnMnCr-LDHs吸附磷酸盐的吸附过程更为贴切,并且吸附过程主要是由化学吸附引起的[23],其拟合出的理论吸附量也更贴近实际吸附量。
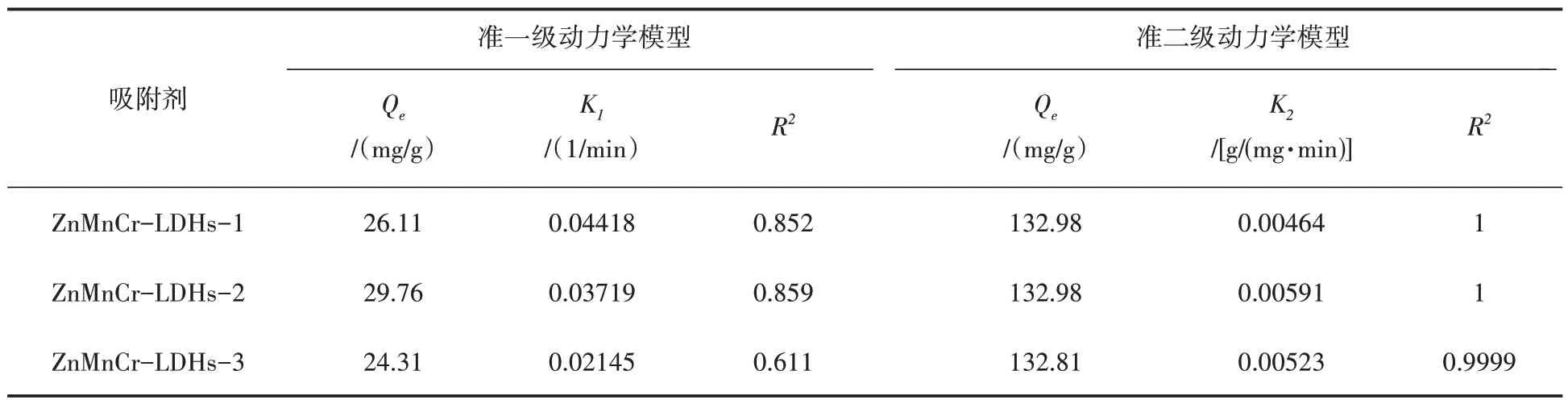
表1 ZnMnCr-LDHs对磷酸盐的吸附动力学拟合参数
表2 为根据吸附温度条件得到的ZnMnCr-LDHs 对磷酸盐的吸附热力学参数。由表2 可知,三个材料的ΔG皆小于0,证明该材料吸附是自发的;三个材料的ΔH都大于0,证明吸热过程为主导[24]。ΔS都大于0,表明吸附过程中无序性随之增加。

表2 ZnMnCr-LDHs对磷酸盐的吸附热力学参数
2.5.5 吸附等温线
由表3 中显示的拟合参数可知,三种ZnMnCr-LDHs 纳米材料的Freundlich 模型相关系数R2分别为0.9659、0.9666和0.9738。因此三种ZnMnCr-LDHs 都更倾向于符合Freundlich 模型,说明三种纳米材料可能是多层化学吸附。

表3 ZnMnCr-LDHs对磷酸盐的吸附等温线拟合参数
2.5.6 循环再生实验
LDHs 纳米材料的循环再生性能是评判材料好坏的指标之一,同时在实际废水处理中也是至关重要的。因此对ZnMnCr-LDHs 进行了5 次循环再生实验。由图8 可知,初始材料对于磷酸盐的去除率皆在99% 以上,经过5 次循环再生测试之后,ZnMnCr-LDHs 对磷酸盐的吸附率均达到76%以上。结果表明,该纳米材料具有较好的循环利用率,在实际废水处理中也具有较高的价值。

图8 ZnMnCr-LDHs的循环再生测试
3 结 论
本研究采用水热法成功制备出了三种不同元素比例的ZnMnCr-LDHs 纳米材料,通过各种表征方法证明成功制备出类水滑石材料。通过多种影响因素测试可知,在pH 为3—6 时具有稳定的吸附效果,但随pH 增大而吸附量有所降低;投加量为15 mg 时磷酸盐可基本去除;理论吸附容量与实际实验数据几乎没有相差;ZnMnCr-LDHs 在五次循环后仍有76%以上的吸附率,证明对磷酸盐的循环处理领域有较高的利用价值。ZnMnCr-LDHs 材料具有较好的吸附效果、较快的吸附速率和良好的循环利用性能等优点,可以为磷酸盐去除领域提供新的方向。

