一种具有识别Hg2+和ClO-荧光探针的设计和应用
廖元淏, 王帅, 陈婉慧, 冯华杰, 陈光英, 何文英*
(1. 热带药用植物化学教育部重点实验室, 海南 海口 571158;2. 海南师范大学 化学与化工学院, 海南 海口 571158)
1 引言
许多重金属离子如Cd2+、Cr2+、Hg2+、Pb2+等不仅对人体有害,分布在水体或土壤中也不能分解或降解[1-2]。 其中Hg2+就是一种很典型的重金属污染物,可在水中被微生物转化为甲基汞,通过食物链进入人体并在人体内蓄积,生物体摄入后可导致正常的生理功能紊乱,引起消化道、肾脏、大脑或神经系统等的病变;汞沉入水中后可经过水生食物链快速积累,对水体环境造成极大的污染[3-4]。次氯酸/次氯酸(HOCl/ClO-)在日常生活中可用于杀菌、染料脱色、土壤氧化污染的处理等;在生物体内控制参与多种生理过程, 如组织修复、细胞生命周期和防御系统中的抗菌活性等。但过量的ClO-会导致如肺部病变、心血管疾病或动脉粥样硬化等多种人体疾病[5-6]。因而通过研究新合成的1, 2, 3-三氮唑衍生物对汞离子或ClO-的特征显色识别和建立在生理条件下检测这两种离子的方法,实现在活体细胞中的应用,对环境和人类的生命安全具有非常重要的理论与实际意义。
离子的检验方法多种多样,取决于所要检测的离子种类以及分析的具体需求。常见的离子检验方法:滴定法(Titration),原子吸收光谱法, 离子选择性电极法(Ion-selective electrode, ISE), 质谱法,色谱法,电化学法[7-8]。而荧光光谱法具有良好的生物相容性、较低的毒性和易于结构修饰而得到广泛的发展,其作为一种分析工具, 具有选择性高、操作简单、消耗少、成本低等优点, 在生物成像方面应用最为广泛,可对化学及生物样品进行定性和定量测定,在药学、农学、食品工业等领域已有众多的应用[2-6,9-10]。罗丹明类化合物是具有独特“开-关”结构的荧光化合物。当金属离子被识别时,螺内酰胺环除具有优异的光化学和光物理性质外,还具有特定的电子重排形成一个大而稳定的刚性平面,在这个过程中荧光和颜色的变化是肉眼识别的基础。罗丹明类衍生物因具有摩尔消光系数高、光稳定性好、荧光量子产率高、较大的激发和发射波长等优异的光学性能,被广泛地应用于离子探针的设计[11-13]。近年来,具有双功能的荧光探针也越来越受到关注, 可用来同时检测生物体等样品中的阴阳离子或其他小分子[14-15]。
1,2,3-三氮唑是一类非常重要的含氮杂环化合物,具有如抗菌、抗结核病、抗病毒、抗疟疾、抗肿瘤等多种生物活性[16],易与其他取代基合成多种类型的衍生物,在有机化学、材料化学、环境科学及医药学等方面已显示出其特有的物理化学性质、药理活性和广阔的应用前景[17-18]。有些合成的三氮唑衍生物可与某些金属离子特异性键合,显示如良好的催化性等多方面的功能[9,19-20],尤其是一些金属离子与三氮唑通过发生不同的显色反应,可作为金属离子的探针进行定性或定量分析,在化学、生物、环境科学及其他领域具有众多应用[21]。因此,基于1,2,3-三氮唑的低毒性和良好生物活性,开发1,2,3-三氮唑-罗丹明类荧光探针具有良好的应用价值。
本文通过点击化学方法合成了一种新的1,2,3-三氮唑罗丹明B衍生物L2。L2具有检测两种阴阳离子的荧光探针性质;探针L2不仅显示出良好的荧光性能,且对Hg2+和ClO-有高选择性和灵敏性的识别;并可用于HeLa细胞中Hg2+和ClO-的细胞成像。
2 实验
2.1 仪器与试剂
测试仪器:400 MHz AV-400型超导核磁共振波谱仪(德国Bruker公司),1H NMR和13C NMR分别以CDCl3-d/DMSO-d6为溶剂, 以四甲基硅烷(TMS)为内参照;Agilent 1100-Bruker Esquire HCT高分辨质谱仪(美国Agilent公司-德国Bruker公司离子质量分析器);U3900/3900H紫外可见光分光光度计(日本日立公司);F-7000荧光分光光度计(日本日立公司); MCO-15A型CO2细胞培养箱(日本SANYO);Nikon TS100-F倒置荧光显微镜(日本尼康);SW-CJ-1F净化工作台(苏洁净化);6孔细胞培养板(Costar公司);PHSJ-3F型pH计(上海仪电科学仪器股份有限公司)。
本实验所用试剂均为商品化的分析纯或化学纯产品, 未经纯化直接使用。所使用的超纯水为实验室自制。19种金属离子Hg2+、Ag+、W6+、Cu2+、Zn2+、Al3+、Pb2+、Ca2+、Mn2+、Cd2+、Co2+、Fe3+、Mo6+、K+、Mg2+、Ni2+、Na+、Pd2+、Sn4+和14种阴离子ClO-、S2-、SCN-、CN-、CO32-、SO42-、ACO-、NO2-、NO3-、Br-、F-、Cl-、ClO2-浓度均为1000 µg/mL,购自国药化学试剂公司,均不含结晶水。其中,Mo6+所用缓冲溶液为H2O/tr.NH4OH,W6+所用缓冲溶液为0.2%(v/v)HNO3和2%(v/v)HF,Hg2+、Cd2+和Pb2+所用缓冲溶液均为HNO3(1.0 mol/L),Ag+、Pd2+和Sn4+所用缓冲溶液均为5%(v/v) HNO3,Cu2+和Co2+所用缓冲溶液均为3%(v/v) HNO3,Ca2+和Mg2+所用缓冲溶液均为5%HCl,Fe3+、Zn2+和Al3+所用缓冲溶液均为10% HCl,Ni2+所用缓冲溶液均为2%(v/v) HNO3,Mn2+所用缓冲溶液为5%(v/v) H2SO4,其他的阳离子和阴离子所用的缓冲溶液均为H2O。人宫颈癌细胞株HeLa细胞由海南师范大学热带药用植物化学教育部重点实验室提供,DMEM培养基及噻唑蓝购自北京索莱宝公司,胎牛血清购自浙江天杭生物公司。
2.2 探针L2的合成路线及方法
首先合成了2H-1,2,3-三氮唑-4,5-二乙酸乙酯,再通过偶联反应生成了2-苯基-2H-1,2,3-三氮唑-4,5-二乙酸乙酯,然后经过水解、酰氯反应、与罗丹明酰肼的酰胺缩合反应等,合成了化合物L2(图1)。
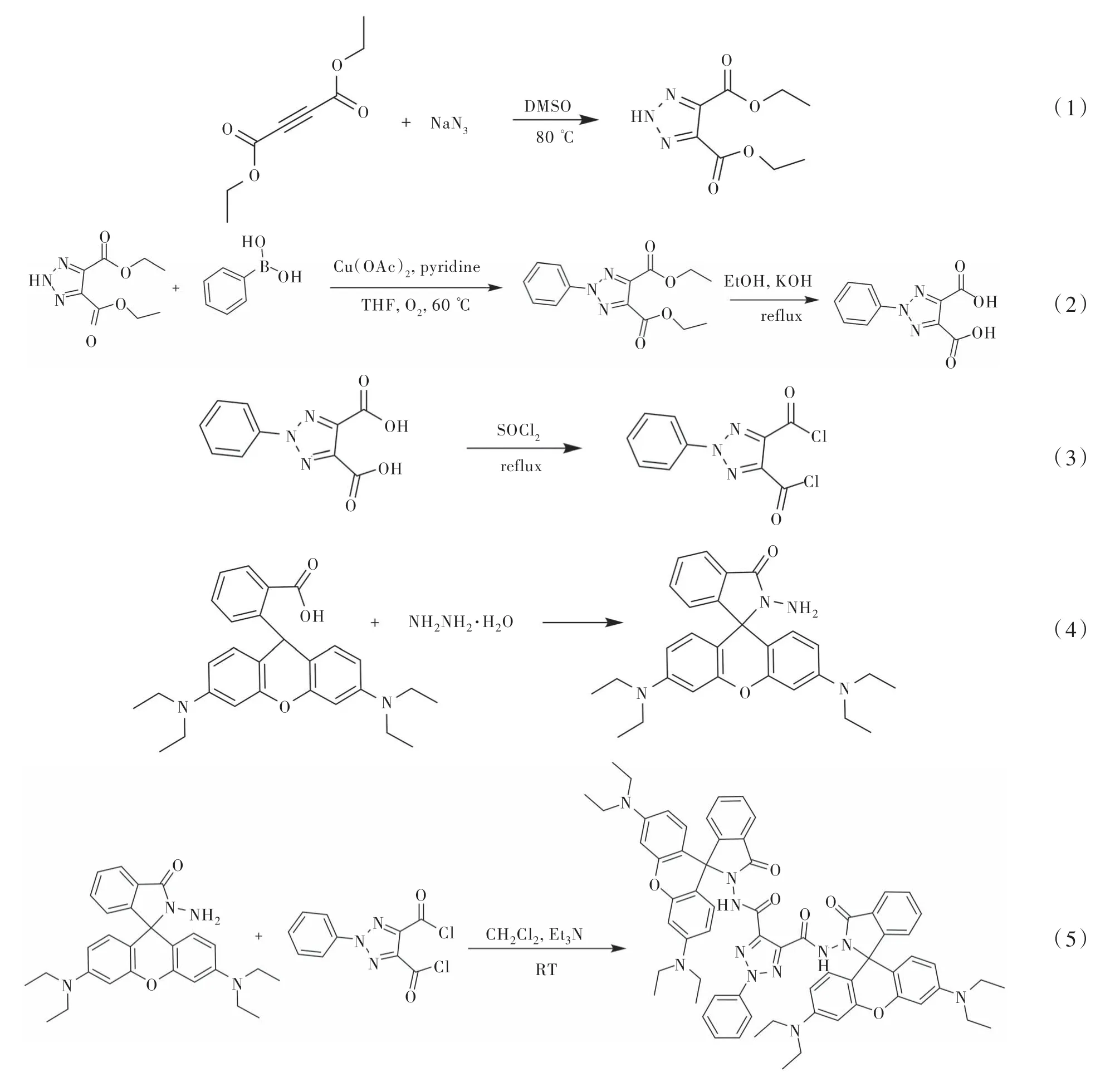
图1 探针L2的合成Fig.1 Synthesis of the probe L2
2.2.1 2H-1,2,3-三氮唑-4,5-二乙酸乙酯的合成
称取2.5 g(14.69 mmol)丁炔二酸二乙酯在250 mL圆底烧瓶中,加入100 mL二甲基亚砜作溶剂,在室温下搅拌半小时后,再称取1.91 g(29.38 mmol)NaN3缓慢加入圆底烧瓶中,然后升温至80 ℃,通过TLC监测反应。反应完毕后,冷却至室温,缓慢加入100 mL次氯酸钠水溶液搅拌猝灭反应,然后使用3 mol/L 盐酸溶液调节pH值为2左右,反应体系颜色由深棕色变为红色;使用乙酸乙酯和水萃取,有机相使用饱和氯化钠溶液洗涤,无水硫酸钠干燥,柱层析PE/EA=2∶1,即可得到黄色油状液体。1H NMR(400 MHz, 氘代氯仿)δ分别为4.47(q,J= 7.1 Hz, 4H), 1.41(t,J=7.1 Hz, 6H) (补充文件图S1),13C NMR(101 MHz, 氘代氯仿)δ分别为160.36, 139.20, 62.90,14.54 (补充文件图S2)。
2.2.2 2-苯基-1,2,3-三氮唑-4,5-二羧酸的合成
称取2H-1,2,3-三氮唑-4,5-二乙酸乙酯1.60 g(7.50 mmol)到100 mL圆底烧瓶中,加入1.20 g(15 mmol)吡和40 mL 四氢呋喃,搅拌均匀,称取1.36 g(7.5 mmol)醋酸铜到圆底烧瓶中,再称取1.83 g(15.0 mmol)苯基硼酸缓慢加入圆底烧瓶中,使整个体系处于氧气环境下,然后升温至60 ℃反应12 h,通过TLC监测反应。反应结束后,用乙酸乙酯萃取,再用无水硫酸钠干燥,柱层析PE/EA=10∶1,粗品加入无水乙醇40 mL,称取0.84 g(15 mmol)氢氧化钾固体,搅拌均匀后加热回流3 h。通过TLC监测反应结束,旋蒸后加热少量水以溶解产物。再使用浓盐酸调节pH值为1,出现大量白色固体析出,抽滤,干燥后即可得到白色固体产物。1H NMR(400 MHz, DMSO-d6)δ分别为8.05(d,J= 7.6 Hz, 2H),7.62(t,J= 7.8 Hz,2H), 7.53(t,J= 7.4 Hz, 1H)(补充文件图S3),13CNMR(101 MHz, DMSO-d6)δ分别为161.69,142.18, 138.88, 130.42, 129.79, 119.85(补充文件图S4)。
2.2.3 2-苯基-1,2,3-三氮唑-4,5-二酰氯的合成
称取200 mg的2-苯基-三氮唑-4,5-羧酸,然后加入2 mL过量氯化亚砜,加热回流3 h,TLC监测反应结束后,蒸出多余的氯化亚砜,即可得到白色固体产物,粗品直接用于下一步。
2.2.4 罗丹明B酰肼的合成
参照文献[22],在100 mL圆底烧瓶中,分别加入30 mL乙醇与5.0 g(10.5 mmol)罗丹明B,在室温下剧烈搅拌,然后缓慢滴入80%的水合肼(12 mL)。滴加结束,搅拌回流,TLC检测反应完毕后,冷却溶液,再减压蒸去乙醇。在烧瓶中加入1 mol/L的HCl 50 mL,得到橙红色溶液;在不断搅拌下,慢慢加入1 mol/L NaOH溶液,调节pH到9~10之间至出现大量白色沉淀;进行抽滤后用少量水洗涤滤饼3次;再通过真空干燥,得到罗丹明B酰肼。1H NMR(400 MHz,DMSO-d6)δ分别为7.76(d,J= 5.8 Hz, 1H), 7.53~7.41(m, 2H), 6.98(d,J= 5.9 Hz, 1H), 6.35(d,J= 16.6 Hz, 6H), 4.26(s, 2H), 3.33~3.25(m, 8H), 1.08(t,J= 7.0 Hz,12H)(补充文件图S5);13C NMR(101 MHz, DMSOd6)δ分别为165.82,153.49,152.33,148.60,132.89, 128.60, 128.13, 123.93, 122.65, 108.27,105.83, 97.89, 65.28, 44.16, 12.90(补充文件图S6)。
2.2.5 探针L2的合成
将上述2-苯基-1,2,3-三氮唑-4,5-二酰氯粗品称取0.23 g(0.85 mmol),加入10 mL二氯甲烷搅拌溶解后,缓慢加入0.77 g(1.7 mmol)的罗丹明B酰肼,然后再滴加过量三乙胺作缚酸剂,常温下搅拌12 h以上。通过TLC监测反应结束后,除去溶剂二氯甲烷后用乙酸乙酯萃取,再用无水硫酸钠干燥,柱层析PE/EA=1∶1,即可得到白色固体产物L2(产率34%)(如图1)。1H NMR(400 MHz, 氘代氯仿)δ分别为10.00(s, 2H),7.93(m,3J= 9.5,6.8, 1.8 Hz, 4H),7.48~7.41(m, 4H),7.39~7.34(m, 3H), 7.10~7.05(m, 2H), 6.75(d,J= 8.8 Hz,4H), 6.32(s, 4H), 6.26(d,J= 8.2 Hz, 4H), 3.24(d,J= 6.9 Hz, 16H), 1.08(t,J= 7.0 Hz, 24H)(补充文件图S7);13C NMR(101 MHz, CDCl3)δ164.46(s),157.44(s), 153.43(s), 152.71(s),152.65(s),148.93(s),139.87(s),138.44(s),133.05(s), 133.03(s),129.27(s),128.88(s),128.03 (s), 123.87(s),123.47(s),120.03(s),114.25(s) 107.94(s), 104.23(s), 97.87(s)44.31(s), 12.67(s)(补充文件图S8)。质谱检测HRMSm/z([M+H]+): 计算值1110.5276; 实验值:1110.5261(补充文件图S9)。
2.3 实验试剂配制
标准离子的配制:取一定体积Hg2+、Ag+、W6+、Cu2+、Zn2+、Al3+、Pb2+、Ca2+、Mn2+、Cd2+、Co2+、Fe3+、Mo6+、K+、Mg2+、Ni2+、Na+、Pd2+、Sn4+金属阳离子标准溶液和ClO-、S2-、SCN-、CN-、CO32-、SO42-、AcO-、NO2-、NO3-、Br-、F-、I-、Cl-、ClO2-阴离子标准溶液于10 mL比色管中,加去离子水定容配制为1.0×10-3mol/L标准溶液。
探针L2溶液的配制:称取55.5 mg的探针L2于50 mL的容量瓶中,使用DMSO定容配制为1.0×10-3mol/L的溶液。
细胞相关溶液的配制:DMEM完全培养基:购买市售培养基溶液,按总体积10%的体积加入灭活的胎牛血清,再加入1%的双抗;PBS缓冲液:使用电子分析天平称取NaCl:8.0 g,KCl:0.2 g,KH2PO4:0.24 g,Na2HPO4:1.44 g,用超纯水定容1 L,在120 ℃高压灭菌器中灭菌30 min;胰蛋白酶:使用电子分析天平结晶胰岛素粉末2.50 g,高压灭菌后的PBS缓冲液1 L,充分搅拌溶解后,用0.22 µmol/L的灭菌过滤器过滤溶液进行灭菌;MTT溶液:使用电子分析天平称取MTT粉末0.50 g,用PBS缓冲液100 mL充分溶解后,分装在1.5 mL EP离心管中,放置-5 ℃冰箱中避光冷冻待用。
2.4 光谱实验测定
紫外吸收光谱测定:设置波长扫描范围为250~700 nm,扫描速度为快,扫描间隔为1 nm,取60 µL DMSO到1 cm石英比色皿中,再加入60 µL的探针(1.0×10-3mol/L),用DMF/Tris-HCl(1∶1,v/v)缓冲溶液或甲醇溶液定容3 mL,进行波长扫描,再分别逐渐加入Hg2+或ClO-进行测定。
荧光光谱测定:设置激发波长为560 nm(检测Hg2+)和555 nm(检测ClO-), 扫描发射波长为570~700 nm,激发和发射狭缝宽度均为5.0 nm,电压为700 V,响应时间为0.1 s 扫描速度为1200 nm/min。取60 µL的探针(1.0×10-3mol/L),用DMF/Tris-HCl(1∶1,v/v)缓冲溶液定容3 mL,进行波长扫描。
2.5 理论计算
所有几何优化和能量计算都是使用B3LYP泛函在Gaussian 09中进行的,采用密度泛函理论DFT方法在6-311G(d)基组下进行了基态的全优化, 用含时密度泛函TD-DFT对最低激发态的构型进行全优化,Hg的基集为LANL2TZ, H、C、N和O的基集为6-311G(d)[23]。
2.6 细胞毒性测定
将HeLa细胞经过细胞复苏、细胞冻存、细胞传代处理,取对数生长期的HeLa细胞,通过细胞计数,调整细胞浓度为2.5×104/孔;将DMEM细胞培养液加入到96孔板中,每孔100 µL,在37 ℃5% CO2培养箱中培养24 h;按梯度浓度将L2浓度调整为0,10,20,40,60,80,100 µmol/L,使得DMSO加入的体积在细胞中含量小于4‰即可。依此方法将HeLa细胞分为空白组和实验组,实验组按照上述浓度梯度每孔加入100 µL,空白组只加培养液100 µL,每个浓度均设置6个复孔;然后放入细胞培养箱中继续培养24 h后,每孔加入20 µL MTT试剂,放入细胞培养箱中继续培养4 h,使得MTT还原成蓝紫色结晶甲瓒;弃去培养液,每孔加入200 µL DMSO轻微震荡使其充分溶解;通过酶标仪测定570 nm处吸光值。重复实验3次,计算L2对HeLa细胞的毒性。
2.7 细胞成像实验
取对数生长期的HeLa细胞,将细胞培养液加入到35 mm细胞培养皿中,在37 ℃ 5% CO2培养箱中培养24 h,吸取培养液,用PBS冲洗细胞3次;加入探针L2(20 µmol/L)培育1 h后,用PBS冲洗3次;除去未进入细胞的探针,随后分别加入浓度均为20 µmol/L Hg2+和ClO-溶液,继续培养0.5 h后,用PBS洗涤3次后,进行荧光成像。
3 结果与讨论
3.1 紫外-可见光谱分析
通过分析有机化合物的紫外光谱可初步获得分子层面的结构信息。为筛选探针L2对不同金属离子和阴离子溶液中的识别能力,在DMF/Tris-HCl(1∶1,v/v, 20 µmol/L)溶液中,分别测定了L2对Hg2+、Ag+、W6+、Cu2+、Zn2+、Al3+、Pb2+、Ca2+、Mn2+、Cd2+、Co2+、Fe3+、Mo6+、K+、Mg2+、Ni2+、Na+、Pd2+、Sn4+作用的紫外吸收光谱(见图2(a)),以及在甲醇溶液中对ClO-、S2-、SCN-、CN-、CO32-、SO42-、AcO-、NO2-、NO3-、Br-、F-、I-、Cl-、ClO2-作用的紫外吸收光谱(见图2(b))。由于探针L2为无色溶液,故选择纯水做空白参比。从图2可以看出,在设置波长为400~700 nm范围内,吸收峰的起止波长和加入前后最大吸收波长处强度的变化不大,L2+Hg2+体系在565 nm处有最大紫外吸收峰,L2- ClO-体系在555 nm处有最大紫外吸收峰,说明Hg2+和ClO-的存在使得L2的分子结构发生了一定的变化而产生了两个新的吸收峰。同时,两组不同溶液体系的颜色由无色透明液体转变为粉红色,而其他离子的加入不会引起溶液中明显的颜色变化。实验结果表明,探针L2对Hg2+和ClO-具有较高的选择性,L2与Hg2+或ClO-的相互作用影响了罗丹明基团的吸收,导致其螺环结构发生开环,使得在565 nm和555 nm处出现吸收增强的现象。

图2 (a)在DMF/Tris-HCl溶液(1∶1,v/v,pH=6.0)中,不同金属离子存在时,L2 (20 µmol/L)的紫外可见吸收光谱;(b)在MeOH溶液中,不同阴离子存在时,L2 (20 µmol/L)的紫外可见吸收光谱Fig.2 (a)UV-Vis spectra of L2(20 µmol/L) in the presence of different metal ions(20 µmol/L) in DMF/Tris-HCl(1∶1, v/v,pH=6.0). (b)UV-Vis spectra of L2(20 µmol/L) in the presence of different anions(20 µmol/L) in MeOH
3.2 荧光光谱分析
为探究L2和不同阴阳离子的荧光性质,在DMF/Tris-HCl(1∶1,v/v, 20 µmol/L)溶液中测定了L2与各种金属离子的荧光光谱,以及在MeOH溶液中L2与各种阴离子的荧光光谱,所有加入离子浓度均为等量(见图3)。从图3可见,当激发波长为563 nm时,L2没有出现明显的荧光发射峰,这也是罗丹明结构的一个典型特点;但当其与不同的阴阳离子相互作用时,只有Hg2+使体系的荧光强度在585 nm处出现明显增强(图3(a)),也只有ClO-使体系的荧光强度在576 nm处有显著增大(图3(b)),而其他金属离子或阳离子几乎没有带来变化。同时,伴随着荧光光谱峰型和强度的变化,只有Hg2+-L2体系或ClO--L2体系的颜色也呈现出裸眼可见的粉红色溶液(如图2中插图所示),而在相同条件下的其他离子-L2体系则没有颜色的变化。这再次表明探针L2在两种溶液体系中对Hg2+和ClO-具有高选择性和特异性。通常情况下,具有闭环酰肼结构的罗丹明及其衍生物是无色或非荧光的,而开环酰肼结构的罗丹明可产生较强的荧光并伴随溶液呈现粉色的颜色变化[24-25]。据此推测本实验中Hg2+或ClO-可能使L2分子中的罗丹明基团从闭环的酰肼结构转换为开环的酰肼结构,从而形成了Hg2+-L2或ClO--L2两种新的配合物,也导致溶液有粉色的变化。

图3 (a)在DMF/Tris-HCl(1∶1,v/v)中,L2(20 µmol/L)和不同金属离子(20 µmol/L)存在的荧光光谱,λex=560 nm;(b)MeOH中,L2(20 µmol/L)和不同阴离子(20 µmol/L)存在的荧光光谱,λex=555 nmFig.3 Fluorescence spectra of L2(20 µmol/L) in the presence of different metal ions(20 µmol/L) in DMF/Tris-HCl(1∶1,v/v)(a)(λex=560 nm) and in the presence of different anions(20 µmol/L) in MeOH(b)(λex=555 nm), respectively
3.3 探针L2对Hg2+和ClO-的选择性和抗干扰性分析
优良的选择性也是荧光探针的重要性能之一。图4为探针L2分别对Hg2+(图4(a))和ClO-(图4(b))的选择性实验。图4(a)为在DMF/Tris-HCl(1∶1,v/v, pH=6.0,20 µmol/L)溶液中,加入金属离子(Hg2+、Ag+、W6+、Cu2+、Zn2+、Al3+、Pb2+、Ca2+、Mn2+、Cd2+、CO2+、Fe3+、Mo6+、K+、Mg2+、Ni2+、Na+、Pd2+、Sn4+)时测定不同体系的荧光强度,可看出仅仅当Hg2+与 L2相互作用时,在585 nm处的荧光强度约为1500,且溶液颜色呈现粉红色;而加入其他金属离子后,这些体系的荧光强度则没有显示出明显的增大和颜色的变化。从图4(b)可看出,ClO-与L2相互作用也发生相似的情况,在甲醇(20µmol/L)溶液中加入不同的阴离子(ClO-、S2-、SCN-、CN-、CO32-、SO42-、ACO-、NO2-、NO3-、Br-、F-、I-、Cl-、ClO2-)时,在576 nm处的荧光强度约为1100,且溶液颜色呈现较深的粉红色,而加入其他阴离子后的体系则没有引起明显的荧光强度和颜色变化。这些结果表明,相比实验中绝大多数的阴阳离子,L2对Hg2+和ClO-有较高的选择性,可以特异性地裸眼识别Hg2+和ClO-。
另外,由于L2是分别在DMF/Tris-HCl(1∶1,v/v,pH 6.0, 20 µmol/L)和MeOH(20 µmol/L)溶液中对Hg2+和ClO-显示出高选择性和灵敏性,尽管L2-Hg2+和L2-ClO-体系的最大荧光强度分别在585 nm处(图3(a))和576 nm(图3(b)),但不同溶剂的体系可以避免同时测定Hg2+和ClO-时的相互干扰效应。
为评估探针在共存离子情况下的抗干扰性,进行了离子竞争实验. 分别在有探针L2存在的DMF/Tris-HCl(1∶1,v/v, 20 µmol/L)溶液中加入Hg2+和MeOH(20 µmol/L)溶液中加入ClO-测试体系的荧光强度,再分别加入等量的同离子再测试其荧光强度(图5)。从图5可看出,在相同的实验条件下,加入Hg2+和ClO-体系中测得的荧光强度和其他金属离子或阴离子与Hg2+或ClO-共存时不同体系的荧光强度有略微的波动,但变化不大,说明这些离子的存在对探针检测Hg2+和ClO-没有明显的干扰。因此,探针L2可以作为高选择性的Hg2+和ClO-荧光探针。

图5 (a)在DMF/Tris-HCl(1∶1,v/v,pH=6.0)中,L2对Hg2+(20 µmol/L)及与其他离子(20 µmol/L)共存时的荧光强度,λex=560 nm;(b)在MeOH(20 µmol/L)中,L2对ClO-(20 µmol/L)及与其他离子(20 µmol/L)共存时的荧光强度,λex=555 nmFig.5 (a)The fluorescent selectivity of L2 toward Hg2+(20 µmol/L) coexisting with other metal ions(20 µmol/L) in DMF/Tri-HCl(1∶1, v/v, pH=6.0), λex=560 nm. (b)The fluorescent selectivity of L2 toward ClO-(20 µmol/L) coexisting with other anions(20 µmol/L) in MeOH, λex=555 nm
3.4 探针L2对Hg2+和ClO-的定量分析
基于以上紫外和荧光光谱的定性分析结果,暗示L2可以被开发利用作为定量分析Hg2+和ClO-的一种新型探针。我们首先评估了pH值对探针L2荧光强度的影响,由于本研究检测Hg2+时使用DMF/H2O(1∶1)体系,而检测ClO-时在MeOH体系完成,因此以下只分析L2与Hg2+体系的pH值适用范围。我们测试了L2和Hg2+-L2体系在pH值3.0~10.0范围内荧光强度的变化曲线(补充文件图S10),从图S10可见,在pH<4.0的较强酸性条件下,L2本身会产生微弱荧光;而在4.0<pH<10.0范围内,L2的荧光愈加减弱并接近消失。这些结果表明,在pH值3.0~10.0范围内,L2结构中的罗丹明是一种闭环的酰肼结构。相应地,当在L2中加入Hg2+后,pH值在3.0~7.0范围内荧光强度很高,尤其是pH=6.0时荧光强度最大。虽然pH在6.0~7.0之间体系的荧光强度有所降低,但均说明L2结构中的罗丹明酰肼键处于开环状态。当pH值从7.0调节为8.0时,体系荧光强度骤然下降到几乎没有荧光,这可能是因为OH-跟Hg2+结合形成了沉淀,而无法跟L2发生络合。因此,本研究中所有的光谱实验均选择在pH值为6.0的DMF/Tris-HCl(1∶1,v/v)溶液体系中进行。另外,选择荧光光谱分析的时间-荧光强度模式,测定了L2对Hg2+和ClO-的响应时间及稳定时间(补充文件图S11)。实验结果表明,两个体系发生显色反应的时间很短,且L2与Hg2+或ClO-作用后比较稳定,在1800 s内荧光强度没有发生明显的增加或下降趋势,这说明探针L2可以在水溶液或甲醇溶液中对Hg2+或ClO-进行实时分析。
良好的灵敏度是离子探针的一个重要指标。通过荧光滴定实验确定探针L2对Hg2+和ClO-的灵敏度。分别在存在L2(20 µmol/L)的DMF/Tris-HCl(1∶1,v/v, 20 µmol/L)、MeOH溶液中,逐渐加入浓度梯度的Hg2+或ClO-进行荧光测试(图6)。从图6可以看出,随着Hg2+或ClO-浓度的增加,探针L2-Hg2+体系在585 nm处的荧光在逐渐增强,这可能是由于探针L2对Hg2+发生配位反应,发生内酰胺开环释放荧光;而ClO-的氧化作用也可以使得L2断键在576 nm处释放荧光。图6中的两个插图表明L2与Hg2+(5.0~26.7 µmol/L,R2=0.9802)、L2与ClO-(3.33 µmol/L~0.7 mmol/L,R2=0.9959)分别存在两种线性相关关系。根据相关公式CL= 3σ/K(其中,CL为检出限,σ为测定空白值的标准偏差,K为标准曲线的斜率), 计算出L2对Hg2+的检出限为7.45 nmol/L,对ClO-的检出限为0.67 µmol/L. 实验结果表明,探针L2对Hg2+和ClO-的检测具有潜在的应用价值,可以用来检测环境或生物样品中这两种有害离子的含量。
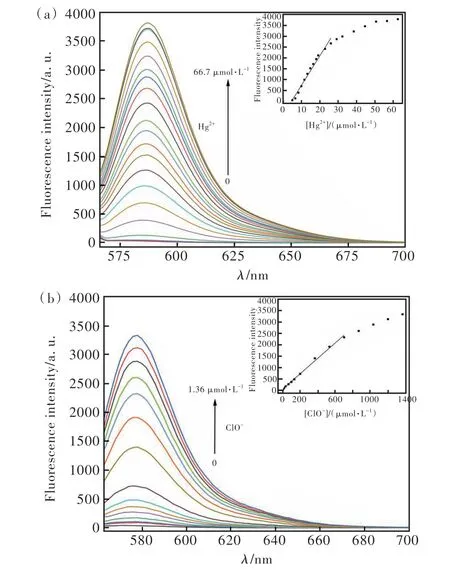
图6 (a)在DMF/Tris-HCl(1∶1, v/v, pH=6.0)中,λex=560 nm,随着Hg2+浓度(浓度变化对应数值:0,3.3,4.9,6.6,8.3,9.9,11.5,13.1,14.7,16.3,18.0,19.1,22.8,25.9,29.1,32.2,38.4,44.5,50.6,56.6,62.5,66.7µmol/L)增加,探针L2 (20 µmol/L)的荧光光谱;(b)在MeOH中,λex=555 nm,随着ClO-浓度(浓度变化对应数值:0,3.33,10.0,16.6,33.3,66.6,100, 133.3,200,366.6,533.3,700,866.6,1033.3,1200, 1366.6 µmol/L)增加,探针L2(20 µmol/L)的荧光光谱,其中的插图分别为L2与Hg2+和L2与ClO-的线性关系Fig.6 Fluorescence spectra of L2(20 µmol/L) with the increasing concentration of Hg2+(0-66.7 µmol/L) in DMF/Tris-HCl(1∶1, v/v, pH=6.0)(a)(λex=560 nm) and with the increasing concentration of ClO-(0-1.36 mmol/L) in MeOH(b) (λex=555 nm), the linear relationship between L2 with Hg2+ and ClO-(inset)
3.5 L2响应Hg2+或ClO-的机理推测
为阐明探针L2与Hg2+和ClO-的作用机理,分别采用质谱分析、Job's plot等摩尔连续变化法、1H NMR核磁滴,研究该探针对Hg2+和ClO-的识别机制。
首先运用质谱仪器Aglient1100-Bruker的正离子模式测定探针与Hg2+和ClO-发生反应后分子量的变化情况 (补充文件图S12)。通过图S9(a)可以看出,质谱中m/z为1651.2,分子量与[L2+2Hg2++2NO3-+H2O]的分子量相匹配;在相同条件下,测定探针L2-ClO-的质谱为图S9(b),可看出质谱中m/z为465.3,分子量与[RhB+Na+]的分子量465相吻合。对于L2-Hg2+体系,这些结果说明探针L2与Hg2+能够产生荧光是两者可能发生1∶2配位络合的原因,该结果也与后面用等摩尔连续变化法测定的络合比结果一致;对于L2-ClO-体系,ClO-可能通过氧化L2而导致其中罗丹明结构中的酰肼键开环,进而产生荧光。
另外,采用Bruker AV-400核磁仪器,以DMSO-d6为氘代溶剂,分别测定了L2及L2-Hg2+、L2-ClO-的1H NMR谱(见补充文件图S13和图S14)。从图S9和图S10分析,在单独探针L2的氢谱中,氨基—NH的H信号化学位移为1.136×10-5左右,苯环上的氢的化学位移为(7.9~8.0)×10-6,(7.8~7.9)×10-6,(7.5~7.6)×10-6左右。对L2-Hg2+体系,当加入Hg2+后,L2探针的—NH的H质子信号1.128×10-5移动,苯环上的氢的化学位移变为(7.75~8.0)×10-6,(7.5~7.75)×10-6左右。探针的—NH的H质子信号化学位移向高场1.128×10-5移动,苯环上氢由(7.8~7.9)×10-6向高场移动说明可能是Hg2+的加入使其化学环境发生了改变。Hg2+加入可能使探针的内酰胺发生开环(NH2和羰基参加配位后开环),C=O和氨基N原子与Hg2+络合形成五元环,而这个五元环的形成导致氨基上的氢的化学环境改变,进一步对苯环上的氢的环境产生影响导致苯环上的氢的化学位移向高场移动,峰的裂分也受到影响。
对L2-ClO-体系,探针的—NH在1.136×10-5的H质子信号消失,苯环上的氢的化学位移变为(7.75~8.0)×10-6,(7.25~7.75)×10-6左右,且在8.30×10-6处出现了一个新峰,可能是由于电子转移的原因,ClO-与L2发生了氧化作用使得—NH官能团从探针L2中脱离,导致加入ClO-后探针L2中—NH的H质子信号峰消失,从而打开了罗丹明的闭环结构产生了荧光,使得核磁结果产生了新的峰及峰的耦合变化,质谱图及数据也证实了罗丹明B的产生。这些结果表明,L2对Hg2+或ClO-有不同的响应机理。
为了进一步验证L2与Hg2+发生相互作用时可能的络合比,采用等摩尔连续变化法[26],分别配制L2/L2+Hg2+浓度比为0.1,0.2,0.3,0.4,0.5,0.6,0.7,0.8,0.9的系列溶液,测定最大发射波长峰处的荧光强度(图7)。图7曲线表明,当摩尔分数约为0.34时,荧光强度有最大值,说明L2与Hg2+的配位络合比为1∶2,与前面用质谱测定的结果相一致。

图7 探针L2-Hg2+的化学计量比的Job's plot图Fig.7 Job's plot for determining the stoichiometry of L2 and Hg2+
为了进一步验证以上实验结果,利用量子化学相关方法再次确证L2对Hg2+的作用机理。在Gaussian 09软件中,采用基于B3LYP泛函的TD DFT方法,计算了L2和L2-Hg2+配合物的最高占据分子轨道(HOMO)和最低未占据分子轨道(LUMO),以此判断L2和L2-Hg2+配合物的HOMO能级与LUMO能级之间是否发生相互作用及形成过渡态的主要原因;而能隙是LUMO轨道和HOMO轨道之间的能差,是影响化合物稳定性的关键因素[27]。补充文件中表S1为优化的L2基态参数,表中的键角和键长数据表明L2为非平面的分子结构;补充文件图S11为探针L2与两个Hg2+离子结合的优化结构,显示出L2有足够的空间来容纳两个Hg2+且可达到稳定状态。图8为探针L2和L2-Hg2+配合物的前沿分子轨道,可看出L2和L2-Hg2+配合物的电子转移主要发生在由HOMO跃迁到LUMO,即表明它们具有荧光性质,光谱实验也证明了该结果。计算出的L2的能隙值为3.50591 eV,L2+2Hg2+的能隙值为0.23129 eV,说明探针与2个Hg2+分子结构更稳定,能隙更小。因为复合分子的能隙越小,极化越强,这与高的化学反应活性和低的动态稳定性直接相关。电子由于具有较低的能隙,更容易被激发从基态跃迁到激发态从而产生荧光[27],也再次从理论上确证了L2与Hg2+的配位络合比为1∶2是合理的。
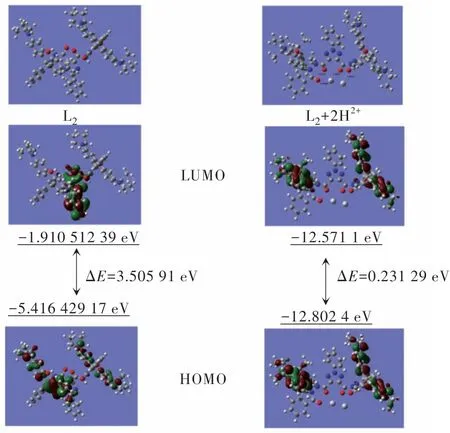
图8 探针L2和L2-Hg2+配合物的基态LUMO、HOMO及其能隙前沿分子轨道Fig.8 The frontier molecular orbital of ground state on LUMO,the frontier molecular orbital of ground state on HOMO, and the HOMO-LUMO gap of L2 and L2-2Hg2+
综合以上实验结果,推测分析了探针L2与Hg2+和ClO-响应机制,如图9所示。对于L2-Hg2+体系,没有配合Hg2+时,结构中的酰肼的闭环导致罗丹明本身的荧光猝灭;但有Hg2+存在时,L2可能通过C=O和氨基上的N原子与Hg2+配合形成稳定的五元环,导致罗丹明螺旋环开环,使得探针发出荧光。对于L2-ClO-体系,L2与ClO-的响应机制可能是L2的二芳基甲酰肼被ClO-氧化释放二芳基甲酰二亚胺,产生罗丹明B结构,从而引起探针L2中的螺旋环开环产生荧光[24]。这里,L2可以作为反应基团,其中的罗丹明B分子作为提供光信号的基团,共同组成了一种荧光化学计量器来检测Hg2+或ClO-。当Hg2+或ClO-存在时,L2分子中罗丹明从闭环的酰肼键结构转换为开环的酰肼结构,伴随着肉眼可见的粉红色显色反应发生。 虽然L2对Hg2+或ClO-有不同的响应机理,但是很确定的结论是L2与Hg2+以1∶2的络合比进行反应,前面的质谱、1HNMR滴定、等摩尔连续变化都佐证了这个结论。
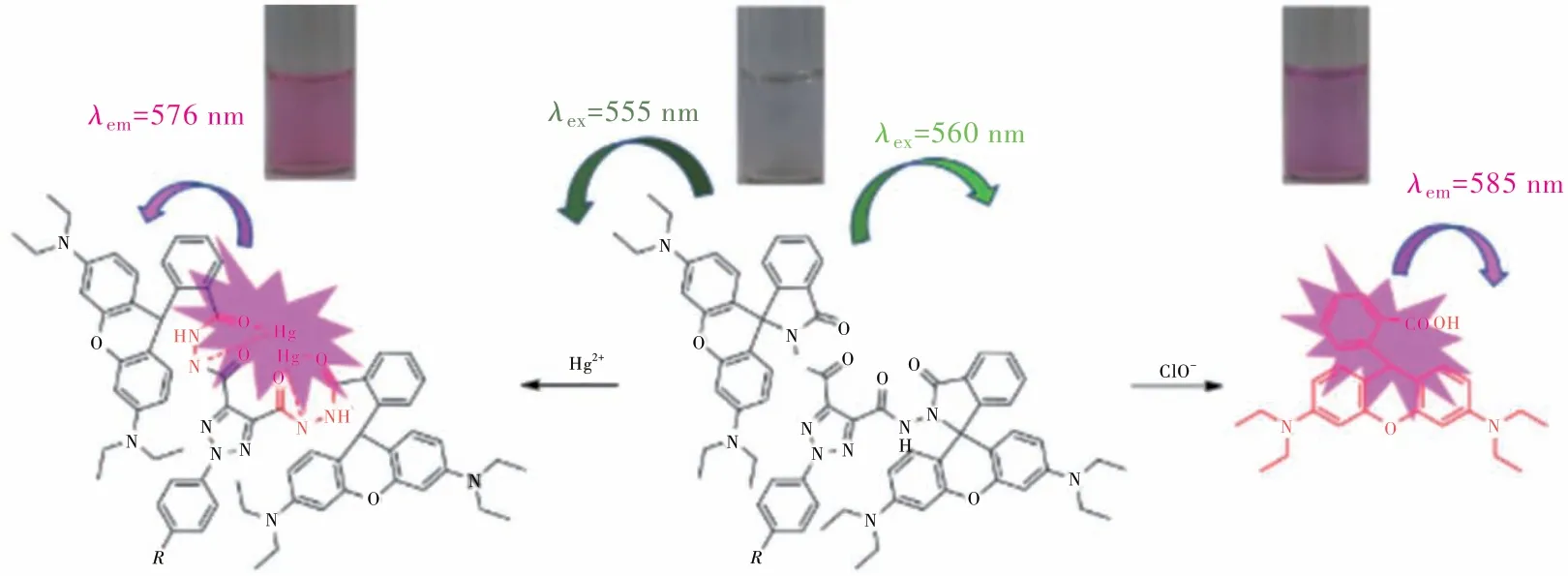
图9 探针L2对Hg2+和ClO-响应机理推测图Fig.9 Proposed mechanism of the the probe L2 response to Hg2+ and ClO-
3.6 细胞毒性和细胞成像分析
作为一种含氮五元杂环化合物,1,2,3-三氮唑类衍生物在生物、医药、农药、超分子材料等领域都具有广泛的应用,具有低毒及多种药理活性[21,25,28]。考虑到探针L2可能被开发应用在生物样品中的Hg2+或ClO-测定,有必要对其进行细胞毒性和细胞成像的测定。首先利用MTT方法,将探针L2按梯度浓度调整为0,10,20,40,60,80,100 µmol/L,将HeLa细胞分为空白组和实验组,在酶标仪上测定570 nm处的吸光值,计算L2干预下HeLa细胞的24 h后存活率(图10)。从图10可看出,探针L2在0~60 µmol/L浓度范围内,对HeLa细胞的存活率均在80%,表现出良好的细胞低毒性,说明L2可以较好地运用在细胞中用来检测离子的存在,具有良好的生物实用性。
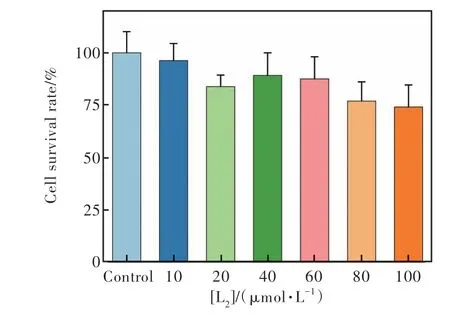
图10 探针L2在HeLa细胞中孵育24 h后的细胞存活率Fig.10 Cell viability graph of L2 using HeLa cells incubating for 24 h
鉴于探针L2有较低的细胞毒性及对检测Hg2+或ClO-有高选择性,可进一步开发是否能在生物样品中应用。将HeLa细胞在37 ℃、5%CO2培养箱的6孔板中培养24 h后,再加入探针L21(20µmol/L)孵育1 h,随后分别向6孔板中加入含(20µmol/L)Hg2+和ClO-,继续孵育1 h后,在荧光显微镜下捕获荧光图像(图11)。如图11所示,单独探针L2的HeLa细胞没有发出荧光,而加入Hg2+和ClO-明显观察到HeLa细胞发出红色荧光。这说明探针L2不仅可以很好地进入细胞内部,有良好的膜渗透性,也显示出荧光探针具备特异显色的“开关”性质,对于实现探针的生物体内应用具有很重要的价值。

图11 探针L2在HeLa细胞中的细胞荧光成像:(a)单独探针L2的明场图;(b)探针L2与Hg2+的明场图;(c)探针L2与ClO-的明场图;(d)单独探针L2的荧光图;(e)探针L2与Hg2+的荧光图;(f)探针L2与ClO-的荧光图Fig.11 Fluorescence images of HeLa cells treated with L2: (a)bright-field images of the probe L2, (b)bright-field images of L2-Hg2+ system, (c)bright-field images of L2-ClO- system, (d)fluorescence images of the probe L2 , (e)fluorescence images of L2-Hg2+ system, (f)fluorescence images of L2-ClO- system
4 结论
本文合成了基1,2,3-三氮唑化合物与罗丹明B酰肼构建的双功能荧光探针L2,分别在DMF/Tris-HCl(v/v=1∶1, pH=6.0)溶液中或MeOH溶液中可高选择性地用于检测溶液中的Hg2+和ClO-;并整合利用Job-plot、核磁滴定、质谱确证了探针L2识别Hg2+和ClO-的响应机制,两种被测离子可将探针L2结构中罗丹明分子的螺环闭环转换为开环状态从而引起显色反应。生物细胞毒性测定结果表明,探针L2具有较低的细胞毒性,并可成功用于HeLa细胞中Hg2+和ClO-的荧光成像。探针L2在生物科学中有望被开发用于检测Hg2+和ClO-,具有较大价值。
本文补充文件和专家审稿意见及作者回复内容的下载地址:http://cjl.lightpublishing.cn/thesisDetails#10.37188/CJL.20230297.

