灵芝miRNA对人皮肤成纤维细胞衰老的作用研究
余雯斌,徐晓渊,盛 清
(浙江理工大学生命科学与医药学院,杭州 310018)
0 引 言
灵芝(Ganodermalucidum)是一种大型药用真菌,担子菌纲多孔菌科灵芝属[1]。灵芝作为药食同源的传统中药已有两千多年的历史,具有滋补强壮、延年益寿等功效,对多种不同疾病都有有益作用[2]。目前,对灵芝发挥药效的物质基础和作用机理研究主要集中在灵芝多糖、灵芝三萜及部分甾醇类物质等领域[3-5],而对其核酸、蛋白质等初级代谢产物尤其是各种RNA的活性研究相对较少[6-10]。microRNA(miRNA)是一类含有18~25个核苷酸的非编码小RNA(Non-coding small RNA),在动植物和微生物中普遍存在,能够调控特定基因的转录后表达,在细胞增殖、分化和衰老等过程中起着重要的作用[11]。研究发现,miRNA参与不同细胞类型和环境老化过程,可作为重要的衰老生物学标志物[12];miR-126等25种外泌体miRNA对血管细胞增殖、迁移、凋亡、炎症和分化等衰老相关功能具有调控作用[13]。miRNA通过p53/p21/Rb通路、p16-pRb通路、PI3K/AKT/mTOR通路和SIRT1通路等多个与细胞衰老相关的信号通路参与细胞衰老的生物过程[14-15]。在衰老过程中,miRNA的表达改变与包括癌症和心血管疾病在内的衰老性疾病有关,使用miRNA的治疗方法将促进衰老相关疾病的治疗或预防[16-17]。
2012年,Zhang等[18]首次发现,植物miRNA可以通过口服摄入调控人体内的基因表达;自此以来,越来越多的证据表明,外源miRNA可以调控动物体内相关基因的表达,发挥重要的生物学作用[19]。通过连续灌胃可显著增加小鼠外周血和肺中金银花miR2911的表达量,且合成的 miR2911 模拟物能显著抑制H1N1 病毒的复制[20];红景天煎煮液中的miRNA在体内和体外实验中均表现出较强的抗纤维化作用等[21]。Huang等[22]在对10种草药的研究中发现,每种草药中有大量小RNA能够进入哺乳动物的血液和肺部,能以序列特异性的方式对哺乳动物基因进行跨界调控。
灵芝具有极高的药用价值,是延缓衰老的珍品[23];《神农本草经》记载,灵芝“久服轻身不老,延年神仙”[24]。现代药理研究表明,灵芝多种活性成分具有延缓衰老的作用[25],但其延缓衰老的分子机制尚有待进一步阐明。中药miRNA可以发挥跨界调控作用,那么灵芝中的miRNA对衰老会有怎样的作用和影响?Li等[26]首次报道了灵芝miRNA的鉴定研究,从灵芝子实体中分离并确证了132个已知miRNA和34个灵芝特有的miRNA;靶基因预测发现,灵芝中的miRNA针对人生命过程的靶基因多达111个,多数miRNA具有不止一个靶基因,或一个靶基因可以受多个miRNA调控,而丰度较高的灵芝特有miRNA Glu-miR-01、Glu-miR-03能够靶向与衰老相关信号通路中的关键基因。
本文研究灵芝特有miRNA Glu-miR-01,Glu-miR-03对细胞衰老的作用。通过探究灵芝miRNA模拟物(miRNA mimics)对过氧化氢(H2O2)诱导的人皮肤成纤维细胞衰老的作用,检测其对细胞衰老相关指标的变化、衰老相关通路关键蛋白的表达水平的影响等,探明灵芝miRNA作为灵芝新活性成分对延缓细胞衰老的作用及机制,为阐明灵芝miRNA跨界调控的分子机制奠定基础。
1 实验部分
1.1 材 料
1.1.1 细 胞
人皮肤成纤维HSF细胞(美国模式培养物集存库,ATCC)。
1.1.2 miRNA模拟物
Glu-miR-01模拟物(Glu-miR-01 mimics)、Glu-miR-03模拟物(Glu-miR-03 mimics)和阴性对照(Negative control)(上海吉玛制药技术有限公司)按表1中序列制备。

表1 灵芝miRNA 序列
1.1.3 试 剂
3%过氧化氢(H2O2)、噻唑蓝(MTT)、二甲基亚砜(DMSO)和胰酶(Trypsin)(美国Sigma公司),DMEM高糖培养基、双抗(青霉素、链霉素)和PBS(维森特生物技术(南京)有限公司),超氧化物歧化酶(SOD)试剂盒、丙二醛(MDA)试剂盒和总抗氧化能力(T-AOC)试剂盒(南京建成生物工程研究所),胎牛血清(美国Gibco公司),细胞衰老相关β-半乳糖苷酶(SA-β-gal)染色试剂盒、线粒体膜电位(JC-1)检测试剂盒(上海碧云天生物技术有限公司),ECL显色液(美国Advansta公司),LipofectamineTM3000转染试剂(美国Thermo Fisher Scientific公司),SDS-PAGE凝胶快速制备试剂盒(上海雅酶生物医药科技有限公司)。
1.1.4 抗 体
p53(DO-1)抗体(1∶500)、p16INK4a(JC8)抗体(美国Santa Cruz公司,1∶500),p21Waf1/Cip1(DCS60)抗体(1∶2000)、Rb(4H1)抗体(美国Cell Signaling Technology公司,1∶2000),α-tubulin抗体(1∶5000)和羊抗兔IgG(HRP标记,美国Proteintech公司,1∶5000)。
1.2 HSF细胞衰老模型的构建
采用H2O2诱导HSF细胞的方法构建氧化应激导致的HSF细胞衰老模型,具体参见文献[27]。将HSF细胞铺板过夜,设置H2O2浓度梯度为0.2、0.4、0.6、0.8、1.0 mmol/L和1.2 mmol/L,H2O2诱导的时间梯度为3、6、12 h和24 h,对 HSF 细胞进行 H2O2诱导;经不同浓度、不同时间诱导后,观察细胞形态的改变,采用MTT实验检测细胞活力的变化,以确定H2O2最适浓度与诱导时间;收集细胞后检测SOD、MDA和T-AOC等氧化应激指标的变化,以确定HSF细胞衰老模型的成功构建。
1.3 细胞中灵芝miRNA表达量的检测
将灵芝miRNA mimics转染HSF细胞后,收集细胞,提取细胞总RNA,以总RNA为模板,使用特异性茎环引物,将RNA 逆转录成cDNA。快速启动通用SYBR Green Master的RT-qPCR程序,程序设置为:95 ℃处理10 min,然后95 ℃处理15 s,随后转为60 ℃处理15 s,最后72 ℃处理30 s,共40个循环,以人源5.8 S 为内参检测miRNA的相对表达量。茎环引物和反转录引物序列见表2。使用ABI 7500 Software(V2.3)软件进行数据分析。

表2 RT-qPCR引物设计
1.4 灵芝miRNA对衰老细胞活力影响的检测
采用MTT法评价Glu-miR-01和Glu-miR-03对H2O2诱导的HSF衰老细胞的活力影响。将HSF细胞接种于96孔板中,细胞密度为2.5×104/孔。用质量浓度为0.75、3.5 μg/mL和7.5 μg/mL的Glu-miR-01 mimics、Glu-miR-03 mimics和对应阴性对照,分别转染HSF细胞,每个浓度6个复孔。参照LipofectamineTM3000转染试剂说明书操作:取HSF细胞,弃去旧培养基,每孔加入2 mL无血清DMEM培养基。将转染试剂、Glu-miR-01 mimics、Glu-miR-03 mimics以及阴性对照分别用无血清DMEM培养液按说明书比例稀释混匀。将稀释后的转染试剂分别与已稀释的Glu-miR-01 mimics/Glu-miR-03 mimics/阴性对照按照1∶1比例混匀。室温静置孵育15~20 min。将孵育充分的混合物分别加入设定孔中,继续培养24 h后更换培养基,每孔加入200 μL含有0.8 mmol/L H2O2的培养基;诱导3 h后吸去培养基,再加入浓度为5 mg/mL的20 μL MTT溶液,在CO2培养箱中于37 ℃孵育4 h后加入150 μL DMSO溶液,摇匀,待结晶充分溶解后,使用酶标仪于波长570 nm处测定每个孔的吸光度值(OD)。细胞活力(Cell viability,CV)计算如式(1)所示:
(1)
其中:CV为细胞存活率,%;OD实验为实验组在570 nm处的吸光度;OD对照为对照组570 nm处的吸光度。
1.5 衰老相关氧化应激指标和细胞SA-β-gal的检测
氧化应激相关细胞衰老的特征性指标主要包括SOD、MDA和T-AOC等[28]。SOD是生物体内清除超氧阴离子自由基的一种重要的抗氧化酶,可以保护机体免受氧自由基的损害;MDA是脂质与氧自由基形成的产物之一,其含量代表脂质过氧化的程度;T-AOC是指各种抗氧化物质和抗氧化酶等构成的总抗氧化水平,用于评价生物活性物质的抗氧化能力。选择培养的HSF细胞接种于6孔板,使每孔细胞密度为 1×106个,分为0.8 mmol/L H2O2诱导的模型组、实验组即0.8 mmol/L H2O2诱导+转染Glu-miR-01 mimics(Glu-miR-03 mimics)的Glu-miR-01组(Glu-miR-03组)、0.8 mmol/L H2O2诱导+转染阴性对照的阴性对照组,在转染miRNA mimics 24 h后,吸去旧培养基,每组都分别加入1 mL含有0.8 mmol/L H2O2的DMEM培养基,培养3 h后收集细胞,进行SOD、MDA和T-AOC等氧化应激相关指标检测。
细胞衰老相关β-半乳糖苷酶是检测细胞衰老的常用指标,利用衰老细胞中SA-β-gal活性水平上升进行细胞染色[29]。正常细胞中仅观察到零星的SA-β-gal阳性细胞;研究发现,长时间暴露于H2O2可导致细胞过早衰老,表现为细胞增殖受到抑制,SA-β-gal染色增强[30]。细胞衰老相关SA-β-gal的检测参照以上分组并按照试剂说明书进行。
1.6 细胞线粒体膜电位的检测
线粒体膜电位(ΔΨm)用于评估线粒体的活力,ΔΨm的变化反映细胞衰老变化。荧光探针JC-1可用于检测ΔΨm,细胞活力强时,ΔΨm较高,呈现红色荧光,而ΔΨm较低时呈绿色荧光,提示细胞衰老凋亡[29]。选择培养的HSF细胞接种于6孔板,使每孔细胞密度为 1×106个,分为正常细胞的正常组、0.8 mmol/L H2O2诱导的模型组、实验组即0.8 mmol/L H2O2诱导+转染Glu-miR-01 mimics(Glu-miR-03 mimics)的Glu-miR-01(Glu-miR-03)组、0.8 mmol/L H2O2诱导+转染阴性对照的阴性对照组,在转染miRNA mimics 24 h后,弃去旧培养基,除正常组外分别加入含有0.8 mmol/L浓度H2O2的DMEM培养基,培养3 h后使用线粒体膜电位试剂盒检测每组细胞的ΔΨm变化。
1.7 细胞中蛋白质表达量的检测(Western blotting)
细胞衰老的作用机制包括p53、p21Cip1/Waf1、p16INK4a等衰老相关分子标志物的调控,以及Rb蛋白的磷酸化状态(pRb /tRb)等[31]。p53受到DNA损伤和端粒侵蚀的刺激,导致P21表达增加,Rb蛋白去磷酸化,最终导致细胞复制性衰老[32]。P53的失活则促进衰老细胞的增殖,而P21缺乏则延缓衰老过程,提示p53/p21/Rb通路可能是调控细胞衰老的主要途径之一。选择在培养的HSF细胞,将Glu-miR-01 mimics和Glu-miR-03 mimics转染至细胞中,24 h后加入0.8 mmol/L H2O2诱导细胞,3 h后收集细胞。用细胞裂解液提取总蛋白。采用 SDS-PAGE分离总蛋白,用免疫印迹法将总蛋白转移到PVDF膜上。用5%脱脂牛奶与吐温(pH 7.4)在室温下封闭2 h后,用p53抗体、p16INK4A抗体、p21Waf1/Cip1抗体、Rb抗体在4 ℃过夜孵育,以羊抗兔IgG(HRP标记)作为二抗,使用ECL显色液检测蛋白表达。
1.8 统计分析
所有数据都是以平均值±SD表示3个独立实验的平均值,采用GraphPad Prism 6.0软件进行单因素方差A检验和LSD检验。当p值<0.05时,差异显著。
2 结果与讨论
2.1 H2O2诱导HSF细胞衰老模型的细胞活力变化
细胞衰老是由细胞内氧自由基堆积产生导致[33],正常有氧代谢产生的活性氧(Reactive oxygen species,ROS)对生物分子造成损害,并最终导致组织功能下降和衰老[34]。氧化应激导致的细胞衰老一直被视为衰老研究中经典的体外模型,H2O2是产生ROS的主要成分,H2O2诱导产生的氧化应激可引起人体皮肤成纤维细胞氧化损伤[35]。图1为不同浓度H2O2诱导下HSF细胞的活力变化。图1表明:当H2O2的浓度大于等于1.0 mmol/L时,经3 h诱导后CV约为50%,但经6 h以上诱导后,CV逐渐降低至20%以下,细胞大多数已经死亡。通过比较,最终选择0.8 mmol/L为最适浓度,3 h为最适作用时间,确定为H2O2诱导氧化应激构建细胞衰老模型的最适条件。

图1 H2O2诱导下HSF细胞活力变化直方图
2.2 HSF细胞衰老模型中氧化应激指标的变化
图2为H2O2刺激下HSF细胞内各氧化应激指标含量的变化。由图2可知,相比于正常细胞组,在0.8 mmol/L H2O2诱导3 h的模型组中,SOD和T-AOC的水平显著降低(p<0.01),而MDA含量相对于正常组显著增加(p<0.05)。这些氧化应激指标的显著改变,表明采用0.8 mmol/L H2O2、处理3 h的条件进行诱导的HSF细胞衰老模型构建成功,可用于后续实验。
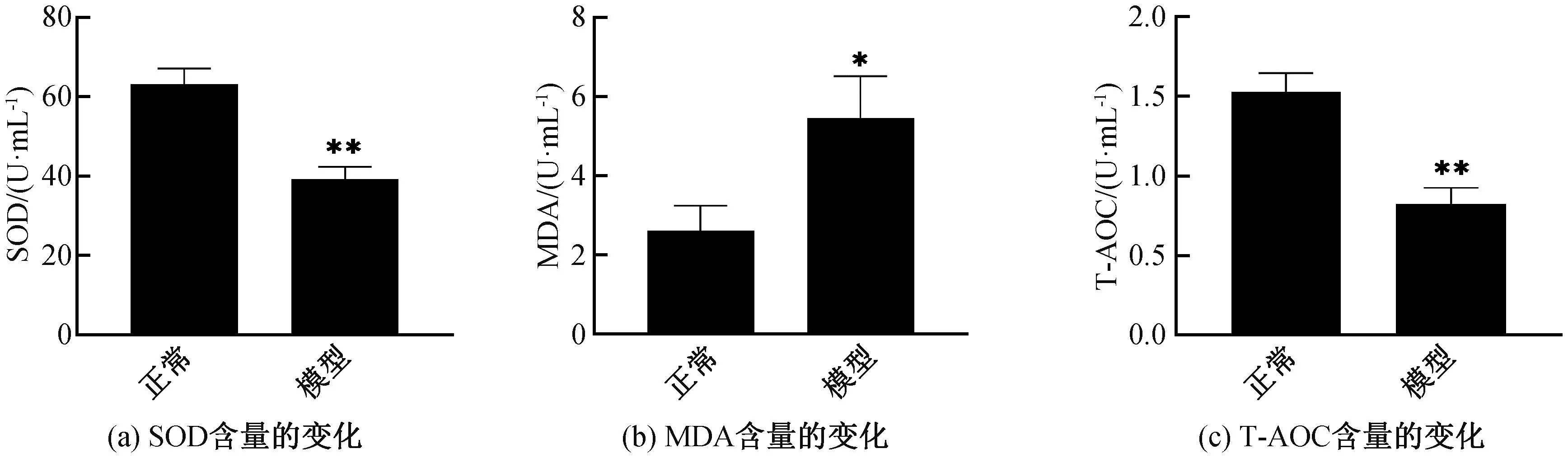
图2 H2O2诱导下HSF细胞衰老模型的氧化应激指标变化直方图
2.3 灵芝miRNA在HSF细胞中的转染效率
因为阴性对照组带有荧光标记(FAM),并且其核酸结构与合成的miRNA mimics相似,所以其荧光强度可以近似反映出Glu-miRNA的转染效率,图3为转染miRNA mimics 后细胞荧光强度,以及Glu-miR-01和Glu-miR-03在HSF细胞中的相对表达水平,由图3(a)—(b)可知,Glu-miRNA的转染效率相对较高;如图3(c)—(d) 相对表达水平检测实验结果显示,相比于对照组,实验组中Glu-miR-01 和Glu-miR-03表达水平都有显著升高,表明HSF细胞中Gas-miR-01 和Glu-miR-03都有较高的转染效率。

图3 转染miRNA mimics 细胞荧光强度显微图及Glu-miR-01和Glu-miR-03在HSF细胞中的相对表达水平直方图
2.4 灵芝miRNA对HSF衰老细胞活力的影响
为了探究转染灵芝miRNA对HSF细胞模型的影响是否具有剂量依赖性,在转染不同浓度miRNA mimics后,对H2O2诱导的HSF细胞模型细胞活力的变化进行检测。结果如图4所示。由图4可知,相比于只有正常细胞的正常组,模型组的HSF细胞由于一定浓度H2O2的诱导CV明显下降至正常组的50%~60%;而转染灵芝miRNA mimics实验组相比于模型组的细胞存活率明显升高,并且不同浓度的Glu-miR-01 mimics组CV显著高于阴性对照组(p<0.01);Glu-miR-03组具有相似的作用效果(p<0.05),说明转染的灵芝miRNA mimics可以逆转HSF的细胞活力,而跟剂量无关。

图4 灵芝miRNA转染后HSF衰老细胞活力变化直方图
2.5 灵芝miRNA对HSF衰老细胞中氧化应激指标和衰老细胞SA-β-gal生成的影响
图5和图6分别为Glu-miR-01、 Glu-miR-03对H2O2诱导的HSF细胞模型各个氧化应激指标的影响结果。图5表明:相较于H2O2诱导后HSF细胞的SOD和T-AOC活性降低,MDA含量升高,转染了灵芝miRNA mimics的HSF衰老细胞相应氧化应激指标发生了逆转。转染Glu-miR-01 mimics组SOD活力相对于只加入H2O2诱导的模型组显著升高(p<0.01),而MDA含量显著降低(p<0.01),T-AOC则明显上升(p<0.05)。由图6可知:Glu-miR-03 与 Glu-miR-01 具有一致的作用效果,SOD、MDA和 T-AOC 的变化亦呈显著性差异(p<0.05)。

图5 Glu-miR-01转染后HSF衰老细胞的氧化应激指标变化直方图

图6 Glu-miR-03转染后 HSF衰老细胞的氧化应激指标变化直方图
SA-β-gal活性变化结果如图7所示。由图7可知:H2O2诱导的模型组中SA-β-gal染色阳性细胞显著增加,而转染Glu-miR-01 mimics和转染Glu-miR-03 mimics的HSF衰老细胞中SA-β-gal阳性占比均明显低于模型组。这说明灵芝特异miRNA对缓解HSF细胞衰老具有一定作用。

图7 灵芝miRNA转染后HSF衰老细胞的SA-β-gal变化直方图
2.6 灵芝miRNA对HSF衰老细胞中ΔΨm的影响
图8为灵芝miRNA对HSF细胞衰老模型中ΔΨm的影响结果。图8表明,正常细胞中,红色占比较高,而经H2O2处理的HSF中绿色荧光占比增加,表明衰老细胞增加,活力减弱,而经Glu-miR-01 mimics和Glu-miR-03 mimics分别处理HSF衰老细胞后,红色荧光增加,相比于模型组具有显著差异(p<0.05),表明灵芝miRNA mimics 逆转了HSF衰老细胞的线粒体活力。

图8 灵芝miRNA转染后 HSF细胞衰老的ΔΨm变化示意图

2.7 灵芝miRNA对HSF衰老细胞中p53/p21/Rb信号通路的作用
越来越多的研究[14]证实,miRNAs可以参与衰老相关的信号通路如p53/p21/Rb通路的调节。因此,本文探究了灵芝miRNA对HSF衰老细胞中p53/p21/Rb信号通路相关蛋白的作用影响。图9为灵芝miRNA对H2O2诱导的HSF细胞衰老模型中p53/p21/Rb信号通路上相关蛋白表达水平的影响结果。图9表明:通过H2O2诱导的HSF衰老细胞所在模型相比于正常细胞组,P53、P21以及P16蛋白水平升高,Rb蛋白水平降低;转染灵芝Glu-miR-01后,各蛋白表达水平发生了改变;相比于模型组,P53、P21和P16蛋白水平明显下降,Rb蛋白水平显著上升,结果由图9(a)—(b)所示。转染Glu-miR-03的结果与之一致,结果如图9(c)—(d)所示。以上结果表明,灵芝miRNA mimics对衰老相关p53/p21/Rb信号通路的关键蛋白具有调控作用,提示灵芝特异miRNA可能通过调控p53/p21/Rb信号通路延缓HSF细胞衰老。

图9 灵芝miRNA转染后HSF衰老细胞相关蛋白表达变化示意图
3 结 论
本文探究了中药灵芝中特异miRNA对细胞衰老的作用及影响,主要结论如下:
a)灵芝特异Glu-miR-01和Glu-miR-03能够使HSF衰老细胞的SOD和T-AOC水平上升,MDA含量下降,并且能减少SA-β-gal阳性细胞的生成,提高衰老细胞的线粒体膜电位,从而增强细胞的抗氧化能力,对衰老细胞具有积极的修复作用。
b)灵芝Glu-miR-01和Glu-miR-03都能下调HSF衰老细胞中p53/p21/Rb信号通路上的关键蛋白P53、P21、P16表达,上调Rb蛋白的表达,证明灵芝Glu-miR-01和Glu-miR-03对衰老细胞的p53/p21/Rb信号通路具有调控作用。本文为阐明灵芝特异miRNA对延缓衰老的作用机制提供了理论依据,为进一步研究灵芝miRNA跨界调控的分子机制奠定了基础。

