1例梅花鹿狂犬病的病理学诊断及其病原遗传进化分析
高 雅,智 宇,张 迪,乔 蕾,邵国玉,丁玉林,葛金英,王金玲
(1.内蒙古农业大学兽医学院,内蒙古 呼和浩特 010018;2. 农业农村部动物疾病临床诊疗技术重点实验室,内蒙古 呼和浩特 010018;3. 内蒙古自治区农牧业科学院,内蒙古 呼和浩特 010051;4. 内蒙古通辽市科尔沁区畜牧水产工作站,内蒙古 通辽 028000;5. 中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室,黑龙江 哈尔滨 150001;6. 内蒙古自治区兴安盟科尔沁右翼前旗动物疫病预防控制中心,内蒙古 科尔沁右翼前旗 137713)
狂犬病(Rabies)是由狂犬病病毒(Rabies virus,RABV)引起的侵犯神经系统的一种人兽共患的自然疫源性疾病[1]。RABV是单股负链不分节段的RNA病毒,属于弹状病毒科(Rhabdoviridae)、狂犬病毒属(Lyssavirus)[2]。RABV的糖蛋白(Glycoprotein,G)能有效刺激机体产生中和抗体,与病毒的毒力和致病性有关,因此,G基因是检验不同病毒株之间关系的最好选择[3]。核蛋白(Nucleoprotein,N)基因结构高度保守,因此,N基因经常作为病毒基因分型和进化的标准[4]。几乎所有温血脊椎动物都易感染RABV,但自然界中最易感染RABV的动物是犬科和猫科动物,以及一些翼手目动物(如蝙蝠)和一些啮齿类动物[5]。野生动物(如狼、狐狸和鼬獾)是RABV的主要自然宿主。RABV对野生动物的危害是十分巨大的。在韩国[6]、阿根廷[7]和墨西哥[8]等国家均报告过鹿狂犬病病例,其感染与蝙蝠、浣熊和臭鼬有关。但是,目前世界范围内缺乏野生动物狂犬病散发性病例的相关临床数据。中国RABV分离株来源于6个进化分支,China Ⅰ、China Ⅱ、China Ⅴ、China Ⅵ属于Asian谱系,China Ⅲ属于Cosmopolitan谱系,China IV属于Arctic-like谱系[9]。本试验通过组织病理学检查、直接免疫荧光法(Direct immunofluorescence assay,DFA)和免疫组织化学(Immunohistochemistry,IHC)对导致1例梅花鹿病死病例的RABV进行鉴定,同时还进行了RABV分离毒株N和G基因的遗传进化分析,以期为野生动物狂犬病的诊断和防控提供参考资料。
1 材料与方法
1.1 病料来源 内蒙古自治区包头市某鹿园共饲养梅花鹿60只,有10余只梅花鹿陆续死亡,其中有1只成年梅花鹿(病例号为IMAU No. 11189)死前有明显的狂暴型神经症状,表现出流涎、流泪、结膜充血和食欲废绝等症状。据饲养员介绍园内常有野狗出入。
1.2 主要试剂 95%酒精和无水乙醇,均购自天津风船化学试剂科技有限公司;二甲苯,购自天津市北联精细化学品开发有限公司;荧光标记的狂犬病病毒核蛋白单克隆抗体和狂犬病病毒ERA株弱毒疫苗免疫小鼠获得的多克隆抗体,均由中国农业科学院哈尔滨兽医研究所提供;小鼠/兔通用型SAP试剂盒(货号:SAP-9100),购自北京中杉金桥生物技术有限公司;胰酶抗原修复液,赛默飞世尔科技(中国)有限公司;病毒DNA/RNA提取试剂盒、一步法逆转录PCR试剂盒和DL-2 000 DNA Marker,均购自南京诺唯赞生物科技股份有限公司。
1.3 主要仪器 组织脱水机(Tissue-TeK®VIPTM5 Jr)、组织包埋机(Tissue-TeK®TECT)、水平切片机和烤片机(Tissue-TeK Slide Warmer PS-53),均购自日本Sakuar樱花公司;展片机,购自德国Leica公司;染色机(Varistain Gemini 371)和盖片机(Clearvue),购自Thermo Scientific公司;PCR扩增仪(C1000 TouchTM)和全自动凝胶成像分析仪(GelDoc),均购自Bio-Rad公司;电泳仪(DYY-6D),购自北京六一生物科技有限公司;光学显微镜(CX40),购自德国莱卡仪器有限公司。
1.4 试验方法
1.4.1 剖检病变观察 观察园区内情况,通过问诊饲养员了解发病鹿病史,观察并记录发病鹿的临床症状,并对1例发病死亡的梅花鹿进行系统的病理剖检。
1.4.2 组织病理学检查 剖检时取脑、肝脏、肺脏、淋巴结和脾脏等主要的组织器官,立即放入固定液中固定。同时取小脑组织放入-80 ℃冰箱保存备用。将固定好的组织制作成石蜡切片,经苏木素-伊红(Hematoxylin eosin,H.E.)染色后于显微镜下观察。
1.4.3 DFA检测 取1.4.2中制备的梅花鹿小脑组织石蜡切片,按照DFA常规步骤进行[10],以正常梅花鹿的小脑组织作为阴性对照。
1.4.4 IHC检测 取1.4.2中制备的梅花鹿小脑组织石蜡切片,切片厚4 μm,用75%乙醇梯度脱蜡和水化,0.1%胰酶抗原修复液进行抗原修复,按照小鼠/兔通用型SAP试剂盒说明书,依次滴加内源性过氧化物酶阻断剂、山羊血清封闭,使用一抗(狂犬病病毒ERA株弱毒疫苗免疫小鼠获得的多克隆抗体)4 ℃孵育过夜,PBS缓冲液洗去一抗后,依次滴加生物素标记山羊抗鼠IgG和辣根过氧化物酶标记链霉卵白素工作液。阴性对照使用PBS代替一抗,二氨基联苯胺(3,3′-diaminobenzidine,DAB)显色,中性树胶封片后在显微镜下观察。
1.4.5 PCR扩增 根据NCBI上已发表RABV序列KC193267设计N和G基因特异性引物(表1),交由生工生物工程(上海)股份有限公司合成。使用病毒DNA/RNA提取试剂盒提取梅花鹿小脑组织RNA。对提取的RNA进行N和G基因一步法反转录聚合酶链反应(Reverse transcription-polymerase chain reaction,RT-PCR)鉴定。PCR扩增体系:2×One Step Mix 25 μL,One Step Enzyme Mix 2.5 μL,上、下游引物各2 μL,RNA模板2 μL,用RNase Free dH2O补足至50 μL。PCR扩增程序:反转录50 ℃ 30 min,预变性95 ℃ 3 min;变性94 ℃ 30 s、退火50 ℃ 30 s、延伸 72 ℃ 2 min,共30个循环;72 ℃终延伸10 min。PCR扩增产物经1%琼脂糖凝胶电泳检测。
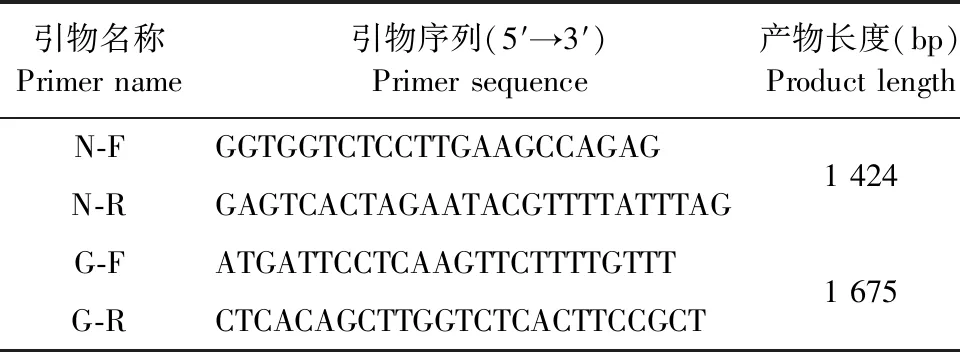
表1 引物序列信息
1.4.6 RABVN和G基因的遗传进化分析 将1.4.5的阳性PCR产物送至生工生物工程(上海)股份有限公司进行N和G基因测序。测序结果用Mega 6生物分析软件的最大似然法(Maximum likelihood method),通过1 000次重复计算引导值构建系统发育树,使用DNASTAR 5.0软件分析比较试验获得RABV序列与参考毒株序列的核苷酸同源性。
2 结果
2.1 剖检病变观察 对发病死亡的梅花鹿进行病理剖检,可见脑水肿明显,脑脊液增多,脑膜静脉充血扩张(图1A),脑干切面弥散分布针尖大小的出血点(图1B)。其他组织器官眼观无明显病变。

图1 病死梅花鹿脑组织剖检病变观察
2.2 病理组织学检查 病死梅花鹿脑充血和水肿,呈现典型的非化脓性脑炎,可见大量以血管为中心的出血灶(图2A)。部分脑神经细胞变质,偶见大量淋巴细胞和少量巨噬细胞呈围管性浸润,形成淋巴细胞性“管套”病变(图2B)。在脑组织神经细胞的胞浆内可见大小不等的、嗜酸性圆形或椭圆形的RABV包涵体,特别是在小脑浦肯野细胞(图2C蓝色箭头)、大脑锥体细胞(图2D蓝色箭头)、大脑多形细胞、海马多形细胞、锥体细胞和脊髓多极运动神经元胞浆内。肝脏、肺脏、脾脏、淋巴结和肾脏等实质器官出现充血和出血性变化。
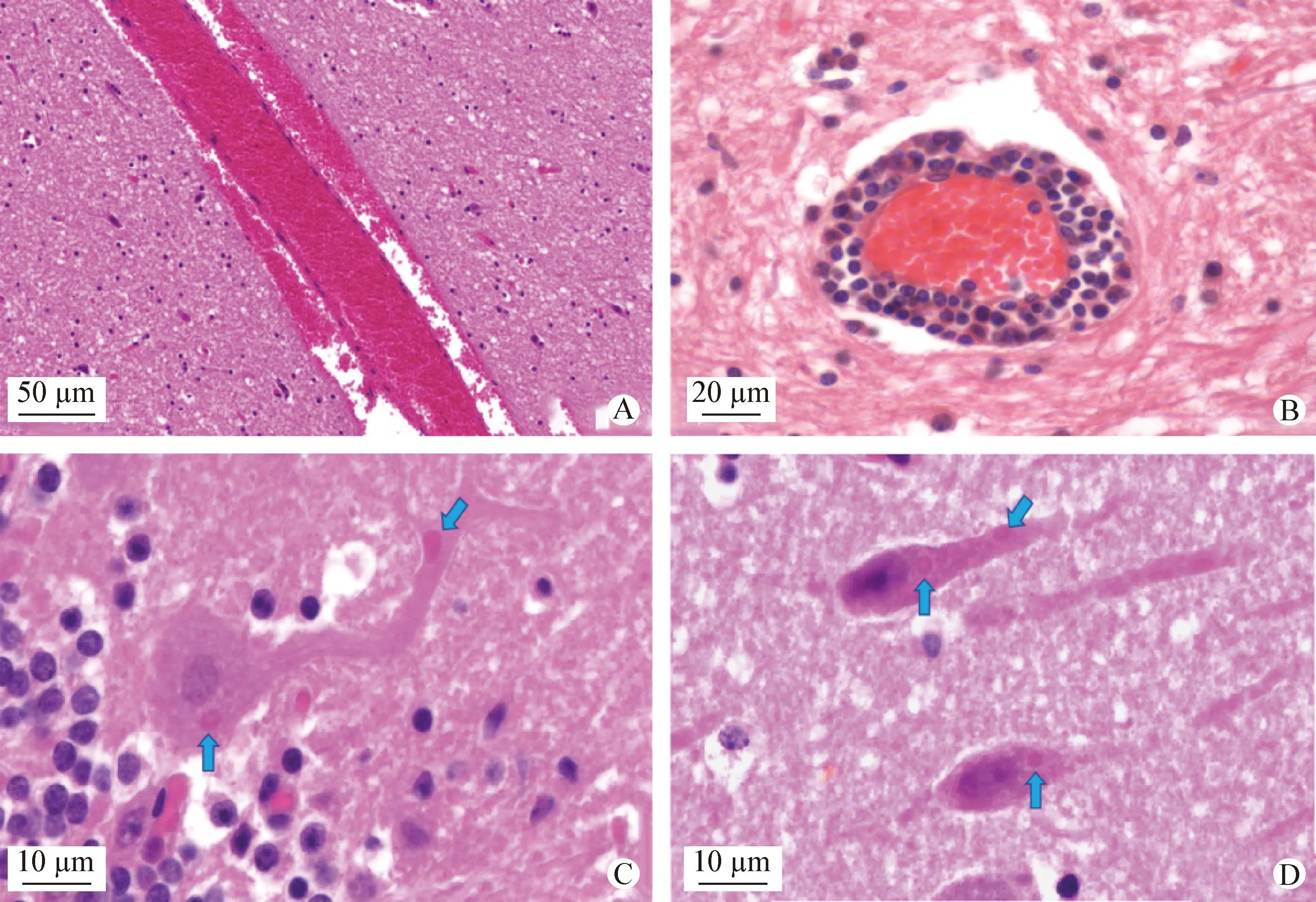
图2 病死梅花鹿脑组织病理组织学变化(H.E.染色)
2.3 DFA检测 结果显示,在阴性对照成立的情况下,在病死梅花鹿的小脑组织中检测到大量特异性的亮绿色的RABC抗原阳性信号(图3)。

图3 DFA检测病死梅花鹿小脑组织(A)和阴性对照(B)中狂犬病病毒抗原(400×)
2.4 IHC检测 结果显示,在病死梅花鹿的小脑浦肯野细胞的胞浆内检测到大小不等的、圆形或椭圆形的典型的棕色RABV抗原的特异性阳性信号(图4)。

图4 IHC检测病死梅花鹿小脑组织(A)和阴性对照(B)中狂犬病病毒抗原(400×)
2.5 PCR扩增 PCR扩增得到1 675和1 424 bp大小的目的条带(图5),符合预期产物大小,将该RABV分离株命名为NM Deer 01。

图5 病死梅花鹿脑组织RABV G和N基因的PCR扩增
2.6 RABVN基因的遗传进化分析 通过Mega 6和DNASTAR 5.0软件对本试验获得RABV分离毒株N和G基因序列与参考毒株进行遗传进化分析。N基因核苷酸序列分析结果显示,病毒NM Deer 01同2019年河南犬源毒株(MK567666)、2019年甘肃羊源毒株(MK577649)、2015年湖北牛源毒株(KR230090)、2009年福建犬源毒株(FJ866835)、2015年呼和浩特牛源毒株(KC193267)和2014年山东犬源毒株(JQ970486)位于同一分支,均属于Asian谱系;NM Deer 01毒株与2015年呼和浩特牛源毒株(KC193267)和2015年湖北牛源毒株(KR230090)核苷酸同源性最高,均为99.5%,与其他参考毒株核苷酸同源性介于86.4%~99.5%(图6)。

图6 基于梅花鹿源RABV N基因构建的遗传进化树
2.7 RABVG基因的遗传进化分析G基因核苷酸序列分析结果显示,病毒NM Deer 01同2019年河南犬源毒株(MK567666)、2019年甘肃羊源毒株(MK577649)、2015年湖北牛源毒株(KR230090)、2009年福建犬源毒株(FJ866835)、2015年呼和浩特牛源毒株(KC193267)和2014年山东犬源毒株(JQ970486)位于同一分支,均属于Asian谱系;NM Deer 01毒株与2014年山东犬源毒株(JQ970486)和2015年呼和浩特牛源毒株(KC193267)同源性最高,均为99.3%,与其他参考毒株核苷酸同源性介于83.0%~99.3%(图7)。

图7 基于梅花鹿源RABV G基因构建的遗传进化树
3 讨论
动物狂犬病的临床表现可分为狂暴型和麻痹型2种[11]。狂暴型表现为极典型的神经症状,如兴奋、具有攻击行为,后期会引起咽肌局部发生痉挛或全身肌肉麻痹而造成死亡。而麻痹型狂犬病发病动物从发病初期至死亡一直表现为精神沉郁[12]。本试验中的病死梅花鹿有流涎、乱跑、顶人和乱撞等明显的神经症状,可判断该鹿表现为狂暴型。狂犬病不同的临床类型表现与咬伤部位感染的病毒量和毒株的种类不同有关[13]。
狂犬病的病理组织学诊断标准是在脑神经细胞胞浆内观察到嗜酸性包涵体,即内基氏小体(Negri body),这种小体主要分布于大脑皮层和海马回椎体细胞、小脑浦肯野细胞和基底核、脊神经核以及交感神经节等处神经细胞的胞质内[14]。本试验病死梅花鹿除非化脓性脑炎病变外,在脑组织多数神经细胞胞浆内均发现了典型的嗜酸性RABV包涵体。DFA是世界卫生组织(World Health Organization,WHO)推荐的狂犬病实验室诊断方法,我国也将此法作为检测狂犬病的首选方法,该方法具有特异性高、灵敏度强的优点[15]。有研究表明,犬和猫的大脑海马是RABV检测的最佳部位;牛在脑干部检测RABV效果最明显,其次在小脑;颈脊髓和靠近脑干的区域是马属动物检测RABV抗原的最好部位;浣熊和臭鼬在脑组织的各个部位都可检测到RABV[16]。本试验病死梅花鹿采用DFA和IHC均在小脑组织中检测到RABV特异性阳性信号。
鹿主要通过被带毒犬咬伤以及在放牧、交配争斗和锯鹿角时损伤而感染RABV[17]。有报道显示,我国自1950年以来,鹿狂犬病在部分地区的发病率高达30%,多出现于一些养殖场和养殖户中[18]。野生鹿群感染狂犬病大多数由于与蝙蝠、浣熊和臭鼬接触或鹿群的饮水和饲料被RABV污染。本试验根据对现场环境调查结合问诊园内兽医得知,鹿园内常有流浪犬进出引起鹿群不安,个别梅花鹿身体上出现过咬伤,因此推测本例梅花鹿发生狂犬病与被带毒流浪犬咬伤密切相关。RABV从伤口处进入并繁殖,然后通过逆行轴突运输到中枢神经系统,导致大脑或脊髓发生炎症;RABV在中枢神经系统中经过一段时间的复制后,病毒粒子可通过轴突进入唾液腺,从而很容易地完成传播周期并感染下一个新的易感宿主[19]。
亚洲和非洲是狂犬病的高发地区,RABV在人、宠物、家畜和野生动物之间不断循环感染[20]。截至2014年,内蒙古地区共报道了30多种动物患狂犬病,包括狗、貉、红狐、牛、羊和骆驼等[21]。2018年,于明洋等[22]报道了2014—2016年内蒙古地区5起野生狐狸、牛、骆驼和犬的狂犬病疫情,对6株RABVN基因序列进行遗传进化分析,结果显示,6株毒株均属于Cosmopolitan谱系草原型RABV,该型毒株广泛在俄罗斯、蒙古和哈萨克斯坦的野生狐狸和狼群中传播。2022年,Feng等[23]报道了2019—2021年内蒙古地区家畜和野生食肉动物(狐狸、獾和浣熊)的狂犬病发生情况,并对80株RABVN基因序列进行遗传进化分析,结果显示,97.5%的病毒株属于Cosmopolitan谱系草原型,其余毒株属于Arctic-related谱系和Asian谱系。2011年,Shao等[24]报道了内蒙古地区5例浣熊狂犬病病例,对RABVN基因和G基因的遗传进化分析显示,分离毒株与俄罗斯远东地区和韩国分离的Arctic-like谱系RABV密切相关,但不同于中国流行地区广泛分布的Asian谱系RABV。不同于上述文献对内蒙古地区野生动物RABV谱系的报道,本试验对病死梅花鹿的N和G基因序列进行遗传进化分析,结果显示,分离毒株NM Deer 01的N和G基因均与2015年呼和浩特牛源毒株(KC193267)同源性最高,从基因层面上证明了该梅花鹿感染了RABV,分离毒株的N和G基因同呼和浩特、河南、甘肃、山东、湖北和福建等地毒株位于同一分支,同属于Asian谱系,这与该鹿园与呼和浩特、河南、甘肃和山东的地理位置较近有关。依据疾病发生的时间和位置,推测该病毒有从北方逐渐向南方扩散蔓延的趋势。
近年来,RABV依旧在世界范围内不断感染野生动物和家畜,因此,对动物狂犬病进行防治十分必要。建议本试验中的鹿场加强饲养管理,将鹿园周围围栏加装细铁丝网,以防再有流浪犬进入鹿园;立即对未感染鹿群集体注射狂犬病疫苗,公梅花鹿2.5~3.5 mL/头,母梅花鹿2.5 mL/头[25];患病鹿立即处死,焚烧或紧急接种治疗;病死鹿尸体立即焚烧,禁止取皮或食用;饲养人员也应尽早注射狂犬病疫苗,以防人员感染。

