Toll样受体在钙化性主动脉瓣疾病中的研究进展
任一鸣,张晋辉,王聪聪,王天堃,任学群,周建良
1. 河南大学淮河医院普外科(河南开封 475000)
2. 武汉大学中南医院心血管外科(武汉 430071)
3. 武汉大学中南医院循证与转化医学中心(武汉 430071)
心脏瓣膜病是最常见的心血管疾病之一,风湿性心脏病和老年退行性心脏瓣膜病是最常见的后天性发病因素。在过去20 年中,风湿性心脏病的死亡率保持稳定,而钙化性主动脉瓣狭窄的死亡率逐步上升[1]。钙化性主动脉瓣疾病(calcified aortic valve disease, CAVD)是指从主动脉瓣增厚和钙化而无血流动力学的变化,到主动脉瓣狭窄而引起左室流出道梗阻的一系列变化过程。临床现阶段唯一的治疗手段仍是主动脉瓣置换术,依然缺乏可以阻止或延缓CAVD 进展的药物[2-3],因此,探明CAVD 的发生发展机制,寻找药物治疗靶点是该领域亟待解决的重点问题。
既往研究认为CAVD 是一个与衰老相关的、被动的、退行性的过程。而随着近年来研究发现,CAVD 实际是一个主动的、多因素参与的、可积极调节的生物学过程[4-5],类似于血管动脉粥样硬化,涉及内皮功能活动障碍、炎症反应、脂质浸润、细胞外基质重塑和成骨分化等过程[6-7]。越来越多的证据表明,炎症反应是CAVD 的重要环节,不仅参与CAVD 的起始步骤,还通过调节骨形成相关的信号通路促进钙化形成[8],其中Toll 样受体(Toll-like receptors,TLRs)的功能尤为重要。TLRs 是免疫模式识别受体家族成员之一,可以通过识别外源性病原体相关分子模式(pathogen-associated molecular patterns,PAMPs)和内源细胞损伤相关分子模式(damage-associated molecular patterns,DAMPs)来激活一系列先天免疫反应[9]。本文就近年来TLRs 在CAVD 的机制进行综述,旨在为CAVD进一步的研究和治疗提供科学依据。
1 Toll样受体概述
1.1 Toll样受体的结构、适配器和配体
TLRs 是一种Ⅰ型跨膜蛋白,由细胞外区、跨膜区和细胞质区3 个部分组成。TLRs 的细胞外区通过触发先天免疫反应在细胞外病原体攻击和组织损伤过程中起着关键作用;跨膜区决定了TLRs的亚细胞定位[10];TLRs 的细胞质区域被称为Toll/IL-1 受体(Toll/interleukin receptor,TIR)结构域,它在信号转导过程中特异性地募集下游接头[11]。最近的研究报道了5 种含有TIR 结构域的适配器,分别为髓样分化因子88(myeloid differentiation factor 88,MyD88)、诱导IFN-β 的含TIR 结构域的转接蛋白(TIR domain-containing adaptorinducing IFN-β,TRIF)、MyD88- 转接体样/TIR-相关蛋白(MyD88 adaptor-like/TIR associated protein,MAL/TIRAP)、Toll 受体相关分子(Toll receptor associated molecule,TRAM)以及SARM(sterile-α and HEAT/Armadillo motifs)[12]。
病原体释放的抗原被称为PAMP,主要包括脂多糖(lipopolysaccharide,LPS)、 肽聚糖(peptidoglycan,PGN)、单链RNA(single-stranded RNA,ssRNA)、双链RNA(double-stranded RNA,dsRNA)等[13]。根据其细胞位置和特定配体,识别PAMP 的TLRs 可分为两类[14]。其中一种表达于细胞表面,识别微生物的膜成分(TLR1、TLR2、TLR4、TLR5、TLR6 和TLR11);另一种在细胞内囊泡上表达并识别微生物核酸(TLR3、TLR7、TLR8 和TLR9)[15]。DAMPs 是从受损或垂死的细胞中产生释放的各种细胞内分子,主要包含HMGB-1、三磷酸腺苷(ATP)、线粒体DNA 和RNA 等[16]。DAMPs 通过直接促进炎症介质的释放,调节先天性和获得性免疫的发展方向,影响严重反应的发展,诱导免疫细胞向炎症部位迁移,增加炎症细胞黏附和浸润能力来调节炎症反应[17]。
1.2 Toll样受体的信号通路
TLRs 介导的信号通路错综复杂。目前,TLRs 有两条主要的信号通路,即MyD88 依赖性通路和TRIF 依赖性通路,启动免疫反应最常见的信号通路是MyD88 依赖性通路[18]。
除TLR3 以外的所有TLRs 都可以通过MyD88依赖性信号通路引发免疫反应。TLRs 和MyD88的结合刺激了IRAK 家族成员(IRAK1、IRAK2、IRAK4 等)的招募,其中IRAK4 是极其重要的。IRAK4 是一种促进IRAK1 磷酸化的激酶,在下游信号转导中募集磷酸化的IRAK1 和TRAF6[19]。TRAF6 与适配器形成复合物,通过MAPK 激酶激酶(MAP3K)通路激活TAK1,导致I-κB 激酶(IKK)复合物和P38 磷酸化,激活NF-κB 通路,从而诱导IL-1β 和TNF-α等炎症因子的表达[20]。
TLR3 和TLR4 可以通过TRIF 依赖性通路调节信号转导,TLR3 可直接连接到TRIF,而TLR4通过TRAM 连接到TRIF。TRIF 激活TANK 结合激酶1(TBK1)后,IRF3 被激活,之后转移到细胞核中,并调节IFN-β 的合成。同样,TRIF 依赖性通路也可以通过激活TRAF6 向NF-кB 通路的转化来诱导炎症[21]。
2 钙化性主动脉瓣疾病的病理生理学概述
主动脉瓣是一个半月状结构,在促进血液从左心室到主动脉的单向流动中发挥重要作用。主动脉瓣的组织结构通常分为纤维层、海绵层和心室层。纤维层和心室层是最外层,分别面向主动脉和左心室。纤维层主要含有胶原纤维,而心室层具有高含量的弹性纤维,并且由主动脉瓣膜间质细胞(aortic valve interstitial cell,AVIC)填充。中心海绵层的糖胺聚糖含量较高,在主动脉瓣的生物力学特性中发挥重要作用,在心动周期期间吸收部分机械负荷[22]。主动脉瓣被瓣膜内皮细胞(valve endothelial cell,VEC)覆盖,研究表明主动脉瓣和血管内皮具有不同的生物学特性,这可能会影响CAVD 的发展[23]。
对从手术中获得的人钙化主动脉瓣进行微观分析,结果揭示了CAVD 的一些重要关键特征。首先,脂质渗透到矿化区附近的瓣膜组织中;其次,在一些瓣膜中存在致密的炎性浸润,并观察到氧化脂质和微钙化[24];最后,在约15%的微钙化中观察到成骨化生。Coté 等研究发现在285个钙化主动脉瓣中,28%的瓣膜存在致密的慢性炎性浸润,且与骨化生、新血管形成和更高水平的组织重塑相关[25]。此外,钙化主动脉瓣中炎性细胞密度与主动脉瓣狭窄进展速度加快相关,故CAVD 的发生发展过程与炎症可能有重要关系。
3 Toll样受体在钙化性主动脉瓣疾病中的作用机制
自1997 年起,陆续有研究在主动脉瓣狭窄的瓣叶上检测到了肺炎衣原体和与慢性牙周感染相关的细菌等病原微生物[26-28]。Cohen 等研究发现,在复发性低度心内膜炎的家兔模型中接种口腔细菌可导致主动脉瓣钙化[29]。然而,内皮损伤后短暂的菌血症导致细胞因子反应的潜在致病机制仍未被探明。
先天性受体被认为是病原体衍生分子、炎症和CAVD 之间的分子枢纽[30]。TLRs 是进化上保守的模式识别受体,是先天免疫和炎症之间的重要中介。在主动脉瓣中,TLRs 不仅存在于浸润免疫细胞中,而且存在于固有细胞中,其中TLR4是最丰富的亚型[31]。近年来CAVD 与TLRs 相关的通路机制进展见图1。
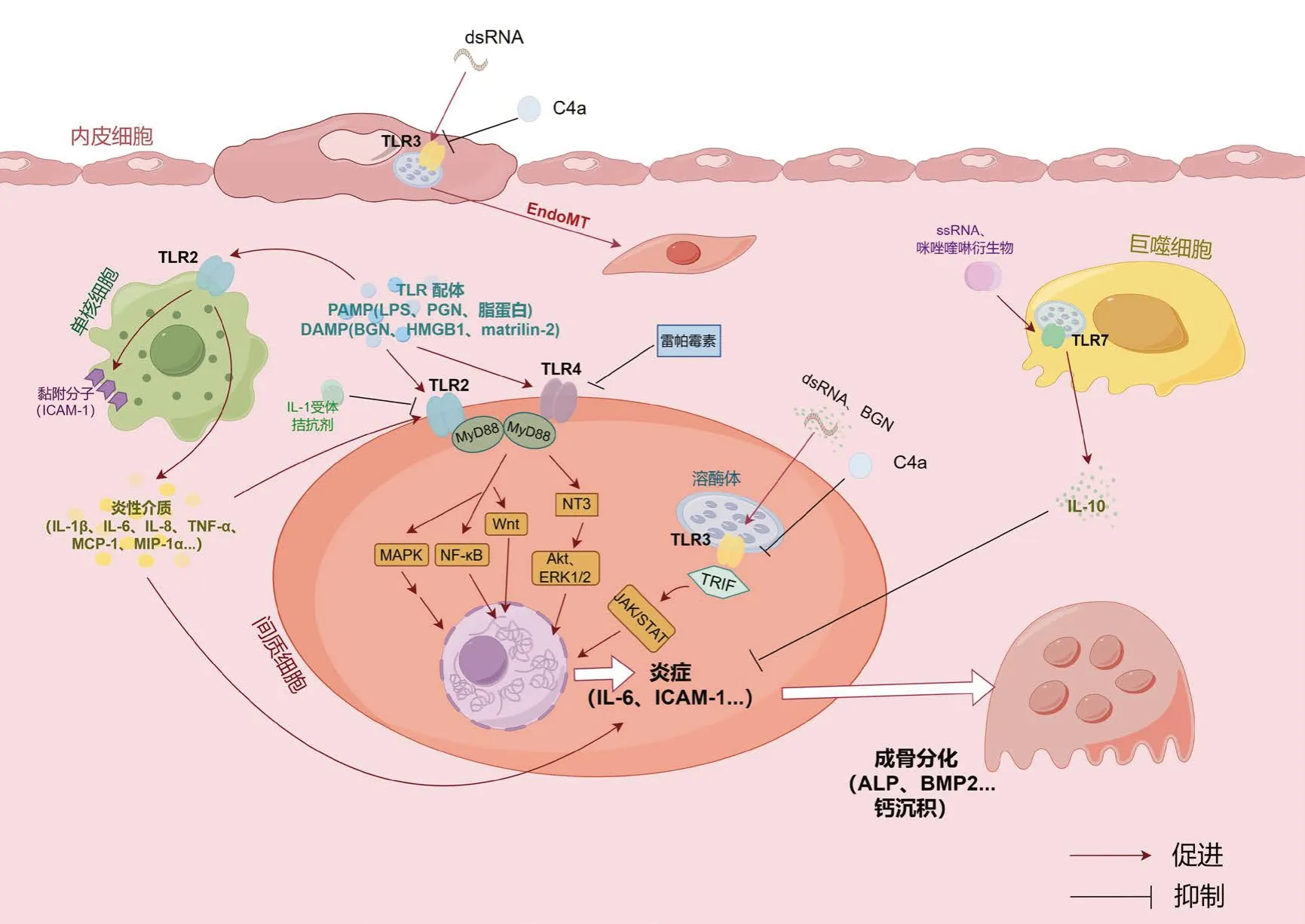
图1 Toll样受体在钙化性主动脉瓣疾病中作用机制图Figure 1. Mechanism diagram of Toll-like receptors in CAVD
3.1 TLR2在钙化性主动脉瓣疾病中的作用
最先被发现在主动脉瓣组织和AVIC 中表达的TLRs 家族成员是TLR4 和TLR2,它们在钙化的瓣膜中上调[31]。此外,与肺动脉瓣、二尖瓣或三尖瓣相比,主动脉瓣组织和AVIC 中表达更多的TLR4 和TLR2 且对其激动剂的促炎促成骨反应更大[32-33]。
TLR2 可以与外源性配体如PGN、脂蛋白等与PAMPs 结合,激发炎症反应,因此实验中常用PGN 和Pam3CSK4 等为TLR2 激动剂。TLR2 和TLR4 经常共同作为研究对象并通过适配器MyD88和NF-κB 通路介导它们的作用[31,34-35]。Song 等在研究中发现双糖链蛋白聚糖(biglycan,BGN)通过TLR2 和TLR4 诱导人AVIC 中细胞间黏附分子-1(intercellular cell adhesion molecule-1,ICAM-1)和单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)的表达,并需要激活ERK1/2 通路,但TLR2 的敲低和对炎症反应的抑制作用比TLR4 阻断和敲低更明显[36]。Lee 等发现IL-1 受体拮抗剂能减少TLR2 刺激下AVIC 中骨形态发生蛋白-2(bone morphogenetic protein-2,BMP2)的产生,而在TLR4 的刺激下未发生此作用[37],表明IL-1受体拮抗剂只针对TLR2 发挥抗炎作用(图1)。这些研究都突出了TLR2 在CAVD 中发挥重要作用,且在某些方面的作用甚至比TLR4 更为重要。Rabkin 等的研究表明在AVIC 中炎症因子通过TLR2 作用使p38 MAPK 去磷酸化而对主动脉瓣产生影响,并排除了其通过血管紧张素Ⅱ或过氧亚硝酸盐的介导作用[38](图1)。单核细胞浸润和主动脉瓣中单核细胞/巨噬细胞积聚是进行性CAVD 的特征[39]。Zhang 等将低浓度TLR2 激活剂Pam3CSK4 加入AVIC 和单核细胞共培养体系中,发现仅在使用Pam3CSK4 刺激单核细胞后的上清液培养或与其共培养时,AVIC 产生的ICAM-1和血管细胞黏附因子-1(vascular cell adhesion molecule-1,VCAM-1)显著增加,且肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)水平也明显升高;AVIC 中TLR2 的抑制或敲低显著降低了Pam3CSK4 刺激单核细胞诱导的ICAM-1 和VCAM-1 的表达,中和TNF-α也能显示同样作用,表明单核细胞通过旁分泌上调TLR2 水平来增强AVIC 的炎症反应[40](图1)。
3.2 TLR3在钙化性主动脉瓣疾病中的作用
TLR3 配体dsRNA 存在于病毒中,也可以在正链RNA 病毒、dsRNA 病毒和DNA 病毒的复制下产生,内源性来源可能是组织损伤或坏死[41]。López 等人使用poly(I:C)模拟dsRNA 效应,首次报道了TLR3 介导的人AVIC 的钙化[35]。Zhan 等证实了dsRNA 介导的炎症介质和促成骨活性的上调,并通过基因沉默和中和抗体进一步证明了非经典途径TLR3-TRIF 以及NF-κB 通路和ERK 通路的参与[34,42]。Parra-Izquierdo 等还发现了JAK/STAT 信号转导介导dsRNA 触发主动脉瓣的炎症、细胞凋亡和钙化,以及I 型IFN 也激活了AVIC 中的STAT1 和NF-κB 通路,而使用JAK 抑制剂鲁索替尼或Ⅰ型干扰素受体阻断抗体可以阻止这种情况的发生[43](图1)。Gollmann-Tepeköylü 等以APOE 缺陷小鼠和特异性斑马鱼为研究模型,通过体内实验验证了BGN-TLR3-IFNAR1 轴在CAVD 中的作用,并通过两个大规模队列研究证实了CAVD 与BGN-TLR3-IFN 通路相关基因遗传变异的相关性[44]。TLRs 在CAVD中的体外研究大部分都聚焦于AVIC 上,而Niepmann 等的研究也关注了VEC 在CAVD 中发生的变化,研究发现与正常小鼠相比,TLR3基因敲除小鼠在钢丝损伤主动脉瓣后的钙化发生率显著降低,证实了内源性TLR3 配体在主动脉瓣狭窄病理学中的作用,还观察到TLR3 的激活也会损伤小鼠的内皮功能。TLR3 抑制剂C4a 不仅阻止了AVICs 中炎性细胞因子和成骨标志物的上调,以及VECs 中内皮间充质转化的上调,而且在体内显著消除了主动脉瓣狭窄的发生[45](图1)。
3.3 TLR4在钙化性主动脉瓣疾病中的作用
TLR4 是AVIC 中表达最高的TLRs[35]。研究发现成人比儿童AVIC 对TLR4 刺激表现出更强的炎症和成骨反应[46]。多研究表明TLR4 通路在CAVD 的发病机制中起促进作用,减少TLR4 的表达可以逆转AS 的进展[36,47]。Deng 等猜测TLR4介导作用在儿童中由于涉及STAT3 激活的保护机制而被阻止,但在成人中不存在这种保护机制[46]。后续研究发现TLR4 的外源性刺激剂LPS 可以促进AVIC 成骨标志物的表达,雷帕霉素可以通过上调STAT3 的表达而抑制这种反应[48](图1)。Parra 等也发现LPS 和IFN 联合缺氧诱导因子1α(HIF-1α)时,STAT-1 也发挥重要作用[49]。这些研究均表明STAT 相关通路在CAVD 发展过程中的重要作用。Yao 等发现LPS 可以诱导TLR4 依赖性NT3 的产生,这种作用通过抑制Akt 和ERK1/2 通路而被消除[50],Jarrett 等也证实了LPS 刺激AVIC纤维化依赖Wnt 信号通路的介导[51](图1)。
还有研究描述了与CAVD 发病机制相关的几种DAMP,它们都能通过TLR4 介导其作用。BGN 是一种广泛分布于组织中的小分子蛋白聚糖,在病理条件下大量产生,在CAVD 中也大量表达[52]。可溶性BGN 通过TLR2 和TLR4 诱导脂质修饰酶和细胞因子表达,在AVIC 中通过TLRs途径充当促炎诱导剂[52-53]。Song 等研究发现BGN介导AVIC 成骨分化,以BMP-2 和转化生长因子-β1(TGF-β1)为分子介质,其中以TLR4依赖性方式上调TGF-β1,而TLR2 作用较小[53]。HMGB1 是一种调节性核蛋白,当分泌到细胞外时,其充当促炎细胞因子[54]。目前已在CAVD 患者体内和动物模型中发现了HMGB1,且其水平在CAVD 患者组织和血浆中增加[55],并且可以在从患病瓣膜中分离的内皮细胞和间质细胞的分泌颗粒中检测到[56]。Wang 等还证明重组HMGB1通过增加人AVIC 中的成骨标志物和钙沉积而具有促成骨活性[57]。此外,Shen 等的研究使TLR4及其通路NF-κB 和JNK 的作用在体外和体内得到验证,沉默或TLR4 缺陷可使HMGB1 促成骨活性显著降低[58]。Matrilin-2 是一种可在不同组织中表达的细胞外蛋白,在人主动脉瓣的钙化结节中积累[59]。Matrilin-2 通过AVIC 中的TLR2/4增强成骨活性,且需要NF-κB 转录因子家族及NFATc1 的调节[60]。
3.4 TLR7在钙化性主动脉瓣疾病中的作用
TLR7 属于细胞内Toll 样受体组,位于内溶酶体中[61]。到目前为止,已鉴定出的TLR7 配体是ssRNA 和咪唑喹啉衍生物。TLR7 是TLRs 中表达最低的TLR 之一[62]。Karadimou 等发现主动脉瓣组织中TLR7 与M2 巨噬细胞标志物mRNA 有相关性,TLR7 也与主动脉瓣中的M2 型巨噬细胞亚群共定位,用TLR7 配体刺激体外瓣膜组织导致免疫调节细胞因子IL-10 的分泌,但提取原代巨噬细胞和AVIC 后再用TLR7 配体分别刺激后发现仅有巨噬细胞的上清液中IL-10 的释放量增加,而AVIC 中未检测到反应,都表明主动脉瓣中M2 巨噬细胞亚群TLR7 的激活与减轻主动脉瓣炎症可能相关[63](图1)。
4 结语
综上,TLRs 与CAVD 的病程密切相关,其作用机制主要与通过MyD88 依赖信号通路以及TRIF 依赖性信号通路诱导炎症反应引起炎症因子、基质胶质纤维蛋白的增加、AVIC 成骨分化、单核细胞的促进协同等作用有关。然而研究使用PAMP 作为TLRs 激动剂时并未检测到主动脉瓣中是否有相应的病原体及其衍生物定植,未来可由此方面开展深入研究。牙周炎相关病原体是最早在主动脉瓣中被检测到的病原体之一[27],近些年越来越多的研究在心脏瓣膜样本中发现了不同种类的口腔细菌[64-66],但目前仅在家兔模型中验证过口腔细菌的接种可导致主动脉瓣钙化。Neculae等人在综述中假设了口腔生态失调与心脏瓣膜病的潜在联系,提及其可能涉及TLRs 相关通路[67],但仍需相关实验在组织、细胞、动物和类器官模型等层面上进行验证与探索。
另外,由于TLRs 分型较多,仍有部分TLRs的功能未被揭示,未来的研究也需继续聚焦于多种TLRs 功能的相互作用。随着研究的不断深入,对CAVD 发生发展的作用认识也将逐步完善,通过干预、调节TLRs 的表达有望成为CAVD 防治新手段之一。但靶向这一途径的主要挑战将是最大限度地减少有害的先天免疫反应,同时保留适当的先天免疫防御机制。

