环状RNA ciRS-7在结直肠癌中的表达变化及其与患者临床病理特征和预后关系研究
王忠瑜,季艳霞,赵艳争,张伟光,杨慧敏
(邯郸市中心医院,河北 邯郸 056008)
结直肠癌(Colorectal cancer,CRC)全球病死率和发病率分别位居恶性肿瘤的第二位和第三位[1-2]。我国CRC病死率和发病率在恶性肿瘤中均位居第五位,且发病率逐年上升[3-5]。近年来,CRC的诊治取得了很大进展,但CRC患者预后仍不理想。发达国家患者5年生存率约65%,欠发达国家5年生存率不足50%[6-8]。因此,寻找可以预测CRC患病风险、癌症进展及预后的生物标志物对于CRC早期诊断、病情进展监测及治疗方案调整具有非常重要的意义。环状RNA是一类普遍存在于哺乳动物中的具有稳定闭合环状结构的非编码RNA,通过调控靶基因转录、沉默微小RNA(microRNA,miR)或直接与蛋白结合等方式来广泛参与多种生理及病理活动[9-11]。环状RNA ciRS-7因靶向结合miR-7而得名,通过与miR-7竞争性结合上调miR-7靶基因,如血管表皮生长因子受体和G1/S特异性细胞周期蛋白E1,从而广泛参与多种癌症的病理活动。已证实ciRS-7在食管癌、非小细胞肺癌、胃癌等患者中高表达且与患者预后呈显著负相关[12-15]。然而,ciRS-7在CRC发生和发展中的作用鲜有研究报道。因此,本研究探讨ciRS-7在CRC患者中的表达变化及其与患者临床病理特征和预后的关系。
1 资料与方法
1.1 一般资料 本研究前瞻性纳入2019年1月至2020年12月接受手术治疗的CRC患者120例。病例纳入标准:经术后病理学检查确诊为原发性CRC;年龄≥18周岁;无远端转移;接受定期随访;患者及家属对本研究知情同意。排除标准:接受新辅助治疗;合并其他恶性肿瘤;孕妇或哺乳期妇女。入组患者中,男性66例,女性54例;平均年龄(66.04±11.87)岁;高分化18例,中分化84例,低分化18例;肿瘤直径5.02[3.96,5.53] cm;T1期6例,T2期17例,T3期95例,T4期2例;N0期71例,N1期32例,N2期17例;TNM Ⅰ期18例,Ⅱ期52例,Ⅲ期50例。本研究经本院医学伦理委员会批准。
1.2 研究方法
1.2.1 定量聚合酶链式反应(qPCR)检测组织ciRS-7表达:通过手术获取患者癌组织和癌旁组织,液氮急冻后于-80 ℃保存。取冻存的组织样本在研钵中加液氮充分研磨,加入TRIzol 试剂依据说明书提取总RNA。使用Nanodrop检测浓度和纯度,RNase R消化线性RNA。采用反转录试剂盒(批号:RR047A,中国大连宝生物工程有限公司)将RNA反转录为cDNA,反应条件为42 ℃ 60 min、98 ℃ 5 min。随后以反转录产物为模板,使用SYBR Premix Ex TaqⅡ试剂盒(批号:RR003A,中国大连宝生物工程有限公司)和ABI 7900荧光定量聚合酶链式反应仪进行实时荧光定量PCR,反应条件:95 ℃预变性10 min;94 ℃ 10 s,60 ℃ 30 s,72 ℃ 30 s,共循环40次。以GAPDH为内参,采用2-ΔΔCt法分析患者癌组织和癌旁组织中ciRS-7相对表达量。ciRS-7正向引物序列为5’-CTTGACACAGGTGCCATC-3’,反向引物序列为5’-ACGTCTC-CAGTGTGCTGA-3’。GAPDH正向引物序列为5’-TGACCACAGTCCATGCCATCAC-3’,反向引物序列为5’-GCCTGCTTCACCACCTTCTTGA-3’。
1.2.2 随访:所有患者随访至2022年11月30日,中位随访时间30.5个月。总体生存期(OS)定义为患者从开始手术治疗到最终病死的时间。
1.3 统计学方法 采用SPSS 22.0统计学软件分析数据。不符合正态分布的计量资料以M[P25,P75]表示,癌和癌旁组织ciRS-7相对表达量比较采用Wilcoxon符号秩检验;ciRS-7与患者临床病理特征的关系采用Mann-WhitneyU或Kruskal-WallisH秩和检验;绘制Kaplan-Meier曲线并采用Log-Rank检验分析ciRS-7高低表达水平与患者OS的关系;采用Cox回归分析CRC患者OS的影响因素;P<0.05表示差异有统计学意义。
2 结 果
2.1 癌组织与癌旁组织ciRS-7表达水平比较 癌组织中ciRS-7表达水平为2.80[1.78,4.27],癌旁组织中为0.88[0.27,1.52]。癌组织中ciRS-7表达水平高于癌旁组织(Z=-5.073,P<0.001)。
2.2 ciRS-7表达水平与患者不同临床病理特征的关系 见表1。ciRS-7表达水平与肿瘤直径、T分期、N分期、TNM分期有关(均P<0.001)。

表1 ciRS-7表达水平与患者不同临床病理特征比较
2.3 ciRS-7不同表达水平与患者OS的关系 见图1。ciRS-7低表达患者中位OS为41.0个月(95%CI:39.0~43.0个月),ciRS-7高表达患者中位OS为37.0个月(95%CI:33.8~40.2个月)。Kaplan-Meier曲线和Log-Rank检验结果显示,ciRS-7表达水平与患者OS呈负相关(P=0.001)。
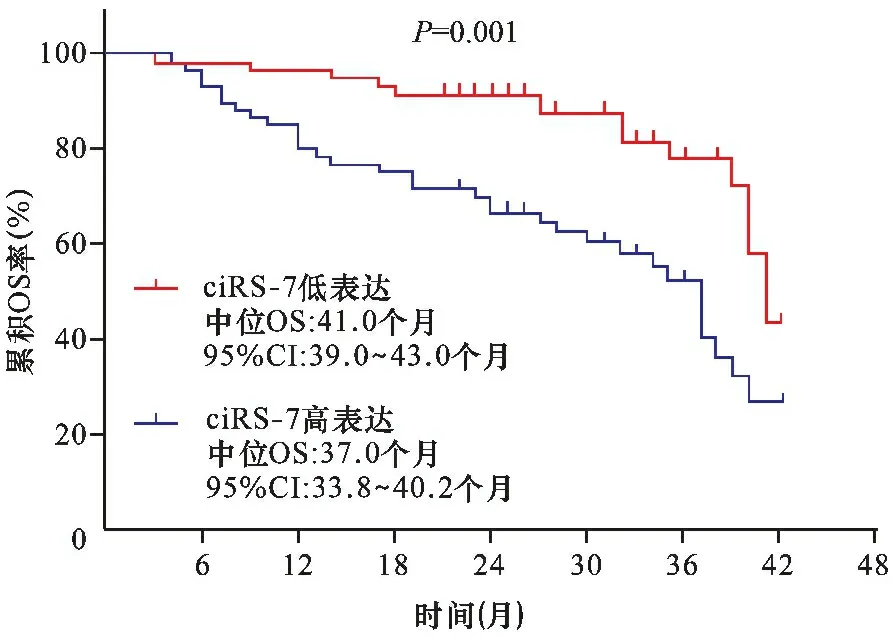
图1 ciRS-7相对表达量与患者OS的关系
2.4 影响患者OS的单因素Cox回归分析 见表2。以患者OS为因变量(OS>41.0个月=0,OS≤41.0个月=1),以ciRS-7表达(高表达=1,低表达=0)、年龄(≥60岁=1,<60岁=0)、性别(男性=1,女性=0)、病理分化等级(低/中分化=1,高分化=0)、肿瘤直径(≥5 cm=1,<5 cm=0)、T分期(T3、T4期=1,T1、T2期=0)、N分期(N1、N2期=1,N0期=0)、TNM分期(Ⅲ期=1,Ⅰ-Ⅱ期=0)为自变量行单因素Cox回归分析。结果显示,ciRS-7表达水平、病理分化等级、肿瘤直径、T分期、N分期、TNM分期与患者OS有关。
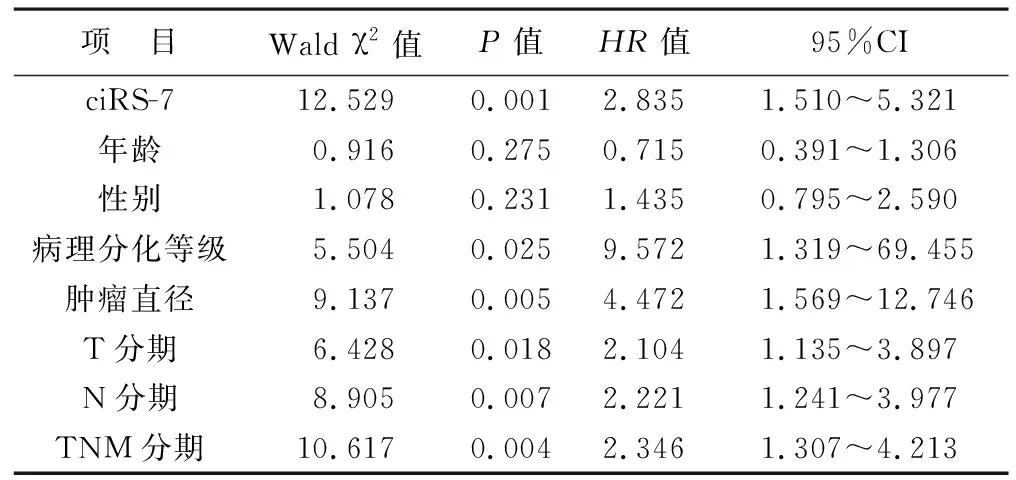
表2 影响患者OS的单因素Cox回归分析
2.5 影响患者OS的多因素Cox回归分析 见表3。以单因素分析中具有统计学意义的指标作为自变量(赋值相同),以患者OS为因变量,进行多因素Cox回归分析。结果显示,ciRS-7高表达、病理低/中分化、T3和T4分期是患者OS的独立危险因素(均P<0.05)。
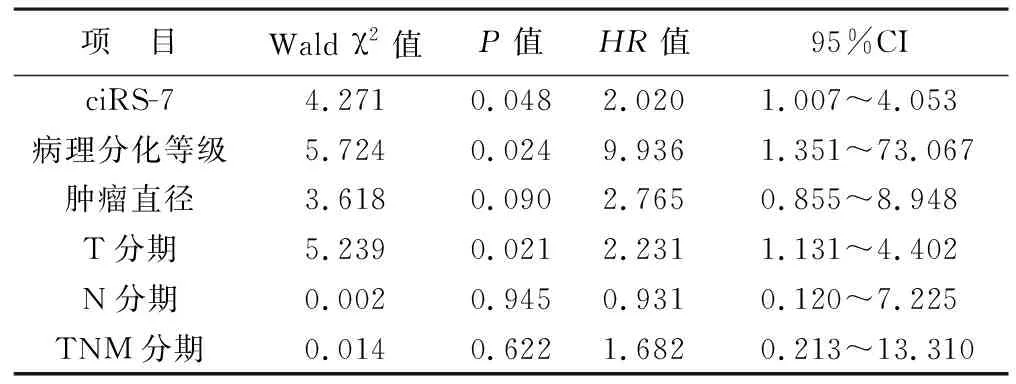
表3 影响患者OS的多因素Cox回归分析
3 讨 论
ciRS-7在多种癌症中高表达并通过各种机制参与癌症病理过程,加重癌症进展[16-20]。有研究[21]发现,ciRS-7在年龄小于40岁,甲胎蛋白水平高于400 ng/μl或出现微血管侵犯的肝细胞癌患者中的表达水平显著升高,可以作为出现微血管侵犯的独立预测因素,表明ciRS-7表达水平与肝细胞癌疾病进展显著正相关;同时,在出现微血管侵犯的肝细胞癌组织中,ciRS-7表达水平与miR-7表达水平显著负相关而与miR-7靶基因PIK3CD和p70S6K表达水平显著正相关。ciRS-7也被发现在非小细胞肺癌患者癌组织中显著高表达且与患者TNM分期和淋巴结转移数成正比,表明ciRS-7与肺癌疾病进展正相关[13]。在另一个研究[12]中,ciRS-7在食管癌组织中的表达水平显著高于癌旁组织,细胞实验表明ciRS-7可以促进食管癌细胞(KYSE150细胞系和Eca9706细胞系)的转移和侵袭,而加入核因子(NF)-κB拮抗剂BAY 11-7082可以抑制ciRS-7介导的食管癌细胞侵袭。此外,ciRS-7在乳腺癌细胞(MDA-MB-453细胞系)中表达显著上调,而下调ciRS-7表达则抑制乳腺癌细胞迁移和侵袭。进一步研究[22]表明乳腺癌组织中ciRS-7表达水平和miR-1299表达水平显著负相关,且上调miR-1299表达可以抑制乳腺癌细胞的迁移和侵袭。以上研究表明ciRS-7可能通过抑制miR-7功能、NF-κB通路或miR-1299功能来参与多种癌症病理活动并和癌症进展正相关,然而ciRS-7与CRC的关系鲜有报道。
本研究发现,ciRS-7表达水平在CRC患者癌组织中显著升高并与患者肿瘤直径,T分期,N分期和TNM分期有关,提示ciRS-7表达水平与CRC患者癌症进展有关。分析可能原因,文献报道miR-7可以通过调控表皮生长因子受体信号通路和NF-κB信号通路等来诱导包括CRC细胞在内的多种癌细胞凋亡。而ciRS-7作为miR-7的内源竞争RNA(ceRNA)能够阻断miR-7的抑癌功能从而促进多种癌细胞的增殖、转移和侵袭。因此ciRS-7可能通过抑制miR-7促进CRC细胞的增殖、转移和侵袭,促进癌症的发生和发展。miR-1299能够通过信号转导与转录活化因子通路抑制CRC细胞的增殖,ciRS-7可能通过抑制CRC细胞中miR-1299的正常功能从而促进CRC细胞的增殖进而加重CRC癌症进展[23]。ciRS-7还有可能通过其他机制如和下游mRNA的3’非翻译区结合或直接和RNA结合蛋白相互作用从而参与CRC病理过程,然而这一假设需进一步深入研究[24]。
本研究发现,ciRS-7表达水平与CRC患者OS显著负相关,ciRS-7高表达是患者OS的独立危险因素。这与之前已报道的ciRS-7表达水平与其他癌症患者OS相关的结果一致。在非小细胞肺癌患者中,ciRS-7表达水平与患者OS显著负相关,且其可作为患者不良预后的独立预测因素[12]。在胃癌患者中,ciRS-7高表达者其OS显著低于ciRS-7低表达者,且ciRS-7高表达是胃癌患者不良预后的独立预测因素[14]。在肝细胞癌患者中,ciRS-7表达水平与患者无病生存期(DFS)负相关[20]。在食管癌患者中,ciRS-7高表达患者其DFS和OS均显著低于ciRS-7低表达患者[25]。ciRS-7表达水平和CRC患者OS显著负相关并可以作为患者更短OS的独立预测因素,可能与ciRS-7作为抗癌基因(如miR-7、miR-1299)的ceRNA来抑制其介导的抑癌作用,从而促进CRC细胞增殖、转移和侵袭。因此,上调ciRS-7表达水平将促进癌症进展,缩短患者OS。
综上所述,ciRS-7在CRC患者中高表达,与癌症进展和不良预后有关,ciRS-7高表达是患者OS的独立危险因素。本研究仍存在不足:样本量较少有可能降低统计效能;只探讨了ciRS-7与CRC患者癌症进展与预后的关系,而ciRS-7影响CRC患者癌症进展与预后的分子生物学机制还有待进一步研究。

