中性粒细胞/淋巴细胞比值和预后营养指数在帕金森病患者伴发抑郁中的预测价值
陈宇鲜,许富贵,乙红艳,梁晓静,杨 秀,魏 明,佟 强*
1南京医科大学附属淮安第一医院神经内科,江苏 淮安 223300;2淮安市第五人民医院神经内科,江苏 淮安 223300
帕金森病(Parkinson’s disease,PD)是一种常见的神经系统退行性疾病,临床表现可分为运动症状和非运动症状;其特征性的运动症状为静止性震颤、运动迟缓和肌肉强直。在PD的非运动症状中,抑郁最为常见,甚至出现在PD患者运动症状之前,严重影响患者的生活质量[1-2]。因此,对于PD 患者临床症状的综合评估和干预,除了关注其运动症状外,还需要重视并积极干预其非运动症状,以达到提高治疗效果和改善患者生活质量的目的。
中性粒细胞/淋巴细胞比值(neutrophil-to-lymphocyte ratio,NLR)反映了机体的炎症状态和免疫功能。作为一种全身炎症标志物,因其廉价和易获取,目前被广泛应用于恶性肿瘤、外科手术预后以及心脑血管疾病的评估和预测[3-9]。有研究证明,PD 患者外周血NLR 水平较健康人群显著升高。预后营养指数(prognostic nutritional index,PNI)是由5倍淋巴细胞计数和血清白蛋白之和构成[10],反映患者的营养水平和免疫状况。目前营养不良已经被证实与多种疾病不良预后有关,如缺血性卒中[11]、恶性肿瘤[12]和心力衰竭[13]。Budrewicz 等[14]研究发现,PD患者的病情严重程度(尤其是运动症状)与反映患者营养状况的参数相关。
研究表明,抑郁与患者的炎症水平和营养状况存在关联[15-16]。Gong等[17]发现NLR升高与脑出血3个月后的抑郁症状相关,提示NLR可能是预测脑出血后抑郁的重要生物标志物。一项基于NHANES数据的横断面分析指出,在调整潜在混杂因素后,NLR与抑郁症状呈非线性相关,可能需要前瞻性研究来进一步揭示其非线性关系[18]。一项临床对照研究发现,精神分裂症患者血清白蛋白水平显著低于健康对照组,血清白蛋白水平与抑郁评分显著相关,提示血清白蛋白水平降低可能是导致精神分裂症的原因之一[19]。目前NLR 和PNI 与PD 伴发抑郁之间的关系尚不明确,因此,本文旨在探讨NLR 和PNI 与PD 患者伴发抑郁的关系,分析二者对PD 患者伴发抑郁的预测价值,进一步构建并验证PD 患者伴发抑郁风险的列线图预测模型,以期为临床提供更为准确有效的预测手段和治疗策略。
1 对象和方法
1.1 对象
选择2021年1月—2023年6月期间南京医科大学附属淮安第一医院医院诊治的182例PD患者为PD组,根据汉密尔顿抑郁量表24项(hamilton depression rating scale-24,HAMD-24)评分将PD 患者分为PD不伴抑郁组(n=101)和PD伴抑郁组(n=81)。并选取175例同时期健康体检人群为健康对照组。PD组纳入标准:符合《中国帕金森病的诊断标准2016版》。PD 组排除标准:①继发性帕金森综合症或帕金森叠加综合征者;②患有严重精神疾病(除外抑郁症);③合并严重的心脏、肝脏、肾脏以及血液系统疾病者;④合并急、慢性感染史、恶性肿瘤史以及近期接受过抗生素、激素、免疫抑制和输血治疗者;⑤不能排除其他疾病导致的抑郁症状;⑥患有严重认知障碍不能配合量表评估;⑦临床资料不完整。健康对照组排除标准:①合并严重的心脏、肝脏、肾脏以及血液系统疾病者;②合并急、慢性感染史、恶性肿瘤史以及最近接受过抗生素、激素、免疫抑制和输血治疗者;③临床资料不完整。本研究经南京医科大学附属淮安第一医院医学伦理委员会批准(KY-2022-085-01),患者或近亲属对研究方案同意并签署知情同意书。
1.2 方法
1.2.1 左旋多巴等效剂量(levodopa equivalent dose,LED)的计算
PD 患者需收集病程和药物使用情况,包括性别、年龄、慢性病史以及吸烟饮酒史。根据抗帕金森病药物剂量和种类进行LED的计算[20]。
1.2.2 NLR和PNI的计算
收集所有对象的清晨空腹静脉血样本,并使用全自动血细胞分析仪(SYSMEX XN9000)来测定全血细胞计数。同时使用全自动生化仪(奥林巴斯AU400,日本)来测定血清中的白蛋白水平,根据测定结果计算出NLR和PNI。
1.2.3 量表评估
Hoehn-Yahr分期(H-Y):用于评估PD患者的病情严重程度,共分为1~5期,分期越高则提示病情越重。统一帕金森病评定量表第3 部分(part Ⅲof the unified Parkinson’s disease rating scale,UPDRS-Ⅲ):用于PD患者的运动症状评估,包括14个条目,分数越高则提示运动症状越重。HAMD-24:用于评估PD患者有无抑郁和抑郁严重程度,该量表共包含了24 个项目,每个条目为0~2 分或0~4 分,其中评分<8 分判定为无抑郁,评分≥8分判定为抑郁[21],由两名神经科医师独立完成测评。
1.3 统计学方法
采用SPSS 23.0 软件进行数据分析。符合正态分布及方差齐性的计量资料以均数±标准差(±s)表示,组间比较采用两独立样本t检验;不符合的计量资料采用中位数(四分位数)[M(P25,P75)]表示,组间比较采用Mann-Whitney 检验。计数资料采用率(%)表示,组间比较采用χ2检验。采用多因素Logistic 回归分析探究PD 患者伴发抑郁的影响因素。基于回归分析结果,采用R 软件4.2.2(rms 程序包)构建个体化预测PD 患者伴发抑郁风险的列线图模型,绘制受试者工作特征曲线(reciever operating characteristic,ROC)并根据曲线下面积(area under curve,AUC)评估模型的区分度,并使用Bootstrap1000 自抽样内部验证,绘制校准曲线以评估模型的临床一致性,绘制决策曲线以评估模型的临床适用性。P<0.05为差异有统计学意义。
2 结果
2.1 健康对照组和PD组间临床资料比较
健康对照组和PD 组间的中性粒细胞计数、淋巴细胞计数、血清白蛋白、PNI和NLR差异有统计学意义(P<0.05)。两组间的性别、年龄、慢性病史、吸烟饮酒史、白细胞计数、血小板计数和单核细胞计数差异无统计学意义(P>0.05,表1)。

表1 健康对照组和PD组间临床资料比较Table 1 Comparison of clinical data between healthy control group and PD group
2.2 PD伴与不伴抑郁组间临床资料比较
PD伴与不伴抑郁两组间的年龄、中性粒细胞计数、淋巴细胞计数、血清白蛋白、PNI、NLR、LED、H-Y 分期、病程和UPDRS-Ⅲ差异有统计学意义(P<0.05)。两组间的性别、慢性病史、吸烟饮酒史、白细胞计数、血小板计数和单核细胞计数差异无统计学意义(P>0.05,表2)。
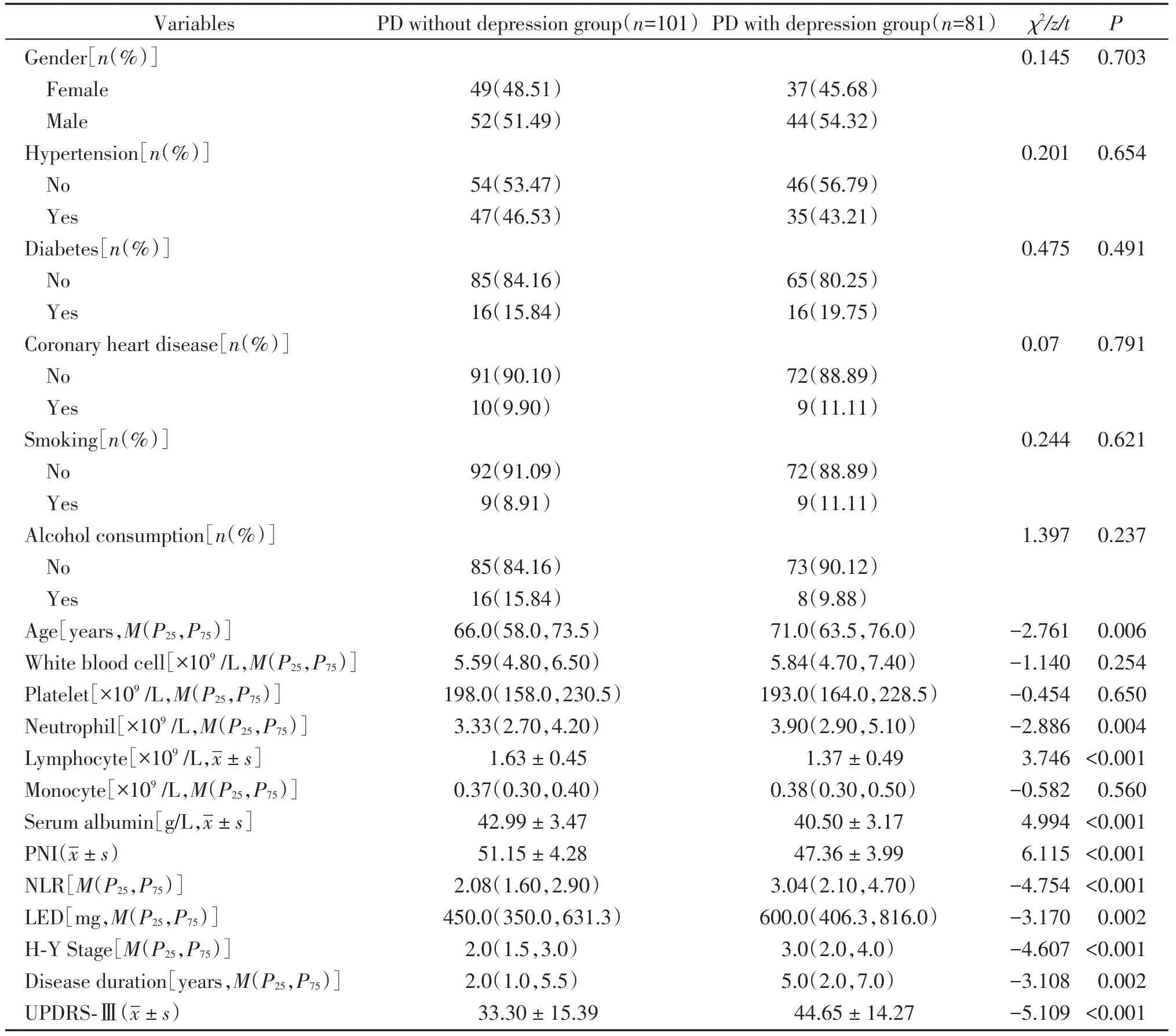
表2 PD伴与不伴抑郁组间临床资料比较Table 2 Comparison of clinical data between PD with and without depression
2.3 PD伴发抑郁的多因素Logistic回归分析
以表2 中P<0.05 的变量(年龄、中性粒细胞计数、淋巴细胞计数、血清白蛋白、PNI、NLR、LED、H-Y分期、病程和UPDRS-Ⅲ)作为自变量。以PD患者伴与不伴抑郁(是=1,否=0)作为因变量,进行多因素Logistic 回归分析,采用逐步法(stepwise)筛选变量,最终纳入PNI、NLR、LED 和UPDRS-Ⅲ这4 个变量,结果显示PNI 降低、NLR 升高、LED 增加和UPDRS-Ⅲ升高是PD患者伴发抑郁的独立危险因素(P<0.05,表3)。
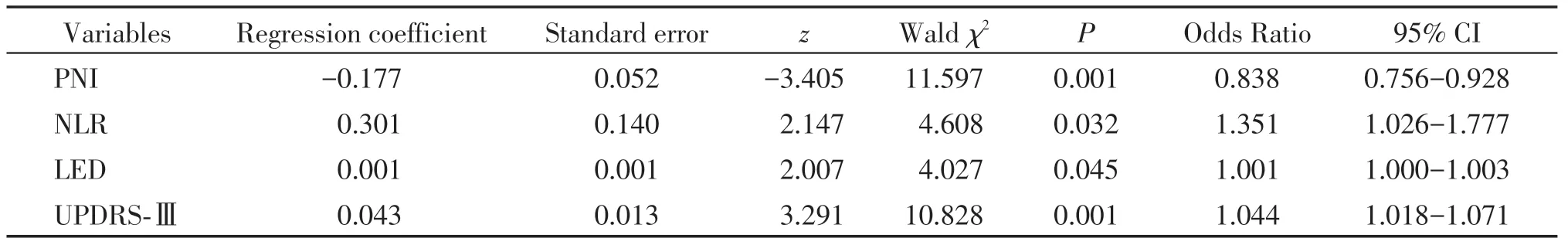
表3 PD患者伴发抑郁的多因素Logistic回归分析Table 3 Multivariate logistic regression analysis of PD patients with depression
2.4 PD伴发抑郁风险列线图预测模型的构建
基于多因素Logistic回归分析结果,应用R软件(rms 程序包)构建个体化预测PD 患者伴发抑郁风险的列线图模型(图1)。

图1 PD患者伴发抑郁风险的列线图预测模型Figure 1 The nomogram prediction model of PD patients with depression risk
2.5 PD伴发抑郁风险列线图预测模型的验证
该列线图模型预测PD 患者伴发抑郁风险的ROC 曲线示AUC 为0.835(95%CI:0.776~0.893,P<0.01),灵敏度为0.704,特异度为0.832,提示该列线图模型具有较好的区分度和诊断效能(图2)。Hosmer-Lemeshow拟合优度检验结果示χ2=11.576(P=0.171),提示该列线图模型校准度较好。通过使用Bootstrap1000自抽样内部验证,绘制该列线图模型的校准曲线,可见校准曲线(bias-corrected)接近理想曲线(ideal),斜率接近1,提示该列线图模型具有较好的临床一致性(图3)。由图4 列线图模型决策曲线可知,该列线图模型具有较高的获益性和较好的临床适用性。

图2 列线图模型预测PD患者伴发抑郁风险的ROC曲线Figure 2 ROC curve of the nomogram model for predicting the risk of comorbid depression in PD patients
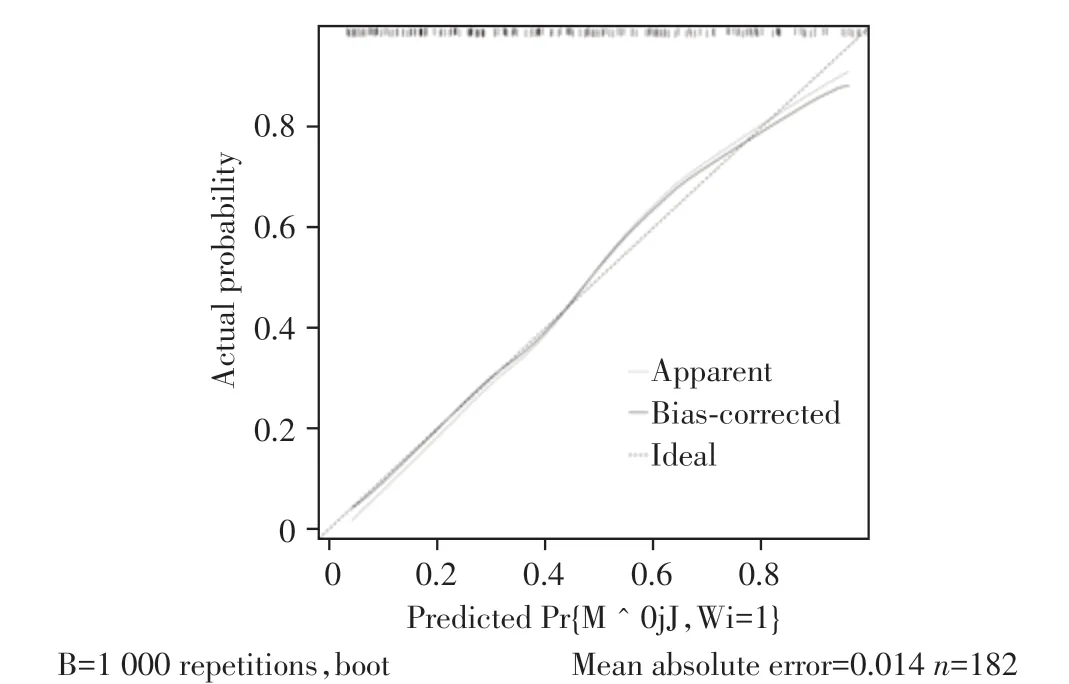
图3 列线图模型预测PD患者伴发抑郁风险的校准曲线Figure 3 Calibration curves for the nomogram model to predict the risk of comorbid depression in PD patients
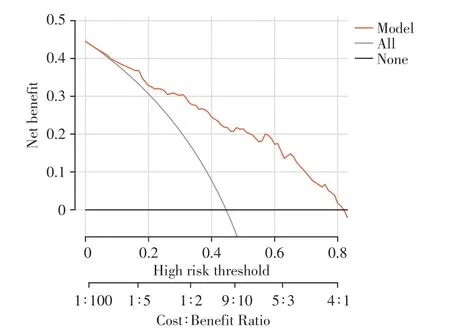
图4 列线图模型预测PD患者伴发抑郁风险的决策曲线Figure 4 Decision curves for the nomogram model to predict the risk of comorbid depression in PD patients
3 讨论
PD是老年人第二常见的神经退行性疾病,其特征性病理表现为黑质致密部多巴胺能神经元进行性缺失以及路易小体的形成[22]。虽然PD的发病机制目前尚未完全阐明,但大量的基础及临床证据均显示神经炎症在PD的发生、进展中发挥了至关重要的作用。慢性神经炎症可导致血脑屏障的改变,这有利于外周免疫系统的趋化因子和细胞浸润中枢神经系统(central nervous system,CNS)[23]。CNS的炎症激活以及外周免疫细胞释放的炎性因子被认为是促进和加快神经退行性变的关键因素[24-26]。
本研究显示PD 患者的中性粒细胞计数及NLR均显著高于健康对照组,而淋巴细胞计数显著低于健康对照组,这与Stanca 等[23]研究结果一致。这一结果将有助于更好地理解PD 的发病机制。血清白蛋白作为人体中一种重要的抗氧化剂,发挥着神经保护作用,具体机制尚不明确。Zhou等[27]的一项前瞻性研究显示,低血清白蛋白水平与缺血性脑卒中患者较高的死亡率和不良的功能预后密切相关;但是,目前PD 和血清白蛋白之间的关系鲜有研究报道。本研究显示,PD患者的血清白蛋白水平显著低于健康人群,这与Wang等[28]的研究结果一致。此外,本研究还观察到PD患者的PNI明显低于健康人群。
PD 的运动特征主要表现为运动迟缓、肌肉强直、静止震颤和姿势不稳,随时间进展累及双侧。相比运动症状,非运动症状的出现对PD 患者的疾病进展以及生活质量方面具有重要的影响。抑郁作为PD常见的非运动症状,其发病率从3%~90%不等,其中42%PD患者有明显的临床抑郁症状,与本研究中44%发病率大致相符[29]。PD 的抑郁症状可能在疾病的早期阶段就出现,甚至在患者出现运动症状之前。因其致残率较高且预后不佳,所以及时识别和管理至关重要。
本研究通过多因素Logistic 回归分析筛选出PNI、NLR、LED 和UPDRS-Ⅲ评分是PD 患者伴发抑郁的独立影响因素。血清白蛋白是人血浆中最丰富的蛋白质,具有各种基本功能,包括作为各种类固醇、激素和脂肪酸的重要载体蛋白、药物结合、抗氧化活性、炎症反应和免疫调节,在临床上也可用于评估营养状况[30]。近期一项关于血清白蛋白和抑郁关系的横断面研究指出,较高的血清白蛋白浓度与较低的抑郁症状风险相关,即高白蛋白浓度可能是抑郁症状的保护因素[31]。本研究发现伴抑郁的PD患者血清白蛋白水平明显低于不伴抑郁的PD患者。关于PD患者血清白蛋白水平低可能是由于PD 患者运动并发症或者严重的运动症状使得静息状态下能量代谢增加以及摄入不足或吸收障碍,造成PD患者营养状况变差[32]。目前血清白蛋白和抑郁症之间的机制尚不明确。Liu 等[33]一项关于抑郁症的Meta分析指出,血清白蛋白减少可能导致氧化应激失调,而在抑郁症患者中可检测到更高的血清自由基和氧化损伤产物水平。炎症与抑郁症之间的密切关系已经被众多研究证实,即抑郁与机体免疫失调和炎症反应系统激活有关[15]。中性粒细胞作为白细胞的一种,是人体免疫系统的重要组成部分,有研究指出中性粒细胞的活化可通过释放活性氧引起氧化应激,这可能是导致抑郁的发病机制[34-35]。淋巴细胞是白细胞的另一个重要组成部分,主要介导适应性免疫反应,与生理应激有关[35]。一项纳入41 例未接受药物治疗的重度抑郁症患者和47 例健康对照人群的研究发现,与健康对照人群相比,重度抑郁症患者的中心粒细胞计数、白细胞计数明显升高和淋巴细胞百分比明显下降[36]。PNI在临床上常用于评估患者营养情况和免疫炎症状态,本研究发现伴抑郁的PD 患者PNI 显著低于不伴抑郁的PD 患者,并且PNI 升高是PD 患者伴发抑郁的独立保护因素。NLR 由中性粒细胞和淋巴细胞构成,代表着两种不同的免疫途径,是一种新的全身炎症反应的生物标志物。一项纳入256例抑郁症患者的回顾性研究发现,重度和极重度抑郁症患者NLR 水平明显高于轻度和中度抑郁症患者,并且NLR 是重度或极重度抑郁症的独立预测因子[37]。本研究发现伴抑郁的PD患者NLR明显高于不伴抑郁的PD患者,并且NLR升高是PD患者伴发抑郁的独立危险因素。UPDRS-Ⅲ是用于评估PD 患者运动症状的临床工具。Dissanayaka 等[38]一项纳入639 例PD 患者临床研究指出,PD 严重程度(H-Y 分期、UPDRS-Ⅲ评分)的增加和抑郁症风险相关。但小娟等[39]一项纳入1 138 例老年PD 患者的回顾性研究显示,PD伴抑郁的UPDRS-Ⅲ评分明显高于PD不伴抑郁。本研究发现伴抑郁的PD患者UPDRS-Ⅲ评分明显高于不伴抑郁PD 患者,并且UPDRS-Ⅲ评分升高是PD 患者伴发抑郁的独立危险因素,与上述研究结果基本一致。一项纳入59例PD受试者的静息状态功能性磁共振成像(functional magnetic resonanle imaging,fMRI)研究发现,运动症状与抑郁症状的交互作用与黑质、海马、眶下额皮质、颞顶叶交界处0.10~0.25 Hz 的能量呈负相关,而与同一区域0.02~0.05 Hz的能量呈正相关[40],提示PD患者运动症状和抑郁症状可能存在共同的神经通路,还需要更多的基础和临床研究去探索二者之间的关联。需要注意的是,关于病程、H-Y 分期与PD 伴发抑郁之间的相关性仍然存在一定争议。虽有研究发现PD 伴发抑郁的患者病程更长、H-Y 分期更高,且为独立危险因素,但本项研究发现,与不伴抑郁PD患者相比,伴抑郁的PD患者H-Y分期更高、病程更长,并未发现二者是PD 伴发抑郁的独立危险因素,与但小娟[39]和金莹[41]等研究结论一致。以上结论提示并非单纯病情更重、病程更长的PD 患者易发生抑郁,即PD 患者伴发抑郁可能是多种因素共同作用的结果,因此我们需要更多的研究来进一步了解PD 伴发抑郁与病程、H-Y 分期之间的关系。LED 是用来评估PD 患者当前用药情况并根据病情调整剂量以达到最佳治疗效果。目前关于PD 患者左旋多巴剂量和抑郁症状之间的关系研究尚少。Hanganu等[42]研究发现,伴抑郁的PD患者使用左旋多巴剂量明显高于不伴抑郁的PD 患者,且左旋多巴剂量和抑郁症状的严重程度之间呈显著正相关。本研究发现,伴抑郁的PD 患者使用左旋多巴剂量明显高于不伴抑郁的PD 患者,而且左旋多巴剂量增加是PD 患者伴发抑郁的独立危险因素,与上述研究结果一致。
本研究基于多因素Logistic 回归分析结果构建个体化预测PD 患者伴发抑郁风险的列线图模型。列线图模型具有直观、简洁、多维度展示以及可视化等诸多优点,在临床上获得广泛应用,帮助临床医生制定诊疗决策。该列线图模型预测PD 患者伴发抑郁风险的ROC 曲线AUC 为0.835(95%CI:0.776~0.893,P<0.01),灵敏度为0.704,特异度为0.832,提示该列线图模型具有较好的区分度和诊断效能。Hosmer-Lemeshow 拟合优度检验结果示χ2=11.576(P=0.171),提示该列线图模型校准度较好。通过使用Bootstrap1000 自抽样内部验证,绘制列线图模型校准曲线,可见校准曲线接近理想曲线,提示该列线图模型具有较好的临床一致性。根据决策曲线可知,该列线图模型具有较高的获益性和较好的临床适用性。因此该列线图模型具有临床应用前景,可以较为准确地帮助医护人员预测PD 患者伴发抑郁的风险,从而为进一步的干预治疗提供支持。
综上所述,基于PNI、NLR、LED 和UPDRS-Ⅲ评分构建的个体化列线图模型可有效预测PD 患者伴发抑郁的风险,具有一定的临床应用价值。本研究存在一定的局限性,首先,纳入的临床样本量偏少,且为单中心研究。其次,这一列线图模型未能得到外部验证,仅仅进行内部验证后续还需进一步扩大样本量和多中心验证研究,以进一步验证本研究结论。

