三孢布拉霉CrgA 泛素连接酶功能的初步探究
杨佳敏, 杨培龙, 曲音波, 余晓斌, 罗 玮*
(1. 江南大学生物工程学院,江苏 无锡 21422;2. 农业农村部饲料生物技术重点实验室,北京 10008;3. 中国农业科学院饲料研究所,北京 10008;4. 山东大学微生物技术国家重点实验室,山东 青岛 266237)
类胡萝卜素作为一种天然色素, 在抗衰老、抗肿瘤、增强免疫功能等方面均能发挥重要功效。 利用微生物发酵生产β-类胡萝卜素是较为经济、安全的生产方法,而三孢布拉霉(Blakeslea trispora)具有生物量大、产量高、生长迅速、不受环境影响等诸多优势,是工业上大规模生产β-类胡萝卜的理想菌株[1]。
CrgA 起初是在卷枝毛霉中发现的,是一种在类胡萝卜素生物合成的光诱导途径中发挥重要作用的负调节因子[2]。 在藤仓镰孢(Fusarium fujikuroi)[3]、尖孢镰刀菌(Fusarium oxysporum)[4]、三孢布拉霉[5]和布拉克须霉(Phycomyces blakesleeanus)[6]中也都鉴定到了同源基因。在卷枝毛霉中crgA基因的表达是由光脉冲活化的,且其进程均与类胡萝卜素合成的结构基因相似。在卷枝毛霉中敲除crgA基因会导致在黑暗中类胡萝卜素的大量积累,参与类胡萝卜素合成的结构基因carB基因和carRP基因在黑暗和光照条件下均被活化表达[7],表明CrgA 可能作为一种与carB和carRP基因合成有关的负调控因子参与类胡萝卜素的合成。 McCrgA 和BtCrgA 都含有2个环指结构域和不完整的LON 结构域,见图1。 环指结构域的存在显示其具有泛素连接酶活性。 Silva等的研究显示,McCrgA 参与MCWC-1b 的非降解型的单泛素化和双泛素化修饰,导致MCWC-1b 失活但并不降解, 在黑暗中CrgA 则通过单泛素化和双泛素化MCWC-1b 使其失活[8],影响了调控因子进而抑制类胡萝卜素的合成。

图1 McCrgA 及BtCrgA 结构示意图Fig. 1 Strudure representation of McCrgA and BtCrgA
三孢布拉霉crgA基因导入卷枝毛霉的crgA缺陷型菌株后产生了相同的光诱导和光适应现象,表明CrgA 参与的调节机制在这些真菌之间基本保守, 三孢布拉霉中CrgA 的调节机制可能与卷枝毛霉相似[5]。 巩尊洋等构建了三孢布拉霉的crgA缺陷型突变株并对其进行研究,发现缺陷型菌株中参与类胡萝卜素合成的3 种结构基因转录显著增强,生产的类胡萝卜素水平相较于野生型提高了31.2%[9],因此三孢布拉霉CrgA 同样也是作为一种负调控因子调节类胡萝卜素的相关合成,且在功能上可能与卷枝毛霉CrgA 相似, 其对类胡萝卜素合成的调控可能也是通过对WC-1b 蛋白的泛素化的调控进而影响类胡萝卜素的合成。
由于目前三孢布拉霉遗传转化操作困难,三孢布拉霉类胡萝卜素合成机制的解析也较为困难,在已知BtCrgA 作为类胡萝卜素合成的负调控因子的情况下, 作者尝试通过异源表达及体外检测对BtCrgA 参与的机制进行初步分析,期望通过基因挖掘和生物信息学分析三孢布拉霉泛素化相关酶的基本性质,并获得体外泛素化反应候选酶,通过异源表达、 亲和纯化及体外泛素化来构建BtCrgA 的体外泛素化反应体系, 以寻找能协助BtCrgA 实现泛素连接酶功能的相关酶, 确定BtCrgA 的泛素连接酶功能并探究其是否能实现对BtWC-1b 的泛素化,进而从体外实现对CrgA 部分功能的探究,为解析CrgA 在三孢布拉霉菌体内的功能及对类胡萝卜素合成中的负调节作用奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒三孢布拉霉(Blakeslea trispora)NRRL 2896 (- )、Escherichia coliBL21(DE3): 作者所在实验室保藏菌株, 表达载体为pET-28a。
1.1.2 试剂 真菌总RNA 抽提纯化试剂盒、 硫酸卡那霉素: 生工生物 (上海) 有限公司;HiFiScript gDNA Removal RT MasterMix、SDS-PAGE 凝胶制备试剂盒: 康为世纪生物科技有限公司; 质粒提取、DNA 产物纯化试剂盒:天根生化科技(北京)有限公司;泛素兔单克隆抗体:武汉爱博泰克生物科技有限公司;0.2 μmPVDF 膜、Myc 抗体(小鼠单抗)、Flag抗体(小鼠单抗)、辣根过氧化物酶标记山羊抗小鼠IgG、辣根过氧化物酶标记山羊抗兔IgG:上海碧云天生物技术有限公司;DNA marker、BamH I 限制性内切酶、Sac I 限制性内切酶:Takara 公司;蛋白质预染marker、2×Phanta Max Master Mix、ClonExpress®II One Step Cloning Kit、高敏型ECL 化学发光检测试剂盒:诺唯赞生物科技股份有限公司;其他试剂:国药集团药业股份有限公司;引物合成、基因合成及测序均由苏州金唯智公司完成。
1.2 方法
1.2.1 泛素化相关因子基因挖掘 利用真菌总RNA 提取试剂盒提取三孢布拉霉NRRL 2896(-)总RNA。 利用HiFiScript gDNA Removal RT MasterMix反转录获得cDNA。
根据卷枝毛霉E1(EPB87762)氨基酸序列,从三孢布拉霉NRRL2456 全基因组数据库(https://mycocosm.,jgi.doe.gov/pages/blast-query.jsf?db=Blatri1)中的Blast 功能得到同源蛋白质的基因位置信息,根据氨基酸序列与碱基序列对应关系初步拼接基因序列并设计引物,以三孢布拉霉cDNA 为模板进行PCR 扩增,通过测序获得完整序列信息。
从UbiProt 数据库(http://ubiprot.org.ru/)中下载酿酒酵母的所有UBC 蛋白质序列,利用TBTools 软件以酿酒酵母所有UBC 蛋白质氨基酸序列与三孢布拉霉的全氨基酸序列进行比对, 得到候选E2 酶家族成员。 根据候选E2 酶的氨基酸序列与全基因组序列数据库进行比对获得基因位置信息,根据氨基酸序列与碱基序列对应关系初步拼接基因序列并设计引物。 以cDNA 为模板进行PCR 扩增,通过测序获得完整序列信息。
1.2.2 三孢布拉霉泛素化相关因子生物信息学分析 利用ProtParam 预测BtE1 的基本性质。 根据基因组位置信息对所有BtUBC 蛋白质进行重新命名,并利用ProtParam 预测各UBC 蛋白质基本性质。 在Euk-mPLoc 网站预测各蛋白质的亚细胞定位。 利用TBtools 的Batch SMART 功能从SMART 数据库批量获取各UBC 蛋白质的保守结构, 分析结果并作图。 利用MEGA7 软件对酵母UBC 蛋白质和三孢布拉霉UBC 蛋白质构建系统进化树。
1.2.3 重组载体构建、 异源表达及纯化 以cDNA为模板, 克隆BtE1、BtCrgA、BtWC-1b 以及BtUBC基因,利用ClonExpress® II One Step Cloning Kit 将目的基因片段克隆到pET-28a 载体的BamH I/Sac I位点, 其中BtCrgA 与Myc 标签融合,BtWC-1b 与Flag 标签融合, 通过热击将重组载体导入E.coli BL21(DE3)。
将含有各重组载体的E.coli 在50 mL LB 液体培养过夜,接种于TB 液体培养基中培养至OD600为0.6~0.8, 加入0.3 mmol/L 的异丙基-D-硫代半乳糖苷(IPTG),在16 ℃、125 r/min 诱导表达20 h。 诱导后菌液经离心弃去上清液、PBS 缓冲液洗涤重悬后,超声破碎细胞, 于4 ℃、8000 r/min 离心10 min 后取上清液,经0.45 μm 滤膜抽滤后,使用Ni-NTA 进行蛋白质纯化, 纯化得到的蛋白质经SDS-PAGE验证。
1.2.4 CrgA 泛素连接酶功能分析 参考Honda等[10]的反应体系进行CrgA 参与的泛素连接酶功能探究,30 μL 的体外泛素化反应体系中包含了1.5 μL 20×反应缓冲液(1 mol/L Tris-HCl、40 mmol/L ATP、100 mmol/L MgCl2、40 mmol/L DTT、pH 7.5), 加入300 ng BtE1、300 ng BtE2、2 μg 泛素、1 μg BtCrgA及1 μg BtWC-1b 蛋白质,30 ℃反应2 h, 加入5×SDS-PAGE 上样缓冲液,煮沸5 min,在SDS-PAGE凝胶上进行电泳分离,进行Western blot 分析,将凝胶中分离的蛋白质经半干转印仪转印至PVDF 膜,用含有质量分数5%脱脂奶粉的TBST 溶液室温封闭1 h,一抗4 ℃孵育过夜,TBST 溶液洗涤3 次,二抗孵育1 h, 洗涤3 次后使用ECL 发光检测试剂盒检测,在化学发光成像系统中进行成像。
2 结果与讨论
2.1 三孢布拉霉泛素化相关酶基因挖掘
泛素化修饰是一种重要的蛋白翻译后修饰途径, 完整途径包括了泛素活化酶E1 (ubiquitinactivating enzyme,UBA)、泛素结合酶E2(ubiquitinconjugation enzyme,UBC ) 和泛素连接酶 E3(ubiquitin-protein ligase)[11], 要实现对BtCrgA 泛素连接酶功能的体外探究,首先需要获得泛素活化酶及泛素结合酶的相关序列信息。
根据卷枝毛霉已报道的泛素活化酶序列以及三孢布拉霉全基因组信息设计引物,以三孢布拉霉cDNA 为模板进行扩增, 得到全长约为3000 bp 的条带,与预期结果一致,对扩增得到的序列进行测序,得到3030 bp 的序列,对应的氨基酸序列与卷枝毛霉E1 酶序列同源性为88.4%, 可初步认定该蛋白为E1 酶,将该基因命名为BtE1,见图2。

图2 BtE1 及BtUBC 基因编码序列核酸电泳图Fig. 2 Nucleic acid electrophoresis of BtE1 and BtUBC gene coding sequences
利用TBtools 软件, 以酵母已报道的泛素结合酶序列为模板,从三孢布拉霉基因组数据库信息中共筛选得到三孢布拉霉的18 种UBC 蛋白质, 根据基因信息设计引物,以三孢布拉霉cDNA 为模板进行扩增,得到不同长度的基因序列,经测序后得到BtUBC 基因编码序列长度在411~1227 bp。
2.2 三孢布拉霉泛素化相关酶特征分析
2.2.1 泛素活化酶基本性质分析 泛素活化酶E1,是泛素化修饰途径中的重要起始酶类,依赖ATP 作用下激活泛素并将其转移至E2 酶[12]。三孢布拉霉泛素活化酶BtE1 由1009 个氨基酸组成,蛋白质相对分子质量预测为113700,等电点为5.02,为稳定性蛋白质,亚细胞定位预测显示它位于细胞质中。
2.2.2 泛素结合酶基本性质分析 泛素结合酶E2在泛素化途径中起到接受E1 酶的泛素并将泛素转移给E3 酶或底物蛋白质的作用,E2 酶的主要特征是含有高度保守的泛素结合(UBC)结构域[13]。 目前仅鉴定出三十几个物种的泛素结合酶E2 家族成员,主要为酿酒酵母、秀丽线虫、多种植物及人类,且不同物种中的泛素结合酶E2 数目在十几到数十个不等[14]。而从三孢布拉霉中一共鉴定到18 种泛素结合酶。 这18 种三孢布拉霉UBC 蛋白质由136~408个氨基酸组成, 蛋白质相对分子质量在15200到46100,基因内含子数量为1~9,蛋白质大多数位于细胞核和细胞质,少数位于细胞骨架或细胞膜上,这表明BtUBC 多在细胞内环境中发挥作用。 不同蛋白质的等电点不同(4.17~9.62),BtUBC 蛋白质均属于不稳定蛋白质,亲水性平均系数代表蛋白质的亲水性情况,除BtUBC C 蛋白质外,其余蛋白质均为亲水性蛋白质。
对所有BtUBC 蛋白质进行保守结构域分析,结果显示所有BtUBC 蛋白质均含有UBCc 结构域,见图3(a)。 表明这18 种蛋白质均属于UBC 蛋白质,在BtUBC A/E/G/I/K/L/N/O 中含有一个低复杂度结构,该结构可能具有位置依赖作用,其在序列中的位置可能与蛋白质的结合特性及生物学作用有关[15],BtUBC I 和BtUBC O 的N 端含有跨膜结构域。
对所有BtUBC 保守结构域进行多序列比对和二级结构预测,见图3(b)。 多序列比对结果显示这些UBC 保守结构域序列的一致性为36.58%, 二级结构预测结果显示在UBC 保守结构域中含有4 个α 螺旋和3 个β 折叠,另外几乎所有BtUBC 蛋白质中均含有泛素硫酯中间体相互作用残基和E3 相互作用残基, 大部分蛋白质含有半胱氨酸活性位点,部分蛋白质如BtUBC E/I/K/O/P 则缺乏半胱氨酸活性位点,可能属于类E2 酶,主要是与通过活性E3 酶合作在泛素化修饰中发挥功能[16]。 对14 个酿酒酵母和18 个三孢布拉霉E2 酶成员进行了系统发育分析,见图3(c)。 BtUBC 蛋白质与ScUBC 蛋白质在进化上并不是完全对应关系,表明在进化不同物种进化过程中UBCs 发生了不同的变化, 酵母和三孢布拉霉的E2 成员分布在7 个亚家族中。 根据结构特征, 各UBC 蛋白质又可分为4 类 (以不同标记区分),分别为仅含有UBC 结构域的I 类、含有C 端延伸及UBC 结构域的II 类、含有N 端衍生及UBC 结构域的III 类和含有C 端、N 端延伸及UBC 结构域的IV 类[17-19],在涉及的UBC 蛋白质中,BtUBC D/J/B/P/H/C/Q/R 和ScUBC 4/5/7/9/13/MMS2 属于I 类,BtUBC G/I/L/N/O 和ScUBC1/2/3/6/8 属于II 类,BtUBC A/F 和ScUBC 12/X 属于IV 类,BtUBC E/K属于IV 类。 系统发育树上相同或相似分支的大部分ScUBC 蛋白质和BtUBC 蛋白质属于同一类型的UBC, 但也有少数类型不一致, 如ScUBC X 和BtUBC C、ScUBC 2 和BtUBC R。
2.3 泛素化相关酶的异源表达及蛋白质纯化
Rad18 是一种泛素连接酶, 能与泛素结合酶Rad6(UBC 2)形成复合物,实现底物蛋白质的单泛素化修饰[20]。 McCrgA 含有的RAD18 超家族结构表明McCrgA 可能也属于Rad18 这类蛋白质,而BtCrgA 虽然不含RAD18,但它与McCrgA 有很高的同源性, 所以考虑将与ScUBC 2 亲缘关系较近的BtUBC A/E/K/N/Q/R 作为候选泛素结合酶。 此外,ScUBC4/5 具有强大的泛素转移活性,可以协助各种泛素连接酶进行泛素化修饰功能[21],因此BtUBC D蛋白质也同样作为候选E2 酶。 这些BtUBC 基因成功构建出重组载体, 但只有BtUBC A、BtUBC D 和BtUBC Q 成功实现异源表达。BtUBC E、BtUBC N 和BtUBC R 经过密码子优化后可以在大肠杆菌中表达,而BtUBC K 即使经过密码子优化也无法表达。
所有能表达异源蛋白质的重组菌经培养、诱导表达、超声破碎、亲和纯化获得相应蛋白质,并进行SDS-PAGE 检测。 其中BtE1 蛋白质的预测相对分子质量约为113000,BtCrgA 蛋白质约为70000,BtWC-1b 蛋白质约为85000。 BtUBC A、BtUBC D、BtUBC E、BtUBC N、BtUBCQ 和BtUBC R 的蛋白质的相对分子质量分别为20300、16900、37500、18400 和17300。SDS-PAGE 结果显示,目标蛋白质条带出现在相应位置,BtWC-1b 蛋白质的实际大小大于预测的相对分子质量,见图4。

图4 泛素化相关蛋白质纯化图Fig. 4 Purification of ubiquitination related proteins
2.4 CrgA 泛素连接酶功能体外分析
以纯化得到的各组分进行体外泛素化反应,经SDS-PAGE 分离、转膜后利用泛素抗体、Myc 抗体以及Flag 抗体检测反应情况, 结果显示在BtUBC A/D/E/N/Q/R 这6 种UBC 蛋白质中,仅有BtUBC D 可介导BtCrgA 发生泛素化,但并未导致WC-1b 发生泛素化, 可能是尚未找到能协助CrgA 发挥对WC-1b 蛋白质泛素化功能的UBC 蛋白质, 可能是目前的体外泛素化条件并未达到要求等原因导致,如某些E2 酶就是与泛素样分子发生作用而不是与泛素分子。
为进一步确定反应的泛素化情况, 排除是E1酶、E2 酶泛素化反应后产生该类结果的可能, 分别设置缺乏不同成分的对照组进行体外泛素化反应和Western Blot 检测, 结果显示当E1、E2、E3 均存在的条件下,CrgA 能够发挥其泛素连接酶的功能,自身会发生泛素化,而WC-1b 则并未受到影响,见图5。
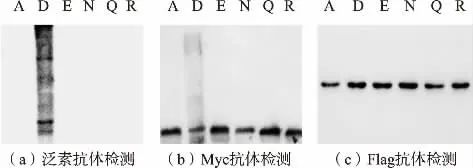
图5 不同UBC 蛋白质的体外泛素化反应结果Fig. 5 In vitro ubiquitination of different UBC proteins
泛素化反应是由泛素激活酶E1 酶起始,E1 酶在ATP 作用下与泛素形成高能硫酯键,活化后的泛素转移到泛素结合酶E2 上, 最后泛素连接酶催化底物蛋白质与泛素连接[22],修饰形式涉及单一泛素附着(单泛素化)、几个单一泛素分子或泛素链附着(多泛素化)[23]。 在6 种候选泛素结合酶参与的反应中, 仅有BtUBC D 参与的反应可以导致BtCrgA 发生泛素化修饰,而BtWC-1b 未受到影响,表明在该作用下BtCrgA 与泛素形成的连接方式可能并不适用于将泛素转移给BtWC-1b。该反应涉及步骤大致为BtE1 在ATP 作用下激活泛素并与之结合, 随即泛素能够转移到BtUBC D 上,最后可能由于缺乏相应底物蛋白质, 或者BtCrgA 自身可能就是一种底物蛋白质,导致BtCrgA 发生泛素化修饰,形成多泛素化,见图6。 这种对于BtCrgA 的泛素化修饰可能与BtCrgA 在菌体内的质量浓度及活性调节有关。
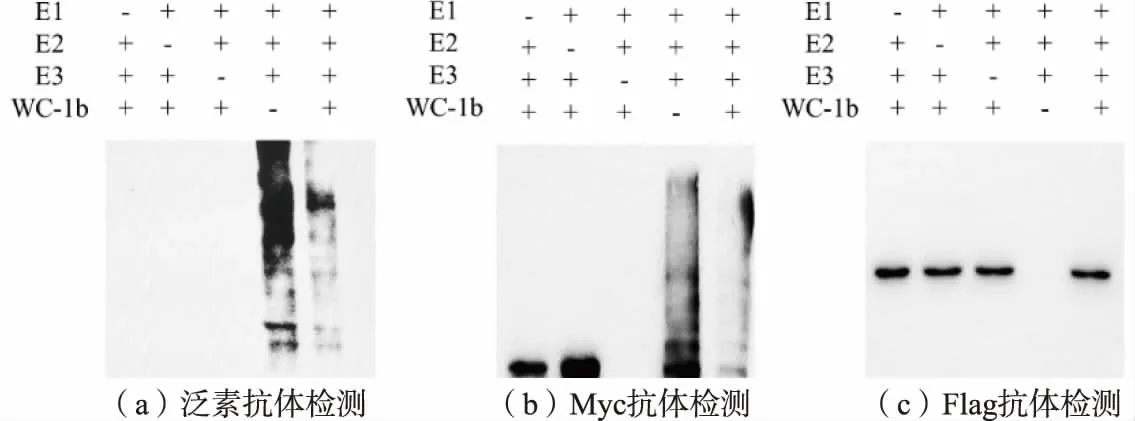
图6 不同组分体系的泛素化反应结果Fig. 6 Results of ubiquitination reaction of different components
有研究表明含有环指结构域的E3 酶通过向自身添加多聚泛素链,进而进入降解途径或发生功能的改变从而调控其作为E3 酶的酶活力[24],从构建的三孢布拉霉和酿酒酵母UBC 蛋白质的系统进化树中可以发现,与BtUBC D 蛋白质亲缘关系较近的为ScUBC 4 和ScUBC 5 两类蛋白质,而这两类蛋白质在酵母中往往是与不稳定的蛋白质相关[25]。 有研究显示, 在野生型卷枝毛霉中,CrgA 难以被特异性抗体检测到, 而在酵母中异源表达CrgA 时同样显示出CrgA 的不稳定性[26],这也可能是由于这类与酵母UBC4、UBC5 同源的UBC 蛋白质参与到了CrgA 的泛素化反应中, 促使CrgA 蛋白质进入26s-蛋白酶体降解途径或其他途径导致CrgA 的降解, 从而维持了CrgA 在菌体内的极低水平。 因此,BtUBC D 也可能只直接介导了BtCrgA 的自泛素化而不用将泛素再转移至其他底物蛋白质, 这对于维持CrgA 在菌体内的水平可能具有重要意义。 而关于BtCrgA对BtWC-1b 的泛素化作用,目前仍未得到验证,可能是由于缺乏必要的泛素化反应条件才导致无法实现该反应,见图7。
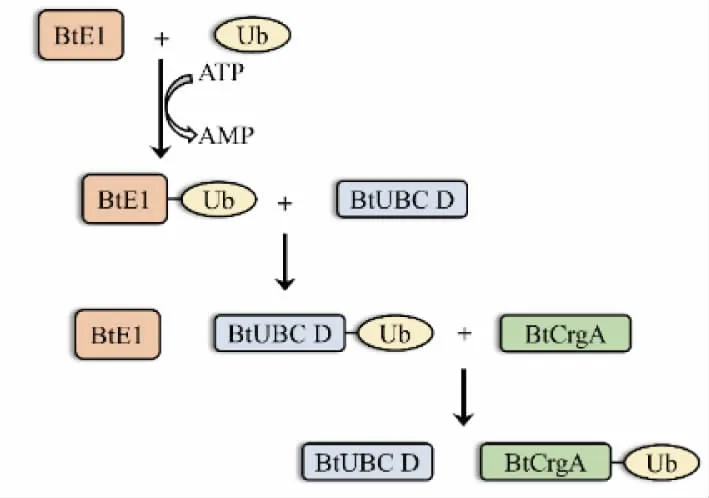
图7 BtCrgA 泛素化修饰示意图Fig. 7 Schematic diagram of BtCrgA ubiquitination modification
3 结语
作者基于基因组数据挖掘,从三孢布拉霉中发现了一种泛素活化酶和18 种泛素结合酶, 利用生物信息学分析了泛素活化酶和泛素结合酶的基本性质, 对三孢布拉霉UBC 蛋白质和酿酒酵母UBC蛋白质构建系统进化树发现,该家族中的蛋白质分属于7 种蛋白质亚家族,并筛选出6 种BtUBC 蛋白质作为候选基因构建体外泛素化反应体系。 通过基因克隆和基因合成在E.coli 中实现了BtE1、6 种BtUBC、BtCrgA 以及BtWC-1b 的异源表达。 通过不同UBC 蛋白质参与的体外泛素化反应,最终检测到BtUBC D 蛋白质能够实现对BtCrgA 的泛素化修饰。 通过不同组分泛素化反应体系的检测结果显示,只有当E1、E2、E3 均存在的条件下,才能检测到CrgA 的泛素化, 验证了CrgA 的泛素连接酶功能。BtUBC D 蛋白质与ScUBC 4 以及ScUBC 5 同源,这可解释CrgA 在菌体内的不稳定性及极低的含量,在这个泛素化反应体系中,泛素经泛素激活酶BtE1活化后转移给泛素结合酶BtUBC D,最后转移至泛素连接酶BtCrgA 上, 导致BtCrgA 发生了泛素化修饰。 目前的研究尚未实现对BtWC-1b 泛素化,或可通过构建三孢布拉霉的crgA 缺陷型菌株来从体内探究CrgA 与WC-1b 之间的关系,从而进一步解析三孢布拉霉类胡萝卜素的合成机制。 另外也可构建crgA 突变型的三孢布拉霉菌株以探究CrgA 的关键性结构域对于三孢布拉霉合成类胡萝卜素的影响,以期为解析类胡萝卜素合成机制以及提高类胡萝卜素产量提供部分依据。

