复合益生菌对染菌白羽肉鸡生长性能及肠道形态、菌群的影响
徐美余, 罗成莹, 辛维岗, 张关令, 王 春, 李亚萍, 林连兵*
(1. 昆明理工大学生命科学与技术学院, 云南 昆明 650500;2. 云南省高校饲用抗生素替代技术工程研究中心,云南 昆明 650500;3. 昆明三正生物科技(集团)有限公司,云南 昆明 650500)
白羽肉鸡具备繁殖成本低、易成活、生长速度快、屠宰率高、肉质好、饲粮比高等特点,在保障中国肉类供应方面发挥了重要作用[1-3]。 同时,白羽肉鸡是目前我国畜禽养殖类中养殖规模化和产业化程度高度集群的禽类,是我国动物蛋白来源的重要组成部分,是中国唯一能通过大量出口创造经济效益的肉类食品[4]。 值得注意的是,目前食品安全问题受到了高度重视,在全面禁止抗生素饲用的大背景下,畜禽的生长性能下降,发病率上升,养殖经济效益大幅缩减等问题逐步加剧。 而白羽肉鸡作为高度集约化养殖的家禽更易感染致病菌,因此,找到有效的抗生素替代品并进行多方面的评价对于保障白羽肉鸡等肉类制品的供应意义重大。
产气荚膜梭菌(Clostridium perfringens),也叫魏氏梭菌(Clostridium welchii),是厌氧型革兰氏阳性病原菌,严重威胁着畜禽养殖和人类食品安全[5-6]。产气荚膜梭菌G 型菌株可分泌α 毒素和NetB 毒素两种主要的毒力因子,感染雏鸡后可引发坏死性肠炎,从而导致小肠黏膜坏死[7-8]。 同时,雏鸡坏死性肠炎在家禽养殖中广泛存在, 是一种产气荚膜梭菌G型菌株感染引起的肠毒型疾病,对肉鸡养殖造成了严重威胁,如改变肠道形态从而降低白羽肉鸡对饲粮的吸收能力,严重者甚至引起肉鸡大量死亡[9]。 目前主要通过在饮水或饲粮中添加抗生素来治疗肉鸡的坏死性肠炎,极易导致耐药性和药物残留等问题[10-11]。 因此,随着我国畜牧业逐步进入无抗养殖时代,如何有效防治产气荚膜梭菌感染引起的家禽坏死性肠炎等疾病再次成为畜牧工作者面临的难题[12]。
益生菌制剂饲喂畜禽可以促进畜禽吸收营养物质和分泌肠道消化酶,提高饲料转化率和畜禽免疫力,改善其生长性能和肠上皮屏障,在肠道健康调节等方面发挥关键作用[13-14]。 例如,益生性枯草芽孢杆菌能分泌胞外酶降解饲料,增强畜禽对饲料的利用,从而对宿主的生产性能产生影响;益生性地衣芽孢杆菌能代谢产生抑菌活性物质从而促进肠道菌群平衡。 以往研究表明,多菌制剂比单菌制剂在畜禽的肠道形态、抗病性方面表现出更好的益生性,如谢文惠等研究表明饲喂复合益生菌可改善雏鸡的血清生化指标、肠道黏膜形态和养分表观利用率[15],刘淑娇等的研究也表明饲喂复合益生菌能显著提高雏鸡的日增重、降低料肉质量比,促进生长,提高肉鸡免疫力[16]。此外,尽管诸多研究证实了复合益生菌可以治疗细菌性感染疾病和提高肉鸡生长性能,但人们对复合益生菌治疗细菌性感染疾病后的影响知之甚少。 因此,作者在构建产气荚膜梭菌攻毒感染模型的基础上,通过在基础日粮中添加由枯草芽孢杆菌和地衣芽孢杆菌制成的复合益生菌制剂,探究其在不同添加质量浓度下对产气荚膜梭菌攻毒感染后的白羽肉鸡生长性能、肠道形态以及肠道菌群结构变化,为复合益生菌改善白羽肉鸡生产中坏死性肠炎的防治和益生菌制剂的科学应用提供一定理论依据。
1 材料与方法
1.1 试验材料
无添加肉鸡基础日粮完全参照作者所在课题组先前研究[17]进行配制;3 日龄白羽肉鸡500 羽、复合益生菌(枯草芽孢杆菌、地衣芽孢杆菌,总菌数1×1010CFU/g)、金霉素制剂、鸡源A 型产气荚膜梭菌:昆明三正生物科技(集团)有限公司;总DNA 抽提试剂盒(TIANamp Stool DNA Kit):天根生物技术公司;QIAquick Gel Extraction Kit 试剂盒:德国Qiagen公司;SMRT Bell Template Prep Kit 试剂盒: 美国Pacific Biosciences 公司;PHY-Ⅲ型病理组织漂烘仪: 常州市中威电子仪器有限公司;Qubit 3.0 荧光计:美国英潍捷基公司;Agilent 2100:美国安捷伦公司;数码三目摄像显微镜(BA400Digital):麦克奥迪实业集团有限公司; 图像分析软件Image-Pro Plus 6.0:美国Media Cybernetics 公司。
1.2 构建白羽肉鸡坏死性肠炎模型
试验采用A 型产气荚膜梭菌毒株攻毒感染构建白羽肉鸡坏死性肠炎模型。 产气荚膜梭菌的培养使用厌氧肉肝汤培养基。 试验3 日龄白羽肉鸡每天每羽灌服鸡源A 型产气荚膜梭菌混悬液1 mL 进行感染,白羽肉鸡表现腹泻,则模型构建成功。
1.3 试验分组与饲喂管理
所有试验按照组方的不同分为5 组:基础日粮组(CHE);基础日粮中添加50 μg/g 金霉素制剂,使用浓度参考以往研究设置(CKB)[17],基础日粮中添加50 mg/kg 复合益生菌(CJK1), 基础日粮中添加200 mg/kg 复合益生菌(CJK2),基础日粮中添加500 mg/kg 复合益生菌(CJK3)。 以上5 组饲粮配好于阴凉干燥处存放。 试验中随机将500 羽产气荚膜梭菌攻毒感染后的白羽肉鸡分配至5 个组,每组5 个重复, 每个重复20 羽。 试验周期为21 d, 以GB/T 19664—2005 为饲养规范,每个重复分开饲养,避免接触感染。
1.4 生长性能测定
试验期间每天记录白羽肉鸡的采食量,分别于实验开始后第1、13、21 天早晨记录白羽肉鸡空腹质量。 平均日采食量见式(1):
式中:F 为平均日采食量,g/d;mT为总耗料量,g;t 为试验天数,d。 平均日增重见式(2):
式中:G 为平均日增重,g/d;ma为总增重,g;t 为试验天数,d。 平均料肉比见式(3):
式中:r 为平均料肉比;F 为平均日采食量,g/d;G 为平均日增重,g/d。 每个分组选取5 羽健康白羽肉鸡进行称量,每羽独立重复3 次。
1.5 肠道形态的测定
在试验第21 天时,每个组抽取5 羽白羽肉鸡,截取肠道卵黄蒂前端5 cm 肠段, 固定采用质量分数10%的中性福尔马林溶液。 固定后的组织用不同体积分数的乙醇梯度脱水,再用二甲苯透明处理样本,用石蜡包埋样品。 包埋后将组织蜡块用切片机切片,经烤片、烘片处理后,用苏木精-伊红染液染色,然后用中性树脂封片,做成永久切片。 采集切片图像并测量绒毛高度(villus height,VH)、隐窝深度(crypt depth,CD),每组数据相对应计算绒隐比。
1.6 肠道微生物的测定
1.6.1 DNA 提取和PCR 扩增 在试验第21 天时,每组随机放血处死并剖检5 羽白羽肉鸡。 无菌结扎盲肠后截取肠段样本,冻存备用于肠道菌群测定分析。将鸡盲肠肠段取出清洗表面微生物并置于2 mL离心管中, 按照试剂盒说明书提取总DNA 并用琼脂糖凝胶电泳检测。 以稀释至1 mg/L 的基因组DNA 为模板,选择带Barcode 的特异引物和高保真酶混合体系进行16S 全长的PCR 扩增。 用2 g/dL的琼脂糖凝胶电泳检测扩增产物。根据PCR 扩增产物浓度进行混合, 使用QIAquick Gel Extraction Kit试剂盒对目的条带进行胶回收。
1.6.2 文库构建和上机测序用SMRT Bell Template Prep Kit 试剂盒构建16S 基因文库, 在扩增后的DNA 片段两端用DNA 聚合酶将测序接头连接上, 用AMpure PB 磁珠纯化DNA 片段, 构建SMRT Bell 文库。 用缓冲液回溶纯化后的DNA 片段,用BluePipin 片段筛选特定片段并用AMpure PB磁珠纯化筛选片段。用Qubit 3.0 荧光计进行文库的浓度定量, 用Agilent 2100 进行插入片段长度的确定,在百迈客生物科技有限公司二代测序平台对样品进行测序和分析。
1.6.3 数据处理 PacBio 下机数据导出为bam 文件。 使用Lima 软件根据barcode 序列区分各样本的数据并以bam 格式保存。 校正序列使用CCS(SMRT Link v5.0) ,矫正参数CCS=3,最小准确率0.9,选取长度范围1340~1640 bp 的序列,以fastq和fasta 保存; 随后进行SSR 过滤含有8 个以上连续相同碱基数的序列并使用cutadapt 去除引物。 可读序列通过(UCHIME Algorithm,http://www.drive5.com/usearch/manual/uchime_algo.html)与全长注释数据库进行比对[18],检测嵌合体序列,并最终去除其中的嵌合体序列(http://www.drive5.com/usearch/manual/chimera_formation.html)[19],得到高质量数据。后续数据分析参考进行alpha 多样性分析、Beta 多样性分析以及在门、属水平统计各样本的群落组成。
1.7 数据分析
所有试验数据均包含至少3 次生物学重复,以平均值±标准差(SD)的方式呈现。 应用IBM SPSS 24.0 统计软件进行单因素方差统计分析和LSD 多重比较,显著差异性水平定为P<0.05,图片绘制采用Origin 2019 进行。
2 结果与分析
2.1 复合益生菌对感染产气荚膜梭菌后的白羽肉鸡生长性能的影响
将5 个组白羽肉鸡分别饲喂被产气荚膜梭菌感染后的白羽肉鸡,在21 d 记录并计算出每组的平均日采食量(ADFI)和平均日增重(ADG),以料肉比(F/G)评估每组白羽肉鸡的生长状况并与传统抗生素金霉素制剂进行比较,见图1。 结果显示,在产气荚膜梭菌感染的情况下,日粮中添加金霉素制剂和复合益生菌均可降低白羽肉鸡的料肉比。 CKB 组、CJK2 组、CJK3 组的料肉比相比于CHE 组显著降低(P<0.05), 且随着日粮中复合益生菌添加水平的上升白羽肉鸡料肉比呈下降趋势,CJK3 组料肉比达到最低。

图1 不同组白羽肉鸡生长性能的比较Fig. 1 Comparison of growth performance of different groups of white feather broilers
2.2 复合益生菌对感染产气荚膜梭菌后的白羽肉鸡肠道形态的影响
本研究结果中每组随机剖检白羽肉鸡5 羽,每羽选取10 根走向平直且形态完整的绒毛计算绒隐比。 结果发现,添加金霉素制剂和复合益生菌后,相比于对照组,肠绒毛发育良好,断裂和肠绒毛损伤减少, 见图2。 在有产气荚膜梭菌攻毒感染的情况下,CKB 组、CJK1 组、CJK2 组、CJK3 组与CHE 组相比均能提高绒毛高度,降低隐窝深度,从而提升绒隐比,改善肠道健康度。 CKB 组、CJK2 组、CJK3 组与CHE 组相比绒隐比提升效果显著 (P<0.05),CJK3 组提升绒隐比的效果最佳,且和金霉素制剂质量分数为50 μg/g 时的效果没有显著差异,见图3。
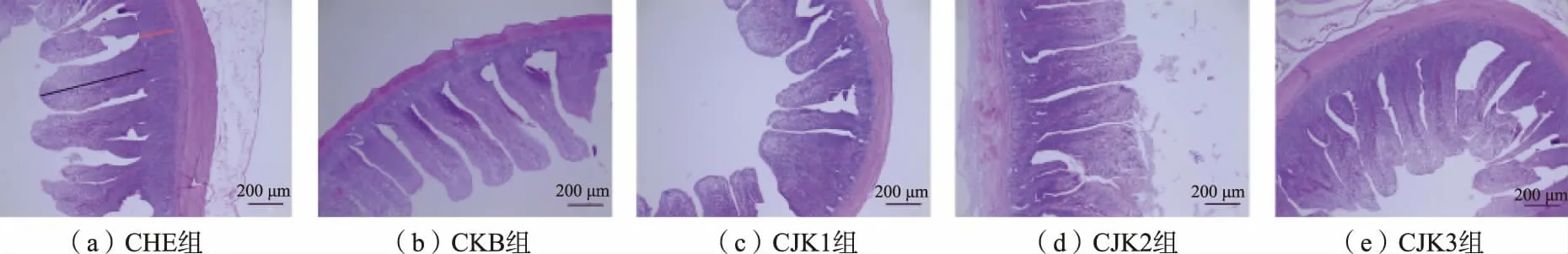
图2 不同组白羽肉鸡肠道组织形态Fig. 2 Intestinal morphology of white-feathered broilers in different groups
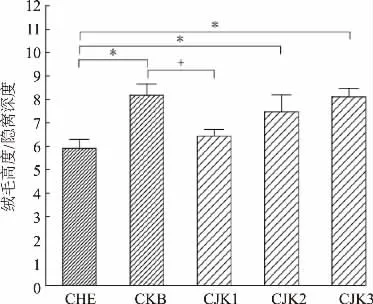
图3 不同组白羽肉鸡肠道组织绒毛高度与隐窝深度比值Fig. 3 Ratio of villus height to crypt depth in intestinal tissue of whitefeather broilers in different groups
2.3 益生菌对感染产气荚膜梭菌后的白羽肉鸡肠道菌群的影响
2.3.1 α 多样性分析 分析表1 可知, 各分组样本的有效序列数在72046~81880 间, 有效序列数目较高,样品的覆盖度(coverage)达到0.999,则测序结果对测序样品的覆盖度较好,各组间OUT 数目没有显著差异(P>0.05)。 分析各试验组与对照组之间的丰富度和多样性指数, 发现CJK3 组、CKB 组的Chao1、Ace 指数均低于CHE 组,CKB、CJK1、CJK2、CJK3 组的Shannon 指数均高于CHE 组,CJK1、CJK2、CJK3 组的Simpson 指数均高于CHE 组 (P<0.05),CJK1、CJK2、CJK3 组的Simpson 指数均高于CKB 组(P<0.05)。 表明产气荚膜梭菌感染白羽肉鸡后,在基础饲粮中添加复合益生菌可提高肠道菌群多样性,降低肠道菌群的丰富度。

表1 α 多样性指数Table 1 α-diversity index
2.3.2 β 多样性分析 β 多样性用于分析组间与组内各样本间微生物群落组成的差异性与相似性,本试验由NMDS(Stress=0.122)(图4(a))和PCoA 法分析(见图4(b))发现,组间样本明显分开,且各组内样本紧密靠近。 各试验组与空白组之间距离相差较大,表明试验分组合理,金霉素制剂和复合益生菌都会对白羽肉鸡肠道菌群造成一定影响。

图4 NMDS 分析图(a)、PCOA 分析图(b)Fig. 4 NMDS(a) and PCoA(b) analysis
2.4 肠道菌群组成及优势菌群相对丰度分析
对产气荚膜梭菌攻毒感染后白羽肉鸡肠道菌群进行分析后,发现在门水平分类单元中,相对丰度前7 位的为厚壁菌门 (Firmicutes)、 拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、软壁菌门(Tenericutes)、放线菌门(Actinobacteria)、梭杆菌门(Fusobacteria)、蓝藻菌门(Cyanobacteria),见图5。为探究不同添加剂量的复合益生菌与金霉素制剂对白羽肉鸡肠道菌群结构的影响,分析了不同剂量的复合益生菌和金霉素制剂组与空白组的相对丰度差异以及不同剂量的复合益生菌与金霉素制剂组的相对丰度差异,见表2。 结果发现,与CHE 组相比,CJK2 组变形菌门相对丰度显著升高,CJK1、CJK2、CJK3 组软壁菌门相对丰度显著下降(P<0.05);CKB组厚壁菌门相对丰度显著升高,软壁菌门相对丰度显著下降(P<0.05)。 与CKB 组相比,CJK1 组拟杆菌门相对丰度显著升高, 厚壁菌门相对丰度显著下降,CJK2 组变形菌门相对丰度显著升高(P<0.05)。

表2 门分类单元下相对丰度前7 位细菌的变化Table 2 Changes in relative abundance of top 7 bacteria phylum taxa

图5 门水平肠道菌群组成Fig. 5 Composition of gut flora at Phyla level in treatment and control groups
在属水平分类单元中, 粪杆菌属(Faecalibacterium)、另枝菌属(Alistipes)、变形杆菌属(Proteus)、Fournierella、肠球菌属(Enterococcus)等的相对丰度最高,见图6。定义属水平上相对丰度前10 位的菌群为优势菌群, 分析比较不同剂量的复合益生菌和金霉素制剂组与空白组的相对丰度差异及不同剂量的复合益生菌与金霉素制剂组的相对丰度差异,见表3。 结果发现,与CHE 组相比CJK2 组变形杆菌属、Clostridiales相对丰度显著升高,CJK3 组肠球菌属相对丰度显著升高,CJK1、CJK2、CJK3 组Fournierella、罕见小球菌属相对丰度均显著升高、Lachnospiraceae 相对丰度显著下降(P<0.05);CKB 组Fournierella、肠球菌属、布劳特氏菌属、Ruminococcaceae 相对丰度显著升高、Lachnospiraceae相对丰度显著下降 (P<0.05)。 与CKB 组相比,CJK1 组另枝菌属相对丰度显著升高,CJK2 组变形杆菌属、Clostridiales相对丰度显著升高、Ruminococcaceae 属相对丰度显著下降,CJK1、CJK2 组肠球菌属、 布劳特氏菌属相对丰度显著下降,CJK1、CJK2、CJK3 组Fournierella 属相对丰度显著下降、罕见小球菌属相对丰度显著升高(P<0.05)。

表3 属分类单元下相对丰度前10 位细菌的变化Table 3 Changes in relative abundance of the top10 in genera taxa

图6 属水平肠道菌群组成Fig. 6 Composition of gut flora at Genera level in treatment and control groups
3 讨论
复合益生菌作为一种绿色健康环保的饲料添加剂,在提升白羽肉鸡生长性能、减缓由于抗生素的添加导致的菌群失调等方面发挥着重要作用。 产气荚膜梭菌对白羽肉鸡的健康构成重大威胁[4],特别是白羽肉鸡感染产气荚膜梭菌后会引起以肠道黏膜出血性坏死为主要特征的消化道传染病,具有较高的发病率和死亡率,对禽类养殖业造成了严重损失[20]。因此,作者通过在白羽肉鸡基础日粮上添加不同剂量的复合益生菌,研究其对产气荚膜梭菌感染后的白羽肉鸡生长性能、肠道形态及肠道菌群的影响,并与传统抗生素金霉素制剂进行比较。 研究结果显示,饲喂复合益生菌组相比于对照组料肉质量比发生了不同程度降低,这与以往益生菌对畜禽生长性能的影响相似[21]。 随着复合益生菌组剂量的上升白羽肉鸡的料肉质量比呈现出下降趋势,高剂量(500 mg/kg)、中剂量(200 mg/kg)的复合益生菌与空白组相比均存在显著差异(P<0.05),表明复合益生菌对于白羽肉鸡的生长具有明显促进效果。 此外,对比不同剂量的复合益生菌与金霉素制剂组之间的料肉比, 复合益生菌与抗生素作用效果类似,能够改善消化道对营养物质的利用能力,从而提高了白羽肉鸡的生长性能[22],达到抗生素的替代效果。
肠道的优化发育对于营养吸收和家禽抵抗疾病尤其重要[23]。 肠绒毛高度反应小肠吸收营养物质的面积大小, 隐窝的深浅代表化学消化功能的强弱。 病原菌感染肠道后,引起绒毛高度降低和隐窝深度增加,降低绒隐比[24]。 产气荚膜梭菌感染后,肠道生理机能发生改变, 白羽肉鸡表现为腹泻等症状。 在基础日粮上添加不同剂量的复合益生菌饲喂产气荚膜梭菌感染后的白羽肉鸡后与对照组相比,复合益生菌组与金霉素制剂组绒毛高度与隐窝深度的比值均有不同程度升高,且复合益生菌添加质量分数为200、500 mg/kg 时, 作用效果与金霉素制剂组相似,能显著提高绒毛高度与隐窝深度的比值(P<0.05),绒隐比比值越大,消化吸收能力就越强[25]。本研究结果表明,饲喂高、中、低剂量的复合益生菌可提升绒毛高度,降低隐窝深度,提升绒毛高度与隐窝深度的比值。 这一研究结果与大多数添加复合益生菌能提高绒隐比的研究类似[26]。因此,复合益生菌饲喂产气荚膜梭菌感染后的白羽肉鸡能增强其消化功能。
畜禽肠道微生物对维持宿主健康起重要作用[27]。结果显示,饲喂复合益生菌后白羽肉鸡肠道菌群在门分类水平上厚壁菌门和拟杆菌门占比较高,该研究结果与以往益生菌对产气荚膜梭菌感染后的白羽肉鸡的研究结果相似[28]。 软壁菌门细菌增多会降低畜禽生长性能[29],与空白组相比,饲喂复合益生菌、金霉素制剂后软壁菌门相对丰度均显著下降(P<0.05), 推测治疗后白羽肉鸡料肉比的下降和绒隐比的上升可能是因为软壁菌门相对丰度下降。 在属分类水平上,10 个优势肠道菌群属的相对丰度在饲喂复合益生菌后发生了不同程度变化。 分析产气荚膜梭菌感染白羽肉鸡属水平相对丰度变化,在属水平上, 发现Fournierella 属相对丰度均显著升高,Lachnospiraceae 属相对丰度均显著下降 (P<0.05)。研究发现Lachnospiraceae 与人类溃疡性结肠炎相关[30],因此推测复合益生菌饲喂产气荚膜梭菌感染后的白羽肉鸡可通过降低Lachnospiraceae 属相对丰度达到白羽肉鸡坏死性肠炎的防治效果。 研究发现,罕见小球菌属随着白羽肉鸡坏死性肠炎的加重呈下降趋势[31],饲喂复合益生菌后感染产气荚膜梭菌的白羽肉鸡肠道菌群中罕见小秋菌属细菌相对丰度显著升高(P<0.05),则饲喂复合益生菌能治疗白羽肉鸡坏死性肠炎。 肠球菌属的屎肠球菌能显著降低肉鸡料肉比[32],与对照组相比,金霉素制剂与高剂量复合益生菌(500 mg/kg)饲喂的白羽肉鸡肠球菌属相对丰度均显著升高,进一步表明肠球菌属能改善白羽肉鸡生长性能。
4 结语
作者利用金霉素制剂和由枯草芽孢杆菌、地衣芽孢杆菌组成的复合益生菌分别饲喂产气荚膜梭菌感染后的白羽肉鸡,比较生长性能、肠道形态和肠道菌群结构的变化。 结果证实,复合益生菌对于感染产气荚膜梭菌后的白羽肉鸡生长性能、肠道形态和肠道菌群结构的影响与金霉素制剂相似,尤其是复合益生菌添加质量分数为500 mg/kg 时饲喂感染产气荚膜梭菌的白羽肉鸡后,有效降低了白羽肉鸡料肉质量比, 促进了白羽肉鸡的快速生长发育,且能够促进肠道对营养物质的消化吸收和改善白羽肉鸡肠道菌群健康。 在当前我国面临饲料中禁抗的关键节点,本研究结果利用不同质量浓度的复合益生菌饲喂感染致病菌后的白羽肉鸡并评估生长性能、肠道形态和肠道菌群结构,为复合益生菌应用于白羽肉鸡养殖提供理论依据。

