氟代碳酸乙烯酯合成中含氟废盐的处理与利用
高维丹, 臧正文, 许阿亮, 吕绪涛, 吴耀寰, 岳涛*
(1.青岛科技大学山东化工研究院, 山东 济南 250014;2.山东百川集大环境工程有限公司, 山东 济南 250098)
氟代碳酸乙烯酯(FEC)作为一种常见的化工产品,主要用作锂离子电池电解液的添加剂[1-2]。氯代碳酸乙烯酯 (CEC) 合成FEC 反应方程式见Scheme 1。

Scheme 1 氯代碳酸乙烯酯合成FEC 反应方程式Scheme 1 FEC reaction equation for the synthesis of vinyl chloride carbonate
FEC 在生产过程中会产生含氟废盐,污染环境。 氟化物对动、植物存在毒害,影响农业和牧业生产,对人体皮肤、消化道、身体关节产生危害[3-4]。我国现行的《污水综合排放标准》(GB 8978—1996)规定排放水中F-的质量浓度不超过10 mg/L,随着学者对氟化物污染的不断关注以及国家对工业废水排放标准规定的日益严格[5],含氟废盐的处理和资源化利用具有现实意义。
含氟废盐主要有两种处理方式,对于不易分解、不溶于水而且含氟量较少的含氟废盐,采取直接焚烧的办法,焚烧过程中一般加入固体氢氧化钙与之充分混合, 再进行焚烧处理。 对于易溶于水的含氟废盐可以采取先溶解、再处理的方法。含氟废水的处理较为常见,主要有化学沉淀[6-7]、絮凝沉淀[8-9]、吸附[10]、反渗透、离子交换、电凝聚和液膜分离等方法,但大多数处理方法的出水水质并不稳定,且二次污染严重,因此实际处理含氟废水多采用多种方法组合处理工艺。
1 实验部分
1.1 实验仪器与试剂
实验仪器、实验试剂分别见表1、表2。

表1 实验仪器Tab.1 Experimental instruments

表2 实验试剂Tab.2 Experimental reagents
1.2 工艺路线
本实验的目的是处理FEC 生产过程中产生的含氟废盐,并对溶剂及副产氯化钾回收。 具体实验流程简介如下: 将制备的FEC 反应液过滤,得到滤饼(含氟废盐),采用干蒸的方法回收滤饼中残留溶剂碳酸二乙酯(DEC)。
脱溶后的滤饼主要成分为KCl 及KF, 本实验采用将固态含氟废盐转化为液态含氟废水的方法处理含氟废盐。 将滤饼溶于水,过滤除去不溶于水的杂质。 向滤液中加入氯化钙与氢氧化钙混合澄清溶液进行初步沉淀,再过滤,滤饼干燥得到氟化钙; 经初步沉淀后的滤液中氟离子含量仍不符合排放标准, 使用絮凝剂硫酸铝对滤液进行更深层次的处理, 得到符合排放标准的废水。 FEC 含氟废盐处理工艺流程图见Scheme 2。两次处理后的滤液中主要成分为KCl, 利用不同温度下KCl 的溶解度差异,进行蒸发浓缩回收KCl, 最终获得纯度高达99.77%的KCl 晶体,另外含有0.19%的Al2(SO4)3,0.04%的CaCl2,回收得到的KCl 可直接用于化工生产。 整个含氟废盐处理过程实现资源重复利用,资源得到最大化利用。

Scheme 2 FEC 含氟废盐处理工艺流程图Scheme 2 FEC fluorine containing waste salt treatment process flowchart
2 结果与讨论
2.1 溶剂的回收
使用氧弹燃烧-离子色谱法检测含氟废盐中阴离子的组成及含量, 再通过感应耦合等离子(ICP-OES)检测阳离子的组成及含量,并对滤饼中残留的DEC 含量进行测定,其结果见表3。
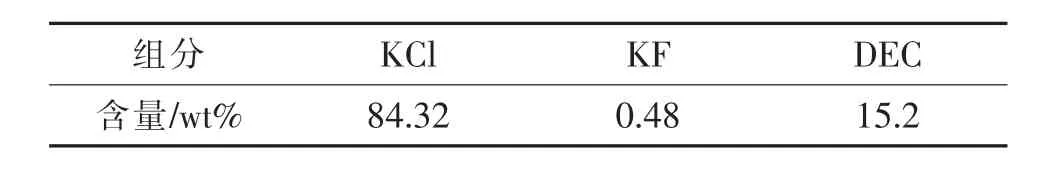
表3 含氟废盐的组成及含量Tab.3 Composition and content of fluoride containing waste salts
通过测定,该含氟废盐的主要成分为KCl,其含量为84.32%,KF 的含量为0.48%。 130 ℃左右对废盐进行干燥,测定其前后质量差,计算DEC含量约为15.2%。
工业生产中,为了使资源利用最大化,需对溶剂进行回收。 固体中溶剂的回收有两种方法。方法一是采用干蒸的方式回收溶剂。 将滤饼蒸干,再经过冷凝,得到DEC,该方法操作简单,不需要溶解,节省时间和资源;缺点是冷凝并不完全,会有少量的DEC 损失。 方法二是将含氟废盐溶于水中,利用DEC 与水不互溶的特性,将DEC分离出来。 这种方法相对来说更能彻底地分离DEC,但是DEC 与水的密度接近,会导致分离不完全,从而造成DEC 的损失。此外,这种方法操作相对繁琐,需要更多的步骤。 本工艺采用干蒸的方法回收溶剂。
2.2 沉淀法除氟
2.2.1 沉淀剂的选择
脱溶后固体的主要成分为KCl,还含有少量的KF。 KF 在室温(25 ℃)下的溶解度为100 g/100 mL H2O。 称取100 g 的含氟废盐,加入1000 g 去离子水,室温下(约25 ℃)搅拌30 min 后,有少量不溶于水的油状物质,过滤除去不溶物。
滤液中氟离子采用 《生活饮用水检验方法》(GB/T 5750—2006) 中生活饮用水标准离子选择性电极法测氟化物进行测定。 经测定,溶液中氟离子含量为153 mg/L。 氟离子含量较高,先使用沉淀剂对溶液进行初步处理,而沉淀剂的不同会直接影响除氟效率。 保持n(Ca2+):n(F-)为0.5,初始pH 为6,考察氧化钙、氯化钙、氢氧化钙以及两种沉淀剂混合使用对氟的沉淀效果,结果见表4。

表4 沉淀剂的种类对残余氟离子浓度的影响Tab.4 The effect of types of precipitators on the concentration of residual fluoride ions
由表4 可知,3 种沉淀剂均对氟离子有一定的沉淀作用。 CaCl2对F-的沉淀效果较好,处理后的滤液中残余氟离子浓度从153 mg/L 降低至62.2 mg/L,氟离子去除率为59.3%;CaO 及Ca(OH)2对F-的沉淀效果相对较差。 混合沉淀剂中CaCl2与Ca(OH)2混配效果最佳。当n(CaCl2):n(Ca(OH)2)=1:1 时,残余氟离子浓度从153 mg/L 降低至50.9 mg/L,氟离子去除率可达66.7%。 从整体来看,CaCl2价格较高,CaO、Ca (OH)2价格便宜, 成本上更有优势,但其除氟效果相对较差;另外,使用CaO 会消耗水,CaO 也容易包裹在CaF2表面, 后续分离困难。综合以上因素,本工艺选取n(CaCl2):n(Ca(OH)2)=1:1 混合作为沉淀剂。
2.2.2 沉淀剂的用量对除氟效果的影响
使用n(CaCl2):n(Ca(OH)2)=1:1 混合物作沉淀剂时,钙离子的量对除氟效果影响较大。 钙离子量过多,会出现反应后钙离子剩余,对后续氯化钾的回收产生影响;当钙离子量过少,会造成沉淀不完全,保持初始pH 为6,对Ca2+的使用量进行探究,结果如图1 所示。

图1 n(Ca2+): n(F-)的量对残余氟离子的影响Fig.1 The effect of the amount of n(Ca2+): n(F-) onresidual fluoride ions
从图1 中可以看出, 随着氯化钙加入量的增大,除氟后残余氟离子的浓度逐渐降低,当n(Ca2+):n(F-)增加到1.2,除氟后残余氟离子浓度为27.2 mg/L,此时再继续增大Ca2+的量,残余氟离子的浓度没有明显变化。 n(Ca2+):n(F-)持续增大,F-残余浓度下降幅度并不明显,这是因为CaF2本身在水中有一定的溶解度(7~8 mg/L 左右)。 经过综合比较,当n(Ca2+):n(F-)为1.2 时,为最优条件。
2.2.3 初始pH 对除氟效果的影响
不同pH 对除氟效果会产生明显的差异。 取100 g 含氟废盐,加入1000 g 去离子水,室温(25 ℃)下使用稀盐酸与氢氧化钾调节溶液pH, 考察pH在4~12 时,除氟后残余氟离子的变化,结果见图2。

图2 pH 对溶液中残余氟离子的影响Fig.2 Effect of pH on residual fluoride ions in solution
由图2 可知,保持n(Ca2+):n(F-)为1.2 不变,调节pH 在4~8 之间,随着pH 的增大,除氟后的残余氟离子浓度从29.6 mg/L 降低至20.3 mg/L;而当pH 在8~12 时,随着pH 的增大,除氟后残余氟离子浓度逐渐增大。 出现该现象的原因是随着pH 增大,H+浓度降低,F-与H+的结合概率降低,与Ca2+结合概率增大,使得F-浓度降低;但pH 继续增大,碱性继续增强,Ca2+与OH-结合,使Ca2+的浓度降低,导致生成CaF2概率降低,氟的沉淀速率下降。 综合比较,pH=8 为最优条件。
2.2.4 絮凝剂的选择
使用沉淀剂对废水进行处理,除氟后的滤液中氟离子的浓度为20.3 mg/L,虽然处理后溶液中氟离子浓度明显降低,但处理后溶液中氟离子的浓度仍未达到国家工业废水氟离子的排放标准(小于10 mg/L), 故在上述基础上再加入絮凝剂进行深度处理。
在深度除氟阶段,在钙盐反应的基础上再投加铝盐、铁盐等混凝剂可以实现更低的残余氟离子浓度。 在相同氟离子浓度(20.3 mg/L)和pH(约为8)的条件下,考察不同絮凝剂对氟离子的沉淀效果,结果见表5。
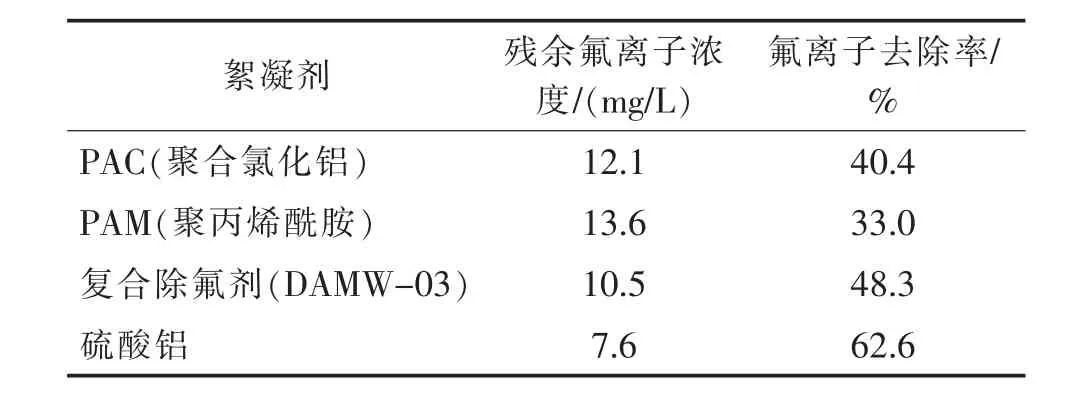
表5 不同的絮凝剂对残余氟离子浓度的影响Tab.5 The effect of different flocculants on the concentration of residual fluoride ions
由表5 可知,硫酸铝作絮凝剂时除氟效果最好, 除氟后残余氟离子浓度从20.3 mg/L 降低至7.6 mg/L,氟离子去除率达62.6%,其他絮凝剂效果相对较差。 硫酸铝除氟效果相对较好,是因为硫酸铝在水中会电离及水解,水解生成氢氧化铝胶体。 这种大表面积的氢氧化铝胶体能够通过各种作用吸附氟离子,并以絮凝沉淀的形式析出。
絮凝剂硫酸铝还会产生硫酸根离子,与溶液中的少量钙离子结合形成硫酸钙沉淀。 可以间接降低溶液中钙离子的浓度, 有利于氯化钾的纯化。 综上所述,硫酸铝作絮凝剂可以同时实现氟离子的吸附和钙离子的沉淀,达到较好的除氟效果且利于后续提纯。
2.2.5 硫酸铝用量对除氟效果的影响
絮凝剂硫酸铝的用量对除氟影响也较大。 保持pH=8、 温度为25 ℃, 对硫酸铝的用量进行考察,考察不同n(Al3+):n(F-)配比对除氟效果的影响,其结果见表6。

表6 硫酸铝用量对残余氟离子浓度的影响Tab.6 The effect of the amount of aluminum sulfate on the concentration of residual fluoride ions
由表6 可知,当n(Al3+):n(F-)从4:1 增大至12:1,溶液中残余氟离子浓度从12.4 mg/L 降低至3.0 mg/L, 氟离子去除率从38.9%增大到85.2%,此时, 氟离子浓度符合国家工业废水排放标准(低于10 mg/L),继续增大硫酸铝的用量,除氟后残余氟离子含量几乎保持不变,因此n(Al3+):n(F-)=12:1 为硫酸铝的最佳投料量。
2.3 氯化钾回收
除氟后的滤液中含有Cl-、K+以及少量的氯化钾的溶解度随温度的变化曲线见图3。 利用氯化钾在不同温度下的溶解度差异,采用浓缩结晶的方式获得氯化钾晶体。

图3 氯化钾的溶解度随温度的变化Fig.3 The solubility of potassium chloride changes with temperature
为了获得纯度更高的氯化钾,将一次浓缩后得到的晶体使用冷水进行洗涤,但洗涤水的用量对产品的纯度、回收率有较大的影响。 洗涤水量过小,洗涤不完全,洗涤后的氯化钾含量不高;洗涤水量过大,虽然氯化钾纯度提高,但氯化钾溶于过多的水中,会造氯化钾的损失,回收率降低。
洗涤水的用量一般是由晶体中杂质的含量决定,晶体中主要杂质为硫酸铝与氯化钙,其具体计算公式见式(1)。
式(1)中:w滤饼为所需洗涤晶体的质量,g;Al2(SO4)3(湿基)%为杂质硫酸铝的质量分数,%;T 为洗涤时的温度,℃;H2O%为滤饼的含湿量。
取蒸发浓缩、过滤后的滤饼300 g,测定滤饼中KCl 含量为86.3%,Al2(SO4)3含量为5.6%,CaCl2含量为0.06%,含水量约为8%。将滤饼分为4 份,每份75 g,洗涤温度为15 ℃,经计算,理论洗涤水用量约为6.84 g,仅改变洗涤水的用量,进行4 组平行实验,探究理论洗涤用水量的0.6 倍、0.8 倍、1.0 倍、1.2 倍对回收氯化钾纯度及回收率影响,洗涤后对固体干燥,实验结果见表7。

表7 洗涤水的用量对回收氯化钾纯度及回收率影响Tab.7 The influence of the amount of washing water on the purity and recovery rate of recovered potassium chloride
从表7看出,随着洗涤水用量的增大,氯化钾晶体的纯度增高,但当洗涤水用量超过理论水用量1 倍时,氯化钾的纯度从98.6%增大到99.7%,增大幅度较小;但随着洗涤水用量的增大,固体溶解损失的越多,导致氯化钾晶体的回收率不断降低。 综合比较,洗涤水使用量为1.0 倍理论用水量为最佳洗涤用水量, 此时可以获得纯度为99.7%的氯化钾,另外产品中含有0.19%的Al2(SO4)3,0.04%的CaCl2。
3 结论
针对FEC 生产过程中产生的含氟废盐设计了沉淀-絮凝两段除氟法, 用于处理和回收含氟废盐,确立其最佳处理工艺条件,联产的氯化钾产品纯度可达99.7%。该工艺流程简单,可操作性强,便于进行工业化生产,满足国家对氟化废盐处理的政策要求,符合绿色化学发展方向,为含氟废盐的处理提供有价值的参考。
——非均布滤饼的局部比阻与平均比阻的测定与计算方法

