复方野菊花眼贴对蓝光诱导小鼠睑板腺功能异常的防治作用及其机制
李勇 黄彩虹 李清坚 王玉倩 吕雨霏 张兆强 胡皎月 刘祖国
1南华大学附属第二医院眼科,衡阳 421000;2厦门大学附属厦门眼科中心 福建省眼科与视觉科学重点实验室 福建省眼再生医学工程研究中心 厦门大学眼科研究所 厦门大学医学院,厦门 361102;3南华大学附属第一医院眼科,衡阳 421000
睑板腺是位于上眼睑和下眼睑的一种特殊皮脂腺,在睑板中呈上下垂直排列[1]。睑板腺通过分泌特定的脂质来维持眼表泪膜的稳态,脂质的主要功能是润滑眼表以防止眼表水分挥发,并保护眼表免受外来病原体的威胁[2-4]。睑板腺功能障碍(meibomian gland dysfunction,MGD)以慢性炎症反应为中心环节,是一种以睑板腺终末导管萎缩和/或睑酯分泌的量或质发生异常为主要特征的慢性、弥漫性睑板腺病变,可导致泪膜稳定性改变,产生眼表炎症和刺激症状[5],是导致干眼的主要原因。MGD的全球患病率为3.5%~70.0%[6],目前其治疗方式主要分为物理治疗、药物治疗和手术[7],但既往方法普遍存在治疗成本高、操作难度较大、治疗周期长、效果较差、对患者伤害较大、不能完全满足患者的需求等问题。有研究表明,复方野菊花眼贴在干眼治疗中获得了较好的临床效果[8],其是否对干眼主要致病因素之一的MGD也具有防治作用尚不清楚。本研究拟观察复方野菊花眼贴对蓝光引起的睑板腺功能异常的防治作用,探讨复方野菊花眼贴改善睑板腺功能异常的效果及可能的机制,为未来开发预防和治疗MGD相关药物提供理论支持。
1 材料与方法
1.1 材料
1.1.1实验动物及分组 15周龄成年雄性SPF级C57BL/6J小鼠64只,购自上海SLAC实验动物中心[许可证号:SYXK(闽)∶2018-0009]。本研究严格遵循视觉与眼科研究协会(ARVO)关于动物用于眼科和视觉研究的声明,并经厦门大学动物伦理委员会批准(批文号:XMULAC20220258)。小鼠可自由饮食和饮水,在(25±1)℃、相对湿度(60±10)%和交替12 h明暗循环(8:00~20:00)的标准无病原体环境中饲养。预防实验和治疗实验中各32只小鼠分别按随机数字表法随机分为正常组、蓝光组、溶剂组和眼贴组,每组8只。
1.1.2主要试剂及仪器 兔抗小鼠核因子(nuclear factor,NF)-κB抗体(4764S)、兔抗小鼠磷酸化NF-κB(phosphorylation of NF-κB,p-NF-κB)抗体(3039S)(美国Cell Signaling Technology公司);山羊抗兔二抗(ab6721)、兔抗小鼠β-actin抗体(ab227387)(美国Abcam公司);苏木精-伊红染色试剂盒(C0105S-2)(上海碧云天生物技术有限公司);改良油红O染色液(BL987A)(安徽Biosharp公司)。SLM-7E型裂隙灯显微镜(山东康华科技有限公司);CX23光学显微镜(日本Olympus公司);M165FC正置荧光显微镜、CM1850冰冻切片机、EG1160石蜡切片机(德国Leica公司);ZK-10-VISU-150手术显微镜(德国蔡司公司)。
1.2 方法
1.2.1眼贴的制备 通过全封闭动态回流多功能提取罐控温萃取甄选的多味中药材,确保提取的无污染、高浓度和充分性;过滤、静置沉淀后将上清液经60~70 ℃真空浓缩、16 300 r/min离心30 min并用超速离心管分离上清,形成提取浓缩液;将提取浓缩液置于冷库中静置沉淀,制剂后进行灌装,最终制成眼贴。
1.2.2实验动物的分组处理
1.2.2.1睑板腺功能异常动物模型 将小鼠按照随机数字表法分成正常组32只和蓝光组32只。正常组和蓝光组各32只小鼠再分别按照随机数字表法随机分为0 d组、7 d组、15 d组和30 d组,每组8只。正常组和蓝光组均置于标准无病原体环境中饲养,蓝光组组小鼠采用波长460 nm、光照度2 000 lx的蓝光,每天暴露6 h,分别在蓝光暴露0、7、15和30 d时进行睑板腺开口拍照、离体睑板腺拍照,观察小鼠睑板腺组织学变化。
1.2.2.2预防实验部分 正常组小鼠置于标准环境下饲养,其余各组在标准环境的基础上进行蓝光暴露(波长为460 nm,光照度为2 000 lx),每天6 h(8:00~14:00),连续暴露15 d建立小鼠睑板腺功能异常模型;溶剂组和眼贴组在蓝光暴露的15 d中每天进行2次相对应的眼贴敷贴预防治疗(7:00、15:00),每次25 min。在第15天对各组小鼠行睑板腺开口拍照,观察小鼠睑板腺功能情况,并采用颈椎脱臼法处死小鼠,取小鼠睑板腺进行睑板腺拍照、油红O染色、苏木精-伊红染色、实时荧光定量PCR和Western blot实验。
1.2.2.3治疗实验部分 正常组小鼠置于标准环境下饲养,其余各组在标准环境的基础上进行蓝光暴露(波长为460 nm,光照度为2 000 lx),每天6 h(8:00~14:00),持续15 d。蓝光组在蓝光暴露结束后不作任何处理,溶剂组和眼贴组在蓝光暴露结束后,每天进行2次相对应的双眼眼贴敷贴治疗(7:00、15:00),每次25 min,持续15 d。在第15天对各组行睑板腺开口拍照,观察小鼠眼表及睑板腺功能,并采用颈椎脱臼法处死小鼠,取小鼠睑板腺进行睑板腺拍照、油红O染色、苏木精-伊红染色、实时荧光定量PCR和Western blot实验。
1.2.3小鼠睑板腺形态检查
1.2.3.1睑板腺开口拍照 操作者用右手将小鼠固定好,左手调整裂隙灯显微镜,保持灯光与小鼠垂直,尽可能保证小鼠睑缘不反光;另一操作者将裂隙灯显微镜焦距调好同时确定拍摄倍数,至屏幕显示出清晰图像即可。
1.2.3.2离体睑板腺拍照 采用颈椎脱臼法处死各组小鼠,迅速取下小鼠上下眼睑,去除多余组织后充分暴露小鼠睑板腺,置于正置显微下观察并拍照。采用ImageJ软件(美国National Institute of Health公司)计算睑板腺剩余面积。睑板腺相对剩余面积=睑板腺剩余面积/睑板腺面积。
1.2.4小鼠睑板腺组织病理学检查
1.2.4.1苏木精-伊红染色观察小鼠睑板腺结构和炎性细胞浸润情况 各组任意选取3块睑板腺组织,用2块载玻片将组织轻轻压平并摊开,用4%多聚甲醛固定组织30 min,待睑板腺初步固定后,将睑板腺轻轻转移至装有1 ml 4%多聚甲醛的EP管中固定24 h,用双蒸水冲洗掉多余多聚甲醛,常温下梯度乙醇脱水(70%、80%、95%、100%、100%、100%乙醇各2 min),后用二甲苯进一步脱水(二甲苯Ⅰ、Ⅱ、Ⅲ各2 min)以及二甲苯透明后浸蜡包埋。采用Leica EG1160石蜡切片机切片,切片方向为垂直于睑板腺腺体方向,切片厚度为5 μm,每个组织制备5个睑板腺组织切片,苏木精-伊红染色,光学显微镜下选取睑板腺中央5个腺体组织,观察睑板腺腺体结构改变以及腺体间细胞增生情况并拍照。采用ImageJ软件进行组织间炎性细胞计数。
1.2.4.2油红O染色观察各组小鼠睑板腺脂质沉积情况 各组任意选取3块睑板腺组织,用专用吸水纸吸干多余水分,同时用2把显微镊轻轻夹住组织边缘并将睑板腺尽可能展开,另一人再次用吸水纸吸干多余水分,再平整地将其置于装有OCT溶液的包埋盒中,待睑板腺组织中气泡完全排出后,用镊子夹取包埋盒缓慢放入液氮中固定。使用冰冻切片机于平行睑板腺腺体方向行5 μm厚切片,每块组织制备5个睑板腺组织切片。进行油红O染色,光学显微镜下选取睑板腺中央5块腺体组织观察睑板腺腺体中脂质堆积情况并拍照。采用ImageJ软件统计睑板腺组织中脂质沉积情况。
1.2.5实时荧光定量PCR法检测各组睑板腺组织中白细胞介素1β、白细胞介素6、肿瘤坏死因子α、γ干扰素 mRNA表达 实验结束后将小鼠全部安乐死,采用随机数字表法随机选取6只小鼠,将小鼠睑板腺取出后置于含1 ml Trizol的EP管中,采用Trizol法提取组织RNA,按照说明书逆转录成cDNA。引物由上海生工生物工程有限公司合成,其引物名称及序列分别为β-actin正向引物:5'-AGATCAAGATCATTGCTCC TCCT-3',反向引物:5'-ACGCAGCTCAGTAACAGTCC-3';白细胞介素1β(interleukin-1β,IL-1β)正向引物:5'-GCACTACAGGCTCCGAGATGAA-3',反向引物:5'-GTCGTTGCTTGGTTCTCCTTGT-3';IL-6正向引物:5'-CTTGGGACTGATGCTGGTGACA-3',反向引物:5'-GCCTCCGACTTGTGAAGTGGTA-3';肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)正向引物:5'-ACAGC AAGGGACTAGCCAGGAG-3',反向引物:5'-AGTGCCTC TTCTGCCAGTTCCA-3';γ干扰素(interferon-γ,INF-γ)正向引物:5'-CTTCAGCAACAGCAAGGCGAAA-3',反向引物:5'-CCGAATCAGCAGCGACTCCT-3'。进行实时荧光定量PCR反应,PCR反应条件:95 ℃预变性10 min;95 ℃变性10 s,60 ℃退火和延伸30 s,进行40个循环。以β-actin为内参,采用2-ΔΔCt法计算各目的基因相对表达量。
1.2.6Western blot法检测睑板腺组织中NF-κB和p-NF-κB蛋白表达 采用随机数字表法随机选取3只小鼠左眼睑板腺,置于含有0.1 ml RIPA的EP管中,研磨组织收集蛋白,进行SDS-PAGE电泳并转膜至醋酸纤维素膜中,2% BSA封闭1 h;分别加入NF-κB一抗(1∶1 000)、p-NF-κB一抗(1∶1 000)4 ℃孵育过夜,1倍TBST漂洗3次,每次5~10 min,加入羊抗兔IgG二抗(1∶500)孵育1 h,1倍TBST漂洗3次,每次5~10 min,使用Western BrightTMECL和Western BrightTMPeroxide按照1∶1配制显影液,使用BIO-RAD显影仪显影。以β-actin为内参,采用ImageJ软件分别计算内参和目蛋白条带灰度值。目的蛋白相对表达量=目的蛋白条带灰度值/内参条带灰度值。
1.3 统计学方法
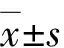
2 结果
2.1 正常组与蓝光组小鼠眼睑板腺形态变化
2.1.1正常组与蓝光组小鼠睑板腺开口阻塞数量比较 裂隙灯显微镜拍照显示,蓝光暴露前(0 d),正常组和蓝光组小鼠睑缘规整、光滑、无阻塞现象;7 d时,正常组和蓝光组小鼠睑缘规整、光滑,少见睑板腺开口阻塞;15 d时,蓝光组小鼠出现睑板腺开口阻塞和睑缘光滑程度下降,正常组睑缘无明显变化;30 d时,蓝光组小鼠睑板腺开口明显阻塞,睑缘光滑程度明显下降,正常组睑缘无明显改变(图1A)。正常组和蓝光组不同时间点小鼠睑板腺开口阻塞数量总体比较差异均有统计学意义(F分组=75.92,P<0.001;F时间=40.32,P<0.001),其中蓝光暴露后15、30 d蓝光组睑板腺开口阻塞数量明显多于正常组,差异均有统计学意义(均P<0.05)(表1)。由于本实验重点关注早期睑板腺功能异常,与暴露15 d相比,蓝光暴露30 d睑板腺功能损伤过重,故选用蓝光暴露15 d所诱导的睑板腺功能异常进行后续研究。

图1 正常组与蓝光组不同时间点小鼠睑缘及睑板腺形态变化比较 A:裂隙灯显微镜下拍照 0 d时,正常组和蓝光组睑板腺开口通畅,睑缘光滑;7 d时,蓝光组较正常组睑缘光滑程度降低,但未见明显睑板腺开口阻塞;15 d时,蓝光组较正常组睑板腺开口出现阻塞,睑缘光滑程度降低(箭头);30 d时,蓝光组较正常组睑板腺开口阻塞程度进一步加重,睑缘不规整(箭头) B:离体睑板腺拍照 0 d时,正常组和蓝光组小鼠睑板腺完整,排列整齐;7 d时,蓝光组较正常组睑板腺基本完整,未见明显缺失;15 d时,蓝光组较正常组睑板腺形态出现异常,下睑腺体部分缺失(箭头);30 d时,蓝光组较正常组睑板腺损伤明显,下睑腺体基本缺失(箭头)Figure 1 Comparison of morphological changes in mice eyelid margins and meibomian glands at different time points between normal group and blue light group A:Slit lamp microscopy images On day 0,the mice meibomian gland opening was normal and the eyelid margin was smooth in the two groups.On the 7th day,the eyelid margin was less smooth in the blue light group compared to normal group,but no significant obstruction of the opening was seen.On the 15th day,the openings were blocked in the blue light group compared to the normal group,with a decrease in the smoothness of the eyelid margin (arrows).On the 30th day,obstruction of the opening was severer in the blue light group compared to the normal group,and the eyelid margins were irregular (arrows) B:Photographs of meibomian gland in vitro On day 0,the mice meibomian gland was intact and neatly arranged in the two groups.On the 7th day,the mice meibomian gland in the blue light group was generally intact without significant loss compared to normal group.On the 15th day,the mice meibomian gland in the blue light group was abnormal, showing partial absence of the lower meibomian gland (arrows) compared with normal group.On the 30th day,the mice meibomian gland damage was more obvious with whole absence of lower meibomian glands (arrows) in the blue light group than in the normal group
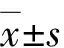
表1 各组小鼠蓝光暴露后不同时间点睑板腺开口阻塞数量比较(,个)Table 1 Comparison of the number of obstructed mice meibomian gland openingsat different time points after blue light exposure between two groups (,pcs)
2.1.2正常组与蓝光组小鼠睑板腺下睑剩余面积比较 离体睑板腺拍照显示,蓝光暴露前(0 d),正常组和蓝光组小鼠睑板腺完整,排列整齐;7 d时,蓝光组和正常组小鼠睑板腺基本完整,未见明显缺失;15 d时,蓝光组小鼠睑板腺形态出现异常并伴下睑腺体部分缺失,正常组睑板腺结构完整;30 d时,蓝光组小鼠睑板腺损伤明显,下睑腺体基本缺失,正常组睑板腺腺体形态完整(图1B)。正常组和蓝光组不同时间点小鼠睑板腺下睑相对剩余面积总体比较差异均有统计学意义(F分组=258.30,P<0.001;F时间=57.47,P<0.001),其中蓝光暴露后15、30 d蓝光组小鼠睑板腺下睑相对剩余面积明显小于正常组,差异均有统计学意义(均P<0.05)(表2)。
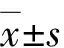
表2 各组小鼠蓝光暴露后不同时间点睑板腺下睑相对剩余面积比较()Table 2 Comparison of the relative remaining area of lower mice meibomian at different time points after blue light exposure between two groups ()
2.2 预防实验中各组小鼠睑板腺相关指标比较
裂隙灯显微镜照相显示,蓝光照射15 d时,正常组小鼠睑缘光滑,无睑板腺开口阻塞;蓝光组和溶剂组小鼠睑板腺开口阻塞明显,睑缘增厚,睑板腺受损;眼贴组小鼠睑缘形态接近正常,偶见睑板腺开口阻塞(图2)。各组睑板腺开口阻塞数量总体比较,差异有统计学意义(F=20.12,P<0.05),其中眼贴组睑板腺开口阻塞数量少于溶剂组,差异有统计学意义(P<0.05)(表3)。
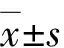
表3 预防实验各组小鼠睑板腺开口阻塞数量比较(,个)Table 3 Comparison of the number of blocked meibomian gland openings among different groups in the prevention test (,pcs)

图2 预防实验中15 d时各组小鼠睑板腺形态比较 裂隙灯显微镜下拍照可见,正常组小鼠睑板腺开口未见栓塞,睑缘光滑;蓝光组和溶剂组可见乳白色栓塞(箭头),睑缘不规则;眼贴组偶见睑板腺开口阻塞(箭头)(红框内为小鼠睑缘中央睑板腺开口所指)。离体睑板腺拍照可见,正常组小鼠睑板腺排列整齐,睑板腺完整;蓝光组和溶剂组睑板腺形态不规则,下睑板腺腺体缺失(箭头);眼贴组睑板腺腺体基本完整,未见明显缺失Figure 2 Changes in mice meibomian gland tissue in different groups on day 15 in the prevention test In slit lamp microscopy images,no significant obstruction of the openings was observed and the eyelid margin was smooth in normal group.In blue light and solvent groups,creamy obstructed openings (arrows) and irregular eyelid margins were seen.In eye pad group,few obstruction of the openings (arrows) were visible (Within the red frames were meibomian gland openings at the central mice eyelid margins).In photographs of meibomian gland in vitro,well-aligned and intact meibomian glands were seen.In blue light and solvent groups,irregular meibomian gland and absence of lower meibomian glands (arrows) were observed in normal group.In eye pad group,meibomian glands were intact and not missing
离体睑板腺拍照显示,蓝光照射15 d时,正常组小鼠睑板腺腺体结构完整;蓝光组和溶剂组睑板腺受损,睑腺体部分缺失;眼贴组睑板腺腺体结构基本完整,未观察到明显缺失(图2)。各组睑板腺下睑相对剩余面积总体比较,差异有统计学意义(F=31.24,P<0.05),其中眼贴组睑板腺下睑相对剩余面积明显大于溶剂组,差异有统计学意义(P<0.05)(表4)。
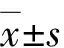
表4 预防实验各组小鼠睑板腺下睑相对剩余面积比较()Table 4 Comparison of the relative remaining area of lower mice meibomian gland among different groups in the prevention test ()
2.3 预防实验中各组小鼠睑板腺组织病理学表现
苏木精-伊红染色结果显示,正常组睑板腺腺体完整,结构清晰,细胞排列紧密,腺体间无炎性细胞浸润;蓝光组睑板腺腺体排列紊乱,腺体形态异常,呈现腺体萎缩的趋势,间充质细胞过度增加,腺体间出现炎性细胞浸润;溶剂组睑板腺腺体形态基本完整,睑板腺腺体间充质细胞过度增生,伴有炎性细胞浸润;眼贴组睑板腺腺体基本完整,形态规则,组织增生和炎性细胞浸润程度较溶剂组降低,呈现好转趋势。油红O染色结果显示,正常组、蓝光组、溶剂组、眼贴组睑板腺腺体、导管内无大量脂质沉积,形态结构正常(图3)。

图3 预防实验中15 d时各组小鼠睑板腺组织病理学表现 苏木精-伊红染色可见,正常组睑板腺腺体形态完整,细胞排列紧密,边界清晰,腺体间无组织增生和炎性细胞浸润;蓝光组腺体排列异常,边界不清,腺体间出现组织增生和炎性细胞浸润(箭头);溶剂组腺体形态基本正常,睑板腺腺体间组织增生并伴有炎性细胞浸润(箭头);眼贴组睑板腺腺体间组织增生减少,炎性细胞浸润程度降低(×200,标尺=50 μm)。油红O染色可见,正常组、蓝光组、溶剂组和眼贴组睑板腺腺体及导管内均无明显脂质沉积(×100,标尺=50 μm)Figure 3 Histopathological manifestations of mice meibomian gland in different groups on day 15 in the prevention test By hematoxylin-eosin staining,intact meibomian gland in morphology with tightly arranged cells and clear borders were observed in normal group,and no tissue hyperplasia or inflammatory cell infiltration was seen between glands.In the blue light group,abnormally arranged meibomian glands with unclear borders,tissue hyperplasia and inflammatory cell infiltration between glands (arrows).In the solvent group,basically normal gland with inter-gland tissue hyperplasia and inflammatory cell infiltration (arrows) were seen.Reduced inter-gland tissue hyperplasia and inflammatory cell infiltration were seen in the eye pad group (×200,scale bar=50 μm).By oil red O staining,no significant lipid deposition was seen in the meibomian glands and ducts in the four groups (×100,scale bar=50 μm)
2.4 预防实验中各组小鼠睑板腺组织中炎性因子相对表达量比较
正常组、蓝光组、溶剂组和眼贴组IL-1β、IL-6、TNF-α、IFN-γ mRNA相对表达量总体比较,差异均有统计学意义(F=50.56、26.97、66.81、23.71,均P<0.001),其中眼贴组IL-1β、IL-6、TNF-α、IFN-γ mRNA相对表达量较蓝光组和溶剂组明显降低,差异均有统计学意义(均P<0.05)(表5)。
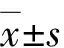
表5 预防实验各组小鼠睑板腺组织中IL-1β、IL-6、TNF-α、IFN-γ mRNA相对表达量比较()Table 5 Comparison of relative expressions of IL-1β,IL-6,TNF-α and IFN-γ mRNA in mice meibomian gland tissue among different groups in the prevention test ()
2.5 预防实验中各组小鼠睑板腺组织中NF-κB和p-NF-κB蛋白相对表达量比较
Western blot检测结果显示,蓝光组睑板腺组织中NF-κB和p-NF-κB蛋白灰度强于正常组,眼贴组NF-κB和p-NF-κB蛋白灰度弱于溶剂组(图4)。正常组、蓝光组、溶剂组和眼贴组睑板腺组织中NF-κB和p-NF-κB蛋白相对表达量总体比较,差异均有统计学意义(F=37.85、57.64,均P<0.001),其中眼贴组NF-κB和p-NF-κB蛋白相对表达量明显低于溶剂组,差异均有统计学意义(均P<0.05)(表6)。
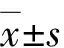
表6 预防实验各组小鼠睑板腺组织中NF-κB和p-NF-κB蛋白相对表达量比较()Table 6 Comparison of the relative expression of NF-κB and p-NF-κB proteins in mice meibomian gland tissue among different groups in the prevention test ()

图4 预防实验各组睑板腺组织中NF-κB和p-NF-κB蛋白表达电泳图 蓝光组NF-κB和p-NF-κB蛋白灰度强于正常组,眼贴组NF-κB和p-NF-κB蛋白灰度弱于溶剂组 1:正常组;2:蓝光组;3:溶剂组;4:眼贴组 NF-κB:核因子κB;p-NF-κB:磷酸化核因子κB;β-actin:β-肌动蛋白Figure 4 Electrophoretogram of NF-κB and p-NF-κB protein expression in mice meibomian gland tissue in different groups in the prevention test Grayscale intensities of NF-κB and p-NF-κB proteins were stronger in the blue light group than in the normal group,weaker in the eye pad group than in the solvent group 1:normal group;2:blue light group;3:solvent group;4:eye pad group NF-κB:nuclear factor-κB;p-NF-κB:phosphorylation of nuclear factor-κB
2.6 治疗实验各组小鼠睑板腺相关指标比较
裂隙灯显微镜照相显示,蓝光照射15 d时,正常组小鼠睑缘光滑,无睑板腺开口阻塞;蓝光组、溶剂组和眼贴组小鼠睑板腺开口阻塞明显,睑缘增厚,睑板腺受损(图5)。各组睑板腺开口阻塞数量总体比较,差异有统计学意义(F=28.34,P<0.05),其中蓝光组和眼贴组睑板腺开口阻塞数量明显多于正常组,差异均有统计学意义(均P<0.05)(表7)。
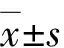
表7 治疗实验各组小鼠睑板腺开口阻塞数量比较(,个)
离体睑板腺拍照显示,蓝光照射15 d时,正常组小鼠睑板腺腺体结构完整,蓝光组、溶剂组和眼贴组睑板腺受损,下睑腺体部分缺失(图5)。各组睑板腺下睑相对剩余面积总体比较,差异有统计学意义(F=31.27,P<0.05),其中蓝光组和眼贴组睑板腺下睑相对剩余面积明显小于正常组,差异均有统计学意义(均P<0.05)(表8)。
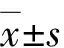
表8 治疗实验各组小鼠睑板腺下睑相对剩余面积比较()
2.7 治疗实验各组小鼠睑板腺组织病理学表现
苏木精-伊红染色结果显示,正常组睑板腺腺体完整,结构清晰,细胞排列紧密,腺体间无炎性细胞浸润;蓝光组睑板腺腺体排列紊乱,腺体形态异常,分界不清,间充质细胞过度增加,腺体间出现炎性细胞浸润;溶剂组睑板腺腺体形态基本完整,睑板腺腺体间充质细胞过度增生,伴有炎性细胞浸润;眼贴组睑板腺腺体基本完整,形态规则,组织增生和炎性细胞浸润较溶剂组减轻。油红O染色结果显示,正常组、蓝光组、溶剂组和眼贴组睑板腺腺体及导管内均无大量脂质沉积,形态结构正常(图6)。

图6 治疗实验15 d时各组小鼠睑板腺组织病理学表现 苏木精-伊红染色结果显示,正常组睑板腺腺体形态完整,细胞排列紧密,边界清晰,腺体间无组织增生和炎性细胞浸润;蓝光组和溶剂组均表现为腺体排列紊乱(箭头),边界不清,腺体形态异常,腺体间组织增生明显并出现炎性细胞浸润;眼贴组睑板腺腺体结构基本完整,形态规则,腺体间组织增生减少,炎性细胞浸润程度较溶剂组减轻(×200,标尺=50 μm)。油红O染色结果显示,正常组、蓝光组、溶剂组和眼贴组睑板腺腺体及导管内均无明显脂质沉积,形态结构正常(×100,标尺=50 μm)Figure 6 Histopathological manifestations of mice meibomian gland in different groups on day 15 in the treatment test By hematoxylin-eosin staining,intact meibomian gland in morphology with tightly arranged cells and clear borders were observed in normal group,and no tissue hyperplasia or inflammatory cell infiltration was seen between glands.In blue light and solvent groups,disordered meibomian glands (arrows) with unclear borders and abnormal morphology,obvious tissue hyperplasia and inflammatory cell infiltration between glands.Meibomian glands with intact structure,regular morphology,reduced inter-gland tissue hyperplasia and inflammatory cell infiltration than solvent group were seen in eye pad group (×200,scale bar=50 μm).By oil red O staining,regular morphology and structure without significant lipid deposition was seen in the meibomian glands and ducts in four groups (×100,scale bar=50 μm)
2.8 治疗实验各组小鼠睑板腺组织中炎性因子相对表达量比较
实时荧光定量PCR检测结果显示,正常组、蓝光组、溶剂组和眼贴组睑板腺组织中IL-1β、IL-6、TNF-α、IFN-γ mRNA相对表达量总体比较,差异均有统计学意义(F=45.04、35.68、39.94、30.13,均P<0.001),其中眼贴组IL-1β、IL-6和IFN-γ mRNA相对表达量明显低于蓝光组和溶剂组,差异均有统计学意义(均P<0.05);眼贴组TNF-α mRNA相对表达量与蓝光组和溶剂组比较,差异均无统计学意义(均P>0.05)(表9)。
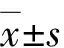
表9 治疗实验各组小鼠睑板腺组织中IL-1β、IL-6、TNF-α、IFN-γ mRNA相对表达量比较()Table 9 Comparison of relative expressions of IL-1β,IL-6,TNF-α and IFN-γ mRNA in mice meibomian gland tissue among different groups in the treatment test ()
2.9 治疗实验各组小鼠睑板腺组织中NF-κB和p-NF-κB蛋白表达量比较
Western blot检测结果显示,蓝光组睑板腺组织中NF-κB和p-NF-κB蛋白灰度强于正常组,眼贴组NF-κB和p-NF-κB蛋白灰度弱于溶剂组(图7)。正常组、蓝光组、溶剂组和眼贴组睑板腺组织中NF-κB和p-NF-κB蛋白相对表达量总体比较,差异均有统计学意义(F=43.13,P<0.001;F=21.31,P=0.004),其中眼贴组NF-κB和p-NF-κB蛋白相对表达量明显低于蓝光组和溶剂组,差异均有统计学意义(均P<0.05)(表10)。
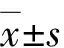
表10 治疗实验各组小鼠睑板腺组织中NF-κB和p-NF-κB蛋白相对表达量比较()Table 10 Comparison of the relative expression of NF-κB and p-NF-κB proteins in mice meibomian gland tissue among different groups in the treatment test ()
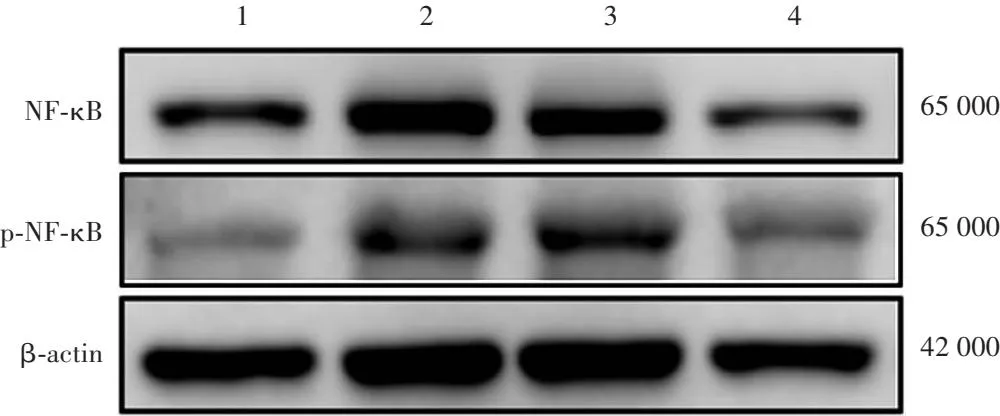
图7 治疗实验各组睑板腺组织中NF-κB和p-NF-κB蛋白表达电泳图 Western blot检测结果显示,蓝光组NF-κB和p-NF-κB蛋白灰度强于正常组,眼贴组NF-κB和p-NF-κB蛋白灰度弱于溶剂组 1:正常组;2:蓝光组;3:溶剂组;4:眼贴组 NF-κB:核因子κB;p-NF-κB:磷酸化核因子κB;β-actin:β-肌动蛋白Figure 7 Electrophoretogram of NF-κB and p-NF-κB protein expressions in mice meibomian gland tissue in different groups in the treatment test Western blot analysis showed that grayscale intensities of NF-κB and p-NF-κB proteins were stronger in blue light group than in normal group.Grayscale intensities of NF-κB and p-NF-κB proteins were weaker in eye pad group than in solvent group 1:normal group;2:blue light group;3:solvent group;4:eye pad group NF-κB:nuclear factor-κB;p-NF-κB:phosphorylation of nuclear factor-κB
3 讨论
MGD是眼科常见病,以老年患者居多[6]。目前MGD的发病机制尚不完全明确,但有不少研究证实慢性炎症在MGD中起着中心环节的作用[9-10]。产生慢性炎症的诱因包括眼部因素、年龄、免疫系统疾病、用药因素和环境因素等。慢性炎症导致睑板腺功能异常,睑板腺开口阻塞。睑板腺开口阻塞是MGD出现的标志之一,往往同时伴随睑板腺脂质堆积、睑板腺腺体萎缩、睑缘鳞状上皮化生等一系列病理改变。因此,如何有效控制慢性炎症反应是预防和治疗MGD的关键。
目前,MGD的主要治疗方法包括热敷、睑缘清洁、局部用药和全身用药等。近年来,中药眼贴等中药制剂也被逐渐用于MGD的辅助治疗,并取得良好的疗效[7,11-12],但其作用机制仍不明确。有研究表明,中医疗法对于慢性炎症性疾病的治疗有其独特优势,在中国古代医学著作,如《伤寒杂病论》《金匮要略》《温病条辩》《眼科龙目论》等中均有记载野菊花、丹参、黄柏等药材有降低体内燥热、虚火等功能。目前大量的研究也表明,野菊花、丹参、黄柏、黄连、薄荷的提取物具有较强的抗炎作用[13-15];丹参酮ⅡA已被证明可通过抑制TLR4/NF-κB信号通路和Nrf2信号通路,减少炎性因子的表达[13,16-17];黄柏和薄荷是常用的祛火抗炎药物[18];黄连可抑制环氧合酶2(cyclooxygenase-2,COX-2)和COX-5的生成,从而起到抗炎作用[14,19]。
复方野菊花眼贴是在传统眼贴中加入野菊花、丹参、黄柏、黄连、薄荷等祛火抗炎中药,其主要成分为野菊花和丹参,是按照现代工艺所制成的一种新型中药眼贴。复方野菊花眼贴在减轻眼部慢性炎症中已有不少应用,且疗效较好[8]。目前,野菊花类眼贴对MGD治疗效果尚不清楚,且既往研究多集中在当MGD较为严重时进行治疗。因此,本研究通过预防实验和治疗实验探讨复方野菊花眼贴对MGD的影响及其作用机制。
本研究中采用高能短波蓝光致小鼠睑板腺功能异常模型。已有研究表明,蓝光暴露所产生的慢性损失可导致眼部慢性炎症的产生,从而导致结膜炎、视网膜病变、白内障、神经退行性相关病变等[20-23]。雄性12~15周龄C57BL/6J小鼠在光照度为2 000 lx、波长460 nm的蓝光作用下,每天暴露6 h,15 d后即可出现睑板腺开口阻塞,睑酯呈混浊黏稠牙膏状,下睑睑板腺发生萎缩,与临床诊断要求相符,证明睑板腺功能异常模型造模成功。在前期实验中发现,随着在蓝光中暴露时间的延长,小鼠睑板腺的萎缩基本上都是从睑板腺下睑开始,可能与小鼠睑板腺形态有关,即小鼠睑板腺下睑普遍小于上睑,其睑板腺导管及睑板腺开口普遍更小,更容易发生阻塞,进而引起小鼠睑板腺腺体萎缩。
在预防实验中,眼贴组小鼠睑板腺开口阻塞程度和睑板腺下睑剩余面积指标优于溶剂组;而在治疗实验中,眼贴组的小鼠睑板腺开口阻塞程度和睑板腺下睑剩余面积指标较溶剂组基本无变化,提示复方野菊花眼贴在睑板腺功能异常早期对小鼠睑板腺有一定的保护作用。在预防实验和治疗实验中,睑板腺油红O染色发现,蓝光组、溶剂组、眼贴组中均无大量脂质沉积,可能是睑板腺开口阻塞后引起睑板腺腺泡中大量脂质的堆积需要一定时间,同时也证明了本实验所用模型为轻度睑板腺功能异常模型。本研究中苏木精-伊红染色结果可见,预防实验和治疗实验的眼贴组睑板腺腺体完整,结构清晰,细胞排列紧密,腺体间无炎性细胞浸润,表明复方野菊花眼贴能够有效减轻睑板腺组织的炎症损伤。本研究中实时荧光定量PCR结果显示,在预防实验中眼贴组的IL-1β、IL-6、IFN-γ和TNF-α mRNA相对表达量较溶剂组均有所降低;在治疗实验中,眼贴组的IL-1β、IL-6、IFN-γ mRNA相对表达量较溶剂组均明显降低,TNF-α相对表达量有降低趋势,但差异无统计学意义,可能是由于治疗时间偏短,炎症的消退还需一段时间。有研究表明,MGD是由于NF-κB信号通路的激活[3],导致慢性炎症的发生。NF-κB信号通路的激活会引起IL-1β、IL-6、TNF-α、IFN-γ等炎性因子表达升高,同时也有研究表明TNF-α的升高会激活NF-κB信号通路[3,24]。本研究结果显示,预防实验和治疗实验中眼贴组NF-κB和p-NF-κB相对表达量均低于溶剂组,说明复方野菊花眼贴能够改善睑板腺功能,可能与抑制了NF-κB信号通路有关。然而,究竟是眼贴中哪种具体有效成分发挥了作用仍需进一步研究。
综上所述,本研究通过预防实验和治疗实验观察了复方野菊花眼贴对早期MGD的作用效果,结果发现其可通过抑制NF-κB信号通路,降低睑板腺组织中IL-1β、IL-6、TNF-α、IFN-γ等炎性因子的表达,保护睑板腺组织,改善睑板腺功能。本研究结果为MGD的药物干预研究提供了新的思路。
利益冲突所有作者均声明不存在利益冲突
作者贡献声明李勇:参与研究设计、研究实施、收集数据、分析/解释数据、起草文章、论文修改;黄彩虹、李清坚、王玉倩:实施研究、收集数据、分析/解释数据;吕雨霏、张兆强、胡皎月:参与研究选题、分析/解释数据、起草文章;刘祖国:参与研究设计、论文内容修改和审核、最终定稿

