Shwachman-Diamond 综合征7 例患儿临床特点和基因变异分析
王瑞芳 梁黎黎 张开创 杨 奕 孙宇宁 孙曼青 肖 冰 韩连书 张惠文 顾学范 余永国 邱文娟
上海交通大学医学院附属新华医院 上海市儿科医学研究所 儿内分泌遗传代谢科(上海 200092)
Shwachman‐Diamond 综合征(Shwachman‐Diamond syndrome,SDS,OMIM 260400)是一种罕见的遗传性骨髓衰竭综合征,于1964 年被首次描述[1‐2],其估计发病率为1/76000[3],男女患病率约为1.7∶1[4]。SDS 的临床特征主要为以胰腺外分泌功能不全、骨髓功能障碍和骨骼异常为表现的三联征,此外其还有多种临床表现,包括身材矮小、发育落后、肝脏损害、青春期延迟和牙齿异常等[5]。目前已知SDS的致病基因包括SBDS、EFL1、DNAJC 21或SRP 54,约90%的SDS 由SBDS基因变异所致,该基因编码在核糖体生物合成中起核心作用的蛋白SBDS[6]。另外在核糖体生物发生和蛋白质翻译中发挥作用的EFL 1、DNAJC 21和SRP 54基因的变异也被证实与SDS 发病相关[7]。
SDS是一种累及消化、血液、免疫、骨骼和中枢神经等多系统的疾病,该疾病的临床表型谱很广,在受累个体之间存在显著的表型异质性,为患儿的临床识别和诊断带来挑战。目前国内报道的病例以血液、消化和免疫系统的临床表现多见,但SDS 患儿身材矮小的表现也为其常见的特征,本研究回顾性分析2018—2023年在本院儿内分泌遗传科诊治的7例SDS 患儿的临床资料及其外显子组测序(exome sequencing,ES)结果,旨在探讨中国SDS患儿的临床特点和分子遗传学特征。
1 对象与方法
1.1 研究对象
选择上海交通大学医学院附属新华医院儿内分泌遗传科于2018年1月至2023年9月收治的7例SDS患儿为研究对象。
本研究通过了医院伦理委员会批准(No.XHEC‐D‐2023‐230),所有检查均获得患儿家长或监护人的知情同意。
1.2 方法
1.2.1 SDS诊断标准[3,8]①基因检测:检出SBDS双等位基因致病/可能致病性变异,或其他SDS 相关基因(SBDS、EFL1、DNAJC21或SRP54)的致病/可能致病性变异;②临床表现:血液学特征(至少出现两次):a.中性粒细胞减少(中性粒细胞绝对计数<1.5×109/L);b.其他原因无法解释的贫血或巨红细胞症;c.血小板减少(血小板计数<150×109/L);d.骨髓检查结果异常(骨髓增生异常或白血病或细胞遗传学异常);胰腺特征:a.按年龄校正的胰腺酶类(如血清淀粉酶、血脂肪酶、血清胰蛋白酶原、粪便弹性蛋白酶等)水平降低;b.支持特征:胰腺影像学异常伴脂肪增多症,粪便脂肪排泄增加>72小时;其他支持性证据:a.存在骨骼异常;b.神经认知/行为问题;c.无法解释的身高低于第3百分位数;d.存在被确诊为SDS的一级家庭成员。
1.2.2 临床随访和检查 收集患儿的人口学资料、实验室和辅助检查资料,包括血常规、尿常规、粪便常规、肝肾功能、电解质、凝血功能、血淀粉酶、胰淀粉酶、血脂肪酶、25‐羟维生素D、血胰岛素样生长因子(IGF‐1)、生长激素激发试验;腹部B 超、头颅磁共振成像、双下肢长骨片、骨盆X线片等结果。
1.2.3 基因检测 抽取先证者及其父母静脉血样各3 mL,使用试剂盒(德国 Qiagen 公司)提取基因组 DNA,行家系或者先证者外显子组测序。用外显子组研究检测组套(exome research panel,IDT公司,美国)进行捕获,并用Illumina NovaSeq 6000测序仪(Illumina 公司,美国)对捕获片段进行高通量测序,按照GATK(V3)分析单核苷酸变异和小片段的插入缺失。过滤掉人群数据库中高频的变异(如1000 Genomes Project,Genome Aggregation Database和Exome Variant Server),并且在本地数据库中频率超过1%或超过5%的变异(包括大约6 000 个外显子)也被排除在外,随后通过遗传方式(显、隐性)进一步过滤变异数据。应用外显子组隐马尔科夫模型(eXome Hidden Markov Model,XHMM)在该样本中分析拷贝数变异。经过滤及筛选分析筛选出致病变异位点,按照人类基因组变异协会规则对变异进行命名,参照美国医学遗传学与基因组学学会(American college of medical genetics and genomics,ACMG)的变异解读指南对变异的致病性进行评级[9]。针对检出的阳性变异位点,采用Sanger 测序对先证者及其家庭成员进行验证并判断变异来源。
1.3 统计学分析
采用GraphPad Prism 8.0统计学软件进行数据分析。计量资料符合正态分布的以均数±标准差表示,非正态分布的以中位数M(P25~P75)表示。
2 结果
2.1 一般情况
7例患儿中男3例、女4例,初诊中位年龄为3.0(0.9~4.0)岁,均无家族史。6例患儿均因“身材矮小”首诊于儿内分泌遗传代谢科,余1例因“反复呼吸道感染伴肝功能异常”首诊于儿童感染科,后因存在身材矮小转诊至儿内分泌遗传代谢科,7例患儿的临床特征总结和基因检测结果见表1。
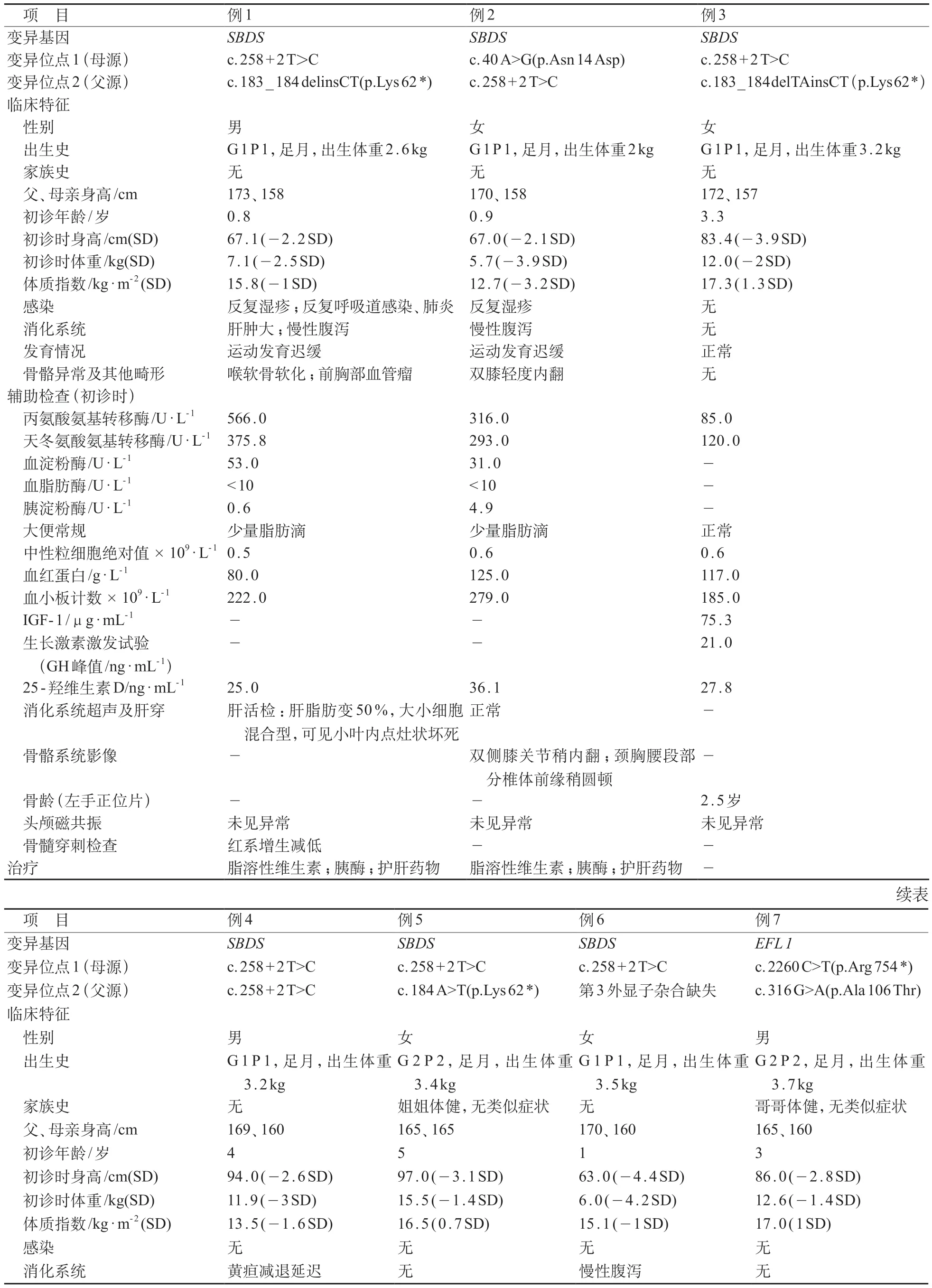
表1 SDS 7例患儿的临床表型和基因型特征总结
2.2 外显子组测序结果
7 例患儿行ES 检测发现6 例患儿携带SBDS双等位基因变异,1 例携带EFL 1双等位基因变异。6例SBDS变异的具体情况见表1(NM_016038.4),共检测出3 种已被报道的突变,包括1 种剪切突变c.258+2 T>C、1 种移码突变c.183_184 delinsCT(p.Lys62*)和1种无义突变c.184A>T(p.Lys62*),另检测到1 种新错义突变c.40 A>G(p.Asn 14 Asp)及第3 外显子的杂合缺失;根据ACMG 遗传变异分类标准与指南,位点c.40 A>G(p.Asn 14 Asp)判定为可能致病性变异。SBDS变异中,c.258+2T>C(7/12,58.3%)和c.183_184delinsCT/c.184A>T(3/12,25%)最常见。
余1例携带EFL1的复合杂合突变[NM_024580.6,c.2260C>T(p.Arg754*)/ c.316G>A(p.Ala106Thr)],其中c.316 G>A(p.Ala 106 Thr)为未报道的新错义突变。根据ACMG 遗传变异分类标准与指南,其为可能致病性变异。
2.3 SBDS缺陷6例患儿的临床表型
6 例携带SBDS变异患儿的临床表型见表1,6例患儿均以矮小(100%)就诊,其中3 例(例1、2、6)伴有慢性腹泻,1 例(例1)伴有反复呼吸道感染。6 例(100%)患儿均出现中性粒细胞减少,其中例1 和例6 伴有贫血。6 例(100%)均有肝酶升高,例1 因肝酶反复增高和肝肿大,行肝脏活检提示肝脂肪变性,可见小叶内点灶状坏死。6 例患儿均存在身材矮小(100%),初诊中位身高83.4 cm(-3.06 SD),例5 完善生长激素激发试验证实为生长激素缺乏症(GHD)。4 例患儿(例1、2、4、5)有骨骼发育异常,包括喉软骨软化、膝内翻、鸡胸、拇指多指畸形等。3 例患儿(例1、2、6)有胰腺外分泌功能不全表现,包括脂肪泻史、胰酶降低或影像学提示胰腺脂肪化等。予加用胰酶制剂、脂溶性维生素等治疗,目前大便次数减少,性状好转。随访肝酶升高的6 例患儿发现,末次随访时例1、2、4 肝酶水平较前下降,例3、5、6 随访肝酶基本正常。例5 确诊GHD 后开始使用生长激素治疗,随访数据缺失。
2.4 EFL1缺陷1例患儿的临床表型
1例携带EFL1变异的患儿临床表型见表1。例7以身材矮小(初诊身高86cm,-2.84SD),走路姿势异常就诊,体检发现双膝外翻、左腿明显弯曲及扁平足,影像检查提示存在脊柱、骨盆、双下肢多发骨质异常,多发性骨骺(股骨/膝关节/踝关节/髋臼)发育不良。患儿无复发性感染、胰腺外分泌功能不全表现和脂肪泻的症状,无肝功能异常及血液系统受累表现。患儿存在矮小及血IGF‐1偏低,且经生长激素激发试验证实为GHD,并接受生长激素注射治疗,末次随访时生长激素治疗时长为15个月,身高提高8.6 cm(0.24SD)。
3 讨论
SDS是一种可累及全身多系统多器官的遗传性综合征,除外基因诊断,根据2011 年国外SDS 的共识,临床诊断主要基于中性粒细胞减少和胰腺外分泌功能不全的特征[8]。但既往报道的国外不同人群SDS临床表现具有广泛的多样性[11‐16],部分患儿以矮小、肝功能异常等其他症状为首发表现,而缺乏经典的胰腺外分泌功能不全和骨髓功能障碍的表现,导致临床容易漏诊。国内目前报道40 余例SDS 患者[17],多为个例报告,临床表型主要累及消化、免疫和血液等系统,其中携带SBDS基因变异的41 例SDS 患儿的中性粒细胞减少症、胰腺外分泌功能不全和骨骼异常比例分别为92.7%、65.8%和41.5%。本研究的7例患儿临床表型差异也较大,7例患儿均存在生长迟缓,其中性粒细胞减少症、外分泌胰腺功能不全和骨骼异常的比例分别为85.7%、42.9%和85.7%。与国内外的相关人群报道比较,中性粒细胞缺乏(59.9%~100%)和胰腺外分泌功能不全(63.6%~100%)在大多数人群中报道的比例相仿,均较高,但骨骼异常在各人群中的比例差异较大(8.8%~80.6%)[11‐16],并常伴有其他多个系统的合并症状。因此,加深对SDS 综合征多样性表型的认识非常关键,疾病早期缺少经典症状的患者也不能排除SDS的诊断,需完善基因检测进一步明确诊断。
SDS 是一种核糖体生物发生障碍性疾病,国外报道约90%的患者携带位于染色体7q11上的SBDS基因的双等位基因变异,该基因编码的同源SBDS蛋白被认为在核糖体生物合成和RNA 代谢中发挥重要作用[7]。约10%的SDS 患者未携带SBDS基因的致病变异,近年研究提示另外3 个与核糖体组装或蛋白质翻译相关的基因(EFL 1、DNAJC 21和SRP 54)也为SDS 综合征的候选基因[18‐20]。国外共报道了63例SDS患者携带此3个基因的变异,其中SRP54变异33例(52%)、DNAJC21变异 17例(27%)和EFL 1变异13 例(21%)[21]。而目前国内共报道了42 例明确基因变异的SDS 患者,其中41 例携带SBDS变异(97.6%),1例携带SRP54变异(2.4%),尚无DNAJC21和EFL1变异的报道[17]。本研究共7例基因确诊的SDS患儿也以SBDS变异为主,分别为SBDS变异6例(85.7%)和EFL1变异1例(14.3%)。
导致SDS 致病最常见的SBDS变异具有狭窄的基因型谱,占致病等位基因76%以上的3 种最常见突变位点为c.258+2 T>C、c.183_184 delinsCT 和(c.183_184delinsCT;258+2T>C)[11]。本研究7例SDS 患儿中6例携带SBDS基因的变异,其中5例携带复合杂合突变,1例携带纯合突变(c.258+2T>C),以热点突变c.258+2 T>C 和c.183_184 delinsCT/c.184A>T为主,分别占58.3%和25%。其中,例1、3、5 患儿均携带复合杂合突变,其中1 条等位基因上携带c.258+2 T>C 突变,另1 条等位基因上携带编码相同氨基酸改变的突变c.183_184delinsCT或c.184A>T,但临床表型有较大差异。例1表现有典型的中性粒细胞减少伴反复湿疹和呼吸道感染、胰腺外分泌功能障碍伴脂肪泻、肝酶明显升高和肝肿大、生长及发育落后,及喉软骨软化等骨骼畸形;例3和例5则以生长迟缓为主,伴中性粒细胞减少和轻度肝酶升高,无胰腺外分泌功能障碍,例5 伴发左拇指多指畸形,此2 例患儿缺乏经典的SDS 临床症状,经基因检测才确定该疾病的诊断。例2 携带剪接突变c.258+2 T>C 与1 个新错义突变c.40 A>G(p.Asn14Asp),临床表型为中性粒细胞减少伴反复湿疹,胰腺外分泌功能障碍伴脂肪泻,肝酶升高,生长及发育落后,及以双膝轻度内翻为表现的骨骼异常;而例4 携带c.258+2 T>C 纯合突变,表现为典型的中性粒细胞减少、黄疸减退延迟和肝酶升高、生长及发育落后,骨骼畸形有牙齿稀和鸡胸等。可见SBDS基因不同变异可引起不同的表型,相同的变异位点其并发的临床表型也呈现异质性,基因型和临床表型无明确的相关性,这更凸显了对临床表型全面评估和准确基因检测的重要性。
在余3 个SDS 相关的非SBDS基因中,EFL 1变异导致的SDS目前国外共报道了13例患儿[20,22‐24],国内尚无相关报道。该基因定位于15q25.2,编码三磷酸鸟苷酶(GTP酶)类延伸因子1(EFL1),为核糖体转位酶延长因子2(EF‐2)的同源物[6,21]。研究显示在核糖体60S亚基成熟的最后一步,SBDS与GTP酶EFL1合作催化核糖体抗结合因子(eIF 6)的释放并激活翻译,EFL1变异阻止了晚期细胞质60S亚基中eIF6的释放,进而损害核糖体亚基的连接并减弱整体的翻译,这为其可能的致病机制[22]。本研究例7携带EFL1的2种变异,其中无义突变(c.2260C>T/p.Arg 754*)位于结构域Ⅳ,其对于EFL 1 在体内的功能是必需的[25]。而另1 个错义突变(c.316 G>A/p.Ala 106 Thr)既往无报道,位于第Ⅰ结构域,该结构域含有参与鸟嘌呤核苷酸(GTP)结合和催化的特征性G 1~G 5 结构基序,这个变异毗邻G 3 基序,该结构域在GTP 酶从非活性状态(GDP)交替到活性状态(GTP)的功能循环期间经历大的构象变化,对GTP酶活性作用的发挥非常重要[26]。根据ACMG标准预测EFL 1的这个变异为致病性变异,且在多种物种间保持高度保守的氨基酸,故该变异可判定为损害EFL 1 功能的变异,且经家系连锁分析也符合遗传模式,该患儿的EFL 1基因型和其SDS 的临床表型符合。国外报道的13例EFL1变异的SDS患者中,中性粒细胞减少症、胰腺外分泌功能不全和骨骼发育异常的比例分别为100%、77%和92%[20,22‐24],而本研究报道的EFL 1变异主要表现为矮小和骨骼发育异常,无胰腺外分泌功能障碍及血液系统受累,与国外报道有较大不同。这提示EFL 1变异引起的SDS 表型也存在异质性,对于存在生长落后及骨骼发育异常的患儿,需警惕SDS的可能。
本研究7例SDS患儿中6例均因“身材矮小”首诊于儿内分泌遗传代谢科,余1例因“反复呼吸道感染伴肝功能异常”首诊于儿童感染科,后因存在身材矮小转诊至儿内分泌遗传代谢科。经评估内分泌系统相关表型除身材矮小外,4 例患儿(例4~7)有血IGF‐1水平偏低,其中2例(例5和例7)同时伴生长激素缺乏,未发现其他内分泌相关异常。血IGF‐1水平的降低可能与生长激素分泌不足、营养不良、慢性肝病等慢性消耗性疾病等因素相关[27]。例5和例7无慢性腹泻表现,肝功能为轻度异常到正常范围,故其血清IGF‐1水平的降低考虑主要由生长激素分泌不足引起,余2例患儿血IGF‐1水平偏低则可能受慢性腹泻和营养不良等因素影响,可在后续随访继续监测。既往相关研究评估了来自波兰的19例SDS患儿内分泌功能情况,13 例(63%)SDS 患儿表现出一种或多种内分泌疾病,其中7 例(37%)为生长激素缺乏(GHD),并对该7 例患儿进行了2 年的生长激素(rGH)治疗,证实rGH治疗可显著改善SDS患儿的身高标准差和生长速率,且未观察到明显的不良反应[28‐29]。因SDS 具有较高的向髓样肿瘤(骨髓增生异常综合征/急性髓系白血病)转化的风险(10%~30%)[21],故权衡rGH 治疗的个体化获益与风险非常重要。目前对SDS合并GHD患儿的生长激素治疗数据较少,本研究的2例SDS合并GHD患儿也进行了生长激素治疗,但目前治疗时间均较短,需要进一步研究来分析生长激素治疗SDS患儿的长期效果和安全性。
综上所述,SDS 是一种罕见的引起多系统受累的遗传综合征,其有经典的三联症表型,但临床症状变异性较大,部分患儿因临床表型不典型易造成漏诊或延迟诊治。本研究总结了7 例SDS 患儿的基因型和临床表型特点,其中1例EFL1变异患儿为在中国人群中首次报道,丰富了SDS 的疾病谱。对出现生长迟缓合并中性粒细胞减少、胰腺外分泌功能障碍、骨骼畸形等多种症状的患儿,应怀疑 SDS,完善基因检测以免漏诊。对基因确诊的患儿,应行多系统随访和多学科综合治疗,其中内分泌也为SDS常累及的系统之一,应全面评估内分泌功能情况,以期尽早干预,改善预后。

