苯乳酸与DNA相互作用及其抑菌机制研究
贾以泽,舒泉先,丛瑞涛,毛银,周胜虎*,邓禹*
1(江南大学 粮食发酵与食品生物制造国家工程研究中心,江苏 无锡,214122)2(江南大学 江苏省生物活性产品 加工工程研究中心,江苏 无锡,214122)3(山东渤海实业集团有限公司 山东省油脂油料精深 加工技术重点实验室,山东 滨州,256599)
苯乳酸(phenyllactic acid, PLA)又称3-苯基乳酸/β-苯基乳酸,分子式为C9H10O3,是一种天然有机酸,首次于蜂蜜中鉴别出来,后被发现广泛存在于奶酪、泡菜、酸面团等发酵食物中[1]。PLA主要是由乳酸菌合成,如植物乳杆菌[2]、鲁氏乳杆菌[3]、乳酸片球菌[4]和布氏乳杆菌[5]等。此外,一些非乳酸菌菌株也具有合成PLA的能力,如凝结芽孢杆菌[6]、丙酸杆菌[7]和白地霉[8]。在微生物合成PLA途径中,L-苯丙氨酸经脱氨被催化为苯丙酮酸,然后再经乳酸脱氢酶加氢还原,生成PLA[9]。PLA对包括细菌和真菌在内的许多微生物具有广泛的抑菌作用[10],是天然的高效、无毒害作用的生物防腐剂。与以山梨酸钾和苯甲酸钠为代表的传统化学防腐剂相比,PLA具有更安全、更高效的优势,是未来食品工业应用的趋势[11]。PLA由于其亲水性而具有良好的水溶性,使其能够在食物系统中进行均匀扩散[12],而且PLA在酸性和高温环境下性质依然不容易改变[13]。因此,PLA在食品和饲料工业中有广泛的应用。例如,PLA应用于乳制品行业抑制李斯特氏菌的生长,能够延长乳制品的保质期[14]。再者,PLA还可以抑制肠道沙门氏菌的生长,这是许多食源性细菌性疾病的主要病原体,也是许多动物性食品污染的原因,如鸡蛋、牛肉、家禽和猪肉[15]。正因PLA在抑菌方面出色的性能,其抑菌机理引起了学者们的极大关注。
作为一种有潜力的防腐剂和抗菌剂,研究人员已经从细胞和分子水平上研究了PLA的抗菌机理。到目前为止,已发现PLA通过与多种靶点相互作用来抑制有害微生物的生长,主要包括对细胞壁、细胞膜和核酸的破坏作用[16]。黄云坡等[17]通过扫描电子显微镜在微观结构上观察到经PLA胁迫后的单增李斯特菌细胞形态发生变形,且细胞表面出现孔洞,证实了PLA的作用靶点之一是细胞壁。ZHOU等[18]通过凝胶阻滞实验验证了PLA能够通过与DNA结合破环DNA的结构。本研究在此基础上,利用荧光光谱方法,结合分子对接技术,系统分析了PLA与DNA的相互作用模式,并确定了两者之间的相互作用力。此外,为了验证PLA在胞内与DNA结合带来的基因转录变化,通过转录组测序对比了乳酸片球菌DY15在PLA胁迫下基因表达差异,挖掘了PLA作用的相关靶基因,探讨了PLA通过与DNA作用引起基因调控变化的抑菌机制,为PLA作为抗菌剂在食品领域的应用提供了理论支撑。
1 材料与方法
1.1 材料与仪器
乳酸片球菌DY15于37 ℃、180 r/min条件下在MRS培养基中生长。培养基成分为20 g/L葡萄糖、8 g/L牛肉提取物、10 g/L胰蛋白胨、5 g/L CH3COONa、4 g/L酵母提取物、2 g/L柠檬酸三铵、2 g/L K2HPO4、0.58 g/L MgSO4·7H2O、0.19 g/L MnSO4·H2O和1 mL/L吐温80,pH 6.5。加入20 g/L的琼脂粉即为固体培养基。L-PLA,国药沃凯公司;小牛胸腺DNA(ctDNA),Sigma-Aldrich公司,纯度检测符合要求A260/A280>1.8,用Tris-HCl缓冲液(pH 7.4)配制ctDNA母液,根据260 nm处的吸光度测定其终浓度为2.5 mmol/L[ε260nm=6 600 L/(mol·cm)]。L-PLA于双蒸水中溶解,终浓度为1 mmol/L,于4 ℃保存。其他试剂均为分析纯。
F-7000荧光分光光度计,日本日立公司;UV-1800紫外分光光度计,日本岛津公司;迷你金属浴,上海生工生物工程有限公司;ZQZY-CF9.9振荡培养箱,上海知楚仪器有限公司;LightCycler 480 II荧光定量PCR仪,上海罗氏制药有限公司。
1.2 PLA与DNA相互作用的测定
1.2.1 荧光光谱的测定
在7份Tris-HCl缓冲液(pH 7.4)体系中,加入L-PLA母液和ctDNA母液,并定容至1 mL,使PLA终浓度为5×10-5mol/L,ctDNA终浓度分别为0、4×10-6、8×10-6、12×10-6、16×10-6、20×10-6、24×10-6mol/L,在298 K恒温水浴中充分混合10 min,得到PLA-ctDNA二元体系。使用荧光分光光度计对二元体系进行荧光光谱扫描,荧光光谱的激发波长为260 nm,发射波长范围为270~400 nm,狭缝宽度为5 nm,扫描速度为100 nm/min,石英电池的路径长度为1 cm。改变水浴锅温度条件分别为310 K和320 K,并重复上述实验,以获得不同温度下的荧光光谱。
1.2.2 KI猝灭实验
取ctDNA(2×10-5mol/L)和L-PLA(5×10-5mol/L)-ctDNA(2×10-5mol/L)溶液,分别加入KI溶液,使KI的终浓度分别为0、0.002、0.006、0.008、0.01 mol/L。充分混合5 min 后,使用1.2.1节中的方法在室温下进行光谱扫描。
1.2.3 DNA熔解曲线的测定
将ctDNA(2×10-5mol/L)和L-PLA(5×10-5mol/L)-ctDNA(2×10-5mol/L)溶液分别置于20~95 ℃的环境中,每5 ℃设为1个梯度。10 min后,快速取出溶液并于紫外分光光度计中测量DNA的吸光度A258nm。根据公式(1)计算。
(1)
式中:A0,20 ℃时的A258nm,Af,95 ℃下的A258nm,A,实时温度下的A258nm。通过计算不同温度下的fss值,得到fss关于温度的曲线,在fss=0.5时对应的温度即为DNA的Tm。
1.3 PLA与DNA的分子对接模拟
使用AutoDock 4进行分子对接模拟,在ZINC小分子化合物数据库中下载L-PLA的晶体结构文件(ZINC ID:388089)。在蛋白质数据库中为ctDNA选择了晶体结构d(CGATCG)2(PDB ID:1nab)。先使用AutoDock 4对二者进行预处理(去水、加氢和添加电荷)。分子对接位置的活性区域包含整个DNA分子,活性区域大小为40 Å×40 Å×160 Å,晶格步长为160 Å,采用拉马克遗传算法(Lamarckian genetic algorithm,LGA)全面搜索可能的构象和结合位点,结合能最低的结构被认为是最佳的相互作用模式。
1.4 转录组测序与实时荧光定量PCR验证
将过夜培养的乳酸片球菌DY15以2%的比例分别接种于10 mL MRS液体培养基和10 mL MRS(含2 g/LL-PLA)液体培养基中,培养8 h后,收集菌体送至苏州金唯智生物技术公司进行转录组测序与基因注释。进行实时荧光定量PCR实验时,取上述菌体,通过Ultrapure RNA试剂盒(康为世纪)提取总RNA。使用HiFiScript gDNA Removal cDNA Synthesis试剂盒(康为世纪)将总共500 ng的总RNA逆转录成cDNA。然后在LightCycler 480 Ⅱ qPCR仪上进行荧光定量PCR实验。选取16S rRNA基因作为内参,并进行3次生物学重复。所有数据均采用2-ΔΔCt方法进行分析。具体引物序列见电子版增强出版附表1(https://doi.org/10.13995/j.cnki.11-1802/ts.035182)。
2 结果与分析
2.1 荧光光谱法研究PLA与DNA的相互作用
2.1.1 ctDNA对PLA的荧光猝灭模型
图1显示了PLA随着ctDNA浓度的增加而产生的荧光发射光谱。PLA在260 nm处被激发后,在290 nm处有一个很强的荧光发射峰,随着DNA浓度的提高,PLA的荧光强度显著降低。结果表明,DNA能与PLA相互作用,猝灭PLA的特征荧光。
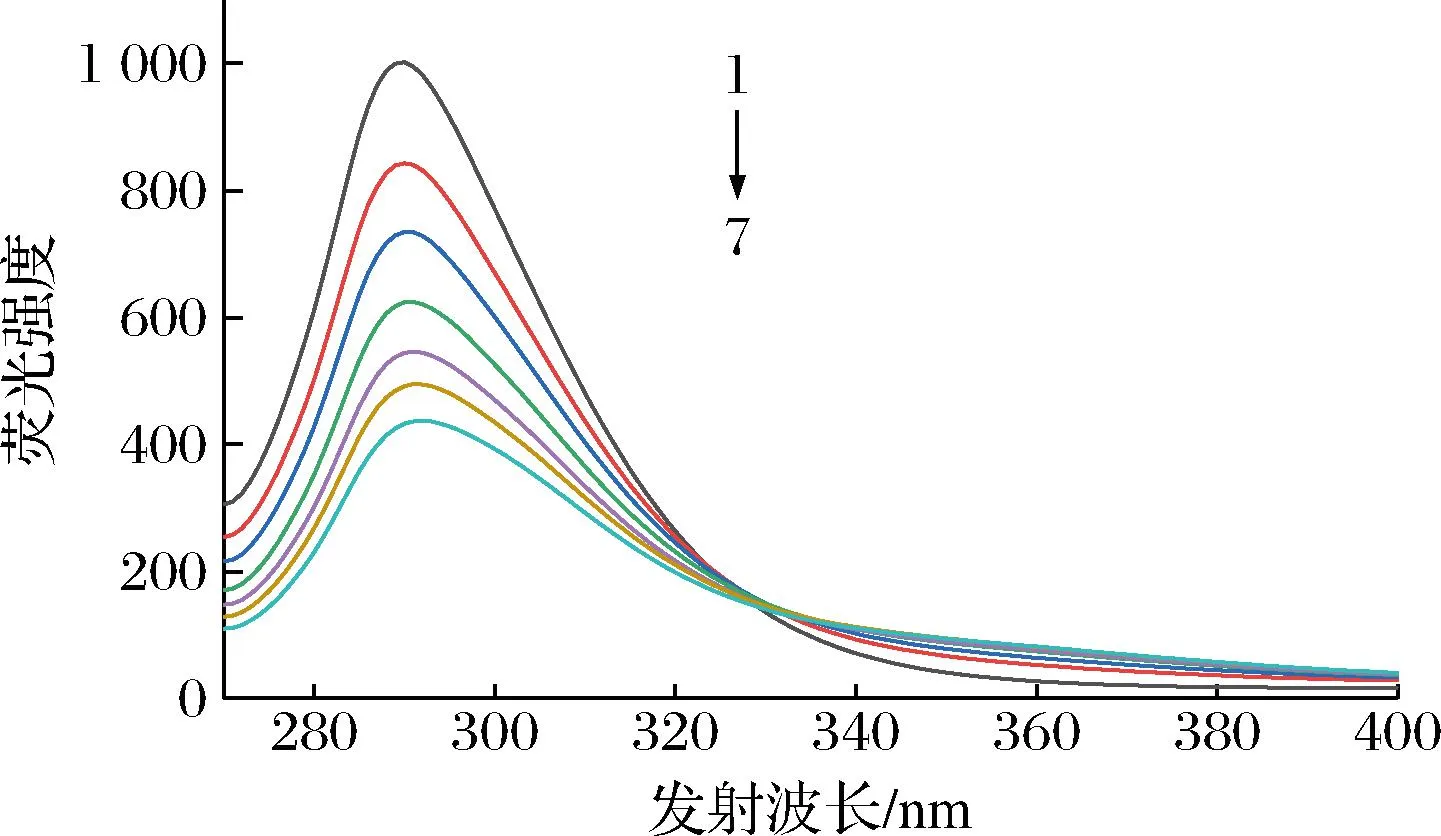
图1 添加ctDNA后PLA的荧光猝灭变化Fig.1 Changes in fluorescence quenching of PLA after the addition of ctDNA
为了研究DNA对PLA的荧光猝灭机理,用Stern-Volmer方程[19]F0/F=1+Kqτ0[DNA]=1+Ksv[DNA]进行数据处理。其中,F0和F为PLA在无猝灭剂和有猝灭剂(DNA)存在时的稳态荧光强度;Kq为生物分子的猝灭速率常数;τ0为没有猝灭剂的荧光团的平均寿命,它的值是10-8s;[DNA]为猝灭剂的浓度;Ksv为Stern-Volmer猝灭常数。
图2显示了Stern-Volmer方程拟合的F0/F与CctDNA的关系曲线。由该曲线的斜率可以得到PLA在ctDNA体系中的猝灭常数Kq和Ksv。数据表明,Ksv随着温度的升高而降低,这表明猝灭不是由碰撞引起的,而是由络合物的形成引起的。此外,如表1所示,猝灭速率常数Kq远大于2×1010L/(mol·s),这是各种猝灭剂与生物聚合物的最大散射碰撞猝灭常数。这些证据表明PLA-ctDNA的荧光猝灭机制是静态猝灭而不是动态猝灭。
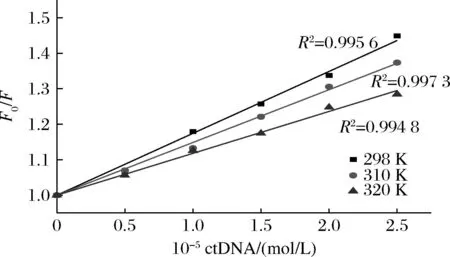
图2 不同温度下ctDNA对PLA荧光猝灭的 Stern-Volmer拟合直线Fig.2 Stern-Volmer plots for ctDNA quenching of PLA fluorescence at different temperatures
2.1.2 结合常数与结合位点数
根据Lineweaver-Burk对数方程lg[(F0-F)/F]=lgKa+nlg[DNA][20],确定了PLA与ctDNA的结合常数Ka与结合位点数n。
由线性拟合方程式的截距得Ka,斜率为n(图3),不同温度下的Ka与n的计算数值列于表1。在不同温度下,PLA和ctDNA的结合位点数均大于1,表明在ctDNA上至少有一个PLA结合部位。此外,结合位点数随着温度的升高而降低,Ka也随温度的升高而降低,与Ksv对温度的依赖关系一致。这表明,升高温度不利于PLA的结合。由于本文的实验温度远低于ctDNA的Tm值,ctDNA应始终保持双螺旋结构。因此,Ka随温度升高而降低的原因不是由于ctDNA的变性,而是PLA与ctDNA的结合过程是放热反应,温度升高,反应平衡左移,结合常数减小。T=298 K时,Ka值为8.57×104,而经典DNA嵌入剂溴化乙啶的结合常数Ka=1.4×106,证明PLA结合能力低于溴化乙啶。
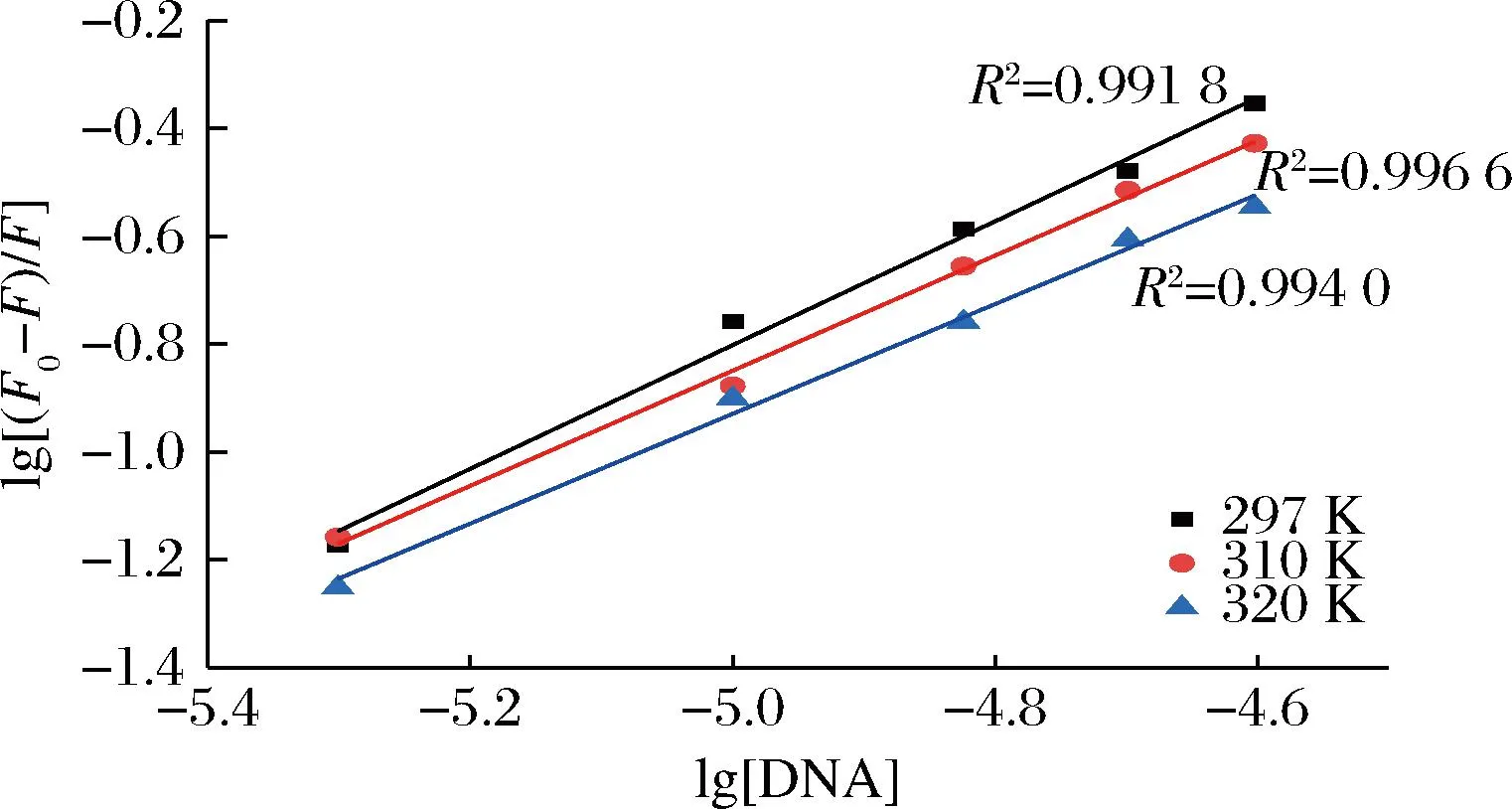
图3 不同温度下ctDNA对PLA荧光猝灭的 Lineweaver-Burk拟合直线Fig.3 Lineweaver-Burk plots for ctDNA quenching of PLA fluorescence at different temperatures
2.1.3 热力学参数与作用力的测定
配体-DNA相互作用的确切模式通常通过热力学表征来确定。从本质上讲,氢键、范德华力、静电力及疏水作用等作用力在DNA和配体之间的相互作用中发挥着主要作用。PLA与DNA结合反应的热力学参数可以确定主要的结合力与反应的自发性。根据从光谱方法获得的数据,使用公式(2)、公式(3)计算热力学参数(ΔH,ΔS, ΔG):
(2)
ΔG=ΔH-TΔS
(3)
表1总结了ΔH,ΔS和ΔG的值。ΔG<0表明结合过程是自发的。已知当ΔH≈0或ΔH<0且ΔS>0时,静电引力为主要作用力;当ΔH>0且ΔS>0时,疏水作用力发挥主要作用;当ΔH<0且ΔS<0 时,主要的作用力为范德华力和氢键作用[21]。结论表明ΔH<0和ΔS<0,这说明PLA与DNA的结合过程中既有氢键作用,也有范德华力。总之,通过荧光光谱实验对PLA-ctDNA之间相互作用研究发现PLA能够自发通过氢键作用力和范德华力结合到ctDNA上,且至少存在1个结合位点。
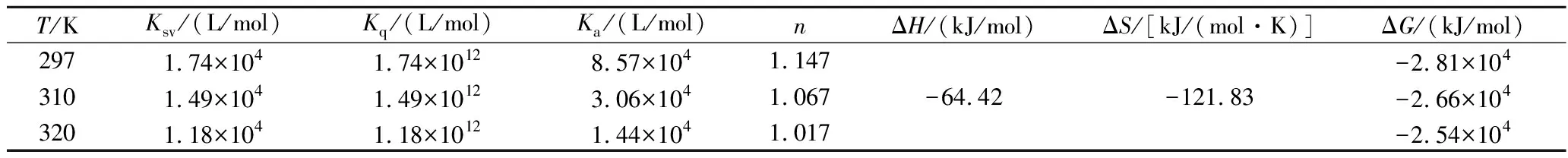
表1 PLA-DNA体系在不同温度下的猝灭常数和热力学参数。Table 1 Quenching constants and thermodynamic parameters for PLA-DNA system at different temperatures.
2.2 PLA与DNA结合方式的测定
DNA双螺旋结构中的大沟、小沟及磷酸骨架、碱基对等部位是配体小分子常见的识别位点。配体与DNA的非共价结合的作用模式主要有3种:静电结合(通过静电作用吸附到DNA外部的磷酸骨架)、沟槽结合(结合到DNA的大沟或小沟的碱基边缘)和插嵌结合(插入DNA内部的碱基对之间)。通过非共价结合往往能够导致许多生物效应,比如抑制DNA的正常复制与转录。
2.2.1 KI猝灭实验
KI是研究小分子与DNA结合方式的常用阴离子猝灭剂。它能有效地猝灭小分子的荧光,根据DNA存在和不存在时荧光的变化,可以推断DNA与小分子的相互作用模式。如果PLA在沟槽中与DNA结合,则结合DNA沟槽中的PLA的Ksv应大于游离PLA的Ksv。这是因为结合的PLA会被暴露在溶剂中,其荧光很容易被阴离子猝灭剂在沟槽中猝灭。相反,插入到DNA碱基对中的PLA的Ksv值应该低于自由小分子的Ksv,因为DNA的双螺旋可以保护结合的分子不受阴离子猝灭剂的影响。图4显示了KI在PLA和PLA-ctDNA体系中的猝灭行为。结果表明,两者的Ksv值分别为154、135 L/mol,说明ctDNA的双螺旋结构对PLA的猝灭起到了保护作用。因此,PLA与ctDNA的相互作用模式应为插嵌结合。
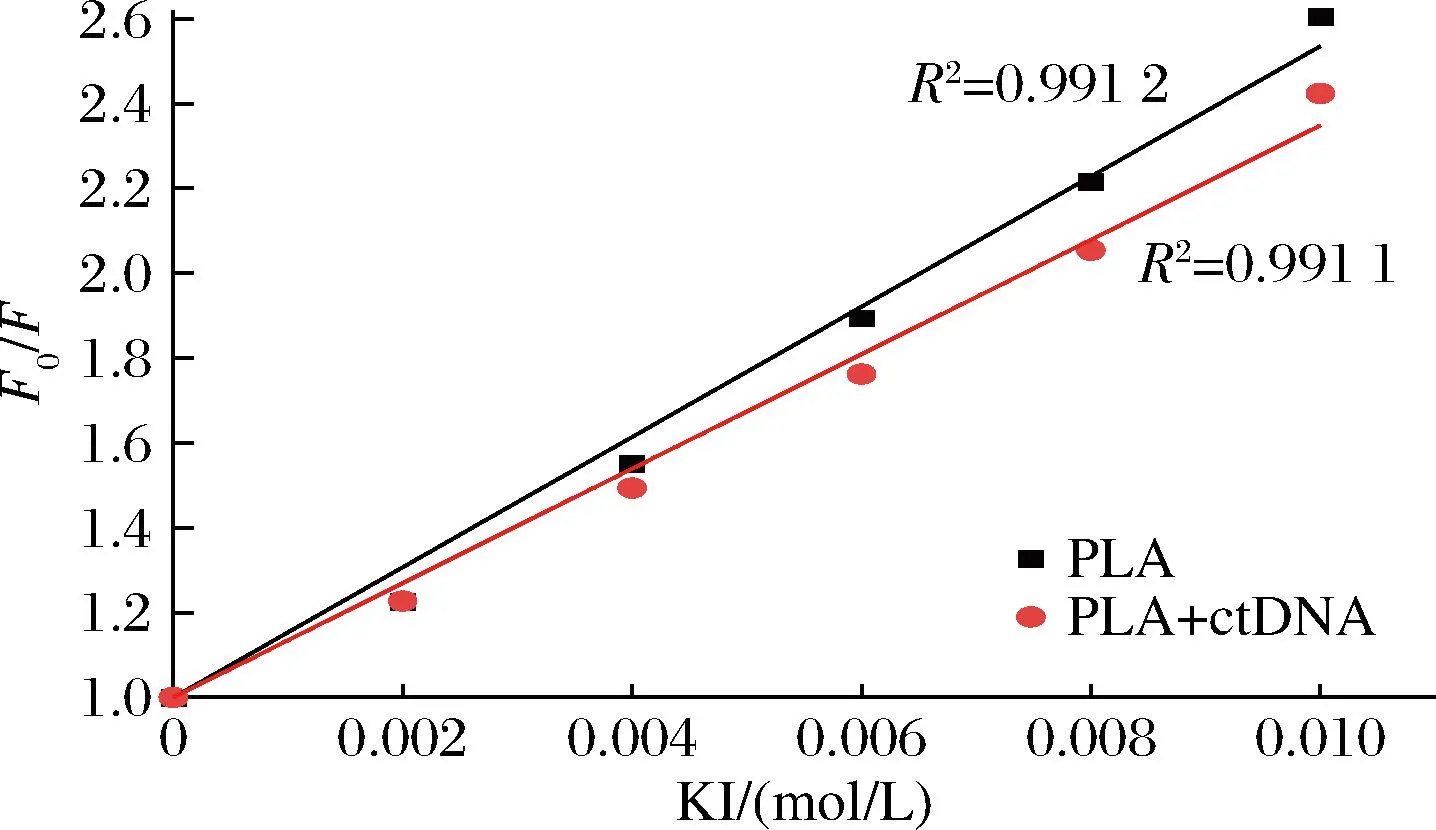
图4 在不存在和存在ctDNA的情况下,KI对PLA的 Stern-Volmer的拟合直线Fig.4 Stern-Volmer plots of PLA by KI in the absence and presence of ctDNA
2.2.2 PLA对ctDNA熔点的影响
配体小分子以插嵌方式与DNA结合可提高双螺旋结构的稳定性,使DNA的Tm值提高,但非插嵌结合对DNA熔点影响较小。通过绘制熔解曲线能够进一步确定PLA-ctDNA的相互作用模式,根据公式(4)计算不同温度下的fss值,得到fss关于温度的曲线,在fss=0.5时对应的温度即为DNA的Tm。
(4)
结果如图5所示,PLA与DNA结合时,Tm值约为80 ℃,相比于纯ctDNA体系的Tm值提高了约7 ℃,这说明PLA的嵌入增强了双螺旋结构的稳定性。通过上述两个实验验证,证实了PLA是以插嵌的方式与DNA结合。
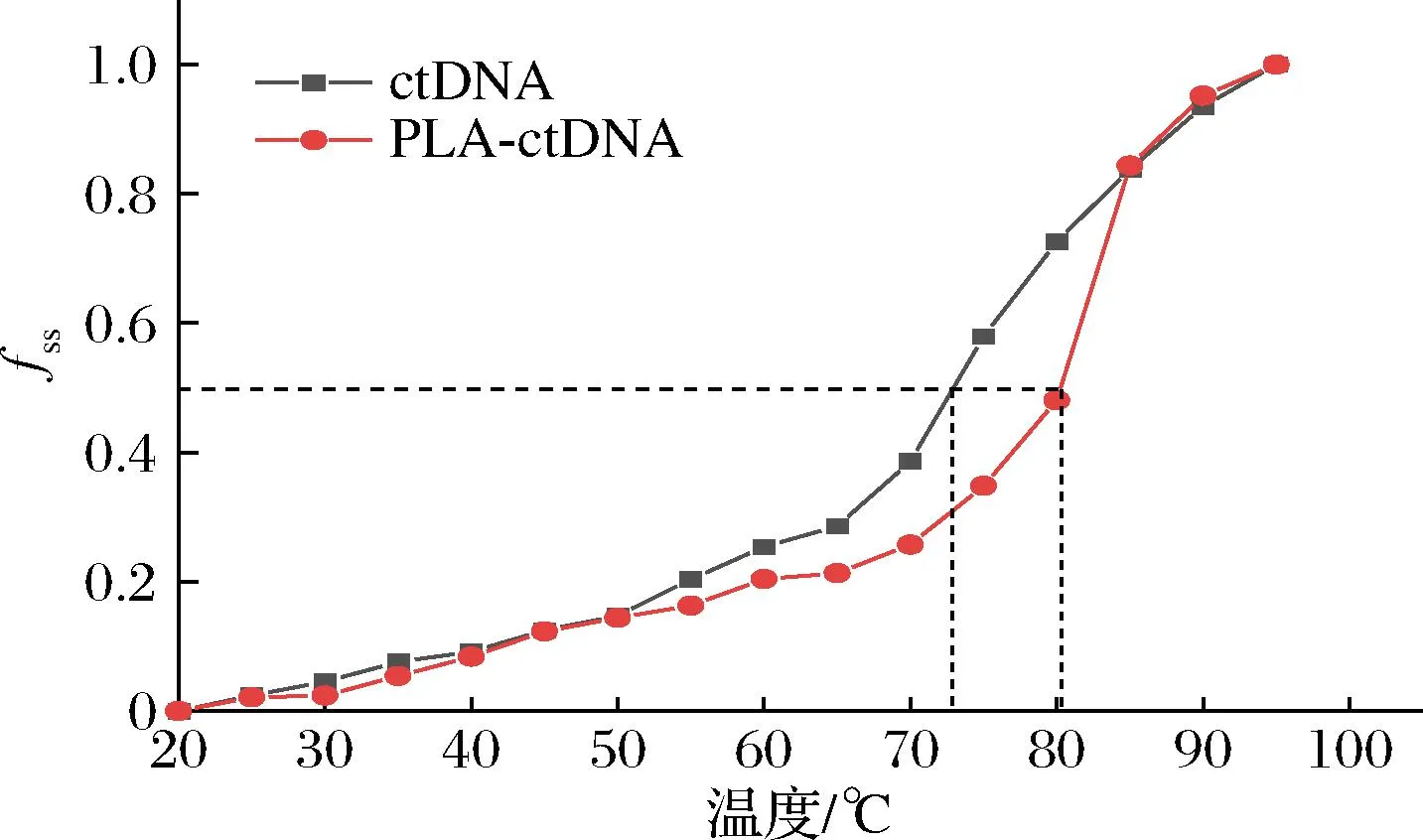
图5 在不存在和存在PLA的情况下,ctDNA的熔解曲线Fig.5 Melting curve of ctDNA in the absence and presence of PLA
2.3 分子对接模拟PLA与DNA相互作用
分子建模可以更好地理解配体和受体之间的相互作用。在这项研究中,使用AutoDock 4程序,验证PLA与选定的DNA片段的结合模式。由于蛋白质数据库(Protein Data Bank,PDB)中没有ctDNA的结构信息,而B型双链DNA的结构是其主要形式,因此选择d(CGATCG)2序列代替ctDNA。通过LGA遗传算法,在得到的50个对接模拟结果中,选择能量相对较低、结合次数最多的构象作为PLA与DNA结合的最佳构象。图6显示PLA与DNA相互作用模式的构象,PLA滑入碱基对CG之间,与CG碱基对之间的结合能为-20.40 kJ/mol。PLA脂肪链部分的羟基和羧基作为氢键受体(供体)与碱基和脱氧核糖形成氢键,结合距离分别为2.2、2.0、1.7 Å,苯环部分通过堆积作用嵌入碱基对之间,与周围的碱基形成大量π—π作用。分子对接的结果证实了上述光谱结果。因此,本研究为PLA与DNA之间的结合作用提供了进一步的证据,证明PLA与DNA之间的结合是通过插嵌结合发生的。
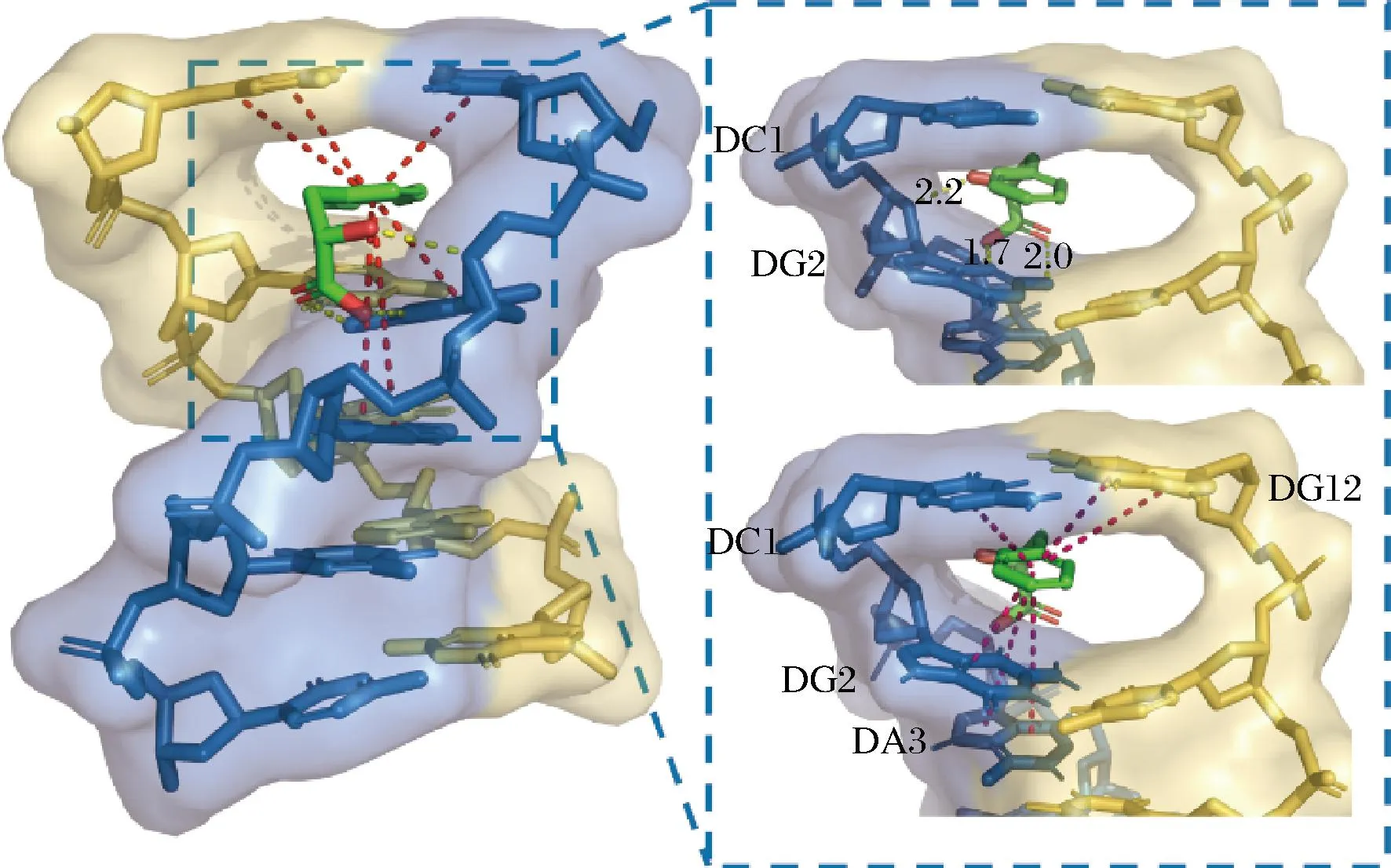
图6 PLA与B-DNA d(CGATCG)2的分子对接模型Fig.6 Molecular docking model of PLA with B-DNA of sequence d(CGATCG)2
此外,为了验证L-PLA对于插入不同碱基对的偏好性,选取不同的B-DNA链进行了分子对接模拟。电子版增强出版附图1(https://doi.org/10.13995/j.cnki.11-1802/ts.035182)中展示了PLA分子对于不同嵌入位点(CG, GA, TG)的模拟对接结果。氢键作用与π—π作用依然为主要作用力,当PLA嵌入CG碱基对之间时,苯环能够与碱基平面形成更多的π—π作用力,且氢键键长更短(2.2、2.0、 1.7 Å),说明有较强的氢键作用力。且当插入CG碱基对之间时,配体与受体之间拥有最低的结合能,种种证据表明,PLA更倾向于插入双链DNA的CG碱基对之间。
2.4 转录组学分析PLA与基因组DNA相互作用的影响
先前的实验证明了PLA能够通过插嵌的方式与DNA稳定结合,为了进一步解析PLA通过与DNA结合是如何影响细菌生长,通过转录组测序分析了PLA在与基因组DNA结合下对细菌转录的影响,解析细菌生长受到抑制的关键基因。以受2 g/LD-PLA胁迫(D组),受2 g/LL-PLA胁迫(L组)和未受胁迫(CG组)的乳酸片球菌DY15为样本,在MRS液体培养基中生长到对数中后期时(8 h),收集菌体进行转录组测序(NCBI登录号:PRJNA921976)。对PLA胁迫条件下与未受胁迫的乳酸片球菌DY15的RNA-seq结果进行分析,以log2(Fold Change)>2,Pval≤0.05作为筛选标准,筛选具有显著差异表达的基因。结果,经D-PLA胁迫生长后,共758个基因表达量发生显著变化,261个上调基因,497个下调基因。经L-PLA胁迫生长后,共630个基因表达量发生显著变化,194个上调基因,436个下调基因。
2.4.1 差异表达基因的GO注释分析
为进一步分析PLA胁迫条件下细胞损伤机理,对差异表达基因进行GO富集分析。结果如图7所示,差异表达基因可分为分子功能、细胞成分和生物过程3大类,又分别分为了11、2、12个亚类。细胞组分中涉及生物膜组分和质膜的差异表达基因占比最高,说明PLA作用靶点之一可能在生物膜上。涉及到核酸合成和复制的差异表达基因也较多,可以看出PLA进入细胞内能够破坏基因组的结构。以上结果可以看出两种PLA胁迫下,差异基因富集趋势基本一致,PLA主要影响的是涉及生物膜组分及核酸合成方面的基因。
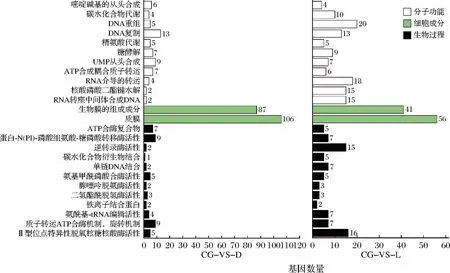
图7 差异表达基因的GO注释Fig.7 GO analysis of differentially expressed genes
2.4.2 差异表达基因的KEGG注释分析
为了进一步分析差异表达基因的生物学功能,对差异基因进行了KEGG注释。两种胁迫条件下差异表达基因分别富集到了73、70条代谢通路中,最后选取了28条富集最显著的代谢通路展示在图8中。分析发现,两种胁迫条件中均显著富集的代谢通路有20条,分别为错配修复、氧化磷酸化、氨酰-tRNA合成、核糖体和精氨酸代谢等,其中与核酸合成和修复相关的富集通路最多,侧面印证了PLA与DNA的结合是其攻击细菌的一种方式。
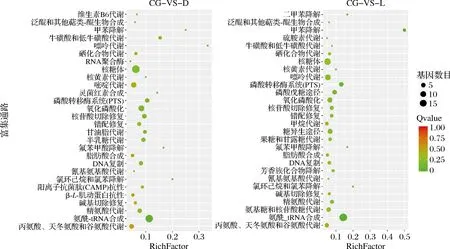
图8 差异表达基因的KEGG注释Fig.8 KEGG analysis of differentially expressed genes
2.4.3 对细胞壁合成和DNA修复关键基因的实时荧光定量PCR验证
通过对差异基因的GO与KEGG注释发现,较多差异基因与生物质膜合成及核酸损失修复相关,因此推测细胞壁与基因组是PLA主要作用靶点。当PLA破环细胞壁或基因组时,胞内的应激反应会使相关基因转录水平上调。选取与细胞壁肽聚糖合成途径中的一系列mur基因进行了实时荧光定量PCR验证,所选的6个基因在L-PLA胁迫下均发生不同程度的转录上调(图9-a)。此外,还分析了DNA损伤修复相关的基因,如:用于DNA损伤修复的DNA聚合酶Ⅳ基因dinB、重组修复基因radA、修复-转录偶联因子mfd、DNA糖基化酶基因mutM和切除修复蛋白基因uvrA,以上代表了细菌几种不同修复机制的基因转录水平也均发生了上调(图9-b)。总之,上述基因转录水平的应激上调间接证实了PLA的主要作用靶点是细胞壁与基因组。
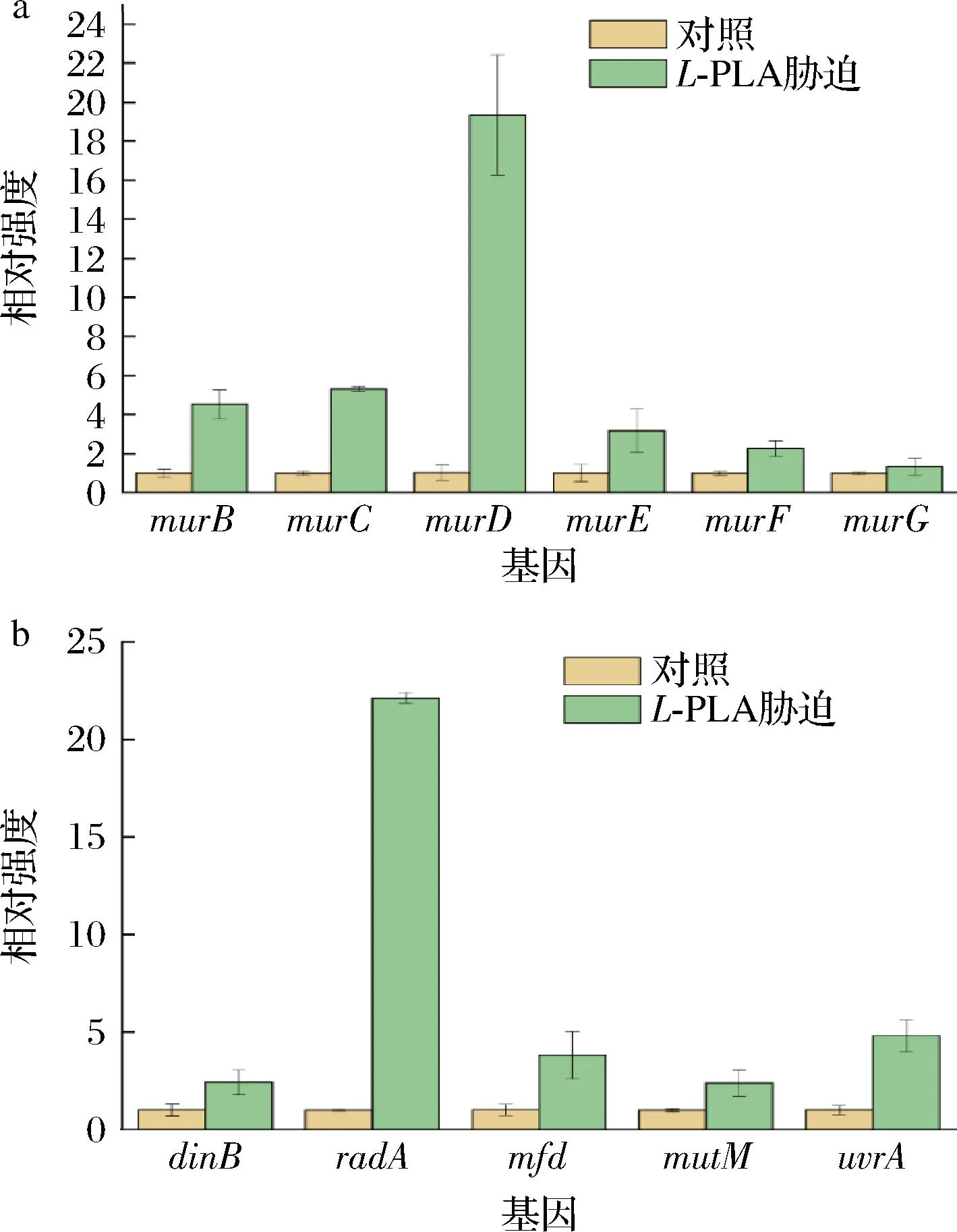
a-实时荧光定量PCR测定受L-PLA胁迫后细胞壁合成 关键基因表达变化;b-实时荧光定量PCR测定受L-PLA 胁迫后DNA损伤修复相关基因表达变化
2.4.4 对精氨酸代谢途径中差异基因的实时荧光定量PCR验证
乳酸菌在生长发酵时会不断产生乳酸,从而降低生长环境中的pH,而乳酸菌之所以能够在酸性环境下生存下来,与其自身的酸胁迫应答机制相关。乳酸菌中常见的耐酸应答机制有质子泵理论、谷氨酸脱羧体系、碱性氨基酸代谢、蛋白修复以及DNA损伤修复机制等[22](图10-a)。
通过对乳酸片球菌DY15的转录组数据分析发现,乳酸片球菌DY15中不存在谷氨酸脱羧酶,在受到PLA胁迫时,与质子泵、蛋白修复和DNA损伤修复相关的基因普遍受到上调,而精氨酸代谢途径受到了极大抑制。在精氨酸代谢途径中,精氨酸经3种酶催化生成2分子NH3从而起到降低pH的作用。通过实时荧光定量PCR对该途径的4个关键蛋白进行基因表达量测定(图10-b),证实经L-PLA胁迫该途径的基因会受到抑制,说明该PLA可能是通过抑制该途径来降低细菌酸耐受性,从而实现抑菌效果。
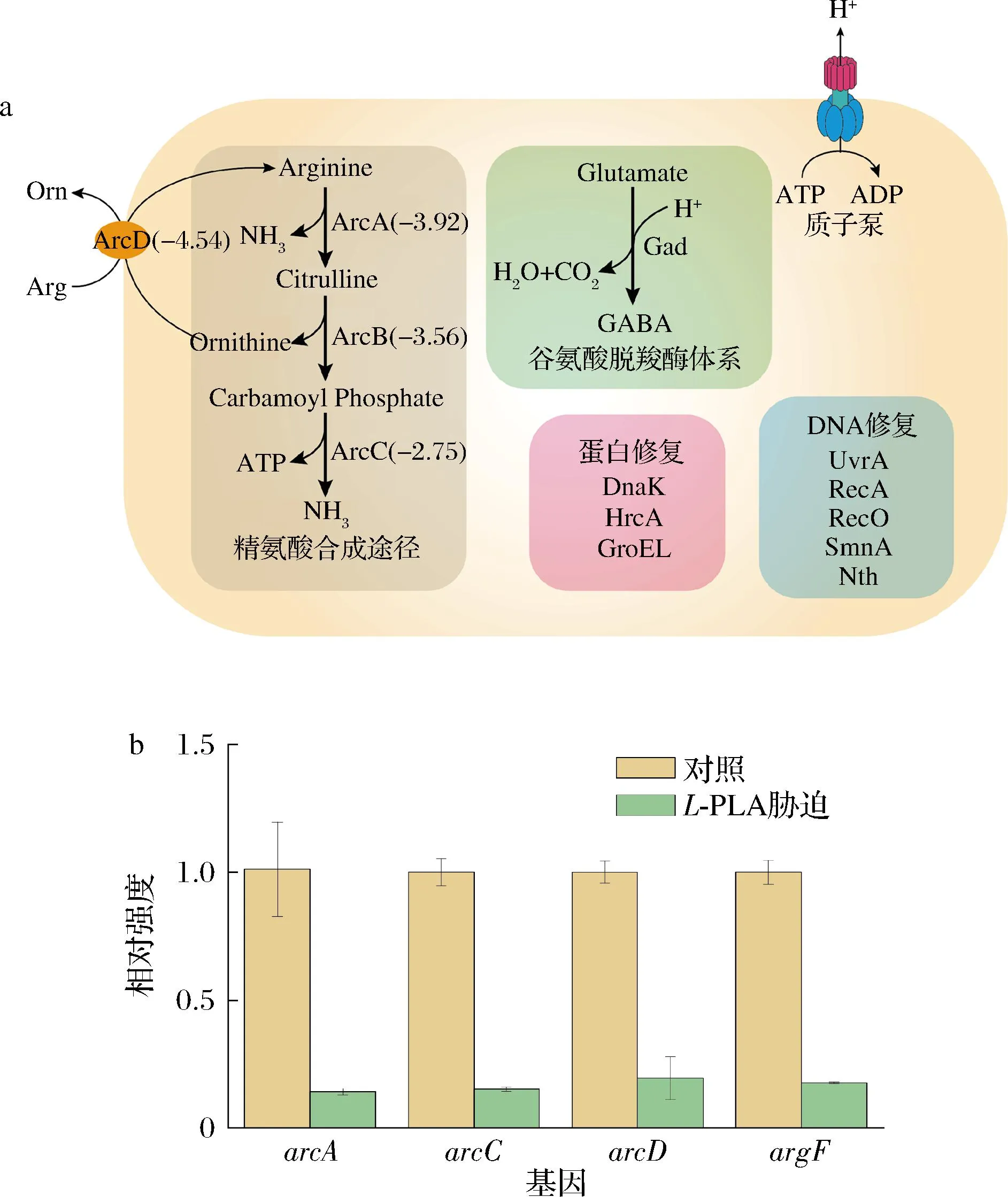
a-乳酸乳球菌DY15的耐酸应答机制,红色代表基因上调,蓝色代 表基因下调,括号里为下调倍数;b-实时荧光定量PCR测定受 L-PLA胁迫后精氨酸代谢途径中关键基因表达变化
3 结论与讨论
PLA作为天然抑菌物质,在食品工业、动物饲料方面有着巨大的应用前景。早前关于PLA研究主要集中于对不同微生物的表观抑制效果,如最小抑菌浓度、与其他有机酸的协同抑菌作用[23]等,以及其破坏生物膜的机理研究。本研究集中于研究PLA与DNA的相互作用以及在PLA对于细菌基因表达的影响。通过荧光光谱实验确定了PLA与模式DNA相互作用方式,并通过分子对接模拟获得了PLA-DNA结合模型,说明PLA能够通过插入DNA进而可能会影响复制和转录。进而通过转录组学分析了PLA与DNA结合可能造成转录变化,发现PLA主要影响细胞壁合成、核酸的复制与修复相关的基因,侧面证实了PLA的攻击靶点是细胞壁和基因组的可能性。同时PLA通过抑制精氨酸代谢途径的关键基因表达从而降低了细菌酸耐受性,进而通过生长环境的酸性来抑制细菌生长,这也与PLA和有机酸的协同抑菌能够达到更好效果的结论相印证。综上,本研究对PLA抑菌机理做出了补充,为PLA的应用提供了理论基础。

