新疆白喉乌头中4种生物碱的分离鉴定及含量测定
曹星星,古丽达力·赛里克,赵翡翠
(1.新疆医科大学第四临床医学院,新疆 乌鲁木齐 830000;2.新疆医科大学附属中医医院,新疆 乌鲁木齐 830000;3.新疆维吾尔自治区中药炮制研究重点实验室,新疆 乌鲁木齐 830000;4.新疆维吾尔自治区名老中医药专家传承工作室,新疆 乌鲁木齐 830000)
白喉乌头为毛茛科乌头属植物白喉乌头(AconitumleucostomumWorosch)的干燥根,主要分布在新疆、甘肃西北部以及东北地区[1]。《哈萨克医志》记载,白喉乌头味辛、苦、热,有大毒,具有祛风散寒、消肿止痛、通经活络等功效,在治疗风湿类疾病方面具有独特疗效[2]。白喉乌头化学成分中生物碱含量最高,其中高乌甲素约占总生物碱的40%[3]。高乌甲素的氢溴酸盐是临床常用的非成瘾性镇痛药[4],因此,白喉乌头可作为生产高乌甲素的新植物原料[5]。白喉乌头含有乌头属植物常见的双酯型生物碱,其可能是白喉乌头的药效成分和毒性成分[6],因此,有必要对白喉乌头中生物碱成分和含量进行研究。
鉴于此,作者采用硅胶柱层析、硅胶柱色谱法等手段对白喉乌头的95%乙醇提取物中的化学成分进行分离纯化,通过1HNMR、13CNMR对分离得到的4种生物碱的结构进行鉴定,并采用HPLC法测定其含量,为白喉乌头植物资源的开发利用提供依据。
1 实验
1.1 材料、试剂与仪器
白喉乌头药材,2022年采自新疆伊宁地区,经新疆医科大学附属中医医院药学部李永和主任中药师鉴定为毛茛科乌头属植物白喉乌头(AconitumleucostomumWorosch)的干燥块根。
硅胶,青岛海洋化工有限公司;ODS反相硅胶,日本Fuji Silysia公司;石油醚、乙酸乙酯、三乙胺、二氯甲烷,天津致远化学试剂有限公司;HSGF254薄层硅胶板,烟台华阳新材料科技有限公司;95%乙醇、盐酸,西安化学试剂厂;乙腈,赛默飞世尔(中国)科技有限公司;氨水,四川西陇科学有限公司。
Waters2695型高效液相色谱仪,美国Waters公司;Direct-QTM5型超纯水仪,Millipore公司;SK3300LH型超声清洗器,上海科导超声仪器有限公司;旋转蒸发仪,上海亚荣生化仪器厂;AG-135型电子分析天平,上海梅特勒-托利多仪器有限公司。
1.2 白喉乌头生物碱的分离纯化
取20 kg白喉乌头药材,粉碎,过3号筛,用95%乙醇冷浸提取4次,每次7 d,过滤除去残渣,减压浓缩,得到浸膏。将浸膏用2%HCl溶液混悬,用石油醚萃取脱脂,水相用氨水调节pH值为4,二氯甲烷萃取3次,合并二氯甲烷萃取液,减压浓缩,得到稠状浸膏257 g。
将稠状浸膏拌样后,进行硅胶柱层析分离,流动相为石油醚-乙酸乙酯-二乙胺(体积比10∶1∶0.5),每次收集1 000 mL,将第7~11次收集的洗脱液合并,减压浓缩,结晶,干燥,得到化合物WF-1(113 mg),通过薄层色谱法和高效液相色谱法确定其为单一化合物,其HPLC纯度达到96%;将第21~40次收集的洗脱液合并,减压浓缩,浸膏拌样后经硅胶柱色谱分离,流动相为石油醚-乙酸乙酯-二乙胺(体积比10∶1∶0.5),每次收集100 mL,将第18~22次收集的洗脱液合并,减压浓缩,结晶,干燥,得到化合物WF-2(188 mg),通过薄层色谱法和高效液相色谱法确定其为单一化合物,其HPLC纯度达到98%;将第41~60次收集的洗脱液合并,减压浓缩,结晶,干燥,得到化合物WF-3(21 g),通过薄层色谱法和高效液相色谱法确定其为单一化合物,其HPLC纯度达到98%;将第73~114次收集的洗脱液合并,减压浓缩,浸膏拌样后经ODS反相硅胶柱分离,流动相为乙腈-水(0~20 min,20%乙腈;20~60 min,20%乙腈~45%乙腈;60~90 min,45%乙腈;90~150 min,45%乙腈~80%乙腈),每次收集100 mL,将第53~114次收集的洗脱液合并,结晶,干燥,得到化合物WF-4(7.5 mg),通过薄层色谱法和高效液相色谱法确定其为单一化合物,其HPLC纯度达到96%。
1.3 白喉乌头生物碱含量的测定
1.3.1 对照溶液的制备
精密称取8-去氧刺乌头碱、异刺乌头碱、高乌甲素、冉乌头碱对照品适量,用乙腈配制成质量浓度分别为1.99 mg·mL-1、2.15 mg·mL-1、4.00 mg·mL-1、4.10 mg·mL-1的混合对照溶液,再梯度稀释,配制成6种不同浓度的混合对照溶液:含0.039 8 mg·mL-18-去氧刺乌头碱、0.043 0 mg·mL-1异刺乌头碱、0.080 0 mg·mL-1高乌甲素、0.082 0 mg·mL-1冉乌头碱的混合对照溶液;含0.199 0 mg·mL-18-去氧刺乌头碱、0.215 0 mg·mL-1异刺乌头碱、0.402 4 mg·mL-1高乌甲素、0.410 0 mg·mL-1冉乌头碱的混合对照溶液;含0.318 4 mg·mL-18-去氧刺乌头碱、0.344 0 mg·mL-1异刺乌头碱、0.643 8 mg·mL-1高乌甲素、0.656 0 mg·mL-1冉乌头碱的混合对照溶液;含0.477 6 mg·mL-18-去氧刺乌头碱、0.516 0 mg·mL-1异刺乌头碱、0.965 8 mg·mL-1高乌甲素、0.984 0 mg·mL-1冉乌头碱的混合对照溶液;含0.636 8 mg·mL-18-去氧刺乌头碱、0.688 0 mg·mL-1异刺乌头碱、1.287 7 mg·mL-1高乌甲素、1.312 0 mg·mL-1冉乌头碱的混合对照溶液;含0.796 0 mg·mL-18-去氧刺乌头碱、0.860 0 mg·mL-1异刺乌头碱、1.609 6 mg·mL-1高乌甲素、1.640 0 mg·mL-1冉乌头碱的混合对照溶液。
1.3.2 供试溶液的制备
精密称取白喉乌头药材粉末约5 g,加入适量氨水密闭,浸润后加入适量无水乙醇,称定质量;超声提取30 min 后,再次称定质量,并用无水乙醇补足,过滤,滤液挥干;残渣用2%HCl溶液调节pH值至2,再用氨水调节pH值至11;用二氯甲烷萃取3次,合并萃取液,挥干,残渣用乙腈溶解并定容至5 mL容量瓶中,过滤,滤液即为供试溶液[7]。
1.3.3 色谱条件
XBridgeTM-C18生物碱专用色谱柱(4.6 mm×250 mm,5 μm)[8];流动相为乙腈(A)-0.5%氨水(B),梯度洗脱,洗脱程序:0~45 min,30%A~60%A;45~80 min,60%A~80%A;80~90 min,80%A~90%A;检测波长235 nm;流速0.7 mL·min-1;柱温30 ℃;进样量10 μL。该色谱条件下,对照溶液与供试溶液的HPLC图谱呈现良好的分离度(图1)。
(6)“煤改气”和建设新增配电网。根据热力和电力需求,支持业主或第三方投资主体因地制宜的以天然气分布式能源实施“煤改气”工程。优先支持拥有分布式电源的企业在投资建设新增配电网。在新增配电网的区域,应运行天然气分布式能源新建微电网和配电网实现就近直供。
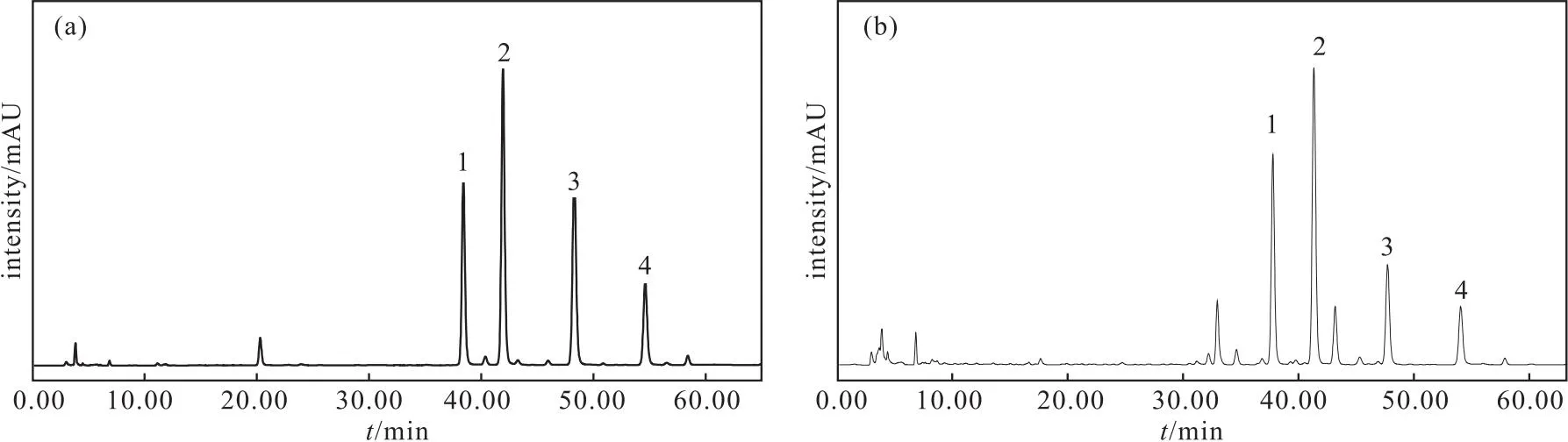
1.冉乌头碱 2.高乌甲素 3.异刺乌头碱 4.8-去氧刺乌头碱
2 结果与讨论
2.1 化合物的结构鉴定
化合物WF-1:分子式为C32H44N2O7;1HNMR(400 MHz,CDCl3),δ:1.6(t,J=7.2 Hz,3H,NCH2CH3),2.3(3H,s,NHC(O)CH3),3.3~3.4(3H,s,-OCH3),3.8(t,1H,14-H),7.1~7.5(t,J=7.7 Hz,2H,Ar-H),7.9~8.7(d,J=6.4 Hz,1H,Ar-H),11.1(1H,s,NHC(O)CH3);13CNMR(101 MHz,CDCl3),δ:84.4(C-1),26.9(C-2),32.1(C-3),84.3(C-4),46.2(C-5),29.3(C-6),46.5(C-7),74.1(C-8),45.4(C-9),37.3(C-10),25.1(C-12),49.7(C-13),84.2(C-14),42.5(C-15),82.6(C-16),61.4(C-17),57.9(C-19),115.8(C-1′),141.6(C-2′),120.3(C-3′),134.4(C-4′),122.4(C-5′),131.0(C-6′),13.5(NCH2CH3),25.4(NHC(O)CH3),48.9(NCH2CH3),56.6(16-OCH3),56.2(1-OCH3),57.8(14-OCH3),167.4(C(O)C6H4C(O)CH3),169.1(NCOCH3)。以上数据与文献[9]报道基本一致,故鉴定化合物WF-1为8-去氧刺乌头碱。
化合物WF-2:分子式为C32H44N2O8;1HNMR(400 MHz,CDCl3),δ:2.3(3H,s,NHC(O)CH3),3.3~3.5(3H,s, -OCH3),7.1(t,J=7.7 Hz,2H,Ar-H),7.5(t,1H,Ar-H),7.9(d,J=8.0 Hz,1H,Ar-H),8.7(d,J=6.4 Hz,Ar-H),11.1(1H,s,NHC(O)CH3);13CNMR(101 MHz,CDCl3),δ:86.5(C-1),26.9(C-2),33.4(C-3),82.6(C-4),47.7(C-5),35.9(C-6),84.3(C-7),76.4(C-8),50.8(C-9),50.1(C-10),51.6(C-11),28.9(C-12),45.1(C-13),83.8(C-14),37.2(C-15),84.2(C-16),62.8(C-17),57.8(C-19),115.8(C-1′),141.7(C-2′),120.3(C-3′),134.4(C-4′),122.3(C-5′),131.0(C-6′),25.6(C-2″),14.4(NCH2CH3),31.9(NCH2CH3),54.4(16-OCH3),56.3(1-OCH3),56.4(14-OCH3),168.0(C(O)C6H4C(O)CH3)。以上数据与文献[10]报道基本一致,故鉴定化合物WF-2为异刺乌头碱。
化合物WF-3:分子式为C32H44N2O8;1HNMR(400 MHz,CDCl3),δ:1.1(t,J=7.2 Hz,3H,NCH2CH3),2.3(3H,s,NHC(O)CH3),2.7(-COCH3),3.3~3.4(3H,s,-OCH3),7.1(t,J=7.7 Hz,2H,Ar-H),7.3(s,1H,Ar-H),7.9(d,J=8.0 Hz,1H,Ar-H),8.7(d,J=6.4 Hz,Ar-H),11.1(1H,s,NHC(O)CH3);13CNMR(101 MHz,CDCl3),δ:84.2(C-1),26.2(C-2),31.9(C-3),84.6(C-4),48.6(C-5),26.8(C-6),47.6(C-7),75.6(C-8),78.6(C-9),49.8(C-10),50.9(C-11),24.1(C-12),36.3(C-13),90.1(C-14),44.9(C-15),82.9(C-16),61.5(C-17),55.5(C-19),115.8(C-1′),141.8(C-2′),120.1(C-3′),134.5(C-4′),122.3(C-5′),131.2(C-6′),25.6(NCOCH3),56.1(16-OCH3),56.6(1-OCH3),57.9(14-OCH3),167.4(C(O)C6H4C(O)CH3),169.0(NCOCH3)。以上数据与文献[11]报道基本一致,故鉴定化合物WF-3为高乌甲素。
化合物WF-4:分子式为C32H44N2O9;1HNMR(400 MHz,CDCl3),δ:1.1(t,J=7.2 Hz,3H,NCH2CH3),2.3(3H,s,NHC(O)CH3),3.3~3.5(3H,s, -OCH3),7.1(t,J=7.7 Hz,2H,Ar-H),7.5(t,1H,Ar-H),7.9(d,J=8.0 Hz,1H,Ar-H),8.7(d,J=6.4 Hz,Ar-H),11.2(1H,s,NHC(O)CH3);13CNMR(101 MHz,CDCl3),δ:83.5(C-1),26.7(C-2),30.2(C-3),84.3(C-4),38.1(C-5),31.7(C-6),85.5(C-7),77.9(C-8),78.5(C-10),48.9(C-11),51.3(C-12),25.9(C-13),32.4(C-14),90.1(C-15),36.6(C-16),82.7(C-17),63.2(C-18),51.4(C-19),115.7(C-1′),141.7(C-2′),120.3(C-3′),134.4(C-4′),122.4(C-5′),131.1(C-6′),14.7(NCH2CH3),25.6(NCOCH3),49.7(NCH2CH3),55.2(1-OCH3),56.3(16-OCH3),58.0(14-OCH3),167.5(C(O)C6H4C(O)CH3),169.1(NCOCH3)。以上数据与文献[12]报道基本一致,故鉴定化合物WF-4为冉乌头碱。
2.2 HPLC方法学考察
2.2.1 线性关系
按1.3.1方法配制不同质量浓度的混合对照溶液,按1.3.3色谱条件进样测定,以质量浓度为横坐标、峰面积为纵坐标绘制标准曲线,拟合得8-去氧刺乌头碱回归方程:y=8260390x+240534.97326,R2=0.9998;异刺乌头碱回归方程:y=9484970x+544257.31881,R2=0.9991;高乌甲素回归方程:y=9083110x+415698.1657,R2=0.9994;冉乌头碱回归方程:y=6402480x+504987.8623,R2=0.9990。表明,8-去氧刺乌头碱质量浓度在0.039 8~0.796 0 mg·mL-1范围内、异刺乌头碱质量浓度在0.043 0~0.860 0 mg·mL-1范围内、高乌甲素质量浓度在0.080 0~1.609 6 mg·mL-1范围内、冉乌头碱质量浓度在0.082 0~1.640 0 mg·mL-1范围内与峰面积呈良好的线性关系。
2.2.2 精密度
取8-去氧刺乌头碱、异刺乌头碱、高乌甲素、冉乌头碱质量浓度分别为0.477 6 mg·mL-1、0.516 0 mg·mL-1、0.965 8 mg·mL-1、0.984 0 mg·mL-1的混合对照溶液,按1.3.3色谱条件连续进样测定6次,计算4种生物碱含量的RSD值分别为2.05%、1.78%、1.98%、1.68%,表明仪器的精密度较高。
2.2.3 重复性
精密称取6份白喉乌头药材,按1.3.2方法制备供试溶液,按1.3.3色谱条件进样测定,记录8-去氧刺乌头碱、异刺乌头碱、高乌甲素、冉乌头碱的峰面积,测得8-去氧刺乌头碱的平均含量为0.028 mg·g-1,RSD值为2.39%;异刺乌头碱的平均含量为0.118 mg·g-1,RSD值为1.25%;高乌甲素的平均含量为1.051 mg·g-1,RSD值为1.86%;冉乌头碱的平均含量为0.565 mg·g-1,RSD值为1.07%,表明该方法的重复性较好。
2.2.4 稳定性
精密称取白喉乌头药材粉末5 g,按1.3.2方法制备供试溶液,按1.3.3色谱条件进样测定,分别在0 h、4 h、6 h、14 h、20 h、24 h 进样并记录色谱峰面积,计算8-去氧刺乌头碱、异刺乌头碱、高乌甲素、冉乌头碱峰面积的RSD值分别为2.01%、1.38%、1.78%、1.69%,表明供试溶液在24 h内稳定性良好。
2.2.5 加标回收率
精密称取白喉乌头药材粉末5 g,按1.3.2方法制备供试溶液,分别加入4种不同质量浓度的8-去氧刺乌头碱、异刺乌头碱、高乌甲素、冉乌头碱混合对照溶液,按1.3.3色谱条件进样测定,计算加标回收率,结果见表1。
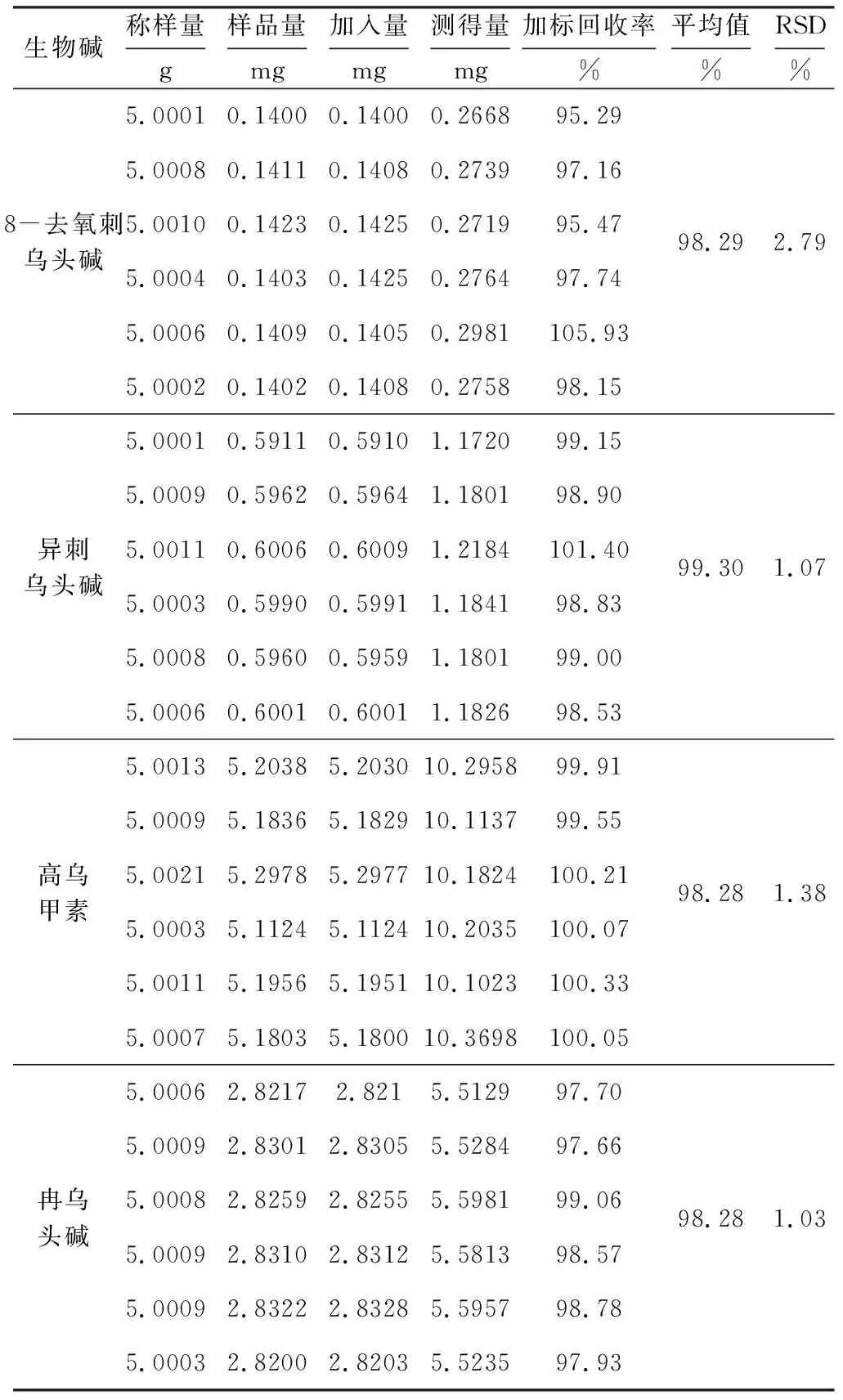
表1 8-去氧刺乌头碱、异刺乌头碱、高乌甲素、冉乌头碱的加标回收率
2.2.6 样品测定
分别精密称取5.002 0 g、5.003 8 g、5.002 3 g白喉乌头药材,按1.3.2方法制备供试溶液,按1.3.3色谱条件进样平行测定3次,计算白喉乌头中8-去氧刺乌头碱、异刺乌头碱、高乌甲素、冉乌头碱的含量,结果见表2。
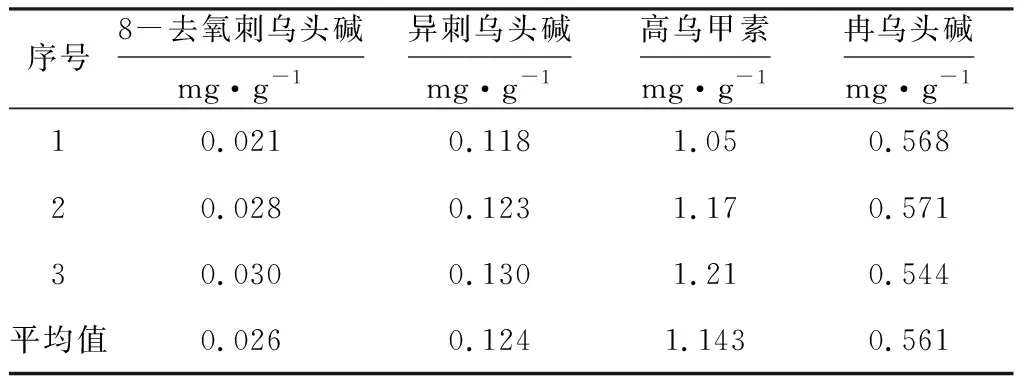
表2 样品测定结果(n=3)
由表2可知,3批白喉乌头药材中8-去氧刺乌头碱、异刺乌头碱、高乌甲素、冉乌头碱的平均含量分别为0.026 mg·g-1、0.124 mg·g-1、1.143 mg·g-1、0.561 mg·g-1,其中高乌甲素的含量最高。
2.3 讨论
近年来,新疆干旱加剧,草场过度放牧,导致天然草原退化严重,可食用草很难生长,毒害草白喉乌头却大范围扩张蔓延,牲畜误食后常出现中毒或死亡现象[13],对新疆草原生态系统和地方畜牧业造成严重危害[14]。每年秋季,新疆地区需投入大量人力、物力防除杂草,或者采用大量除草剂防除杂草,对新疆草场造成污染[15]。将白喉乌头作为一种药用植物资源进行开发利用,变毒为宝,具有重要意义。
从白喉乌头中分离得到4种生物碱,分别是8-去氧刺乌头碱、异刺乌头碱、高乌甲素、冉乌头碱,其中异刺乌头碱是首次从该植物中分离得到,为白喉乌头中生物碱成分的深入研究提供了依据。4种生物碱的含量测定中,高乌甲素的含量最高,分离得到高乌甲素单体21 g。
高乌甲素为C18-二萜生物碱的典型代表[16],是我国首创的非成瘾性镇痛药,常用于临床缓解癌痛和术后镇痛[17],高乌甲素的衍生物氢溴酸高乌甲素联合阿片类药可以更好地缓解患者神经病理性癌痛,减少阿片类药的用量,降低阿片类药带来的不良反应,是治疗神经病理性癌痛安全有效的办法[18]。白喉乌头中高乌甲素的分离及含量测定为白喉乌头作为非成瘾性镇痛药物的原料药材开发提供了依据。
3 结论
采用硅胶柱层析、硅胶柱色谱法等手段从白喉乌头的95%乙醇提取物中分离得到了4个二萜生物碱,分别鉴定为:8-去氧刺乌头碱、异刺乌头碱、高乌甲素、冉乌头碱,其中异刺乌头碱为首次从白喉乌头中分离得到。采用HPLC法同时测定了白喉乌头中8-去氧刺乌头碱、异刺乌头碱、高乌甲素、冉乌头碱的含量,HPLC图谱中各成分色谱峰清晰,分离度较好,稳定性和精密度等方法学考察均符合要求,3批白喉乌头药材中8-去氧刺乌头碱、异刺乌头碱、高乌甲素、冉乌头碱的平均含量分别为0.026 mg·g-1、0.124 mg·g-1、1.143 mg·g-1、0.561 mg·g-1,其中高乌甲素的含量最高。该方法稳定可行,操作简便,可用于白喉乌头中成分的测定和质量控制,为白喉乌头的资源化利用及质量标准制定奠定了基础。