鉴定顺铂对人肝癌细胞系转录物组的影响
郭 鑫,冀梦蝶,王 琦,李雪媛,陈 阳
中国医学科学院 北京协和医学院 基础医学研究所 生物化学与分子生物学系 重大疾病共性机制研究全国重点实验室,北京 100005
肝细胞癌(hepatocellular carcinoma,HCC)是一种常见的恶性肿瘤,也是癌相关死亡的主要原因之一[1]。目前,已经研发出多种用于肝癌治疗的化学治疗药物。其中,顺铂(cisplation,cis-diaminodichloroplatinum,CDDP)是第一种合成的铂类抗癌药物,仍然广泛应用于肝癌治疗。顺铂是一种细胞非特异性药物,在进入细胞后水化反应形成水合顺铂,该物质强烈结合癌细胞DNA形成Pt-DNA加合物,干扰癌细胞DNA的复制,从而引起DNA损伤,抑制癌细胞的增殖,并引发细胞凋亡[2]。
转录物组(transcriptome)是细胞特定发育阶段或生理条件下完整的转录本(RNA)及其数量的总和。转录物组学(transcriptomics)是从RNA水平研究基因表达的情况,其研究对发育和疾病至关重要[3]。目前,顺铂耐药机制上已经取得了一些进展,但肿瘤细胞对顺铂反应的异质性机制仍然需要探索。为了揭示肝癌细胞对顺铂耐药的共性转录物变化,本研究选取两种来源不同的肝癌细胞系HepG2、Huh7,通过不同浓度顺铂处理肝癌细胞系后进行转录物组测序( RNA-sequencing,RNA-seq) 以探索其转录物组发生的改变。
1 材料与方法
1.1 材料
1.1.1 细胞系: 人肝癌细胞系HepG2、Huh7(中国医学科学院基础医学研究所细胞资源中心)。
1.1.2 试剂:细胞培养试剂(Gibco公司);γH2A.X抗体、cisplation抗体(Abcam公司);VAHTS Universal V6 RNA seq Library Prep Kit for Illumina® RNA-seq建库试剂盒(南京诺唯赞生物科技股份有限公司)。
1.2 方法
1.2.1 细胞的培养及处理:均使用DMEM高糖,10%胎牛血清培养HepG2、Huh7细胞,细胞贴壁24 h后使用培养基溶解的不同浓度的顺铂处理细胞后收样检测其活性、构建普通转录物组文库以及进行免疫荧光实验。
1.2.2 RNA-seq检测细胞转录物组:使用VAHTS Universal V6 RNA-seq Library Prep Kit for Illumina试剂盒建库后进行测序。数据下机后,先用fastqc软件对数据进行质控,用bowtie2软件将转录物组数据比对到hg38参考基因组上,然后用Featurecounts软件对基因表达进行定量,最后用R软件对基因表达矩阵进行分组整理。
1.2.3 差异基因(differentially expressed genes,DEG)的分析及KEGG通路富集分析:将feature Counts导出的矩阵导入到DESeq2中,用dds函数构建DESeqDataSet对象,再用DESeq函数进行差异表达分析,获取结果并保存到Excel表格中。绘制差异基因火山图,选取目标基因利用DAVID[4](https://david.ncifcrf.gov/tools.jsp)数据库进行KEGG分析,KEGG的气泡图使用Sangerbox3.0[5](http://sangerbox.com/home.html)工具绘制。
1.2.4 蛋白质相互作用网络分析(protein-protein interaction, PPI)及预后:基于筛选出来的基因,使用STRING[6](https://STRING-db.org/)生成蛋白质相互作用网络,利用Network Analyser工具对网络中的各个节点进行分析,得到各个节点的节点度值。根据节点度筛选出来的基因利用交互式分析平台GEPIA[7](http://gepia.cancer-pku.cn/)分析基因表达与肿瘤患者预后的关系。
1.3 统计学分析
2 结果
2.1 顺铂处理对肝癌细胞系活性影响分析
随着顺铂浓度升高HepG2和Huh7细胞的活性明显下降,且下降趋势一致(图1A),观察随浓度升高,两株细胞形态均改变,发生凋亡(图1B)。

A.cell viability of HepG2 and Huh7 cells treated with different concentrations of cisplatin for 12 hours; B.cell morphology of HepG2 and Huh7 cells treated with different concentrations of cisplatin for 12 hours.
2.2 顺铂处理引起DNA损伤
与对照组相比,随着顺铂浓度升高,两株细胞的细胞核周边逐步出现 cisplatin 信号富集,少量在细胞核上富集,γH2A.X 在受到顺铂处理后信号增强(图2)。

A.immunofluorescence of cisplatin and γH2A.X in HepG2 cells after cisplatin treatment;B.immunofluorescence of cisplatin and γH2A.X in Huh7 cells after cisplatin treatment.
2.3 转录物组测序结果主成分分析及差异基因分析
使用5个浓度处理细胞后进行转录物组测序,每个浓度共2个样本,加上时间对照,每组一共12个样本,在主成分分析(principal component analysis,PCA)中,每组实验样本的两个重复之间呈现出均一的重合分布,而不同浓度的顺铂处理后的样本则显示出分散的分布(图3A,图4A)。DEG分析显示,两株细胞中无药物对照和0 h空白对象相比无明显差异(图3B,图4B)。在HepG2细胞系中,共有255个基因在不同浓度的顺铂处理下被共同上调(图3G),208个基因被共同下调(图3H)。而在Huh7细胞系中,有185个基因在各个实验组中被共同上调(图4G),268个基因被共同下调(图4H)。
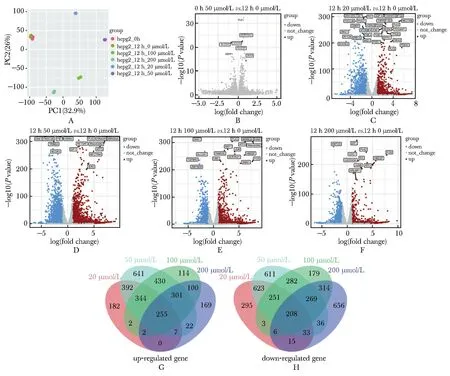
A.PCA analysis of HepG2 cells after cisplatin treatment, PC1 and PC2 represented the first and second principal components of the data; B.volcano plot of differential gene expression in HepG2 cells between 12 h and 0 h HepG2 cells; C.volcano plot of differential gene expression in HepG2 cells between 0 μmol/L and 20 μmol/L cisplatin treatment; D.volcano plot of differential gene expression in HepG2 cells between 0 μmol/L and 50 μmol/L cisplatin treatment; E.volcano plot of differential gene expression in HepG2 cells between 0 μmol/L and 100 μmol/L cisplatin treatment; F.volcano plot of differential gene expression in HepG2 cells between 0 μmol/L and 200 μmol/L cisplatin treatment; G.overlap of up-regulated genes in HepG2 cells with different concentrations of cisplatin; H.overlap of down-regulated genes in HepG2 cells with different concentrations of cisplatin.

A.PCA analysis of Huh7 cells after cisplatin treatment,PC1 and PC2 represented the first and second principal components of the data; B.volcano plot of differential gene expression in Huh7 cells between 12 h and 0 h Huh7 cells; C.volcano plot of differential gene expression in Huh7 cells between 0 μmol/L and 20 μmol/L cisplatin treatment; D.volcano plot of differential gene expression in Huh7 cells between 0 μmol/L and 50 μmol/L cisplatin treatment; E.volcano plot of differential gene expression in Huh7 cells between 0 μmol/L and 100 μmol/L cisplatin treatment; F.volcano plot of differential gene expression in Huh7 cells between 0 μmol/L and 200 μmol/L cisplatin treatment; G.overlap of up-regulated genes in Huh7 cells with different concentrations of cisplatin; H.overlap of down-regulated genes in Huh7 cells with different concentrations of cisplatin.
2.4 不同浓度顺铂处理后两种细胞系重叠基因及富集通路分析
选取了两种细胞所有实验组中共同的上调和下调的DEG,并使用韦恩图展示了上下调的DEG之间的重叠情况。共有59个共同上调基因、196个HepG2特异上调基因以及127个Huh7特异上调基因; 通过分析下调基因,共有81个共同的差异下调基因、127个HepG2特异下调基因以及187个Huh7特异下调基因(图5A,D)。两株细胞共同上调的59个基因主要富集在肿瘤发生发展相关通路(图5B)。而对于两株细胞共同下调的81个基因进行基因功能分析,主要富集在Rap1信号通路、Ras信号通路、调控干细胞多能性、轴突的指导和黏附连接等相关通路(图5E)。
2.5 共同上调、下调基因基因编码蛋白质相互作用网络分析
使用 STRING 数据库分别绘制 59 个共同上调基因以及81个共同下调基因的蛋白质相互作用网络。在共同上调基因的网络中,具有节点度大于5的基因包括FosB 原癌基因,AP-1 转录因子(Fos proto-oncogene, AP-1 transcription factor subunit,FOS)、Jun 原癌基因,AP-1 转录因子(Jun proto-oncogene, AP-1 transcription factor subunit,JUN)、转录激活因子3(activating transcription factor 3,ATF3)、周期素依赖性激酶抑制因子1A(cyclin dependent kinase inhibitor 1A,CDKN1A)、生长停滞DNA损伤可诱导蛋白α(growth arrest and DNA damage inducible alpha,GADD45A)和KLF转录因子(KLF transcription factor 4,KLF4)(图5C)。而在共同下调基因的网络中,节点度最高的基因是AT丰富结合域含蛋白1B (AT-rich interaction domain 1B,ARID1B),其节点度为5(图5F)。

A.overlap of upregulated DEG in both HepG2 and Huh7 cells; B.KEGG analysis of upregulated DEG in both HepG2 and Huh7 cells; C.PPI analysis of upregulated DEG in both HepG2 and Huh7 cells; D.overlap of downregulated DEG in both HepG2 and Huh7 cells; E.KEGG analysis of downregulated DEG in both HepG2 and Huh7 cells; F.PPI analysis of downregulated DEG in both HepG2 and Huh7 cells.
2.6 相关特征基因与预后的关系
对共同上调基因蛋白质相互作用网络中节点度大于5的基因以及共同下调基因的蛋白质相互作用网络中节点度最高的基因ARID1B分析与GEPIA数据库中TCGA-LIHC患者队列生存预后的关系,其中只有 JUN 和 GADD45A与患者生存存在显著相关性(图6)。
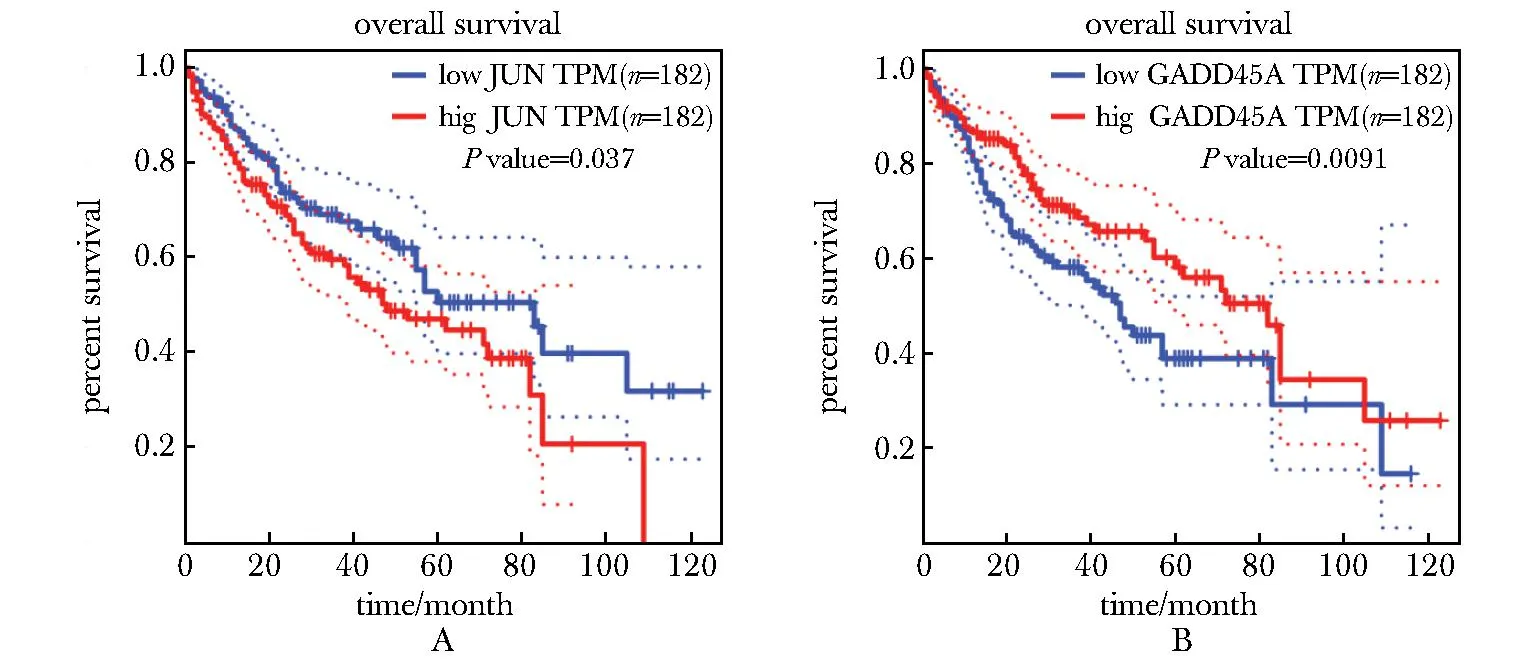
A,B.prognostic correlation of JUN and GADD45A in hepatocellular carcinoma patients; Transcripts per million(TPM) indicated the number of specific genes per million transcripts, taking into account the length of the gene and the total sequencing depth, better reflecting the relative level of gene expression.
3 讨论
本研究显示,随着顺铂浓度的增加,两种肝癌细胞系的活性降低,DNA损伤加重。通过转录物组测序和差异基因筛选,发现HepG2和Huh7细胞共同受影响的KEGG通路。研究还揭示了一些共同上调基因,包括FOS、JUN、ATF3、CDKN1A、GADD45A和KLF4,其中JUN与患者生存期延长相关,而GADD45A则与生存期延长呈负相关,可能可以成为肝癌患者预后的标志物。然而,在共同下调基因中,ARID1B在网络中起到重要作用,但与患者生存期无显著相关。
以上结果表明肝癌细胞对顺铂的应答机制可能与JUN和GADD45A的转录调控有关。其中,JUN是转录激活蛋白1(activator protein 1,AP-1)的主要组成部分,参与细胞增殖、凋亡和肿瘤发生等过程,活化的JUN蛋白在保护人类肿瘤细胞免受DNA损伤诱导的细胞凋亡方面具有重要作用[8]。当神经元遭受DNA损伤诱导的细胞凋亡时,JUN的表达会激活。该激活过程主要受到经典c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)通路以外的信号通路介导[9]。这意味着高表达JUN的肝癌患者可能对JNK抑制剂不太敏感。同时,有研究表明抑制JUN的转录活性可以有效阻止TNFα诱导的染色质重塑和间质转化,有望改善肿瘤进展中的转录调控网络失调[10]。
GADD45A则是一个关键的细胞周期调控蛋白,其通过直接与R环结合招募TET1介导局部DNA去甲基化[11],参与维持基因组的稳定性[12]、DNA修复和抑制细胞增殖[13]。GADD45A的减少可能导致肿瘤抑制基因(例如MLH1)的过度甲基化和失活[14],其高表达可能有助于维持细胞的稳定性,减缓肿瘤的生长速度,从而改善了患者的预后。综上所述,这些研究结果为肝癌顺铂治疗的转录共性变化提供了数据,提示克服顺铂耐药可能关键在于DNA损伤修复的调节。然而,这些发现仍然需要更多的临床研究来验证其可靠性。

