水稻冷害成灾机制与调控机理研究进展及展望
李可 蒋伟勤 车阳 杜小凤 杨文飞 顾大路

摘要: 低温冷害严重影响水稻产量和品质。研究冷害的调控,对水稻优质高产育种和调优栽培具有重要意义。本文简述水稻冷害的基本特征、生理机制以及耐冷性基因取得的成果,从细胞结构、农艺和生理性状、分子机制等角度总结了低温胁迫对水稻伤害的研究进展。重点综述了水稻冷害的调控机理并提出缓解冷害的调控措施,包括选育耐低温品种、喷施外源植物激素、选择适宜播期和合理施肥等,主要阐述了褪黑素、亚精胺、茉莉酸甲酯和水杨酸对水稻冷害的调控作用,即通过促进内源激素合成、提高抗氧化酶活性及分子信号转导等途径在水稻耐冷过程中发挥着重要作用,而较早的播期可以有效避开灌浆结实期低温危害的风险,合理施肥能够提高籽粒产量,并对未来水稻低温冷害的研究方向进行了展望,包括加强水稻耐冷性评价体系标准的一致性,深入研究水稻耐冷的代谢调控网络,从形态建成、酶、激素、源库协调等相关机制出发多方面解析其生理机制,同时配套栽培调控措施,可为水稻耐冷品种选育和栽培调控提供理论依据。
关键词: 水稻;冷害;调控;育种;调优栽培;研究进展
中图分类号:S511.01 文献标志码:A
文章编号:1002-1302(2024)02-0031-09
在我国,水稻种植范围广、品种繁多、种植模式多样,故其在各个生长时期都有可能遭遇低温危害,而近年来全球气候异常,极端天气频发,农业气象灾害如突发性异常低温已经成为威胁农业生产中最常见的非生物胁迫之一。水稻是喜温作物,对低温环境敏感,大量研究表明,低温胁迫对水稻造成诸多损害,包括种子发芽率下降、幼苗失绿白化或枯萎、分蘖减少、孕穗期花粉不育、灌浆期空瘪粒增加等[1-3],是限制水稻增产的关键因子之一,因此低温胁迫下水稻产量下降和品质变劣的生理、遗传原因及其相应的调控措施倍受农业科学家们的高度重视[4-6]。低温胁迫对水稻产量形成的影响可分为3个方面:一是光合作用下降影响同化物积累;二是花药发育受阻造成结实率降低;三是灌浆速率减慢,生育期延长,千粒质量显著下降[7]。研究发现,低温胁迫下大多数植物激素的生物合成及信号转导基因上调,激素介导的防御机制在低温胁迫中发挥重要作用,这些复杂的生理进程既可能相互联系又会独立存在,构成了水稻在低温逆境下的自我调控网络[8]。通过施以植物激素外部调控手段,可以有效地提高作物光合效率、花粉受精率和灌浆速率,进而提高水稻的产量与品质[9]。
植物体内天然植物激素以及人工合成的具有生理活性、对植物生长发育起着调节作用的化合物即为植物生长物质[10]。关于低温限制水稻生长的研究,主要集中在抗逆育种和栽培水平上进行阐述,目的在于挖掘水稻耐冷性基因并进行定位, 通过靶向性改良品种和栽培方式提高产量和品质,但是对外源植物激素提高作物耐冷性和增产潜力的研究较少[11-15]。因此本文在简述低温胁迫下水稻农艺性状和生理机制的基础上,重点综述了褪黑素、亚精胺、茉莉酸甲酯以及水杨酸对低温冷害的调控途径,以期为抗冷品种选育及栽培调控提供理论依据。
1 水稻的冷害
1.1 水稻冷害的基本特征
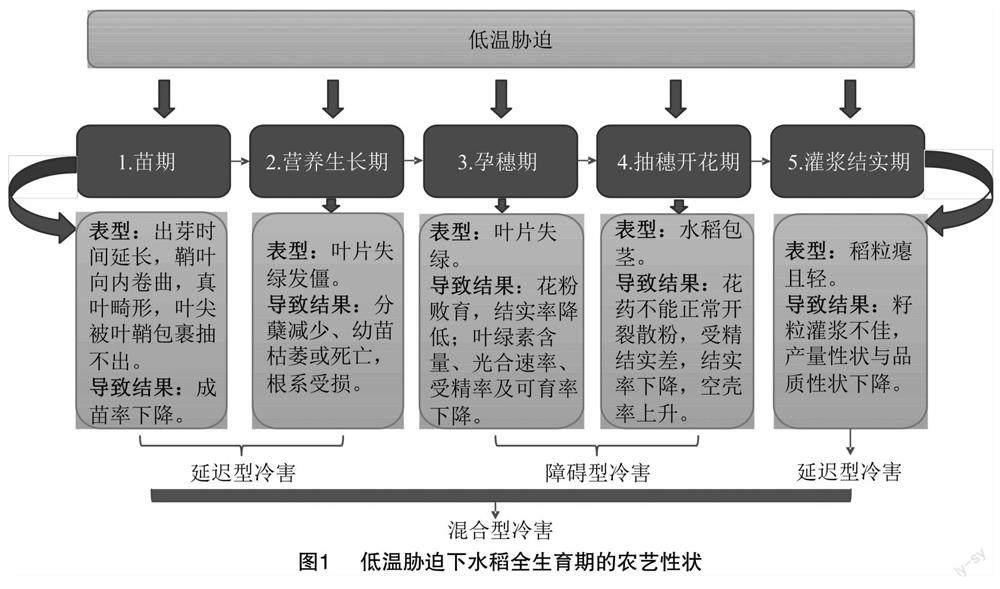
根据低温阈值能够判断水稻是否遭遇冷害,一般开花期临界温度是20 ℃,孕穗期、抽穗期与灌浆期临界温度为18 ℃[16]。水稻冷害主要分为4种类型[17-18]:延迟型冷害表现为水稻营养生长期持续性低温导致积温不足,使得穗分化延迟及籽粒不能正常时间成熟,进而产量降低[19],以及灌浆结实期遇到低温胁迫造成粒质量降低和生育期推迟[20];障碍型冷害则是在穗分化至开花受精阶段由于低温使得花药不能正常散粉,最终导致花粉败育,进而影响结实率的一种冷害[21];作物生长发育期间同时遭受延迟型冷害和障碍型冷害,导致产量和品质下降的现象通常被称为混合型冷害[22](图1);稻瘟病型冷害较少出现,主要集中在云贵高原粳稻区[23]。水稻冷害按照减产幅度分为轻度(5.0%~10.0%)、中度(10.1%~15.0%)和严重(15.1%及以上)等3个级别,江苏省近30年来单季稻抽穗灌浆期总冷害次数达155次[24],因此研究生育期延长背景下的水稻冷害具有重要意义。
水稻在低温胁迫下,不仅会出现细胞壁破裂、叶片气孔缩小等细胞结构的变化,在农艺及生理性状上也会表现出一系列变化,包括叶片失绿发黄、叶绿体破裂与分解、光合性能显著下降、内源性植物激素失衡等[25-27]。不同生育时期对冷害的耐性也不一样,尤其是水稻孕穗期最为敏感[2],可能会涉及混合型冷害,最终导致结实率和千粒质量降低,产量严重下降。
1.2 水稻冷害的机制
从穗分化到开花受精这一时期遭遇低温冷害会破坏生殖器官的结构和功能,可导致小穗发育异常、花粉育性下降和结实率降低等后果[28]。在谷类作物中,雄性和雌性的生殖发育都会受到非生物胁迫的影响,然而,雄性生殖发育会比雌性更加敏感,因此开花受精阶段的低温胁迫会导致雄性不育、形成的细胞超微结构如淀粉在花药壁组织中异常积累、胼胝质过早溶解、异常小孢子壁形成等[29]。低温诱导花粉不育归因于碳代谢的变化, OsINV4 是在花药细胞壁特异表达的转化酶,其催化蔗糖转化成葡萄糖和果糖,而低温抑制 OsINV4 的表达,导致花药中蔗糖浓度显著高于正常水平,绒毡层细胞异常膨胀,同时蔗糖是合成淀粉的主要途径,这造成了成熟花粉粒的淀粉含量不足,从而导致花粉不育[30-31]。此外,雄性不育通常与线粒体有直接关系,研究发现绒毡层中有高密度线粒体,这能够说明花粉的形成需要高能量,而低温影响水稻线粒体的供能,进而影响糖的消耗,导致糖在花药中的积累,进一步造成碳水化合物代谢紊乱,影响营养物质的合成与供给,这种外质体糖转运途径受阻的过程可能是引起花粉不育的原因[32]。
水稻营养生长期遭遇低温会抽穗延迟,全生育期延长,因此选择熟期稍短的抗性品种具有重要的现实意义[19]。水稻延迟性冷害也会发生于灌浆结实期,而籽粒淀粉积累主要发生在灌浆结实期,籽粒淀粉积累与各种淀粉酶反应密切相关,如腺苷二磷酸葡萄糖焦磷酸化酶(AGPase)、可溶性淀粉合成酶(SSS)、颗粒结合型淀粉合成酶(GBSS)、淀粉分支酶(SBE)是淀粉代谢的关键酶,能够限制籽粒充实和自身生理活性[6]。AGPase催化葡萄糖-1-磷酸(G-1-P)与ATP反应,生成腺苷二磷酸葡萄糖(ADPG),可以给淀粉合成供给原始材料,同时能够决定淀粉合成速率和合成量[33];SSS和SBE催化ADPG与葡聚糖发生交互作用,使得葡萄糖分子转运至淀粉引物,主要起到产生分支、延长淀粉链的作用,对支链淀粉的合成具有重要意义[34];SSS有三大类同工酶,分别为SSSⅠ、SSSⅡ及SSSⅢ,SSSⅠ使10个或者10以下葡萄糖聚合度(DP)短链合成,而SSSⅡ和SSSⅢ分别参与中等长度的支链淀粉合成、聚合度為25~35的长链淀粉合成[35]。研究发现,与支链淀粉的合成有密切联系的酶是SBE,有学者观察到水稻中SBEⅢ基因缺失造成支链淀粉含量显著下降[36],此外,支链淀粉的合成受到抑制归因于玉米转基因植株中SBE活性降低85%[37]。低温胁迫显著降低了灌浆结实期SSS和SBE活性,影响淀粉前期合成和后期积累,水稻灌浆受阻,灌浆速率放缓,从而延迟整个灌浆进程[38]。
2 水稻耐冷性
2.1 水稻耐冷性的主要调控机制
CBF、MYB、ICE等转录因子涉及水稻耐冷调控机制[39-40],CBF是冷胁迫下主要调控因子,通过激活一系列靶基因来起到耐冷的作用[41],首先在拟南芥中发现其响应低温胁迫的节律性表达,后研究报道,在植物中普遍存在这种调控模式,而在水稻中,有12个CBF因子参与耐冷害调控生物学过程[40]。传感器COLD1等接收冷刺激,导致Ca2+、ROS和ABA等成为与第二信使相关的胞质信号,并传递和响应[42]。同时将信号进一步转导到激酶和磷酸酶活性的调控中,从而激发蛋白功能,致使下游CBF基因表达产物同上游启动子调控原件结合,来控制基因表达。CBFs是拟南芥中响应低温胁迫的节律性表达基因[43],有学者观察到 tocl-101 突变体表现出耐寒性增强的表型,且其中 CBF3 的表达水平提高[44]; cal-11/lhy-21双突变体中CBF1-3 的低温诱导表达和生物钟调节明显减弱,造成双突变体植株的耐寒性减弱[44]。而MYB与CBF耐冷调控途径不同,二者一般形成拮抗作用,MBY发生表达时,CBF通常处于抑制状态[45],并且MYB转录因子在冷信号刺激下反应速度较CBF调控慢,而MYB转录因子可以分为4类,即1R、R2R3R、R1R2R3和4R,在调控细胞周期和非生物胁迫方面具有重要作用[46]。此外,研究发现,CBF的过表达不会干预到MBY的表达量,2种调控路径可以增强转基因植物的耐冷性,但同时也会降低水稻株高和结实率,推迟花期和减少有效穗数等[47]。
2.2 水稻耐冷性基因
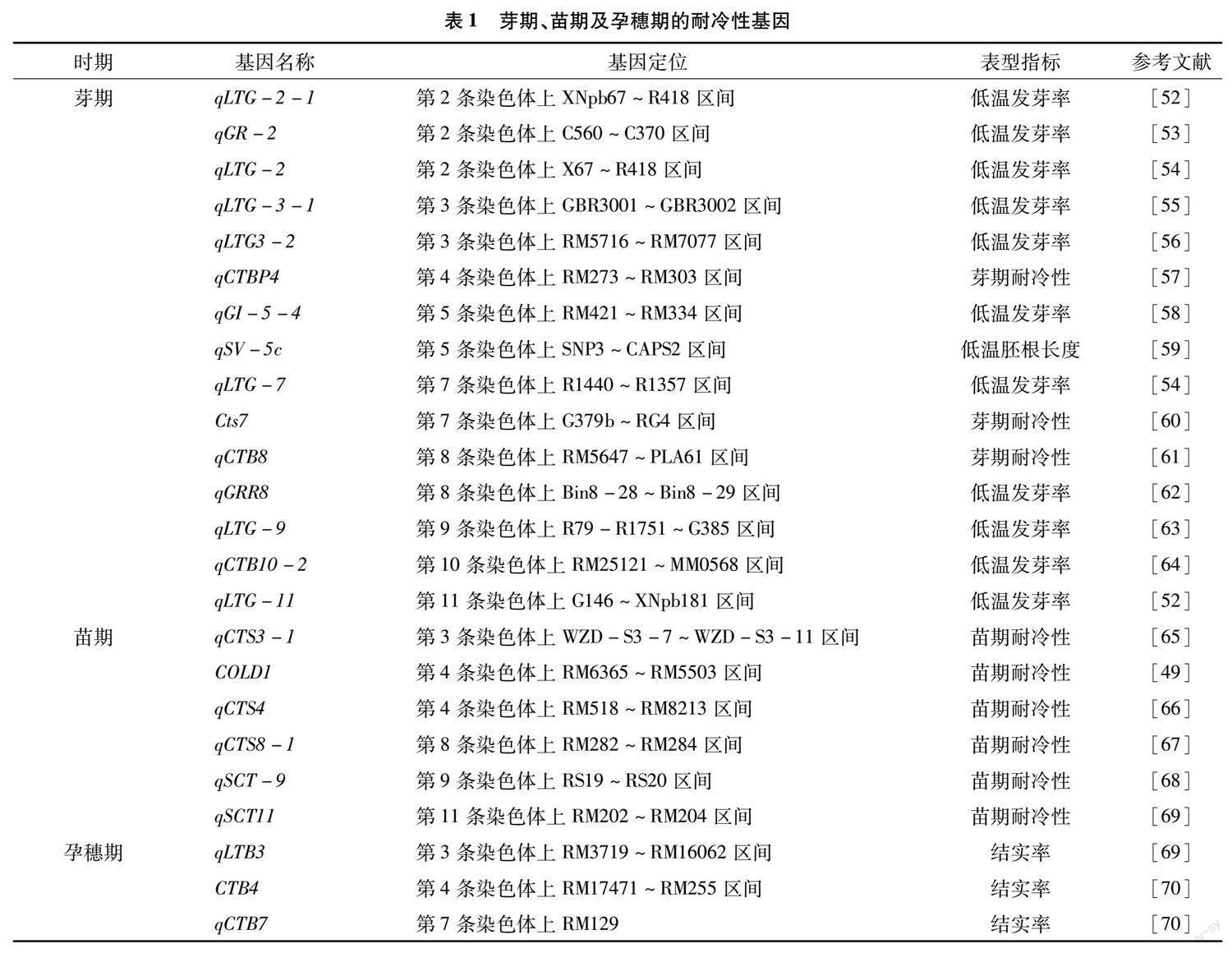
水稻的耐寒性是一个由多个基因控制的复杂数量性状[48],近年来,水稻中鉴定出很多水稻耐冷性基因[11,49-50],根据发生冷害的时期,水稻耐冷性基因分为芽期、苗期、孕穗期三大类型[51]。其中,芽期耐冷基因主要有 qLTG-2-1、qGR-2、qLTG-2、qLTG-3-1、qLTG3-2、qCTBP4、qGI-5-4、qSV- 5c、qLTG-7、Cts7、qCTB8、qGRR8、qLTG-9、qCTB10- 2和qLTG-11 等[52-64],其表型指标以及目标基因所在位置存在差异。苗期耐冷基因主要有 qCTS3-1、COLD1、qCTS4、qCTS8-1、qSCT-9和qSCT11 等[49,65-69],孕穗期耐冷基因有 qLTB3、CTB4a和qCTB7 等[69-70],其表型指标无差异(表1)。
3 水稻冷害调控措施
3.1 培育耐冷性品种
低温影响水稻的生长发育,解决这一问题最经济有效的措施是培育水稻耐冷性品种。为了统一评价体系,根据黑龙江省水稻品种审定标准,以3年处理空壳率为耐冷性鉴定标准。龙粳65、垦粳8号、龙粳3033、绥粳28、垦稻90、松粳28、龙垦227、垦研017、龙粳69和龙垦223[71-80]均为黑龙江省审定品种,具有较好的耐冷性(表2)。其中,龙粳65处理空壳率为4.40%~7.79%,区域试验和生产试验过程中表现优异,其耐冷性、优质性、丰产性和抗病性等均优于对照品种[71]。
3.2 外源植物激素调控途径
3.2.1 褪黑素
植物内源激素是作物生长发育不可缺少的调节物质,在水稻耐冷的生物进程中起到重要作用。褪黑素(melatonin,简称MT)是一种广泛存在于植物、动物和原核生物体内的吲哚类小分子[81],外源喷施能够促进内源MT以及GA类的生物合成,抑制低温胁迫下ABA和H2O2积累,同时上调ABA胁迫信号核心模块的 OsCAT2 表达,具有促进植物光合作用和缓解极端温度胁迫等效应[82]。研究表明,喷施MT对超氧化物歧化酶(superoxide dismutase,简称 SOD)、过氧化物酶(peroxidase,简称POD)活性的提高与可溶性糖、脯氨酸含量的升高均有一定促进作用,且有利于水稻后期籽粒结实,结实率显著增加了16.64%[83];同样地,对烟草幼苗的低温胁迫研究也发现外源MT通过降低丙二醛(malondialdehyde,MDA)含量、提高可溶性糖含量来提高幼苗耐冷性[84];据董倩报道,MT处理后的水稻种子能够显著提高发芽指数,增加还原型谷胱甘肽(GSH)含量, 同时幼苗叶片中与冷信号转导、编码抗氧化酶相关的基因表达均显著上调[85];朱春权等观察到,低温处理下外源施加MT使水稻体内 OsFer1和OsLti6b基因表达量进一步提高,OsFer1在OsTERF2的下游调控水稻耐冷胁迫,而OsLti6b 在水稻遭受冷胁迫时,能够避免质膜不完整性的风险[86]。
3.2.2 亚精胺
大量研究表明,多胺(polyamines,Pas)調控植物生长发育可能涉及一个复杂的激素调控网络,是一类与植物逆境响应相关的小分子量物质[87]。在拟南芥中,编码亚精胺(Spd)合成的基因 AtSPDS1和AtSPDS2 ,其双突变体显示内源Spd含量下降会抑制种子发育[88];然而,从水稻中克隆的42KD亚精胺合酶基因 OsSPDS2 ,其cDNA序列与拟南芥 AtSPDS3 序列具有最高相似性,长期低温胁迫使根系中 OsSPDS2 的mRNA积累,而盐胁迫对 OsSPDS2 水平无显著影响[89]。还有学者发现,RNAi介导的亚精胺合成酶基因沉默造成烟草花粉活力和结实率下降、种子发芽延迟、发芽率降低等现象[90]。经检测,外源Spd调节水稻幼苗碳水化合物水平,协同提高地上部生物量、抗氧化酶活性和内源GA3含量,这可能与同时参与抗氧化防御系统和内源激素代谢的诱导有关,从而提高水稻幼苗的耐冷性[91];研究发现,低温处理使得参与亚精胺生物合成的基因呈现出一种诱导表达的趋势,由此猜测亚精胺可能对水稻具有耐冷作用[30];此外,亚精胺或精胺/腐胺比值与籽粒充实度和千粒质量呈极显著正相关[92],据此推测,亚精胺可通过增强蔗糖-淀粉代谢途径关键酶活性、参与内源激素代谢和抗氧化系统来实现水稻增产。
3.2.3 茉莉酸甲酯
1971年在真菌Lasiodip-lodia theobromae的培养液中分理出游离的茉莉酸[93],此后,学者们开始对茉莉酸和以茉莉酸甲酯(methyl jasmonate,MeJA)为代表的茉莉酸类物质进行研究。研究表明,茉莉酸甲酯作为脂肪酸衍生物,主要合成方式通过亚麻酸被氧化成茉莉酸,经过茉莉酸羧基甲基转移酶合成MeJA[94]。当植物遭遇 逆境时,能够明显观察到茉莉酸 及其衍生物的含量升高,作为第二信号激活植物体内防御基因进行相似性表达,来提高植物的抗性[95];有研究进一步指出,外源喷施茉莉酸能激活低温胁迫下植株体内内源茉莉酸的合成,而对相关基因表达的探究发现,茉莉酸能正向调节CBF(C-REPEAT结合因子)轉录途径,并以上调下游冷应答基因最终增强耐冷性[96];同样地,MeJA在低温条件下上调 OsCDPK7、OsTrx23基因的表达,而OsCDPK7、OsTrx23 过表达时,分别起到缓解水稻冷胁迫和通过激活水稻抗氧化系统提高水稻耐冷性的作用[86];MeJA发生调控作用时,常与其他激素发生互作,外源施加MeJA不仅会制约脱落酸的合成、还会促进脱落酸的分解,导致水稻体内脱落酸含量下降,从而延缓植物衰老[97];此外,异常温度下MeJA能够通过增加水稻中的GA3含量来抵御逆境。这本质上都是应激反应下内源激素的相互调控,以期减轻水稻低温损伤,实现“扩源增库”,进而稳产增产[98]。低温胁迫下茉莉酸甲酯的合成途径见图2。
3.2.4 水杨酸
水杨酸(salicylic acid,SA)作为一种信号传递分子,能够诱导植物体内病程相关蛋白基因表达进而获得抗病性[99],同时与植物对各种非生物胁迫的抗性密切相关,包括干旱、盐和低温等,因此,SA可用于对抗病原体、重金属胁迫以及通过激活抗氧化系统减少氧化损伤[100]。大量研究表明,低温通过抑制叶绿体电子运输,降低卡尔文循环酶等酶活性和活性氧(ROS)清除酶活性,诱导ROS在叶绿体中积累,而且持续的低温胁迫会严重影响叶绿体发育,改变其形状,损伤膜结构,从而加剧细胞器中ROS的产生,维生素C(ASA)、谷光甘肽(GSH)、抗坏血酸过氧化物酶(APX)和谷胱甘肽还原酶(GR)是ASA-GSH循环的重要组成部分,在清除细胞器特别是叶绿体中的ROS方面具有重要意义,而外源SA能够对ASA和GSH的水平以及APX和GR活性产生积极影响。此外,SA可以提高电子传输率,并在低温胁迫下上调编码碳酸酐酶和Rubisco的基因表达,这表明SA能够缓解低温诱导的电子传输率下降和ROS产生造成的过氧化损伤,这也可能解释了喷施外源SA能够产生更高的光化学效率和光合速率的原因[101-103]。然而,研究发现,低温通过增加细胞周期来延长植物的生育期,随着生育期的推迟会遭遇更多的低温胁迫,而细胞周期持续时间的调节与水杨酸有关[104]。前人的研究表明,突变体 Ospls1 早衰特征可能与SA信号转导相关途径有密切联系,SA在一定程度上可能会缩短植物生育期[105]。此外,Chen等观察到,与对照相比,轻度冷胁迫下外源施用200 mg/L SA显著提高水稻产量,平均增产达7.05%,这主要归因于弱势粒得到充分灌浆,而对强势粒充实没有显著影响[106]。
3.3 适宜播期和合理施肥
日平均温度、有效积温等温度指标是影响水稻产量的主要指标,而较早的播期有利于避开单季稻灌浆结实期低温危害的风险。王文婷以沿江地区水稻种植为例,中熟中粳品种、迟熟中粳品种理论适宜播种期分别为5月10—24日及5月10—20日[107]。魏喜陆等报道,寒地水稻在选择耐低温品种的前提下,采取日排夜灌的间断灌溉方式可以有效预防夜间冷水害[108]。
合理施肥是实现水稻高产稳产的重要手段。科学的氮肥运筹能够提高产量和品质,前人在研究高海拔寒地氮肥运筹中发现,在60 kg/hm2施氮量下,较适宜的运筹比例为基蘖肥 ∶ 穗肥=7 ∶ 3,不仅前期形成了足够的有效穗数,还能给后期光合生产提供充足能量,有助于灌浆物质的积累[109]。此外,有学者提出,低温胁迫下增施磷肥可提高水稻可溶性糖含量、脯氨酸含量、CAT活性,并使水稻保持较低的丙二醛含量和酶活性降解幅度,其有效穗数及千粒质量显著增加[110]。曹娜等报道,叶面喷施03%磷酸二氢钾能够有效提高双季杂交早稻幼穗分化期抵御低温的能力[111]。近来又有研究表明,含有环氧基的纳米硅通过调节植物体内各项生理代谢过程,可以有效提高水稻抗低温能力,增产达30.42%[112]。
4 研究存在的问题与展望
4.1 评价标准需统一
水稻是典型的低温敏感型作物,冷害严重影响其产量和品质。自20世纪80年代以来,尤其是近些年来极端低温天气频发,科学家们希望能够通过预防或缓解水稻冷害来调节作物生育进程,从而避免低温灾害并实现提质增效,因此耐冷性水稻品种培育及利用栽培调控途径, 一直都是工作者们努力奋斗的目标。抗逆育种在我国耕地面积逐渐减少的背景下显得愈发重要,水稻耐冷性是一个由多基因控制的数量性状,所以,基因组学和分子定位等技术的研究和利用为水稻耐冷育种的发展起到了重要作用。关于水稻耐冷性基因的挖掘和基因编辑的探索日益深入,由于水稻全生育期都会发生低温冷害,前人对水稻不同时期的耐冷数量性状座位(QTL)做了大量研究, 在12条染色体上共发现270个耐冷性QTL,根据冷害发生时期,芽期、苗期及孕穗期分别检测到97、108、65 个耐冷性QTL[38],但是,由于所用试验材料众多、测定方法以及判断指标不一,使得全面了解冷害机制一直倍受困扰。因此,科学家们可以加强交流,从不同地域、不同方面对同一个耐冷性基因进行深入全面的挖掘发现,同时加强水稻耐冷性评价体系标准的一致性。
4.2 研究机理需深入
水稻冷害的发生与籽粒灌浆酶活性、激素以及糖代谢水平有关。低温下,籽粒自身生理活性即淀粉合成关键酶活性下降,从而限制籽粒充实,此相关分子机制仍不清楚。相关激素和糖代谢过程如何调节冷害的相关机理也未能全面了解,特别是低温下各种激素间的互作需要进一步探究,此外,不同外源植物激素对水稻冷害的调控机理存在共性和特性,发现并利用其规律具有重要作用。通过分子定位发现耐冷新基因,从激素分子信号转导角度深化水稻耐冷的代谢调控网络,多方面解析其生理机制,这对于理解植物感知低温以及水稻耐冷分子设计育种具有重要意义,对中国超级杂交稻亲本和其他籼粳稻的耐冷性改良以及水稻的稳产具有潜在的应用价值。简言之,在结合抗逆育种以及外源激素调控栽培的基础上,使用基因工程方法靶向性地增强水稻耐冷性,从而改良水稻品種,同时合理利用栽培调控技术,共同应对大环境下的水稻冷害情况,提高其产量和品质。
4.3 调控措施需配套
同时科学家们对水稻耐冷性的研究更多在于培育新型品种以及分子育种方面,对栽培调控措施和农艺生理性状的探索发现较少,一定程度上限制了对冷害相关基因的功能解析。合理使用应对措施是预防和缓解冷害的有效手段,例如根据品种生育期合理安排播期,以确保水稻安全齐穗,尽量避免孕穗期及籽粒灌浆初期遭遇低温。此外,加强水肥管理和施加外源植物激素也可以提高水稻产量,目前,笔者以粳稻南粳9108和杂交稻徽两优898为材料,模拟灌浆初期低温环境,外源喷施MT、Spd、MJ、SA、ABA和GA3等植物激素,从农艺性状、生理机制和籽粒产量等方面观察其发挥的作用,旨在为水稻低温冷害提供辅助调控措施,尤其是已经遭遇冷害的情况下,缓解低温冷害的栽培调控措施显得极为重要;对于水稻冷害的研究偏向于籽粒产量及其构成因素的变化方面,今后还需深入探究外源激素对稻米品质的影响。
参考文献:
[1] 聂元元,蔡耀辉,颜满莲,等. 水稻低温冷害分析研究进展[J]. 江西农业学报,2011,23(3):63-66.
[2]李健陵,霍治国,吴丽姬,等. 孕穗期低温对水稻产量的影响及其生理机制[J]. 中国水稻科学,2014,28(3):277-288.
[3]刘琳帅,卞景阳,孙兴荣,等. 水稻低温冷害的研究进展[J]. 江苏农业科学,2022,50(24):9-15.
[4]吴 立,霍治国,姜 燕,等. 气候变暖背景下南方早稻春季低温灾害的发生趋势与风险[J]. 生态学报,2016,36(5):1263-1271.
[5]韩龙植,高熙宗,朴钟泽. 水稻耐冷性遗传及基因定位研究概况与展望[J]. 中国水稻科学,2002,16(2):193-198.
[6]陈红阳,贾 琰,赵宏伟,等. 结实期低温胁迫对水稻强、弱势粒淀粉形成与积累的影响[J]. 中国水稻科学,2022,36(5):487-504.
[7]朱 红. 抽穗后低温胁迫对水稻若干生理特性的影响[D]. 合肥:安徽农业大学,2015.
[8]Zeng Z C,Zhang S C,Li W Y,et al. Gene-coexpression network analysis identifies specific modules and hub genes related to cold stress in rice[J]. BMC Genomics,2022,23(1):251.
[9]曾研华,张玉屏,潘晓华,等. 花后低温对水稻籽粒灌浆与内源激素含量的影响[J]. 作物学报,2016,42(10):1551-1559.
[10] 束 胜,袁凌云,王长义,等. 植物生长调节物质提高蔬菜作物抗逆性的研究进展[J]. 长江蔬菜,2013(16):1-12.
[11]唐 璇,吕树伟,范芝兰,等. 水稻耐冷性鉴定研究进展[J]. 植物遗传资源学报,2023,24(2):325-331.
[12]Saito K,Hayano-Saito Y,Kuroki M,et al. Map-based cloning of the rice cold tolerance gene Ctb1[J]. Plant Science,2010,179(1/2):97-102.
[13]Xie H G,Jiang J H,Zheng Y M,et al. Development of hybrid rice variety FY7206 with blast resistance gene Pid3 and cold tolerance gene Ctb1 [J]. Rice Science,2016,23(5):266-273.
[14]王文霞,吴自明,曾勇军,等. 水氮耦合对直播早籼稻苗期低温冷害的调控效应[J]. 作物杂志,2023(2):83-90.
[15]杨 丽,李 洋,王佳勤,等. 孕穗期低温对小麦幼穗发育及产量的影响[J]. 核农学报,2022,36(12):2490-2500.
[16]耿立清,张凤鸣,许显滨,等. 低温冷害对黑龙江水稻生产的影响及防御对策[J]. 中国稻米,2004,10(5):33-34.
[17]王主玉,申双和. 水稻低温冷害研究进展[J]. 安徽农业科学,2010,38(22):11971-11973.
[18]马文东. 2009年低温冷害对黑龙江省垦区水稻的影响[J]. 种子,2012,31(10):80-81,85.
[19]陶乐圆,刘智蕾,刘婷婷,等. 营养生长期低温持续时间与水稻生长恢复的关系[J]. 生态学杂志,2018,37(12):3610-3616.
[20]金正勋,杨 静,钱春荣,等. 灌浆成熟期温度对水稻籽粒淀粉合成关键酶活性及品质的影响[J]. 中国水稻科学,2005,19(4):377-380.
[21]胡春丽,李 辑,林 蓉,等. 东北水稻障碍型低温冷害变化特征及其与关键生育期温度的关系[J]. 中国农业气象,2014,35(3):323-329.
[22]郭丽颖,耿艳秋,金 峰,等. 寒地水稻低温冷害防御栽培技术研究进展[J]. 作物杂志,2017(4):7-14.
[23]蔡志欢,张桂莲. 水稻低温冷害研究进展[J]. 作物研究,2018,32(3):249-255.
[24]尹思慧,徐蒋来,朱利群. 近30年江苏省水稻抽穗灌浆期低温冷害时空变化及对水稻产量的影响[J]. 江西农业学报,2016,28(5):7-13.
[25]王 静,张成军,陈国祥,等. 低温对灌浆期水稻剑叶光合色素和类囊体膜脂肪酸的影响[J]. 中国水稻科学,2006,20(2):177-182.
[26]张金恩,聂秋生,李迎春,等. 颖花分化期低温处理对早稻叶片光合能力和产量的影响[J]. 中国农业气象,2014,35(4):410-416.
[27]朱 珊,李永辉,熊宏亮,等. 低温胁迫对孕穗期水稻叶片内源激素的影响[J]. 江西农业大学学报,2014,36(1):21-25.
[28]王 丹,肖应辉. 水稻孕穗期耐寒基因研究进展[J]. 中国农业信息,2015(11):97,108.
[29]Mamun E A,Alfred S,Cantrill L C,et al. Effects of chilling on male gametophyte development in rice[J]. Cell Biology International,2006,30(7):583-591.
[30]Takahashi S,Meguro-Maoka A,Yoshida M. Analysis of sugar content and expression of sucrose transporter genes (OsSUTs) in rice tissues in response to a chilling temperature[J]. Japan Agricultural Research Quarterly,2017,51(2):137-146.
[31]Oliver S N,Van Dongen J T,Alfred S C,et al. Cold-induced repression of the rice anther-specific cell wall invertase gene OSINV4 is correlated with sucrose accumulation and pollen sterility[J]. Plant,Cell and Environment,2005,28(12):1534-1551.
[32] Al Mamun E,Cantrill L C,Overall R L,et al. Mechanism of low-temperature-induced pollen failure in rice[J]. Cell Biology International,2010,34(5):469-476.
[33]胡博文,谷嬌娇,贾 琰,等. 盐胁迫对寒地粳稻籽粒淀粉形成积累及产量的影响[J]. 华北农学报,2019,34(1):115-123.
[34]夏 楠,赵宏伟,吕艳超,等. 灌浆结实期冷水胁迫对寒地粳稻籽粒淀粉积累及相关酶活性的影响[J]. 中国水稻科学,2016,30(1):62-74.
[35]Commuri P D,Keeling P L. Chain-length specificities of maize starch synthase Ⅰ enzyme:studies of glucan affinity and catalytic properties[J]. The Plant Journal,2001,25(5):475-486.
[36]Nishi A,Nakamura Y,Tanaka N,et al. Biochemical and genetic analysis of the effects of amylose-extender mutation in rice endosperm[J]. Plant Physiology,2001,127(2):459-472.
[37]柴晓杰. 玉米淀粉分支酶基因表达调控的研究[D]. 长春:吉林农业大学,2005.
[38]程方民,钟连进,孙宗修. 灌浆结实期温度对早籼水稻籽粒淀粉合成代谢的影响[J]. 中国农业科学,2003,36(5):492-501.
[39]杨洛淼. 水稻孕穗期耐冷性QTL的遗传解析[D]. 哈尔滨:东北农业大学,2018.
[40]Lyu Y,Hussain M A,Luo D,et al. Current understanding of genetic and molecular basis of cold tolerance in rice[J]. Molecular Breeding,2019,39(12):1-18.
[41]Kim Y S,Lee M,Lee J H,et al. The unified ICE-CBF pathway provides a transcriptional feedback control of freezing tolerance during cold acclimation in Arabidopsis[J]. Plant Molecular Biology,2015,89(1):187-201.
[42]Chinnusamy V,Zhu J H,Zhu J K. Cold stress regulation of gene expression in plants[J]. Trends in Plant Science,2007,12(10):444-451.
[43]Covington M F,Maloof J N,Straume M,et al. Global transcriptome analysis reveals circadian regulation of key pathways in plant growth and development[J]. Genome Biology,2008,9(8):R130.
[44]周 炎. 水稻生物钟参与低温胁迫应答的机制研究[D]. 长沙:湖南农业大学,2020.
[45]成京晋,李 浩,早浩龙,等. 植物响应低温胁迫的分子调控机制[J]. 分子植物育种,2021,19(9):3104-3115.
[46]Li C N,Ng C K Y,Fan L M. MYB transcription factors,active players in abiotic stress signaling[J]. Environmental and Experimental Botany,2015,114:80-91.
[47]Zhang T,Zhao X Q,Wang W S,et al. Comparative transcriptome profiling of chilling stress responsiveness in two contrasting rice genotypes[J]. PLoS One,2012,7(8):e43274.
[48]金铭路. 水稻微核心种质耐冷性鉴定及不同生长环境下耐冷性相關农艺性状的QTL检测[D]. 延吉:延边大学,2009.
[49]Ma Y,Dai X Y,Xu Y Y,et al. COLD1 confers chilling tolerance in rice[J]. Cell,2015,160(6):1209-1221.
[50]张明星. OsWRKY63 调控水稻耐冷性的分子机制研究[D]. 长春:吉林大学,2022.
[51]潘英华. 水稻芽期、孕穗期耐冷性关联分析、耐冷基因克隆与功能验证[D]. 北京:中国农业大学,2015.
[52]纪素兰,江 玲,王益华,等. 水稻种子耐低温发芽力的QTL定位及上位性分析[J]. 作物学报,2008,34(4):551-556.
[53]Ji S L,Jiang L,Wang Y H,et al. Quantitative trait loci mapping and stability for low temperature germination ability of rice[J]. Plant Breeding,2009,128(4):387-392.
[54]Hou M Y,Wang C M,Jiang L,et al. Inheritance and QTL mapping of low temperature germinability in rice (Oryza sativa L.)[J]. Journal of Genetics and Genomics,2004,31(7):701-706.
[55]Fujino K,Sekiguchi H,Matsuda Y,et al. Molecular identification of a major quantitative trait locus, qLTG3-1 ,controlling low-temperature germinability in rice[J]. Proceedings of the National Academy of Sciences of the United States of America,2008,105(34):12623-12628.
[56]Satoh T,Tezuka K,Kawamoto T,et al. Identification of QTLs controlling low-temperature germination of the East European rice (Oryza sativa L.) variety Maratteli[J]. Euphytica,2016,207(2):245-254.
[57]乔永利,韩龙植,安永平,等. 水稻芽期耐冷性QTL的分子定位[J]. 中国农业科学,2005,38(2):217-221.
[58]Jiang L,Liu S J,Hou M Y,et al. Analysis of QTLs for seed low temperature germinability and anoxia germinability in rice (Oryza sativa L.)[J]. Field Crops Research,2006,98(1):68-75.
[59]Xie L X,Tan Z W,Zhou Y A,et al. Identification and fine mapping of quantitative trait loci for seed vigor in germination and seedling establishment in rice[J]. Journal of Integrative Plant Biology,2014,56(8):749-759.
[60]严长杰,李 欣,程祝宽,等. 利用分子标记定位水稻芽期耐冷性基因[J]. 中国水稻科学,1999,13(3):134-138.
[61]Kuroki M,Saito K,Matsuba S,et al. A quantitative trait locus for cold tolerance at the booting stage on rice chromosome 8[J]. Theoretical and Applied Genetics,2007,115(5):593-600.
[62]Jiang N F,Shi S L,Shi H,et al. Mapping QTL for seed germinability under low temperature using a new high-density genetic map of rice[J]. Frontiers in Plant Science,2017,8:1223.
[63]Li L F,Liu X,Xie K,et al. qLTG-9,a stable quantitative trait locus for low-temperature germination in rice (Oryza sativa L.)[J]. Theoretical and Applied Genetics,2013,126(9):2313-2322.
[64]Li J L,Pan Y H,Guo H F,et al. Fine mapping of QTL qCTB10-2 that confers cold tolerance at the booting stage in rice[J]. Theoretical and Applied Genetics,2018,131(1):157-166.
[65] 周 勇,王中德,陶亚军,等. 水稻苗期耐冷性相关QTL qCTS3- 1的鉴定和分子定位[J]. 江苏农业学报,2013,29(6):1181-1186.
[66]Andaya V C,Tai T H. Fine mapping of the qCTS4 locus associated with seedling cold tolerance in rice (Oryza sativa L.)[J]. Molecular Breeding,2007,20(4):349-358.
[67]Wang Z F,Wang F H,Zhou R,et al. Identification of quantitative trait loci for cold tolerance during the germination and seedling stages in rice (Oryza sativa L.)[J]. Euphytica,2011,181(3):405-413.
[68]王 棋,范淑秀,郭江华,等. 利用籼粳交RIL群体对水稻发芽期和苗期耐冷性的QTL分析[J]. 华北农学报,2019,34(1):83-88.
[69]Li C J,Liu J D,Bian J X,et al. Identification of cold tolerance QTLs at the bud burst stage in 211 rice landraces by GWAS[J]. BMC Plant Biology,2021,21(1):542.
[70]史红丽. 水稻孕穗期耐冷基因 qCTB7 的精细定位和 CTB4a 的分子机制研究[D]. 北京:中国农业大学,2017.
[71]吕 彬,杨 庆,李大林,等. 耐冷优质水稻新品种龙粳65的选育及高产栽培、良种繁育技术[J]. 北方水稻,2021,51(2):39-40,43.
[72]趙海成,李红宇,郑桂萍,等. 寒地水稻新品种垦粳8号的选育及栽培技术[J]. 黑龙江农业科学,2021(1):165-168.
[73]郭震华. 水稻新品种龙粳3033的选育及配套栽培技术[J]. 黑龙江农业科学,2021(8):143-145.
[74]高世伟,聂守军,刘 晴,等. 优质、抗逆、香型水稻新品种绥粳28的选育及应用前景分析[J]. 中国稻米,2019,25(4):106-108.
[75]杜欣芮,臧家祥,孙 伟,等. 水稻新品种垦稻90的选育及栽培要点[J]. 现代化农业,2020(12):37-38.
[76]吴立成,闫 平. 优质粳稻新品种松粳28的选育及应用[J]. 黑龙江农业科学,2020(1):137-138.
[77]张海彬,李晓蕾,宗淑娟. 水稻新品种——龙垦227[J]. 现代化农业,2019(6):34-35.
[78]程芳艳,李春光,刘永巍,等. 寒地优质水稻新品种垦研017的选育及栽培技术[J]. 北方水稻,2019,49(6):50-51,53.
[79]宋成艳,刘乃生,周雪松,等. 水稻新品种龙粳69的选育及特征特性[J]. 北方水稻,2018,48(6):56-57.
[80]张海彬,宗淑娟,李晓蕾. 水稻新品种——龙垦223[J]. 现代化农业,2018(10):38-39.
[81]Hardeland R. Melatonin and the theories of aging:a critical appraisal of melatonins role in antiaging mechanisms[J]. Journal of Pineal Research,2013,55(4):325-356.
[82]Zhang N,Sun Q Q,Zhang H J,et al. Roles of melatonin in abiotic stress resistance in plants[J]. Journal of Experimental Botany,2015,66(3):647-656.
[83]單莉莉. 孕穗期低温对水稻叶片生理、产量的影响及外源褪黑素缓解效应[J]. 中国农业科技导报,2023,25(9):23-33.
[84]李 贺,姜欣悦,陈忠诚,等. 外源褪黑素对低温胁迫下大豆V1期幼苗光合荧光及抗氧化系统的影响[J]. 中国油料作物学报,2020,42(4):640-648.
[85]董 倩. N-乙酰-L-半胱氨酸、褪黑素引发对低温胁迫下杂交水稻种子萌发和幼苗生长及基因表达的影响[D]. 杭州:浙江大学,2020.
[86]朱春权,魏倩倩,项兴佳,等. 褪黑素和茉莉酸甲酯基质育秧对水稻耐低温胁迫的调控作用[J]. 作物学报,2022,48(8):2016-2027.
[87]王文娟,师尚礼,何 龙,等. 干旱胁迫下多胺在植物体内的积累及其作用[J]. 草业学报,2023,32(6):186-202.
[88]Imai A,Matsuyama T,Hanzawa Y,et al. Spermidine synthase genes are essential for survival of Arabidopsis[J]. Plant Physiology,2004,135(3):1565-1573.
[89]Imai R,Ali A,Pramanik M H R,et al. A distinctive class of spermidine synthase is involved in chilling response in rice[J]. Journal of Plant Physiology,2004,161(7):883-886.
[90]Choubey A,Rajam M V. RNAi-mediated silencing of spermidine synthase gene results in reduced reproductive potential in tobacco[J]. Physiology and Molecular Biology of Plants,2018,24(6):1069-1081.
[91]Zeng Y H,Zhang Y P,Xiang J,et al. Effects of chilling tolerance induced by spermidine pretreatment on antioxidative activity,endogenous hormones and ultrastructure of indica-japonica hybrid rice seedlings[J]. Journal of Integrative Agriculture,2016,15(2):295-308.
[92]杨建昌,朱庆森,王志琴,等. 水稻籽粒中内源多胺及其与籽粒充实和粒重的关系[J]. 作物学报,1997,23(4):385-392.
[93]Aldridge D C,Galt S,Giles D,et al. Cheminform abstract:metaboliten von Lasiodiplodia theobromae[J]. Chemischer Informationsdienst Organische Chemie,1971,2(32):1623-1627.
[94]Liu Z,Zhang S M,Sun N,et al. Functional diversity of jasmonates in rice[J]. Rice,2015,8(1):42.
[95]Allah E F A,Alqarawi A,Al-Rashed S,et al. Modulation of adverse impact of chilling in Vicia faba L. by methyl jasmonate involves changes in antioxidant metabolism and metabolites[J]. Pakistan Journal of Botany,2016,48(5):1915-1923.
[96]Hu Y R,Jiang Y J,Han X,et al. Jasmonate regulates leaf senescence and tolerance to cold stress:crosstalk with other phytohormones[J]. Journal of Experimental Botany,2017,68(6):1361-1369.
[97]Singh I,Shah K. Exogenous application of methyl jasmonate lowers the effect of cadmium-induced oxidative injury in rice seedlings[J]. Phytochemistry,2014,108:57-66.
[98]Tang S,Zhao Y F,Ran X A,et al. Exogenous application of methyl jasmonate at the booting stage improves rices heat tolerance by enhancing antioxidant and photosynthetic activities[J]. Agronomy,2022,12(7):1573.
[99]张 蕊,吕 俊,米青山,等. 低温下外源水杨酸对水稻幼苗抗氧化酶系的影响[J]. 西南农业大学学报(自然科学版),2006,28(1):29-32,36.
[100] 鮮先毅,冯德玉,崔广艳,等. 外源水杨酸对水稻幼苗盐胁迫下生理效应的影响[J]. 绵阳师范学院学报,2014,33(2):75-80.
[101]Wang W L,Wang X,Huang M,et al. Alleviation of field low-temperature stress in winter wheat by exogenous application of salicylic acid[J]. Journal of Plant Growth Regulation,2021,40(2):811-823.
[102]Shim I S,Momose Y,Yamamoto A,et al. Inhibition of catalase activity by oxidative stress and its relationship to salicylic acid accumulation in plants[J]. Plant Growth Regulation,2003,39(3):285-292.
[103]Miura K,Tada Y. Regulation of water,salinity,and cold stress responses by salicylic acid[J]. Frontiers in Plant Science,2014,5:4.
[104]Xia J C,Zhao H,Liu W Z,et al. Role of cytokinin and salicylic acid in plant growth at low temperatures[J]. Plant Growth Regulation,2009,57(3):211-221.
[105]杨 茜. 水稻叶片早衰基因 OsPLS1 的功能研究[D]. 杭州:浙江大学,2016.
[106] Chen T T,Zhao X A,Zhang C X,et al. Application of salicylic acid improves filling of inferior grains of rice during late maturity under mild cold stress[J]. Crop Science,2017,57(4):2130-2142.
[107]王文婷. 播期对直播稻产量形成与品质的影响[D]. 扬州:扬州大学,2015.
[108]魏喜陆,郑新峰. 三江平原腹地水稻低温冷害问题分析[J]. 现代化农业,2003(3):15-17.
[109]李景蕻. 高海拔生态区氮肥运筹和增温措施对水稻生长发育的影响及高产栽培技术研究[D]. 南京:南京农业大学,2009.
[110]李跃娜. 低温胁迫下不同磷素营养水平对水稻生理特性及产量的影响[D]. 长春:吉林大学,2011.
[111]曹 娜,陈小荣,贺浩华,等. 幼穗分化期喷施磷钾肥对早稻抵御低温及产量和生理特性的影响[J]. 应用生态学报,2017,28(11):3562-3570.
[112]徐泽华. 在低温胁迫下外源硅对寒地粳稻叶片生理生化指标的影响[D]. 哈尔滨:东北农业大学,2018.
收 稿日期:2023-07-03
基金项目: 淮安市自然科学研究计划(联合专项)(编号:HABL202122)。
作者简介:李 可(1997—),女,安徽蚌埠人,硕士,研究实习员,从事植物逆境生理与栽培调控研究。E-mail:lk2311586@163.com。
通信作者:顾大路,硕士,研究员,从事作物调控技术研究。E-mail:gudalu666@aliyun.com。

