干旱胁迫对青稞幼苗小分子代谢成分的影响
雷东花 王楚轶 王紫阳 赵昊民 康志钰

摘要: 为探究短期干旱胁迫下不同耐旱性青稞幼苗小分子代谢物的变化,以青稞品种(滇青1号和滇青2号)为材料,用20%聚乙二醇(PEG)模拟干旱胁迫,采用气相质谱-色谱联用仪(GC-MS)对处理组(24 h)和对照组(0 h)的代谢组学进行分析,研究干旱胁迫下青稞的代谢物质变化。结果表明,2个处理组(D1-0与D1-24、D2-0与D2-24)分别有24、10个差异代谢物,其中差异代谢物木糖醇、D-葡萄糖、1-单棕榈素、甘油、乙酰基-L-赖氨酸在2个处理组中共有。对2个处理组的差异代谢物进行分析,发现D1-0与D1-24在胁迫24 h的差异代谢物多于 D2-0 与D2-24,在D1-0与D1-24中,糖类及多元醇主要以上调为主,而有机酸和氨基酸主要以下调为主;在 D2-0 与D2-24中发现,糖类及多元醇以上调表达为主。还发现D-葡萄糖、木糖醇、甘油在2个处理组中都是上调表达,而乙酰基-L-赖氨酸、尸胺都是下调表达。KEGG通路分析发现,氨基酸途径在2个处理组中分别有5、1条通路,而碳水化合物途径分别有3、2条通路,其中D1-0与D1-24主要在氨基酸途径中富集,D2-0与D2-24在碳水化合物途径中富集。由此可知在应对短期干旱胁迫时,青稞幼苗主要通过积累木糖醇、D-葡萄糖、甘油、乙酰基-L-赖氨酸等差异代谢物抵御干旱,还发现通路分析中的氨基酸代谢通路和碳水化合物代谢通路与青稞抗旱性密切相关。
关键词: 青稞;干旱胁迫;代谢组;差异代谢物;GC-MS技术;KEGG分析
中图分类号:S512.301 文献标志码:A
文章编号:1002-1302(2024)02-0051-06
干旱是影响农业生产的全球性问题,能使农作物减产达50%以上,由此带来巨大的经济损失[1-2]。青稞主要种植在气温低、海拔高、环境比较恶劣的地方,在这种环境长期的驯化下使得其逐渐适应并生活下来,也由此获得了耐旱、耐寒等优异特性[3-4]。对青稞进行抗旱性研究有助于抗旱基因的发掘和应用,也有助于其他作物抗旱性的遗传与育种研究。作物的幼苗在面对逆境时其抵抗能力减弱[5],这是由于幼苗对逆境胁迫的忍受能力弱,使得作物在幼苗期就停止了生长,所以对作物幼苗期的研究是当下研究的重中之重[6-7]。对于青藏人民来说,由于青稞是他们的主食,所以必要的研究可以促进当地的经济增长和社会稳定[8]。
代谢组学是分子生物学研究领域中广泛使用的生物技术工具[9-10],大多应用于植物对逆境胁迫的分子响应机制,用来评估某一特定代谢物质或代谢途径中的代谢水平[11-12],包括用气相色谱-质谱、液相色谱-质谱(GC-MS)、核磁共振、高效液相色谱和毛细管电泳-质谱等多种方法鉴定植物、微生物等在各种逆境胁迫下的反应机制[13]。该技术已经用于冬小麦[14]、野生大豆[15]、藜麦[16]、紫花苜蓿[17]、长白落叶松[18]、高羊茅[19]、黄芪[20]等的抗旱性研究,从中可以看出脂类、糖类和氨基酸类代谢物是影响较大的几类。代谢组学可以反映植物应对干旱的生理生化变化,从而揭示植物的抗旱机制。本研究用2个抗旱性不同的青稞品种(滇青1号抗旱性强于滇青2号)在20%PEG中处理24 h后,应用GC-MS技术分析小分子代谢物的变化,明确其抗旱机制,为青稞的抗旱性育种提供理论依据。
1 材料与方法
1.1 供试材料与处理
试验材料是由云南农业大学自主培育的2个青稞品种,分别为滇青1号和滇青2号,经研究发现其抗旱性不同[21]。将滇青1号和滇青2号种子用10%过氧化氢消毒40 min,之后用蒸馏水冲洗4~5次。将青稞种子放入有吸水纸的发芽盒中,用蒸馏水浸湿,每个发芽盒50粒种子,先放入25 ℃的黑暗培养箱中催芽,待第1张真叶可见时,转入温度为23~25 ℃培养箱(湿度75%~80%,光—暗周期为 12 h—12 h),期间加少量水保证种子正常生长。待2张真叶可见时,加入1/2的霍格兰水培营养液,每 2 d 换1次。3叶期在营养液中加入20%的PEG模拟中度干旱。将滇青1号和滇青2号分别标记为D1和D2,并分别在干旱胁迫0、24 h时取样,标记为D1-0、D1-24、D2-0、D2-24,叶片迅速用液氮冷冻,用于代谢组学测定。每个处理3个生物学重复。
1.2 代谢物提取和测定
代谢物的提取和测定参照Lisec等的方法[22-24]稍作修改进行。采用7890A/5975B GC-MS气相色谱和质谱联用仪(安捷伦公司)进行。
气相参数设置:进样口的温度为280 ℃,柱流量2 mL/min;初始温度为80 ℃,反应2 min,之后以 15 ℃/min 的速度增长到230 ℃,反应10 min。
质谱参数设置:电子轰击离子源(EI),电子能量70 eV。傳输线温度:250 ℃,离子源的温度为 230 ℃,四极杆的温度为150 ℃。采用全扫描模式进行质谱检测,扫描范围为70~600质荷比,溶剂延迟时间3 min。
1.3 数据处理与分析
得到的GC-MS数据用Excel 2010进行整理,主成分分析(PCA)、差异代谢物筛选、KEGG富集分析用在线软件MetaboAnalyst5.0(https://www.Metaboanalyst.ca/)进行。Venn图、热图用TBtools(https://github.com/CJ-Chen/TBtools)软件制作。
2 结果与分析
2.1 青稞叶片代谢物主成分分析
首先对数据进行归一化处理,根据主成分分析可知(图1),不同处理下的3个样本相互聚集,说明试验重复性好。第1主成分把D1-0、D2-0和 D1-24、D2-24分离, 解释样品总变化量的40.7%。 第2主成分把D1-0和D2-0、D2-24明显分离,其中D1-24分离不明显,解释样品总变化量的33.0%。第1主成分中D1-0和D2-24分离明显,而D1-0和D2-0在第2主成分中分离明显。
2.2 青稞叶片24 h干旱处理下的差异代谢物筛选
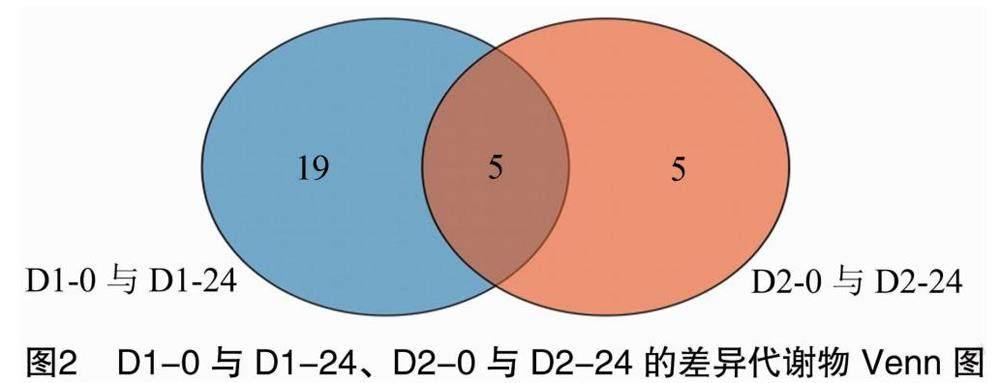
试验数据采取t检验和正交偏最小二乘法得出的VIP值来筛选差异代谢物(VIP>1,P<0.05)。对干旱胁迫24 h的2个处理组作Venn图分析(图2),D1-0与D1-24、D2-0与D2-24分别有24、10个差异代谢物,2个处理组共有5个差异代谢物,分别是木糖醇、D-葡萄糖、1-单棕榈素、甘油、乙酰基-L-赖氨酸。说明青稞在干旱胁迫24 h时,糖类及多元醇、氨基酸和有机酸发挥了重要作用。
2.3 青稞叶片24 h干旱处理下差异代谢物聚类热图分析
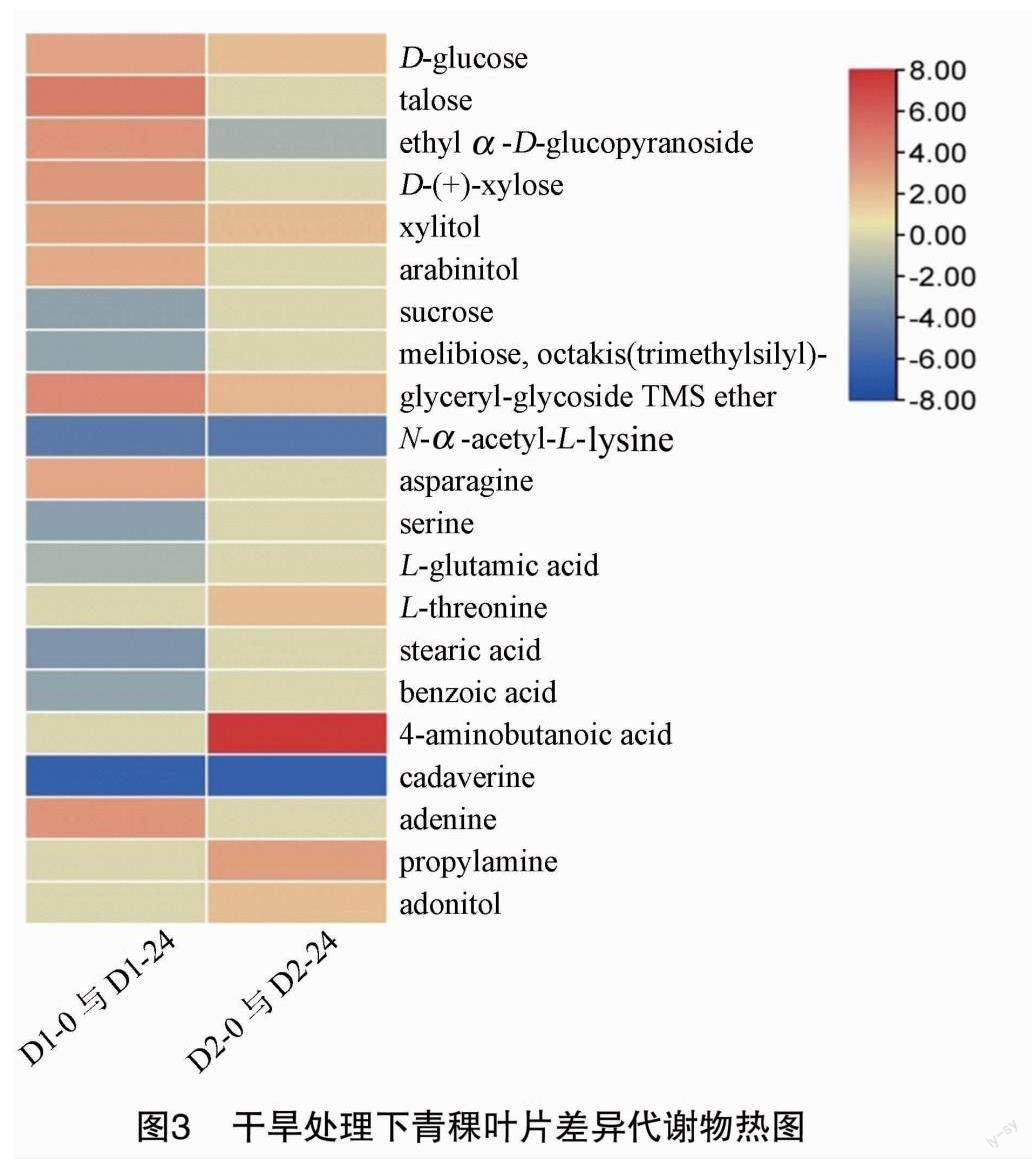
对2个处理组(D1-0与D1-24、D2-0与D2-24)的差异代谢物的差异倍数作热图分析(图3),发现D1-0与D1-24在胁迫24 h的差异代谢物多于D2-0与D2-24,D1-0与D1-24有9个上调,8个下调,而D2-0与D2-24有7个上调,3个下调。在D1-0与D1-24中,糖类及多元醇主要以上调为主,而氨基酸和有机酸主要以下调为主;在D2-0与D2-24中,糖类及多元醇以上调表达为主(表1)。塔罗糖(talose)、D-(+)-木糖[D-(+)-xylose]、阿拉伯糖醇(arabinitol)、蔗糖 (sucrose)、蜜二糖[melibiose,octakis(trimethylsilyl)-] 、天冬酰胺(asparagine)、丝氨酸(serine)、L-谷氨酸(L-glutamic acid)、硬脂酸(stearic acid)、苯甲酸(benzoic acid)、腺嘌呤(adenine)只在D1-0与 D1-24 处理组中表达;而L-苏氨酸(L-threonine)、4-氨基丁酸(4-aminobutanoic acid)、丙烯胺(propylamine)、腺苷醇(adonitol)只在D2-0与D2-24处理组中表达,由此可说明这些代谢物的表达影响了2个青稞品种耐旱性的差异。还发现D-葡萄糖(D-glucose)、木糖醇(xylitol)、甘油(glyceryl-glycoside TMS ether)在2个处理组中都是上调表达,而乙酰基-L-赖氨酸(N-alpha-acetyl-L-lysine)、尸胺(cadaverine)都是下调 表达,乙基-α-D-吡喃葡萄糖苷(ethyl-alpha-D- glucopyranoside)在D1-0与D1-24处理组中上调表达,在D2-0与D2-24处理组中下调表达,说明D-葡萄糖、木糖醇、甘油、乙酰基-L-赖氨酸、尸胺、乙基-α-D-吡喃葡萄糖苷代谢物对青稞的耐旱性发挥了积极的作用。
2.4 干旱处理24 h下青稞叶片差异代谢物KEGG富集分析和注释
将得到的差异代谢物注释到KEGG通路上并进行通路富集分类分析(图4)。D1-0与D1-24、D2-0与D2-24分别注释了11、4条代谢通路(P<0.05),抗旱性强的D1在干旱胁迫24 h下激活了更多的代谢通路,还发现新霉素、卡那霉素和庆 大霉素(neomycin,kanamycin and gentamicin biosynthesis)的生物合成在2个处理组中富集率均最高。本研究发现,D1-0与D1-24注释了5条氨基酸类代谢通路(表2),分别包括丙氨酸、天门冬氨酸和谷氨酸的代谢(alanine,aspartate and glutamate metabolism)、精氨酸的生物合成(arginine biosynthesis)、氨基酸-tRNA的生物合成(aminoacyl-tRNA biosynthesis)、组氨酸代谢(histidine metabolism)、精氨酸和脯氨酸的代谢(arginine and proline metabolism)(图4-A);而 D2-0 与D2-24注释了1条,为缬氨酸、亮氨酸和异亮氨酸的生物合成(valine,leucine and isoleucine biosynthesis)(图4-B)。D1-0与D1-24注释了3条碳水化合物通路,包括半乳糖代谢(galactose metabolism)、戊糖和葡萄糖醛酸的相互转化(pentose and glucuronate interconversions)、淀粉和蔗糖代谢(starch and sucrose metabolism);而D2-0與D2-24注释了2条碳水化合物通路(表2),包括戊糖和葡萄糖醛酸的相互转化、淀粉和蔗糖代谢。D1-0 与D1-24注释了1条脂质代谢通路,为不饱和脂肪酸的生物合成(biosynthesis of unsaturated fatty acids)。研究发现戊糖和葡萄糖醛酸的相互转化、淀粉和蔗糖代谢同时在2个处理组中,说明碳水化合物通路在2个处理组中显著富集,同时这些代谢物对青稞干旱胁迫的调控起到关键的作用。氨基酸代谢通路在D1-0与D1-24处理组中富集率较大,说明D1主要通过氨基酸代谢来抵御干旱胁迫;而碳水化合物代谢途径在D2-0与D2-24处理组中富集率较大,说明D2主要通过碳水化合物代谢来抵御干旱胁迫,可知2个抗旱性不同的品种通过不同的途径来抵御干旱胁迫。由此可说明,碳水化合物代谢和氨基酸代谢途径参与了2个不同抗性青稞在干旱胁迫中的响应。
3 讨论
植物对逆境胁迫的应答是一个复杂的过程,其中代谢的改变是极为重要的一步。在面对胁迫时,植物通过调节代谢网络刺激产生特殊代谢物来抵御各种逆境胁迫,也可以通过监测代谢产物的变化来揭示逆境胁迫下植物的应答机制,因此,研究作物逆境下的代谢物表达水平是了解作物抗逆机制的良好途径[25]。本研究应用GC-MS技术对2个耐旱性不同的青稞品种胁迫24 h,研究其代谢组学的变化,发现D1-0与D1-24在胁迫24 h的差异代谢物多于D2-0与D2-24,且D1-0与D1-24激活了更多的糖类及多元醇、有机酸、氨基酸,差异代谢物大多都以上调为主。有研究采用GC-MS技术探讨冬麦1号在不同温度下的代谢物质变化发现大部分氨基酸、糖类和有机酸代谢随着温度的降低显著升高,可以知道本研究与冬小麦通过大部分氨基酸、有机酸和糖类代谢的显著增加来抵御低温胁迫的研究[26]一致。说明青稞通过增加氨基酸、糖类及多元醇和有机酸等代谢物来抵御干旱胁迫。从Venn图中发现糖类及多元醇、氨基酸、有机酸在2个青稞品种中具有较高的表达水平,其中木糖醇、D-葡萄糖、1-单棕榈素、甘油、乙酰基-L-赖氨酸在干旱处理下的2个品种中都表达,与在拔节孕穗期小麦干旱胁迫下代谢物变化规律的研究中发现葡萄糖、木糖醇、海藻糖等含量显著表达的结果[27]一致,说明青稞在面对短暂干旱胁迫时通过木糖醇、D-葡萄糖、1-单棕榈素、甘油、乙酰基-L-赖氨酸代谢物来维持细胞内渗透压的稳定。有研究表明,在干旱胁迫下,耐旱小麦基因型的蔗糖含量较高[28],本研究发现蔗糖在耐旱品种D1中表达的结果与之一致。
而本研究中的1-单棕榈素、甘油等有机酸代谢物可以提供能量给各种分解和合成代谢途径的前体,使作物面对逆境胁迫时,可以维持生物正常的运行[29]。对2个处理组进行差异代谢物分析发现,D-葡萄糖、木糖醇、甘油、乙酰基-L-赖氨酸、尸胺、乙基-α-D-吡喃葡萄糖苷代谢物在2个处理组中都有表达,说明这些代谢物参与了青稞干旱胁迫。而各种糖代谢物的表达使逆境胁迫下细胞内的渗透达到平衡,从而有利于植物抵抗逆境[30]。
D1-0与D1-24、D2-0与D2-24有28个和20个差异代谢物分别被注释了11、4条代谢通路,D1中多条通路被激活来抵御干旱,其中D1-0与D1-24、D2-0与D2-24主要在氨基酸途径分别有5、1条通路,碳水化合物途径分别有3、2条通路富集。有研究表明植物对非生物胁迫的标志性反应是氨基酸代谢物的积累,因此氨基酸途径在抵御逆境对植物的侵害中发挥着极其重要的作用[31],这与本研究发现氨基酸代谢通路多于其他代谢通路的结果一致。而在D1-0与D1-24处理组中氨基酸代谢途径主要富集,其中差异代谢物天冬酰胺、丝氨酸、L-谷氨酸等显著表达,而丝氨酸作为光呼吸的产物,在一定程度上反映光呼吸的强弱,有研究发现在渗透胁迫下植物叶片中谷氨酸、丝氨酸等氨基酸会大量积累[32],还发现D1-0与D1-24的丝氨酸和L-谷氨酸下调,说明D1在干旱胁迫下通过下调来维持渗透压的稳定。而D2-0与D2-24处理组中碳水化合物代谢途径显著富集,其中D-葡萄糖、木糖醇、甘油等代谢物显著表达,其中糖类代谢除了可以生成大量的可溶性糖等代谢物,还可以促进植物的呼吸作用,通过吸收矿物质并合成有机物为植物的生长发育提供能量,还可以调节细胞渗透势,使植物在逆境环境下也可以正常生长[33-36]。通路富集分析还发现,戊糖和葡萄糖醛酸的相互转化、淀粉和蔗糖代谢在2个处理组中显著富集,说明糖类代谢在青稞干旱胁迫下发挥着显著作用,糖类的分解和合成会影响细胞的渗透性,而渗透能力的变化可以影响机体的抗逆能力,因此细胞内糖类的积累对细胞具有一定的保护作用,可以增强植物抗逆能力[37]。
4 结论
本研究采用GC-MS技术对2个青稞品种在干旱24 h下的代谢物进行分析。经过分析发现2个处理组(D1-0与 D1-24 、D2-0与D2-24)分别有24和10个差异代谢物,可知抗旱性强的D1青稞品种的代谢物多于抗旱性弱的D2青稞品种,其中木糖醇、D-葡萄糖、1-单棕榈素、甘油、乙酰基-L-赖氨酸在2个处理组中都有,说明干旱胁迫下糖类及多元醇、氨基酸和有机酸发挥着重要的作用。代谢物D-葡萄糖、木糖醇、甘油、乙酰基-L-赖氨酸、尸胺、乙基-α-D-吡喃葡萄糖苷在2个处理组中都有表达,说明这些代谢物在青稞干旱过程中发挥着显著的作用。在KEGG通路分析中发现,氨基酸途径在2个处理组中分别有5、1条通路,而碳水化合物途径分别有3、2条通路,其中D1-0与D1-24主要在氨基酸途径中富集,D2-0与D2-24在碳水化合物途径中富集,可知2个品种通过不同的代谢途径来抵御干旱胁迫。因此在干旱胁迫中,青稞品种主要通过氨基酸途径和碳水化合物途径来应对干旱。
参考文献:
[1] 唐益苗,赵昌平,高世庆,等. 植物抗旱相关基因研究进展[J]. 麦类作物学报,2009,29(1):166-173.
[2]降云峰,赵晋锋,马宏斌,等. 作物干旱研究进展[J]. 中国农学通报,2013,29(3):1-5.
[3]王兴荣,李 玥,张彦军,等. 青稞种质资源成株期抗旱性鉴定及抗旱指标筛选[J]. 作物学报,2022,48(5):1279-1287.
[4]李 洁,付 惠,姚晓华,等. 不同耐旱性青稞叶片差异蛋白分析[J]. 作物学报,2021,47(7):1248-1258.
[5]李小双,彭明春,黨承林. 植物自然更新研究进展[J]. 生态学杂志,2007,26(12):2081-2088.
[6]Engelbrecht B M J,Kursar T A,Tyree M T. Drought effects on seedling survival in a tropical moist forest[J]. Trees,2005,19(3):312-321.
[7]Han A R,Kim H J,Jung J B,et al. Seed germination and initial seedling survival of the subalpine tree species,Picea jezoensis,on different forest floor substrates under elevated temperature[J]. Forest Ecology and Management,2018,429:579-588.
[8]郑庆柱,谭海运,高 雪,等. 干旱、盐胁迫及盐旱复合胁迫对青稞幼苗生理生化特性的影响[J]. 江苏农业科学,2020,48(1):97-103.
[9]Wu X J,Cai K F,Zhang G P,et al. Metabolite profiling of barley grains subjected to water stress:to explain the genotypic difference in drought-induced impacts on malting quality[J]. Frontiers in Plant Science,2017,8:1547.
[10] Guo R,Shi L X,Jiao Y,et al. Metabolic responses to drought stress in the tissues of drought-tolerant and drought-sensitive wheat genotype seedlings[J]. AoB Plants,2018,10(2):ply016.
[11]Weckwerth W,Loureiro M E,Wenzel K,et al. Differential metabolic networks unravel the effects of silent plant phenotypes[J]. Proceedings of the National Academy of Sciences of the United States of America,2004,101(20):7809-7814.
[12]Miyako K,Atsushi F,Masanori A,et al. Unbiased characterization of genotype-dependent metabolic regulations by metabolomic approach in Arabidopsis thaliana[J]. BMC Systems Biology,2007,1(1):53.
[13]李亞娇,马培杰,龙忠富,等. 低磷与干旱胁迫下百脉根代谢组学分析[J]. 草地学报,2022,30(2):329-338.
[14]封 富. 冬小麦品种幼苗抗旱性差异的代谢组学分析[D]. 北京:中国农业科学院,2020:16-34.
[15]符 辉. 干旱胁迫下野大豆和大豆幼苗叶片代谢组学比较研究[D]. 长春:东北师范大学,2020:11-30.
[16]时羽杰,邬晓勇,唐 媛,等. 藜麦花期水分胁迫下的代谢组学分析[J]. 河南农业大学学报,2020,54(6):921-930.
[17]徐洪雨,李向林. 控水处理对紫花苜蓿抗寒性影响的代谢组学分析[J]. 草业学报,2020,29(1):106-116.
[18]熊欢欢,张含国,张 磊,等. 干旱胁迫下长白落叶松的代谢组学分析[J]. 东北林业大学学报,2019,47(4):1-7.
[19]李小冬,王小利,王 茜,等. 干旱胁迫下高羊茅叶片的代谢组学分析[J]. 中国草地学报,2016,38(5):59-65.
[20]刘 洋. 应用代谢组学对比研究两种黄芪响应UV-B和干旱胁迫的代谢基础[D]. 哈尔滨:东北林业大学,2018:75-90.
[21]施丹丹,王建军,朵惠民,等. PEG胁迫对2个青稞新品系种子萌发和幼苗生理生化特性的影响[J]. 云南农业大学学报(自然科学),2022,37(3):397-405.
[22]Lisec J,Schauer N,Kopka J,et al. Gas chromatography mass spectrometry-based metabolite profiling in plants[J]. Nature Protocols,2006,1(1):387-396.
[23]曾建斌. 西藏野生大麦低钾耐性机理研究[D]. 杭州:浙江大学,2015:60-61.
[24]全晓艳. 西藏野生大麦低氮耐性机理研究[D]. 杭州:浙江大学,2016:81-83.
[25]郭凤丹,王兴军,侯 蕾,等. 植物代谢组学研究进展[J]. 山东农业科学,2017,49(12):154-162.
[26]包雨卓,杨 宁,苍 晶,等. 冬小麦东农冬麦1号在不同温度下的代谢组学差异分析[J]. 麦类作物学报,2017,37(5):647-655.
[27]郭 瑞,周 际,杨 帆,等. 拔节孕穗期小麦干旱胁迫下生长代谢变化规律[J]. 植物生态学报,2016,40(12):1319-1327.
[28]Guo X Y,Xin Z Y,Yang T G,et al. Metabolomics response for drought stress tolerance in Chinese wheat genotypes (Triticum aestivum)[J]. Plants,2020,9(4):520.
[29]Farooq M,Wahid A,Kobayashi N,et al. Plant drought stress:effects,mechanisms and management[J]. Agronomy for Sustainable Development,2009,29(1):185-212.
[30]Widodo,Patterson J H,Newbigin E,et al. Metabolic responses to salt stress of barley (Hordeum vulgare L.) cultivars,Sahara and Clipper,which differ in salinity tolerance[J]. Journal of Experimental Botany,2009,60(14):4089-4103.
[31]Huang T F,Jander G.Abscisic acid-regulated protein degradation causes osmotic stress-induced accumulation of branched-chain amino acids in Arabidopsis thaliana[J]. Planta,2017,246(4):737-747.
[32]Obata T,Fernie A R.The use of metabolomics to dissect plant responses to abiotic stresses[J]. Cellular and Molecular Life Sciences,2012,69(19):3225-3243.
[33]潘瑞炽. 植物生理学[M]. 7版. 北京:高等教育出版社,2012.
[34]Klein T,Hoch G,Yakir D,et al. Drought stress,growth and nonstructural carbohydrate dynamics of pine trees in a semi-arid forest[J]. Tree Physiology,2014,34(9):981-992.
[35]Subbarao G V,Chauhan Y S,Johansen C.Patterns of osmotic adjustment in pigeonpea—its importance as a mechanism of drought resistance[J]. European Journal of Agronomy,2000,12(3/4):239-249.
[36]李海霞,米银法,陈双臣. 干旱胁迫下6种观赏牡丹生理响应及耐旱性评价[J]. 江苏农业科学,2022,50(7):131-139.
[37]陈玲玲. 敖汉苜蓿小花与种子响应硼胁迫的蛋白质组学与代谢组学分析[D]. 北京:中国农业大学,2017:75-76.
收 稿日期:2023-03-09
基金项目: 云南省重大科技专项计划子课题(编号:202102AE090014)。
作者简介:雷东花(1996—),女,甘肃庆阳人,硕士研究生,主要从事麦类作物遗传育种研究。E-mail:1914970517@qq.com。
通信作者:康志钰,博士,教授,硕士生导师,主要从事作物遗传育种以及种子科学与工程研究。E-mail:kangzhiyu@ynau.edu.cn。

