氮沉降对闽楠幼苗生长和生理特性的影响
郑立津 赖慧捷 范辉华 林智榕 李成珺 刘爱琴

摘要: 为了探讨不同氮沉降处理对闽楠生理生态过程的影响,揭示闽楠对不同形态氮沉降的形态和生理响应机制,选用闽楠幼苗为研究对象,选择氮源和氮浓度2个试验因素,氮源设硝态氮、铵态氮和混合氮3种形态,每种形态的氮素均设4个氮浓度水平[低氮沉降(30 kg/hm2,LN)、中氮沉降(60 kg/hm2,MN)和高氮沉降(90 kg/hm2,HN)和无氮沉降对照(0 kg/hm2,CK)],开展不同形态氮沉降对闽楠幼苗生长和生理生态学特性的影响研究。结果表明,不同形态氮沉降显著影响闽楠幼苗生长及其生理学过程。不同形态氮沉降能明显影响闽楠苗高和地径生长,引起闽楠幼苗各器官生物量积累的差异,改变闽楠幼苗叶片和根的形态。不同形态氮沉降对闽楠幼苗生理学过程有显著影响。随氮沉降浓度的增加,闽楠幼苗净光合速率、光系统的光化学反应降低。闽楠对不同形态氮沉降的适应性表现为铵态氮>混合氮>硝态氮,总体表现出“低促高抑”的趋势,即在低浓度范围内,能促进闽楠生长;超过一定阈值,闽楠幼苗净光合速率、光系统的光化学反应降低。说明闽楠在氮沉降条件下可通过生长和生理学过程的改变来适应氮沉降。研究结果可为制定闽楠人工林的经营对策提供科学依据。
关键词: 氮沉降;闽楠;幼苗;生理学特性;生长
中图分类号:S792.240.5;S718.43 文献标志码:A
文章编号:1002-1302(2024)02-0152-07
近年来,随着人类向大气中排放的氮化合物激增,大气中的氮化合物通过降水进入到地球表层,导致大气氮沉降日趋严重,过量的氮沉降会引起一系列生态环境效应,从而引发森林土壤酸化、水体富营养化,生物多样性降低,进而严重影响陆地生态系统的生产力和生物多样性,成为全球重要的环境问题[1]。
大气氮沉降增加对森林生态系统的生产力和养分循环產生重要影响,威胁到森林生态系统的可持续性[2]。氮沉降通过改变土壤氮含量[3]对森林生态系统植物生长和物种多样性产生深远影响[4]。因此,如何揭示氮沉降对森林生态系统的影响成为当前林学界急需解决的重大课题。
闽楠[Phoebe bournei (Hemsl.) Yang]是我国南方的主要珍贵阔叶树种[5]。近年,国内学者对闽楠进行了大量研究,研究内容主要体现在闽楠生长特性[6]、养分与水分调控对生长的影响等方面[7]。但目前缺乏闽楠对大气氮沉降响应方面的研究[8],极大地限制了人们对闽楠适应大气氮沉降机制的认识。因此,本研究选取闽楠幼苗作为研究对象,利用不同形态的氮沉降模拟控制试验,探讨不同形态氮沉降对闽楠生长和生理生态学特性的影响,分析不同氮沉降处理对闽楠生理生态过程的影响,揭示闽楠对不同形态氮沉降的形态和生理学响应机制,为制定闽楠人工林的经营对策提供科学依据。
1 材料与方法
1.1 供试材料
在福建省林业科学研究院温室内,选择长势均匀、生长良好的闽楠1年生容器苗,将幼苗移植至25 cm(直径)× 45 cm(高)的盆栽盆中,供不同氮沉降模拟试验使用。
1.2 试验设计
鉴于大气的氮沉降一般包含铵态氮、硝态氮等不同形态的氮[9],本研究采用随机区组设计,选择硝态氮(KNO3)、铵态氮[(NH4)2SO4]、混合氮(NH4NO3) 3 种不同氮源开展不同形态氮沉降模拟试验。根据前人的研究及福建氮沉降水平[10],每种形态的氮素均设4个氮沉降水平:低氮沉降(30 kg/hm2, LN)、中氮沉降(60 kg/hm2,MN)、高氮沉降(90 kg/hm2,HN)和无氮沉降对照(0 kg/hm2,CK),共12个试验处理。根据盆栽实际面积换算,低、中、高氮沉降处理每 5 d分别施入0.04、0.08、0.12 g不同形态的氮素[10]。每个试验处理苗木25株,共300株试验苗木。每隔5 d将所需氮溶于自来水中进行喷洒,对照喷等体积的水,每个处理共喷洒12次。第1次氮沉降处理从2020年10月开始,到12月9日结束,试验处理60 d。
1.3 测定方法
1.3.1 幼苗生长测定方法
在不同氮沉降模拟条件下进行闽楠苗高、地径和生物量测定[11]。在试验开始盆栽前、试验过程中每隔15 d及模拟结束前用精度0.1 cm的直尺测定不同试验处理幼苗苗高,用游标卡尺测定幼苗地径。胁迫处理60 d后,在每个试验处理中随机选取3株苗木(共36株),进行不同处理闽楠苗木生物量测定。将不同试验处理苗木根系、茎和叶片洗净分离,用根系扫描仪和叶片扫描仪测定根系和叶片的形态指标[12],然后装入纸袋内,放入烘箱105 ℃杀青0.5 h,用80 ℃烘干至恒质量,用电子天平(精度0.001 g)称量,由此计算不同试验处理苗木的各器官生物量[13]。
1.3.2 幼苗生理特性的测定方法
在胁迫处理 60 d 后测定不同氮沉降模拟条件下闽楠苗木叶绿素含量、叶绿素荧光参数及其SOD活性和MDA含量。
叶绿素含量:采用丙酮、无水乙醇混合提取法测定[14]。叶绿素荧光参数:从不同氮沉降模拟处理中各选5株苗木,取中上部叶片,在晴天09:00—14:00使用叶绿素荧光测定仪[15](OS-30P,Li-Cor)进行闽楠叶片叶绿素荧光参数的活体测定[16]。
SOD活性及MDA含量:采用苏州科铭生物技术有限公司提供的微量试剂盒测定[17]。
气体交换参数:
从不同氮沉降模拟处理中各选取3株幼苗,取中上部叶片,利用便携式光合测定仪(LI-6800型,LI-COR)测定叶片净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)、胞间CO2浓度(Ci)等参数[18]。
1.4 数据处理方法
采用SPSS 26.0软件进行数据统计,用Excel 2019和Origin 9.0软件绘制图表。采用单因素方差分析法(One-Way ANOVA)进行分析,以最小显著差异法(LSD)进行差异显著性检验。
2 结果与分析
2.1 不同形态氮沉降对闽楠幼苗生长的影响
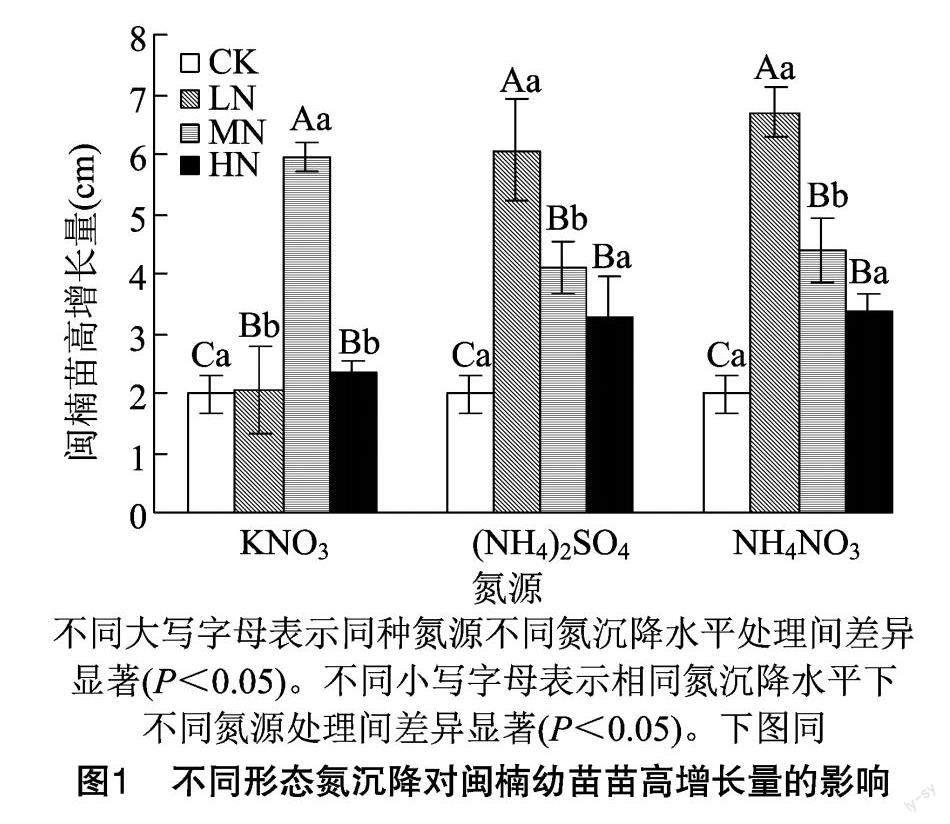
2.1.1 不同形态氮沉降对闽楠幼苗苗高生长的影响
由图1可以看出,不同形态氮沉降下,闽楠幼苗苗高增长量总体表现为混合氮>铵态氮>硝态氮。不同氮沉降处理苗高生长量显著高于对照(P<0.05)。同一氮源不同浓度氮沉降处理的苗高生长规律不同。其中,硝态氮的中氮处理苗高增长量最大,各浓度处理均显著高于对照(P<0.05),表现为MN>HN>LN>CK;铵态氮和混合氮的低氮处理苗高增长量最大,各浓度处理均显著高于对照(P<0.05)。 铵态氮不同浓度处理对苗高增长量的促进效果表现为LN> MN>HN>CK;混合氮不同浓度氮沉降处理对苗高生长量的促进效果表现为LN>MN>HN>CK。
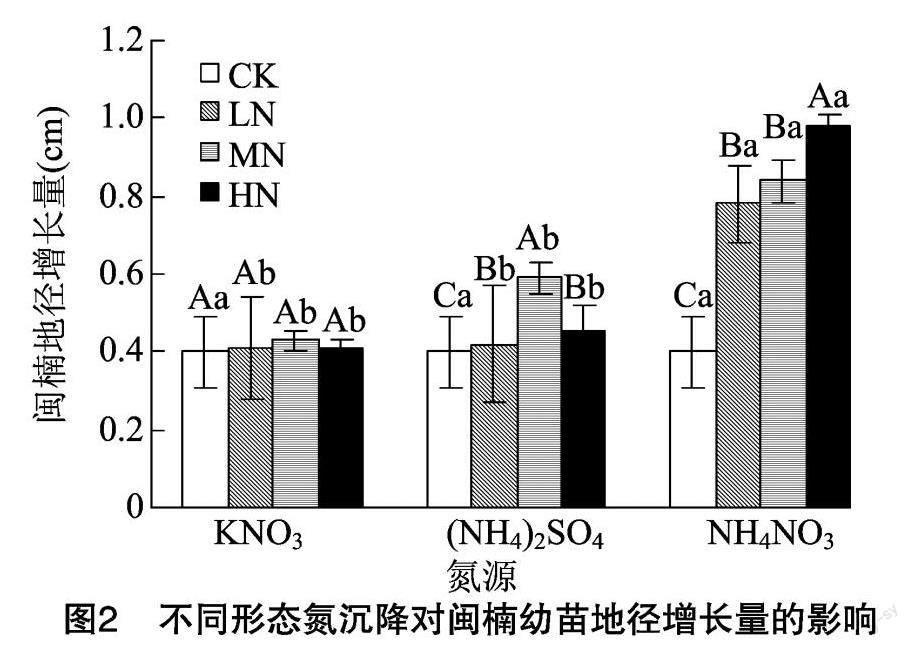
2.1.2 不同形態氮沉降对闽楠幼苗地径生长的影响
由图2可见,不同形态氮沉降下,闽楠幼苗地径增长量表现为混合氮>铵态氮>硝态氮。其中,混合氮沉降处理显著促进闽楠幼苗地径生长,各浓度处理均显著高于对照(P<0.05),不同浓度混合氮处理间存在显著差异(P<0.05),表现为 HN>MN >LN>CK;硝态氮和铵态氮沉降处理均以中氮(MN)处理地径增长量最大,与其他浓度处理间的差异明显。不同浓度硝态氮沉降下,闽楠幼苗地径增长量表现为MN>HN>LN>CK;不同浓度铵态氮沉降下,其表现为MN>HN>LN>CK。
2.1.3 不同形态氮沉降对闽楠幼苗叶片形态的影响
由表1可以看出,不同形态氮沉降下,闽楠幼苗叶片形态表现为混合氮>铵态氮>硝态氮。3种氮源 在中氮处理下,各形态指标最高且与对照有显著
性差异(P<0.05),硝态氮表现为MN>HN>CK>LN,且其LN处理低于对照且有明显差异;在铵态氮处理下,闽楠幼苗的叶面积、叶宽、叶长以及叶周长都明显增加,总体表现为MN>LN>CK>HN,各浓度处理与对照相比存在显著性差异(P<0.05);混合氮不同浓度处理下,闽楠幼苗叶片形态表现为MN>HN>LN>CK, 除了高氮处理下的叶面积以及低氮处理下的叶面积、叶长外,其余指标都高于对照且有显著性差异(P<0.05)。
2.1.4 不同形态氮沉降对闽楠幼苗根系形态的影响
由表2可见,氮对根各项指标的影响从大到小依次为铵态氮>硝态氮>混合氮,氮沉降处理下闽楠幼苗根长、根表面积、根体积3个指标都小于对照且差异达显著水平(P<0.05),施氮条件下根的生长受到了明显的抑制。其中硝态氮表现为CK>MN>LN>HN,在硝态氮处理下,闽楠幼苗的根长、根表面积、根体积都有明显的减少且与对照有显著性差异(P<0.05)。铵态氮总体表现为CK>HN>MN>LN,在铵态氮处理下的闽楠幼苗的根长、根表面积、根体积都有明显的减少且与对照有显著性差异(P<0.05)。混合氮不同浓度处理下幼苗根系总体表现为CK>LN>MN>HN,混合氮处理下的闽楠幼苗的根长、根表面积、根体积且都低于对照且有显著性差异(P<0.05)。
2.1.5 不同形态氮沉降对闽楠幼苗生物量及其分配的影响
由表3可以看出,不同形态氮沉降对闽楠幼苗生物量及其分配有显著影响。不同形态氮沉降下闽楠幼苗生物量依次为混合氮>铵态氮>硝态氮。同一形态氮源不同浓度氮沉降处理下幼苗生物量及其分配表现出不同规律,其中硝态氮表现为CK>MN>LN>HN,在硝态氮处理下,闽楠根、茎和叶的生物量减少明显且与对照有显著性差异(P<0.05);铵态氮表现为CK>LN>HN>MN,除了LN处理下的叶的生物量没有明显变化外,其余处理下的闽楠根、茎和叶的生物量减少明显且与对照有显著性差异(P<0.05);混合氮表现为CK>MN>LN>HN, 混合氮处理下的闽楠根、茎和叶的生物量减少明显且与对照有显著性差异(P<0.05)。
2.2 不同形态氮沉降对闽楠幼苗生理特性的影响
2.2.1 不同形态氮沉降对闽楠幼苗光合特性的影响
由表4可知,不同形态氮沉降对闽楠幼苗光合特性有一定影响,总体上降低了闽楠幼苗的蒸腾速率、净光合速率、胞间CO2浓度和 气孔导度。氮对根的各项指标的影响排序总体为铵态氮>硝态氮>混合氮。其中,硝态氮表现为CK>HN>MH>LN,在硝态氮处理下的闽楠蒸腾速率降低且与对照组有显著性差异(P<0.05);铵态氮表现为CK>LN>MN>HN,除了LN处理下的各项光合指标没有明显变化外,MN和HN处理下的净光合速率以及HN处理下的气孔导度降低明显且与对照组有显著性差异(P<0.05);混合氮表现为CK>MN>LN>HN,除了MN处理下的净光合速率、胞间CO2浓度、气孔导度以及LN处理下的胞间CO2浓度没有明显降低外,其余处理下的光合指标降低明显且与对照组有显著性差异(P<0.05)。
2.2.2 不同形态氮沉降对闽楠幼苗叶片叶绿素含量的影响
由表5可以看出,氮沉降对闽楠叶片叶绿素含量的影响表现为铵态氮>混合氮>硝态氮。其中硝态氮表现为CK>MN>HH>LN,在硝态氮中氮处理下闽楠幼苗叶片的叶绿素b含量和类胡萝卜素含量最高,在低氮处理下闽楠幼苗的叶绿素含量低于对照且差异达显著水平(P<0.05);铵态氮表现为CK>MN>LN>HN,MN处理下的叶绿素含量略高于对照,HN处理下的叶绿素含量降低明显且与对照组有显著性差异(P<0.05);混合氮表现为CK>HN>MN>LN,除了HN处理下的叶绿素含量没有明显降低,LN处理下的所有叶绿素含量指标及MN处理下类胡萝卜素含量降低明显且与对照有显著性差异(P<0.05)。
2.2.3 不同形态氮沉降对闽楠幼苗叶片叶绿素荧光 的影响
由表6可以看出,不同形态氮沉降对闽楠幼苗叶片叶绿素荧光的影响并不明显,对闽楠幼苗叶片叶绿素荧光参数的影响表现为硝态氮>铵态氮>混合氮。在硝态氮和铵态氮处理下闽楠幼苗叶片的SPAD值、PSⅡ潜在活性和PSⅡ最大光化学效率没有明显变化规律且都没有显著性差异(P>0.05)。混合氮处理下表现为MN>LN>CK>HN,HN处理下的幼苗叶片的SPAD值、PSⅡ潜在活性和PSⅡ最大光化学效率明显降低且与对照相比有显著性差异(P<0.05),LN处理和MN处理下的叶绿素荧光指标没有明显变化,且与对照相比没有显著性差异(P>0.05)。
2.2.4 不同形态氮沉降对闽楠幼苗抗性指标的影响
由图3可以看出,不同形态氮沉降对闽楠幼苗MDA 含量的影响表现为硝态氮>铵态氮>混合氮。其中硝態氮表现为HN>MN>LN≈CK,在硝态氮HN处理下闽楠幼苗的MDA含量最高,且与对照相比有显著性差异(P<0.05);铵态氮表现为HN>MN>LN>CK,HN处理下闽楠幼苗的MDA含量最高且与对照相比有显著性差异(P<0.05);混合氮表现为HN>CK>LN>MN,HN处理下闽楠幼苗的MDA含量最高,且与对照相比有显著性差异(P<0.05)。
由图4可以看出,不同形态氮沉降对闽楠幼苗SOD活性影响大小表现为混合氮>铵态氮>硝态氮。同一形态氮源不同浓度氮沉降处理表现出不同 的规律。其中硝态氮表现为CK>MN>LN>HN, 硝态氮HN处理下的闽楠幼苗的SOD活性最低且与对照组相比有显著性差异(P<0.05)。铵态氮表现为CK>LN>MN>HN,其中HN处理闽楠幼苗的SOD活性最弱且与对照相比有显著性差异(P<0.05)。混合氮表现为HN>MN>CK>LN,其中MN、HN处理闽楠幼苗的SOD活性略高于对照但没有显著性差异(P>0.05)。
3 讨论
大量研究表明,氮沉降对陆地生态系统植物生长有显著影响,在一定范围内氮沉降可促进植物生长和生物量积累[19]。但过量氮沉降会导致植物体内氮水平过高,影响植物体内酸碱平衡调节,或使过多有毒代谢物在体内积累,阻碍植物生长[20]。研究表明,氮沉降会显著增加植物根生物量和细根氮含量[21],减少细根生物量,降低细根的C/N[22]。本研究发现,不同形态氮源对闽楠幼苗苗高与地径总体表现为中低水平促进生长、高浓度氮沉降抑制生长。根生物量随氮浓度增加而下降,不同器官生物量积累受到抑制[23]。氮沉降的增加会引起土壤酸化,限制植物根系生长[24]。本研究中闽楠根生物量减少,可能与氮沉降增加引起土壤酸化有关。
大量研究发现,一定浓度的氮沉降能够促进植物光合作用,但过量氮沉降会造成植物营养失衡,使光合作用受到抑制。植物光合作用受到土壤氮的明显影响,与叶片含氮量及净光合速率、叶绿素含量、叶绿素荧光等密切相关[25]。本研究发现,不同形态氮沉降提高了闽楠幼苗叶片叶绿素含量,其影响程度表现为铵态氮>混合氮>硝合氮。但随氮沉降浓度增加,闽楠幼苗净光合速率、光系统的光化学反应降低,闽楠幼苗光合作用受到抑制,这可能与大量氮沉降造成闽楠体内养分元素比例失衡有关。有研究认为,植物在氮沉降下光合功能受损,与其抗氧化酶的差异有关[26],过量氮沉降引起植物体内氧化应激,使膜质过氧化产物丙二醛(MDA)含量增加,加剧细胞膜受损。
4 结论
不同形态氮沉降对闽楠幼苗的苗高与地径生长有明显影响,低氮处理一定程度上能促进闽楠幼苗苗高和地径生长,高氮处理下闽南幼苗的生长受到抑制,总体表现为“低促高抑”。但不同形态氮沉降的闽南幼苗生长促进作用存在差异,按照其对苗高和地径的影响大小依次为混合氮>铵态氮>硝态氮。
不同形态氮沉降影响闽楠幼苗叶片、根系形态特征及生物量分配。总体来看,氮沉降条件下闽楠幼苗的叶面积、叶长宽比和叶周长增加,根表面积和根体积减小,不利于闽楠幼苗生物量积累。不同形态氮沉降对闽楠幼苗生物量影响大小排序为硝态氮>铵态氮>混合氮。
不同形态氮沉降对闽楠幼苗的生理过程有一定影响。不同形态氮沉降提高了闽楠幼苗叶片叶绿素含量,其对闽楠叶片叶绿素含量的影响表现为铵态氮>混合氮>硝合氮。但随氮沉降浓度增加,闽楠幼苗净光合速率、光系统的光化学反应降低,闽楠幼苗光合作用受到抑制。
闽楠幼苗对3种不同形态氮沉降的适应范围存在差异,对铵态氮和混合氮沉降的适应性强于硝态氮。氮沉降对闽楠幼苗生长的影响可能存在阈值,在阈值以下存在促进作用,超过阈值会产生抑制作用。
参考文献:
[1] Gilliam F S,Burns D A,Driscoll C T,et al. Decreased atmospheric nitrogen deposition in eastern North America:predicted responses of forest ecosystems[J]. Environmental Pollution,2019,244:560-574.
[2]Pardo L H,Fenn M E,Goodale C L,et al. Effects of nitrogen deposition and empirical nitrogen critical loads for ecoregions of the United States[J]. Ecological Applications,2011,21(8):3049-3082.
[3]Yao F F,Ding H M,Feng L L,et al. Photosynthetic and growth responses of Schima superba seedlings to sulfuric and nitric acid depositions[J]. Environmental Science and Pollution Research,2016,23(9):8644-8658.
[4]Reich P B,Knops J,Tilman D,et al. Plant diversity enhances ecosystem responses to elevated CO2 and nitrogen deposition[J]. Nature,2001,410(6830):809-810.
[5]周桂圆. 珍贵树种闽楠人工林生长研究[J]. 林业与生态,2022(9):39-40.
[6]罗振财. 广西大桂山林场闽楠育苗造林技术[J]. 种子科技,2022,40(18):124-126.
[7]李德军,莫江明,方运霆,等. 模拟氮沉降对南亚热带两种乔木幼苗生物量及其分配的影响[J]. 植物生态学报,2005,29(4):543-549.
[8]Yue K,Fornara D A,Yang W Q,et al. Effects of three global change drivers on terrestrial C ∶ N ∶ P stoichiometry:a global synthesis[J]. Global Change Biology,2017,23(6):2450-2463.
[9]杜 锟,张江勇,林勇明,等. 邓恩桉林土壤腐殖质对模拟硫、氮复合沉降的响应[J]. 森林与环境学报,2015,35(1):31-37.
[10] Knops J. Southern nitrogens new urea plant on stream[J/OL]. Chemical & Engineering News,2010,35(52)[2023-02-10]. https://vdocuments.mx/southern-nitrogens-new-urea-plant- on-stream.html?page=1.
[11]Li W B,Jin C J,Guan D X,et al. The effects of simulated nitrogen deposition on plant root traits:a meta-analysis[J]. Soil Biology and Biochemistry,2015,82:112-118.
[12]樊后保,袁颖红,王 强,等. 氮沉降对杉木人工林土壤有机碳和全氮的影响[J]. 福建林学院学报,2007,27(1):1-6.
[13]Guan B,Xie B H,Yang S S,et al. Effects of five years nitrogen deposition on soil properties and plant growth in a salinized reed wetland of the Yellow River Delta[J]. Ecological Engineering,2019,136:160-166.
[14]王一会,王志瑞,吴德景,等. 分光光度法测定地表水中叶绿素a的进一步研究[J]. 广州化工,2022,50(12):103-105.
[15]周 丹,罗 灿,于旭东,等. 波罗蜜叶片突变体叶绿素含量测定和超微结构观察[J]. 热带作物学报,2021,42(10):2935-2941.
[16]Du S S,Liu X J,Chen J D,et al. Prospects for solar-induced chlorophyll fluorescence remote sensing from the SIFIS payload onboard the TECIS-1 satellite[J]. Journal of Remote Sensing,2022,2022:9845432.
[17]沈 彥. 盐碱环境胁迫对吸胀萌发期玉米种子SOD活性的影响[J]. 绿色科技,2022,24(13):121-122,126.
[18]陈 鹏,刘奇志. 二斑叶螨为害对草莓叶片H2O2、MDA含量以及部分防御酶活性的影响[J]. 环境昆虫学报,2022,44(3):697-703.
[19]郭 霄. 不同槭属植物幼苗对水分、光照及氮沉降的生理生态学响应[D]. 济南:山东大学,2014.
[20]黄瑞冬,王进军,许文娟. 玉米和高粱叶片叶绿素含量及动态的比较[J]. 杂粮作物,2005,25(1):30-31.
[21]俞 飞,殷秀敏,伊力塔,等. 酸雨对杉木幼苗叶绿素荧光及生长量的影响[J]. 东北林业大学学报,2014,42(1):6-9.
[22]Farquhar G D,Sharkey T D. Stomatal conductance and photosynthesis[J]. Annual Review of Plant Physiology,1982,33:317-345.
[23]蔡乾坤,段洪浪,刘文飞,等. 氮沉降对杉木林土壤有效氮和磷含量的影响[J]. 森林与环境学报,2016,36(3):342-348.
[24]刘悦秋,孙向阳,王 勇,等. 遮荫对异株荨麻光合特性和荧光参数的影响[J]. 生态学报,2007,27(8):3457-3464.
[25]Ding Y Q,Jin Y L,He K Z,et al. Low nitrogen fertilization alter rhizosphere microorganism community and improve sweetpotato yield in a nitrogen-deficient rocky soil[J]. Frontiers in Microbiology,2020,11:678.
[26]Liu E N,Liu C P. Effects of simulated acid rain on the antioxidative system in Cinnamomum philippinense seedlings[J]. Water,Air,& Soil Pollution,2011,215(1):127-135.
收 稿日期:2023-03-03
基金项目:国家重点研发计划(编号:2021YFD2201304-05);中央财政林业科技推广项目(编号:KEY23003XA)。
作者简介:郑立津(1995—),男,福建福州人,硕士研究生,研究方向为森林培育。E-mail:1529238633@qq.com。
通信作者:刘爱琴,研究员,硕士生导师,研究方向为森林培育与林木生理生化。E-mail:379244732@qq.com。

