1株牛源屎肠球菌的分离鉴定及其益生特性
钟舒红 彭红艳 李军 石艳 白慧丽 李常挺 马春霞 吴翠兰 兰美益 彭昊


摘要: 利用形态学观察、生理生化试验与分子生物学方法对分离自牛瘤胃内容物的1株肠球菌GXNN20210320-4进行分类学鉴定,并通过生长性能测定,动物安全性试验、耐受性试验及体外抑菌试验等评价该菌的益生特性,旨在为进一步研究该菌株及开发成益生菌制剂提供一定的前期基础。结果显示,肠球菌GXNN20210320-4为屎肠球菌,该菌从4 h开始进入对数增长期并持续至14 h,生长繁殖速度较快,生长周期短,适合工业化生产。小鼠安全性试验显示,屎肠球菌GXNN20210320-4不是致病性微生物,对于动物可能是安全的。在模拟人工胃液(pH值=3.0)和模拟人工肠液(pH值= 6.8)中孵育3 h后屎肠球菌GXNN20210320-4存活率分别为76.85%、80.26%,在0.3%膽盐浓度下孵育1、3 h的存活率分别为83.15%、70.74%,在0.5%胆盐浓度下孵育1、3 h的存活率分别为57.97%、46.78%,说明屎肠球菌GXNN20210320-4具有较好的耐酸耐胆盐能力,该菌株能够经受胃肠道消化液的抑制而发挥作用。屎肠球菌GXNN20210320-4在60 ℃水浴中孵育15 min后仍有82.35%的菌株存活率,80 ℃水浴中孵育 15 min 后活菌数为0,表明屎肠球菌GXNN20210320-4可耐受60 ℃高温,而不能长时间耐受80 ℃的高温。体外抑菌试验显示,屎肠球菌GXNN20210320-4对鼠伤寒沙门氏菌、大肠杆菌、金黄色葡萄球菌均具有一定的抑制能力,其中对金黄色葡萄球菌的抑菌作用最好。综上所述,本研究中的牛源屎肠球菌GXNN20210320-4生长性能良好,对动物无致病性,具有良好的益生特性和抑菌作用,可作为益生菌株进一步开发和应用。
关键词: 屎肠球菌;分离鉴定;益生特性;抑菌作用;益生菌
中图分类号:S182 文献标志码:A
文章编号:1002-1302(2024)02-0198-07
长期以来,抗生素添加剂在畜禽生产中发挥着积极的促进作用,然而,长期将抗生素作为生长促进剂添加在饲料中所导致的耐药病原体和药物残留严重威胁着公共卫生健康[1]。我国农业农村部194号公告宣布自2020年1月1日起,全面禁止在饲料中添加抗生素。在“禁抗”“替抗”的大环境下,益生菌作为抗生素潜在替代产品成为人们研究的热点[2-3]。益生菌是一类服用一定量后能够定殖在宿主肠道并对机体健康产生益生作用的活性微生物,因其具有抗肿瘤、抗过敏、抑制细菌生长和增强机体免疫等作用,广泛应用于饲料、医药保健和食品等领域[4]。乳酸菌是定殖于动物肠道中的一种重要生理菌群,因其具有调整机体肠道菌群平衡、调节机体代谢、提高机体免疫力和动物生产力等益生功能,广泛应用于畜、禽和水产养殖生产中[5-6]。肠球菌作为乳酸菌的一种,其生长性能好、抗逆性强、能产有机酸、细菌素等抑菌物质,具有促进动物生长、调节机体胃肠道菌群平衡、维持微生态稳定、提高机体免疫等益生作用,常被用作饲料添加剂[7-8]。屎肠球菌作为肠球菌的一种,被列入我国《饲料添加剂品种目录(2023)》。同时,欧盟(EU)发布的2015/1053号法规,批准屎肠球菌DSM 10663/NCIMB 10415作为母牛繁殖、保育仔猪和肉鸡育肥、火鸡育肥、猫和狗的饲料添加剂使用,屎肠球菌作为饲料添加剂在畜禽生产中有着广阔的应用市场[9]。因此,本研究利用传统的形态学观察、生理生化试验与现代分子生物学相结合的方法,从牛瘤胃内容物中分离鉴定得到1株屎肠球菌GXNN20210320-4,并进一步对其生长特性、动物安全性、人工胃肠液耐受性、胆盐耐受性、高温耐受性及体外抑菌活性等益生特性进行测定,旨在为牛源屎肠球菌益生菌制剂的研发提供基础候选菌株。
1 材料与方法
1.1 材料
1.1.1 样品来源 牛瘤胃内容物于2021年3月采自广西南宁某养牛场。
1.1.2 供试菌株 用于体外抑菌试验的大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)、鼠伤寒沙门氏菌(Salmonella typhimurium),均由广西兽医研究所细菌室保存。
1.1.3 供试动物 雄性8周龄健康C57 BL/6J小鼠[体质量(18±2) g],购自长沙市天勤生物技术有限公司。
1.1.4 主要试剂 本研究中用到的主要试剂详见表1。
1.2 方法
1.2.1 益生菌的分离培养 牛瘤胃内容物和灭菌生理盐水按1 ∶ 9混悬,上清液倍比稀释,接种环蘸取适量稀释液划线于MRS固体培养基上,37 ℃恒温培养24 h。接种环挑取单个长势较好的菌落继续划线接种MRS固体培养基,37 ℃恒温培养24 h,直至分离到形态一致的单个菌落,革兰氏染色并观察其染色结果和形态特征。同时,接种环挑取单个菌落接种MRS液体培养基,37 ℃ 200 r/min恒温培养24 h,连续活化3代,4 ℃保存备用。益生菌的分离培养在广西兽医研究所细菌研究室进行,后续益生菌益生性能的测定均相同。
1.2.2 分离菌的生化鉴定 根据《伯杰氏系统细菌学手册(第二版)》肠球菌生理生化鉴定试验,采用细菌微量生化鉴定管对分离菌株进行生理生化鉴定。
1.2.3 16S rRNA基因序列的测定 提取分离菌株DNA,采用通用引物27F(5′- A G A G T T T G A T C M T G G C T C A G -3′)、1492R(5′- T A C G G Y T A C C T T G T T A C G A C T T -3′)进行PCR扩增,预期扩增产物长度为 1 500 bp。扩增体系为25.0 μL,包括Taq mix 12.0 μL,上、下游引物(10 μmol/L)各1.0 μL,DNA模板2.5 μL,ddH2O补至25.0 μL。PCR反应程序为:95 ℃预变性5 min;95 ℃ 30 s,52 ℃ 30 s,72 ℃ 1 min,34个循环;72 ℃延伸10 min。扩增结束后,1%琼脂糖凝胶电泳检测PCR产物。PCR 产物条带大小符合预期,送苏州金唯智生物科技有限公司进行16S rRNA测序鉴定,测序结果通过NCBI中的BLAST进行同源性分析。
1.2.4 分离菌生长曲线测定 将分离菌种子液按2%的接种量接种于MRS液体培养基中,37 ℃、200 r/min 恒温培养,并以MRS液体培养基为空白对照,每隔2 h测定菌悬液吸光度D600 nm,绘制菌株生长曲线。
1.2.5 动物安全性试验 10只8周龄健康C57 BL/6J小鼠随机分成2组,5只/组,分别为试验组(E),空白对照组(C)。E组灌服浓度为1×109 CFU/mL 的分离菌混悬液,C组灌服灭菌生理盐水,0.2 mL/只,连续7 d。记录试验期间2组小鼠的精神状况,采食、饮水、运动及被毛生长情况。
1.2.6 模拟人工胃、肠液耐受试验 参照丁诗瑶等的方法配制模拟人工胃液:稀HCl 16.4 mL,H2O 900 mL,胃蛋白酶10 g,均匀混合后蒸馏水定容至 1 000 mL,调节pH值=3.0,过0.22 μm滤膜除菌,4 ℃保存备用[10-11]。
根据《中国人民共和国药典(2015)》配制模拟人工肠液:KH2PO4 6.8 g,H2O 500 mL使之溶解,NaOH调节pH值=6.8,按10 g/L浓度加入胰蛋白酶,使之溶解,过0.22 μm滤膜除菌,4 ℃保存备用[12]。
菌悬液按10%接种量分别接种至配制好的模拟胃、肠液中,混合均匀,于37 ℃水浴锅中分别孵育0、3 h后,平板计数法分别计数0、3 h混悬液中屎肠球菌活菌数,每个试验重复3次,求平均值。以菌株存活率评估屎肠球菌对模拟人工胃、肠液的耐受能力,菌株存活率计算公式如下:存活率=lg(3 h 活菌数)/lg(0 h活菌数)×100%。后续试验中屎肠球菌存活率的测定方法均相同。
1.2.7 胆盐耐受试验 参照宁豫昌等的方法在MRS液体培养基中分别加入质量分数为0、0.3%和0.5%的猪胆盐,将上述含不同浓度猪胆盐的MRS液体培养基于121 ℃条件下灭菌15 min,冷却备用。菌悬液按10%接种量分别接种于不同浓度猪胆盐的MRS液体培养基中,以不加猪胆盐的培养基为对照,37 ℃培养0、1、3 h后,平板计数法分别计数各浓度各时间段菌悬液中屎肠球菌活菌数和存活率[13]。
1.2.8 高温耐受试验 参照翟梦凯的方法测定屎肠球菌耐高温能力,即提前将水浴锅温度分别调至37、50、60、80 ℃,菌悬液按10%接种量接种至灭菌生理盐水后静置于以上不同水浴中孵育 15 min,以37 ℃作对照,平板计数法分别测定不同温度下菌悬液中屎肠球菌的活菌数和存活率[9]。
1.2.9 体外抑菌试验 参照钟舒红等的方法用牛津杯测定屎肠球菌对大肠杆菌、金黄色葡萄球菌、沙门氏菌的体外抑菌能力,即将灭菌牛津杯分别放置于涂有大肠杆菌、金黄色葡萄球菌、沙门氏菌的LB固体培养基上,每个牛津杯中滴加150 μL屎肠球菌菌悬液,37 ℃恒温培养24 h,测定抑菌圈直徑(mm),以抑菌圈直径大小评估屎肠球菌对致病菌的体外抑菌能力[14]。
2 结果与分析
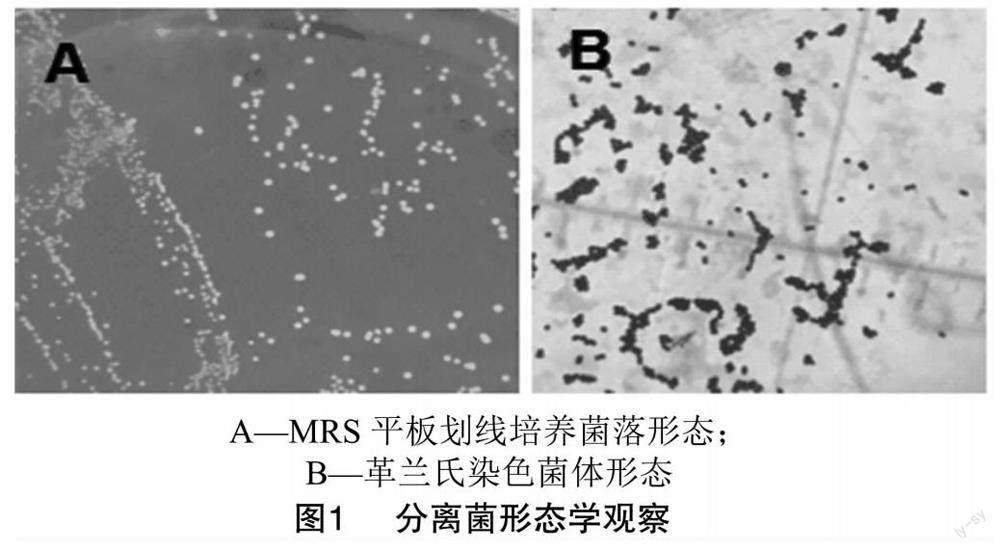
2.1 细菌分离纯化和形态学观察
由图1-A可知,分离菌在MRS琼脂平板上菌落凸起呈圆形、表面光滑、边缘整齐的灰白菌落,直径为0.5~1.0 mm。由图1-B可知,革兰氏染色镜检呈单个、成对或短链状排列,是无芽孢、无荚膜的革兰氏阳性球菌。
2.2 分离菌鉴定结果
由表2可知,分离菌生理生化试验结果显示,七叶苷试验、甘露醇产酸、精氨酸水解酶、马尿酸钠水解均呈阳性,触酶试验、运动性和V-P测定及山梨醇产酸为阴性,能在6.5% NaCl中生长,可发酵糖类,结果符合肠球菌生化标准。结合菌株形态与革兰氏染色结果,可初步鉴定该分离菌株为肠球菌,命名为GXNN20210320-4。
2.3 16S rRNA分子鉴定及序列分析结果
由图2可知,分离菌PCR扩增产物经凝胶电泳检测在1 000~2 000 bp 间出现1 500 bp的预期目的条带。将PCR产物测序序列经BLAST比对,发现与NCBI基因库中已收录的屎肠球菌基因组序列相似度最高,并利用Megalign进行同源性比较。由图 3 可知,GXNN20210320-4(GenBank 登录号MZ452349.1)菌株与基因库中已收录的11株屎肠球菌基因序列相似度高达99%以上,由此判定分离菌株GXNN20210320-4为屎肠球菌。随后利用MEGA 7.0 软件绘制系统发育进化树,由图4可知,MZ452349.1菌株与E.faecium GXNN20201226-1(MZ4523347.1)、E.faecium BHN-LAB 106(MN533909.1)亲缘关系较近。
2.4 生长曲线测定结果
屎肠球菌GXNN20210320-4的生长曲线,由图5可知,从4 h开始进入对数增长期,并持续至14 h,14~18 h进入稳定期, 18 h后进入衰亡期。本研究中分离鉴定的屎肠球菌生长繁殖速度较快,生长周期较短,适合工业化生产,是其作为益生菌制剂的一个很大的优势,为其作为饲料添加剂奠定了基础。
2.5 动物安全性试验结果
本研究试验观察期间,灌服屎肠球菌GXNN20210320-4的阳性对照组小鼠与灌服生理盐水的空白对照组均无死亡情况,2组小鼠一般的体态特征如呼吸、运动、行为、皮毛光泽、精神状态无明显差异。 结果表明,屎肠球菌GXNN20210320-4 不具有致病性,对动物可能是安全的,但为了充分保证分离 菌株屎肠球菌 GXNN20210320-4在临床使用上的安全性,下一步需进行动物的亚急性毒性试验和慢性毒性试验。
2.6 屎肠球菌耐受模拟人工胃、肠液能力测定结果
由表3可知,屎肠球菌GXNN20210320-4分别在模拟人工胃液(pH值3.0)和模拟人工肠液(pH值6.8)中孵育3 h后,存活率分别为76.85%、80.26%,说明屎肠球菌GXNN20210320-4无论对模拟人工胃液还是模拟人工肠液,均具有较好的耐受能力,该菌株能够经受胃肠道消化液的抑制而发挥作用。
2.7 屎肠球菌耐胆盐能力的测定结果
由表4可知,屎肠球菌GXNN20210320-4在胆盐浓度为0.3%情况下分别孵育1、3 h的存活率分别为83.15%、70.74%;随着胆盐浓度由0.3%提高至0.5%,屎肠球菌GXNN20210320-4存活率分别下降至57.97%、46.78%。说明胆盐可降低屎肠球菌GXNN20210320-4的存活率,胆盐浓度越高影响越大,但同时也说明,屎肠球菌GXNN20210320-4对0.3%胆盐具有较好的抵抗能力。
2.8 屎肠球菌耐高温能力的测定结果
由表5可知,在不同高温条件下处理15 min后,以37 ℃为对照,屎肠球菌GXNN20210320-4在50~80 ℃条件下,存活率由103.10%下降至0,但在60 ℃中处理15 min仍有82.35%的存活率,说明屎肠球菌GXNN20210320-4能在60 ℃环境下生长,而不能长时间耐受80 ℃的高温。
2.9 屎肠球菌对致病菌的体外抑菌能力测定结果
由表6可知,屎肠球菌GXNN20210320-4对鼠伤寒沙门氏菌、金黄色葡萄球菌、大肠杆菌的抑菌圈直径分别为13.13、17.17、12.06 mm。结果表明,屎肠球菌GXNN20210320-4对鼠伤寒沙门氏菌、大肠杆菌、金黄色葡萄球菌均具有一定的抑制能力,其中对金黄色葡萄球菌的抑菌作用最好。
3 讨论与结论
本研究从牛瘤胃内容物中分离到的分离菌株GXNN20210320-4菌落凸起呈圆形、革兰氏染色呈单个、成对或短链状排列的G+球菌。其抗逆性较好,能在6.5% NaCl中生长,七叶苷试验、甘露醇产酸、精氨酸水解酶、马尿酸钠水解均呈阳性,触酶试验、运动性和V-P测定及山梨醇产酸陰性,可发酵糖类等主要生物学表型符合肠球菌属特征。且分离菌GXNN20210320-4 16S rRNA测序结果与NCBI基因库中收录的屎肠球菌基因序列相似度高达99%以上,结合形态学鉴定、生理生化试验和16S rRNA序列分析可判定GXNN20210320-4为屎肠球菌。
对分离菌株进行安全性评估,是筛选分离菌株作为益生菌或者微生态制剂基础候选菌株的前提,而动物急性口服毒性试验是作为细菌安全性评估的基本试验[15]。本研究连续7 d灌服屎肠球菌GXNN20210320-4(1×109 CFU/mL)的阳性对照组小鼠与灌服生理盐水的空白对照组小鼠在观察期间,其一般的体态特征、运动、饮食饮水也未发生明显变化,表明屎肠球菌GXNN20210320-4无致病性,对动物可能是安全的,但为充分保证屎肠球菌GXNN20210320-4在临床使用上的安全性,下一步需进行动物亚急性毒性试验和慢性毒性试验,这结果与王朝等的试验研究结果[16]一致。
理想的益生菌或微生态制剂生产用菌株不但应具有较好的生理功能还应具备良好的抗逆性,这不仅可满足菌株在工业生产过程中需要大规模传代复制的要求,也同时能保证菌株更容易在体内胃肠道中存活及定殖,特别是抵抗消化道中胃酸和胆盐的侵袭[17]。体外试验在益生菌的益生特性评判中,由于其准确性高、易于操作等优点,往往作为实验室筛选优良菌株的基础工作。本研究分离鉴定的屎肠球菌GXNN20210320-4从4 h开始进入对数增长期,并持续到14 h,14~18 h进入稳定期,说明该屎肠球菌生长繁殖速度较快,适合工业化生产,是其作为益生菌制剂的一个优势。
动物胃肠道内环境复杂,胃肠道中低pH值、高胆盐环境能抑制微生物的生长,潜在的益生菌应具有较强的耐酸、耐胆盐能力,还需要在肠道定殖并达到一定的浓度后才能发挥益生作用[18-19]。屎肠球菌作为动物肠道的一种常见兼性厌氧型乳酸菌,肠道黏附能力和抗逆性较强[20],而乳酸菌在代谢过程中本身能产乳酸,对低pH值环境适应性强,一般均可抵抗较低pH值的环境[21]。而在动物十二指肠中,从肝脏中分泌出具有抑菌活性的胆盐对细胞膜具有很强的破坏力,它的疏水作用可导致细胞膜破裂和膜蛋白离解[22-23],而小肠中的胆盐浓度一般为0.03%~0.30%[24],所以益生菌要在肠道中黏附和定殖,不仅需要承受低pH值环境,还需要能够耐受高渗透压的胆盐环境。徐淑琴等研究中藏羊源屎肠球菌EF1-mh最低能耐受pH值=2.0的酸性环境,在0.3%的胆盐浓度下培养8 h后活菌数仍有100 CFU/mL[25]。
沈中艳等研究显示,猪源屎肠球菌在pH值=3.0的合成胃液中可存活3 h,在pH值=1.5的合成胃液中可存活3 min,而最高耐胆盐浓度为3.0%[26]。Zaghloul等的研究显示,海洋源屎肠球菌EA9在pH值=3的条件下孵育4 h的存活率为83%,在0.1%、0.3%的胆盐浓度中持续培养24 h后的存活率分别为79.7%、60.0%[27]。因此,屎肠球菌可通过胃存活下来的可能性较大,具有良好的耐酸性,耐胆盐能力,从而顺利进入肠道定殖发挥益生作用。本研究中,屎肠球菌GXNN20210320-4 分别在模拟胃液(pH值3.0) 和模拟肠液(pH值6.8) 中孵育3 h后, 存活率分别为76.85%、80.26%,其菌落形成单位活菌数从 108 CFU/mL降至106 CFU/mL, 说明本研究中的屎肠球菌GXNN20210320-4无论对模拟人工胃液还是模拟人工肠液,均具有较好的耐受能力,该菌株能够经受胃肠道消化液的抑制而发挥作用,而在胆盐浓度为0.3%情况下分别孵育1、3 h,存活率分别为83.15%、70.74%,其菌落形成单位活菌数从108 CFU/mL分别降至106 CFU/mL和105 CFU/mL,表明屎肠球菌GXNN20210320-4对0.3%胆盐具有较好的抵抗能力。骆海龙等对细菌适应胆盐胁迫的机制进行综述,认为细菌可通过形成生物膜、修复受损的蛋白质、调整能量代谢途径与方式、修复与维持细胞膜完整性,利用特定的泵出系统将进入细菌细胞内的胆盐成分排至胞外等产生对胆盐的抵抗能力[28]。
商品化的益生菌在生产、运输过程中可能会面临特殊的环境,如温度变化等。作为饲用微生态制剂时,饲料制粒过程中的高温对细菌的活菌数影响也很大,所以菌株的耐热能力也需要被考虑。蔡爽等在5株猪源屎肠球菌对温度的耐受性试验研究中指出,不同屎肠球菌菌株对温度的耐受具有差异性,经过60 ℃热处理10 min后,5株菌株均可稳定的存在,经过80 ℃热处理10 min后, 只有1株菌株稳定存在[29]。本试验中屎肠球菌GXNN20210320-4 在60 ℃水浴中孵育15 min后仍有82.35%的菌株存活率,80 ℃水浴中孵育15 min后活菌数为0,说明屎肠球菌GXNN20210320-4可耐受60 ℃高温,而不能长时间耐受80 ℃的高温,在后期的益生菌制剂开发过程中可采用真空冷冻干燥或者胶囊包被技术可以提高活菌数。
屎肠球菌在生长过程中能产有机酸、细菌素等特殊物质,这些物质具有抑制其他细菌生长、繁殖的能力[30]。本研究利用牛津杯法测定屎肠球菌GXNN20210320-4对大肠杆菌、鼠伤寒沙门氏菌、金黄色葡萄球菌的抑菌圈直径分别为12.06、13.13、17.17 mm,表明屎肠球菌GXNN20210320-4对大肠杆菌、鼠伤寒沙门氏菌、金黄色葡萄球菌均具有一定的抑制能力。其结果与王朝等的研究结果[16,26]一致。
综上所述,本研究从牛瘤胃内容物中分离鉴定出1株益生性能良好的牛源屎肠球菌GXNN20210320-4,其生长性能良好,对动物无致病性,具有良好的益生特性和抑菌作用,可作为益生菌株进一步开发和应用。
参考文献:
[1] Wang Y W,Dong Z L,Song D,et al. Effects of microencapsulated probiotics and prebiotics on growth performance,antioxidative abilities,immune functions,and caecal microflora in broiler chickens[J]. Food and Agricultural Immunology,2018,29(1):859-869.
[2]申維维,吴 琼,胡 迪,等. 凝结芽孢杆菌对肉鸡免疫功能的影响[J]. 北京农学院学报,2021,36(1):93-99.
[3]Ayala D I,Cook P W,Franco J G,et al. A systematic approach to identify and characterize the effectiveness and safety of novel probiotic strains to control foodborne pathogens[J]. Frontiers in Microbiology,2019,10:1108.
[4]Awais M M,Jamal M A,Akhtar M,et al. Immunomodulatory and ameliorative effects of Lactobacillus and Saccharomyces based probiotics on pathological effects of eimeriasis in broilers[J]. Microbial Pathogenesis,2019,126:101-108.
[5]汪 攀,易敢峰,朱胜男,等. 植物乳杆菌FJR分离鉴定及益生特性研究[J]. 中国畜牧杂志,2023,59(2):274-278,285.
[6]廖 波,王薇薇,王永伟,等. 饲用乳酸菌在畜禽养殖上的应用研究进展[J]. 中国饲料,2019(19):13-18.
[7]王天威,滕坤玲,刘 刚,等. 微生态制剂对断奶仔猪肠道健康的影响及作用机制[J]. 中国科学(生命科学),2019,49(2):97-107.
[8]Amachawadi R G,Giok F,Shi X R,et al. Antimicrobial resistance of Enterococcus faecium strains isolated from commercial probiotic products used in cattle and swine1,2[J]. Journal of Animal Science,2018,96(3):912-920.
[9]翟梦凯. 一株屎肠球菌的益生特性及安全性研究[D]. 泰安:山东农业大学,2017.
[10] 丁诗瑶,雷文平,刘成国,等. 不同来源植物乳杆菌的益生特性研究[J]. 中国乳品工业,2021,49(1):20-24.
[11]吴丹阳. 凝结芽孢杆菌T242益生性及功能特性的研究[D]. 大连:大连工业大学,2016.
[12]国家药典委员会. 中华人民共和国药典:二部[M]. 2015版. 北京:中国医药科技出版社,2015.
[13]宁豫昌,吴祖芳,龚 婷. 贝莱斯芽孢杆菌的生物学特性研究[J]. 中国兽医杂志,2022,58(7):25-32.
[14]钟舒红,彭红艳,李 军,等. 不同方法测定益生菌体外抑菌活性的比较研究[J]. 黑龙江畜牧兽医,2022(6):115-119,138.
[15]Zhou J S,Shu Q,Rutherfurd K J,et al. Acute oral toxicity and bacterial translocation studies on potentially probiotic strains of lactic acid bacteria[J]. Food and Chemical Toxicology,2000,38(2/3):153-161.
[16]王 朝,冉 旋,雷江英,等. 牦牛源产细菌素屎肠球菌的分离鉴定和益生特性[J]. 微生物学通报,2023,50(8):3454-3466.
[17]Davoren M J,Liu J,Castellanos J,et al. A novel probiotic,Lactobacillus johnsonii 456,resists acid and can persist in the human gut beyond the initial ingestion period[J]. Gut Microbes,2019,10(4):458-480.
[18]赵 芳,李艳琴,李彬春. 模拟人体胃肠道环境筛选益生乳杆菌[J]. 微生物学通报,2016,43(6):1396-1403.
[19]杨 颖,田丰伟,陈 卫,等. 两株乳杆菌益生特性的体外研究[J]. 中国乳品工业,2006,34(6):16-19.
[20]葛 龙,李 波. 屎肠球菌在饲用微生态制剂中的研究与应用[J]. 饲料与畜牧,2013(6):57-59.
[21]麦日艳古·亚 生,伊力米热·热夏提,努尔古丽·热合曼.北疆传统发酵生奶酪中乳酸菌的耐受性及益生特性测定[J]. 微生物学通报,2023,50(5):2044-2062.
[22]Timmerman H M,Veldman A,van den Elsen E,et al. Mortality and growth performance of broilers given drinking water supplemented with chicken-specific probiotics[J]. Poultry Science,2006,85(8):1383-1388.
[23]彭 众,董 丽,喻礼怀. 屎肠球菌的作用机制及其在动物生产中应用的研究进展[J]. 中国饲料,2018(17):18-22.
[24]王玉华,张桂荣,刘景圣. 2株耐酸及耐胆盐嗜酸乳杆菌的分离筛选及其发酵特性研究[J]. 东北师大学报(自然科学版),2006,38(3):115-118.
[25]徐淑琴,马祥兆,陈晓慧,等. 藏羊源屎肠球菌的分离、鉴定及体外益生特性[J]. 安徽农业大学学报,2022,49(2):272-278.
[26]沈中艳,赵述淼,梁运祥. 耐胃肠道环境及肠道病原菌拮抗的猪源乳酸菌的分离与筛选[J]. 华中农业大学学报,2007,26(3):348-352.
[27]Zaghloul E H,Abuohashish H M,El Sharkawy A S,et al. Probiotic potential of the marine isolate Enterococcus faecium EA9 and in vivo evaluation of its antisepsis action in rats[J]. Marine Drugs,2023,21(1):45.
[28]駱海龙,张安杰,邱雪梅,等. 肠道细菌适应胆盐胁迫的机制研究进展[J]. 湖北医药学院学报,2020,39(5):510-515.
[29]蔡 爽,陈 涛,毛宗林,等. 一株强抗逆性猪源乳酸菌的筛选及生物学特性研究[J]. 中国饲料,2022(11):23-29.
[30] 梁小东. 一株牦牛酸奶源产细菌素屎肠球菌的分离鉴定及益生特性分析[D]. 成都:西南民族大学,2022:11.
收 稿日期:2023-03-22
基金项目:广西重点研发计划(编号:AB21238003);南宁市重点研发计划(编号:20212023);广西基本科研业务费(编号:桂科专项 21-6)。
作者简介:钟舒红(1986—),女,广西临桂人,硕士,高级兽医师,主要从事动物疫病防控和病原分子生物学研究,E-mail:zhongshuhong11@163.com;共同第一作者:彭红艳(1994—),女,青海西宁人,硕士研究生,主要从事兽医药理与病理学方面的研究,E-mail:2018393040@st.gxu.edu.cn。
通信作者:彭 昊,博士,高级兽医师,主要从事动物疫病防控与病原分子生物学研究。E-mail:hpeng2006@163.com。

