菌剂浸种对大豆的促生增产作用及土壤理化特性与解磷菌群落组成的影响
方明棵 罗心诚 王麒 王莹 武美燕 李会贞 杨亚珍


摘要: 为探究菌剂浸种对大豆的促生增产作用及土壤理化特性与解磷菌群落组成的影响,以无菌水浸种(O)作为对照,用固氮型根瘤菌(ON)、解磷型芽孢杆菌(OP)、解钾型芽孢杆菌 (OK)、固氮-解磷复合型真菌印度梨形孢(OPr)及4种菌剂复配剂(ONPKPr)对大豆进行浸种处理,然后在大田和盆栽试验条件下首先分析了不同菌剂浸种对大豆的促生增产作用;在此基础上,采用生理生化分析和Illumina高通量测序技术研究了不同菌剂浸种对大豆根际土壤理化特性及解磷菌群落组成的影响。结果表明,大田条件下与对照相比,OP、OPr和ONPKPr处理根际土壤速效磷含量极显著提高,分别提高37.44%、35.81%和44.19%;ON和ONPKPr处理能显著提高大豆产量,分别提高4.67%和5.00%。盆栽条件下与对照相比,ON和ONPKPr处理对大豆根瘤数、根瘤干质量和产量提升作用显著,大豆产量增幅分别为14.07%和15.00%,根瘤数分别增加41.13%和32.18%,根瘤干质量分别提高58.52%和49.70%。Illumina高通量测序结果表明,不同菌剂浸种大豆根际土壤解磷菌群落均以放线菌门和变形菌门为主,但放线菌门和变形菌门的比值(A/P)存在差异;在属级水平上ON、OP和ONPKPr处理有利于链霉菌等有益微生物在土壤定殖;冗余分析显示,放线菌门在土壤中丰度与土壤有机质含量呈正相关性,变形菌门丰度与全磷、速效钾含量呈正相关性。该研究可为生物菌剂在大豆生产上的有效使用及土壤改良提供重要理论支撑。
关键词: 解磷菌;群落组成;大豆;土壤理化性质
中图分类号:S182 文献标志码:A
文章编号:1002-1302(2024)02-0190-08
磷素是植物体内蛋白质、磷酸合成及能量循环等代谢过程的必需元素,同时还是衡量土壤肥力的重要元素指标,因而土壤中磷素对于促进作物的生长和增产,提升土壤养分与微生物多样性具有重要作用[1-2]。土壤磷素循环是以微生物活动为中心,不同土壤中的微生物群落在土壤中所扮演的角色也不同。解磷菌在土壤磷素循环中扮演着重要角色,可以将土壤环境中难溶的磷素转化为可被作物吸收利用的正磷酸盐,进而提高有效磷和磷酸酶活性,提升土壤肥力,促进农作物生长与增产[3-4]。因而解磷菌对于土壤改良及作物丰产具有重要意义。
土壤磷素循经常会受到各种外部条件的影响,尤其是外施各种微生物菌剂[5]。陈定安等的研究表明,油茶树根际接种假单胞菌能够对解磷菌产生影响,可提高土壤中磷的有效性[6]。常佳发现,施用搭配解磷菌剂的有机肥可以提高复垦土壤有效磷的含量及玉米的产量[7]。张健等报道,在北方石灰性土壤上分别施入不同解磷菌肥可以提升油菜产量及品质[8];此外,在小麦和棉花田中施加解磷细菌与其他功能微生物能促进土壤中速效磷和速效钾的释放[9-10]。虽然大量研究已证实外加生物菌剂可增产增效提高有效磷的释放,但由于土壤微生物群落的复杂性,目前关于微生物菌剂促进作物增产增效的生物学机制仍不十分明确。一些研究认为,微生物菌剂的增产增效作用是由于菌剂与土壤微生物功能类群之间互作改变了功能微生物的群落结构和丰度;另一些研究则认为,微生物菌剂可改变土壤养分形态和含量,促进作物对土壤有效磷和有效氮等养分的转化和利用[3]。
固氮细菌、解磷菌和印度梨形孢(Piriformospora indica)是3类重要的生物菌肥,在土壤改良和提高作物产量方面具有显著效果,在农作物绿色生产中发挥着重要作用[11-13]。为了明确3类菌剂浸种对大豆的促生增产作用及土壤养分与解磷菌群落組成的影响,本试验以湖北省石首市天鹅洲有机大豆田的贫瘠土壤为基质,以无菌水浸种作为对照,用固氮型根瘤菌、解磷型芽孢杆菌、解钾型芽孢杆菌、固氮-解磷复合型真菌印度梨形孢及4种菌剂复配剂对大豆进行浸种处理,然后在大田和盆栽试验条件下首先分析了不同菌剂浸种对大豆的促生增产作用;在此基础上,采用生理生化分析和Illumina高通量测序技术研究了不同菌剂浸种对大豆根际土壤养分及解磷菌群落组成的影响。该研究结果可揭示生物菌肥浸种对大豆生产、土壤养分及土壤解磷菌群落组成的影响,从而为土壤生态系统中磷素的有效利用提供参考,同时为大豆丰产提供科学依据。
1 材料与方法
1.1 供试材料
大豆品种为中黄13。所使用固氮型根瘤菌(ON)、解磷型芽孢杆菌(OP)、解钾型芽孢杆菌(OK)、固氮-解磷复合型真菌印度梨形孢(OPr)4种菌剂均来自于笔者所在实验室,有效活菌数为1.0×108 CFU/mL。
1.2 试验地概况
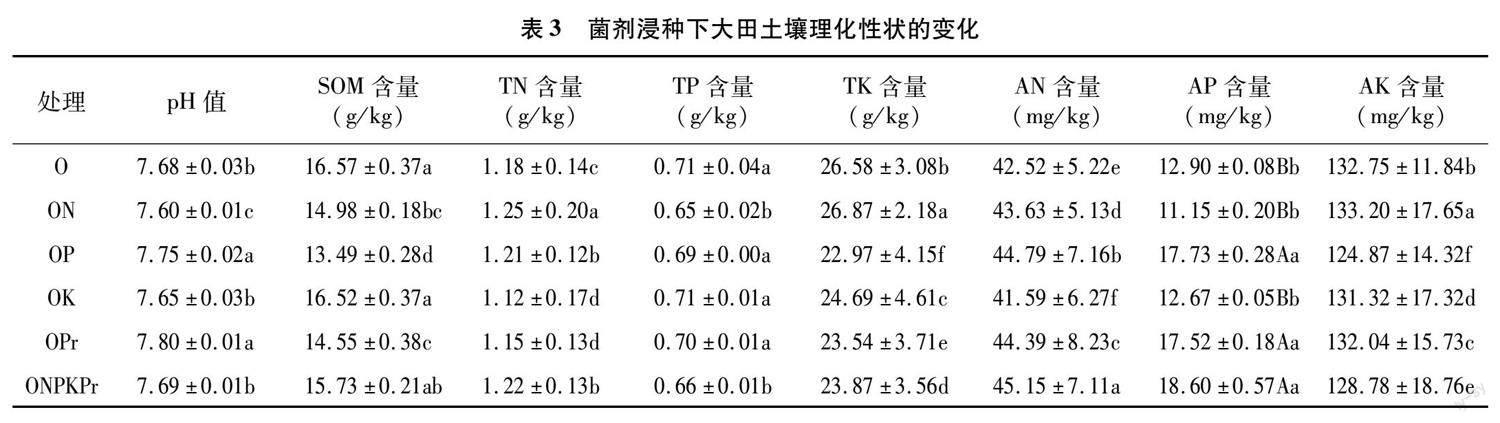
田间试验于2021年4月3日在湖北省石首市天鹅洲小河口镇小河口村(29.85°N,112.57°E)进行。该地气候温暖湿润,年平均气温16.5 ℃,无霜期为261 d,年日照时数为1 800~2 000 h。试验地前茬为有机大豆,土壤类型为轻黏土,是由长江河道冲刷物淤积而成。试验前采集土样进行化验,土壤pH值为7.68,有机质含量16.57 g/kg,全氮、全磷、全钾含量分别为1.18、0.71、26.58 g/kg,碱解氮含量43.63 mg/kg,速效磷含量12.90 mg/kg,速效钾含量132.75 mg/kg。
1.3 试验设置及采样
田间试验共设5个处理:固氮型根瘤菌(ON),解磷型芽孢杆菌(OP),解钾型芽孢杆菌 (OK),固氮-解磷复合型真菌印度梨形孢(OPr),4种菌剂复配剂(ONPKPr);以无菌水作为对照(O)。在大豆播种前,将大豆种子在上述菌剂中浸泡30 min,然后进行4 h阴干处理,经检测种子表面活菌数为1.05×107个/cm2。田间试验小区随机区组排列,每个处理设置3个重复小区,小区面积为100 m2(10 m×10 m),间距 2 m。小区仅以有机肥(有机质>35%, N+P2O5+K2O>6.0%)为底肥,用量为150 kg/hm2, 大豆播种量为6 kg/667 m2,种植密度为7.3×105株/hm2。在2021年10月将大豆连根挖出,采用抖根法获取大豆根际土壤,混匀后分为2份,一份土壤装入无菌袋于-80 ℃冰箱保存,用于菌群落结构分析,另一份风干后过筛用作土壤养分的测定。盆栽试验于2021年4月3日在长江大学农学院钢架塑料大棚内进行。盆栽土壤来自田间试验田,试验处理设计同上。每个处理重复4次,每次重复(盆)定苗4株,在2021年9月采收。
1.4 大豆产量及产量构成测定
大田试验大豆收获后每个小区取5 m2进行农艺性状和产量测定。盆栽试验收获后以每盆为单位进行分析。
1.5 土壤理化性状测定
土壤理化性状pH值及有机质(SOM)、全磷(TP)、全氮(TN)、全钾(TK)、速效磷(AP)、碱解氮(AN)、速效钾(AK)含量的测定方法参照鲍士旦的《土壤农化分析》[14]。
1.6 土壤 DNA 的提取及pho D基因的PCR扩增
使用Omega mag-bind soil kit提取土壤样本总DNA,每个样本各提取3 次,然后合并3 份 DNA溶液为1份供后续分析使用。利用NanoDrop ND-1000测量DNA浓度,采用凝胶电泳法检测DNA质量。有机解磷菌pho D基因的扩增采用特异性引物为520F:5′- AYTGGGYDTAAAGNG -3′和 802R:5′- TACNVGGGTATCTAATCC -3′。PCR体系为:5 μL 5×Q5反应缓冲液,0.25 μL Q5高保真DNA聚合酶,2 μL (10 mmol/L) dNTPs,正反引物(pho D 520F和 802R)均为1 μL,DNA模板物2 μL,ddH2O 8.75 μL。PCR反应条件为:98 ℃预变性2 min;98 ℃ 加热变性15 s,50 ℃退火30 s,72 ℃延伸 30 s,25个循环;72 ℃延伸5 min。
1.7 高通量测序
PCR产物用2%的琼脂糖凝胶电泳检测,利用 Quant-iT PicoGreen dsDNA Assay Kit 对PCR产物的 Microplate reader (BioTek,FLx800)进行定量。然后将PCR扩增验证存在pho D基因的 DNA 样品送上海派森诺生物科技有限公司进行Illumina 高通量测序。
1.8 数据分析
采用SPSS 19.0 软件和 Duncans法对土壤理化性质和大豆农艺性状和产量进行数据统计和方差分析。对测序原始数据先进行质筛和OTU划分,OTU划分和归并按97%的序列相似度进行。使用Mothur软件分析大豆根际土壤解磷菌的 α 多样性指数(Shannon指数和Chao1指数)。利用 Canoca 4.5 软件中的冗余分析(redundancy analysis,RDA) 分析解磷菌群落组成与土壤主要理化性质之间的关系。通过MEGAN软件将样本所含OTU丰度信息和分类学组成数据分析形成微生物分类等级树。
2 结果与分析
2.1 菌剂浸种对大豆农艺性状和产量的影响
不同菌剂对盆栽大豆农艺性状和产量影响不同,其中ONPKPr、ON和OPr处理显著提高大豆农艺性状(株高除外)和产量(表1)。ONPKPr对大豆产量的提高效果最为明显,与对照相比产量提高了15.00%;ON次之,产量提高14.07%,其他处理依次为OPr、OP和OK。ON处理可显著提升大豆的单株根瘤数、根瘤干质量和豆荚数,相比于对照根瘤数和根瘤干质量值分别增加41.13%和58.52%,单株豆荚数提高43.43%。大田试验表明,不同菌剂浸种对大豆百粒质量和产量产生了较为显著的影响。ONPKPr菌剂对大豆产量的提升效果最为明显,与对照相比产量增幅为5.00%。ON和OPr菌剂也表现出較好的增产效果,分别增产4.67% 和2.24%,该结论与盆栽试验结果一致(表2)。
2.2 菌剂浸种对大田土壤养分的影响
菌剂浸种对大田土壤理化性状具有一定的影响(表3)。与对照(O)相比,除OK处理外其余4个处理均显著提高土壤速效氮含量 (P<0.05),其中,ONPKPr处理效果最为明显,速效氮含量提高6.19%。OP、ONPKPr和OPr处理极显著提高速效磷含量(P<0.01),分别提高了37.44%、44.19%和35.81%。而ON处理对土壤速效钾的含量提升作用显著(P<0.05)。ON、OP和OPr处理还会在一定程度改变土壤的pH值。
2.3 菌剂浸种对大田根际土壤解磷菌群落组成的影响
2.3.1 菌剂浸种对土壤解磷菌多样性的影响
采用HiSeq 2500平台完成高通量测序后,对原始数据经过质量筛查、剔除嵌合体获得6个样品测序的有效序列,其范围在70 080.67~86 724.33个之间(图1)。Shannon指数变化范围在7.70~9.40之间,与对照相比,ON和OP处理的根际土壤解磷菌Shannon指数显著提高(P<0.05)(图2),说明ON和OP处理可提高解磷菌群落的多样性。Chao1指数的变化范围在2 557.71~3 499.02之间,与对照相比OP和OPr处理的Chao1指数值显著提高(图3),表明OP和OPr处理可提高解磷菌群落的多样性。
2.3.2 菌剂浸种对土壤解磷菌群落结构的影响
根据OTU划分和分类地位鉴定结果,获取每个样本在门级水平上的群落组成(图4)。在门级水平上土壤解磷菌主要含有变形菌门和放线菌门,其中变形菌门相对丰度为75.6%,放线菌门相对丰度为21.7%,二者占解磷菌总含量的97.3%。ON、OP和ONPKPr处理的土壤中A/P(放线菌门/变形菌门)相比于对照有明显提高,其他处理变化不大。在属级水平上假单胞菌为最大的核心菌属,与对照相比,其在各处理中相对丰度均有较小幅度降低,而另一优势菌属链霉菌属则有小幅提高。使用R软件,对相对丰度前50位的属进行聚类分析并绘制热图,结果显示,OP处理链霉菌属(Streptomyces)和弗兰克氏菌属(Frankia)的相对丰度相比于对照有较明显的提升,但假单胞菌属(Pseudomonas)的相对丰度明显降低,噬氢菌属(Hydrogenophaga)丰度略有降低;ON处理链霉菌属有较小提升;ONPKPr处理链霉菌属、弗兰克氏菌属和糖多孢菌属(Saccharopolyspora)丰度有较大提高;OPr和OK处理均无明显变化(图5)。
2.3.3 菌剂浸种处理土壤解磷菌主成分分析
菌剂浸种处理土壤解磷菌主成分分析(PCA)显示:主成分的影响因子分别为74.99%和21.39%, 从主成分PC1来看,OP、ON和ONPKPr处理距离较近,主要分布于PC1正半轴; 而对照O和OPr距离较近,主要位于PC1负半轴(图6),说明种子浸种OP、ON和ONPKPr给根际土壤解磷菌群落组成带来了较大变化。
2.3.4 菌剂浸种对土壤解磷细菌物种进化及丰度的影响
使用MEGAN软件进行微生物分类等级分析,结果显示,不同菌剂浸种后土壤解磷菌主要属于丙型变形菌纲和放线菌纲,其次是 β-变形菌纲。在种级分类水平OP处理假单胞菌丰度有明显提高,ON处理的假诺卡氏菌和弗兰克氏菌明显提高,且假诺卡氏菌所占的扇形面积达到50%,表明其丰度较高(图7)。
2.3.5 土壤样品中门水级水平解磷菌丰度和土壤因子的关联性冗余分析
通过RDA明确大豆根际解磷菌群落与土壤因子之间的关联性(图8)。放线菌门与有机质夹角呈锐角,说明放线菌门与有机质含量呈正相关,土壤中有机质含量越高,放线菌门的丰度越高;速效氮、速效钾与放线菌门几乎垂直,无相关性。变形菌门与全磷、速效钾、有机质夹角小于90°,说明变形菌门与这些土壤因子呈正相关;全磷、速效钾的射线更长,与变形菌门的夹角更小,说 明土壤中全磷、速效钾含量越高, 变形菌门的丰度越高。
3 讨论与结论
土壤微生物是土壤营养元素循环的主要驱动者,对土壤养分转化、植株的养分吸收、生长发育、能量循环和作物的讯息传递有着非常重要的作用[15-18]。作为土壤健康状态的重要标志,农田生态系统的媒介,土壤微生物群落组成多样性一方面影响作物的生长、发育及产量,另一方面与土壤的理化特性密切相关[19]。不同施肥处理会导致不同的土壤理化性质,进而会影响土壤微生物群落结构的变化[20]。目前生物菌肥的研究越来越受到人们的重视,但是关于生物菌剂对作物的促生增产作用及土壤解磷菌群落结构的影响研究仍有待深入。因此,研究生物菌剂对农作物的促生增产作用及土壤理化特性与解磷菌群落组成的影响对于理解菌肥-土壤微生物-作物之间的关系至关重要。
土壤缺磷是普遍存在的现象,世界上近1/2的农田缺磷,我国大约2/3的农田严重缺磷[21]。但是,目前解决土壤缺磷问题仍主要依赖化学磷肥[22]。过多地施用化学磷肥常常给土壤带来众多不利影响,如导致土壤板结、重金属污染、植物生长条件恶化等[23-26]。因此提高土壤中磷的利用率已成为目前农业生产迫切需要解决的问题。使用微生物菌剂是提高土壤中磷素使用率的有效方式之一。微生物可以通过产生有机酸及各种酶来螯合、溶解难溶磷从而提高土壤中磷素的可利用性[27-29]。研究证实根际接种假单胞菌等有益微生物菌剂能够提高土壤有效态磷含量、土壤磷酸酶活性,进而促进植物对磷素的吸收[30-32]。解磷菌和化肥配合使用,可以提高土壤有效磷的含量及玉米、小麦的产量[33]。此外,还发现施用微生物菌肥可以提高面条菜的产量和品质[34]。大豆产量的高低经常受到多种因素的影响,主要包括大豆品种、土壤状况、气候资源、水肥条件、微生物群落结构以及管理措施等。微生物群落结构是影响大豆产量关键因素之一,故人们可以通过科学施肥来提升大豆的产量和品质,尤其是目前随着绿色农业及有机农业的快速发展,减少化肥的使用,增加生物菌剂的使用正逐步成为主流。本试验表明,不同外源性菌剂也能达到提高大豆产量的效果。ONPKPr菌剂对大豆产量的提升效果最为明显,与对照相比产量增幅为5.00%。ON和OPr菌剂也表现出较好的增产效果,分别增产4.67% 和 2.24%。因而在大豆生育期建议加强菌剂或生物菌肥的使用,不但可以提高有磷素的使用效率,而且可以提高大豆的产量。
解磷菌作为重要的土壤微生物,可以将土壤中难溶状态的磷素转化为可被作物汲取利用的正磷酸盐,进而提高土壤有效磷和磷酸酶活性,增强土壤其他有益微生物的活性[35,36]。Lee等研究认为,作物还可通过分泌物质影响土壤中微生物的菌群组成多样性[37-38]。目前有关菌剂与解磷菌群落组成研究较少,但已有研究表明,外源性微生物与土壤中其他微生物之间的互作、外源微生物与环境之间的互作对土壤微生物群落组成多样性会产生重要的影响[39]。Fierer 等认为变形菌与土壤有机质的含量呈显著正相关,本试验发现不同菌剂浸种处理土壤解磷菌均以变形菌门和放线菌门为主,不同菌剂浸种2种优势菌在丰度上存在较大差异[40]。OP处理的土壤中A/P变化明显,变形菌门明显下降。在本试验中OP处理的土壤有机质含量明显下降,且相关性分析表明变形菌门与有机质含量呈正相关,这与Fierer等的结论一致。放线菌作为土壤微生物的核心菌群,在土壤的碳、氮和磷素循环中发挥着积极作用,它可以利用难分解有机碳源,也可以在磷溶解中发挥主导作用[41-42]。由此可以推断,外源性菌剂对土壤C、N和P等营养物质的转化有一定促进作用。菌剂之所以能提高放线菌门和变形菌门分布比值(A/P值),分析原因认为可能与有效氮含量增加有关。Ramirez等的研究也表明施加氮肥可提升放线菌的相对丰度,酸杆菌的相对丰富度则下降[43]。在本试验中土壤有效氮含量增加,A/P上升,放线菌丰度与土壤中的有效氮含量之间存在正相关性,这与前人试验结果一致。本试验还发现不同菌剂浸种处理土壤中链霉菌属丰度相比于CK有较明显的增高。有研究表明链霉菌可产生有利于植物抵抗恶劣环境的物质,故链霉菌的增加可能也是大豆产量提高的原因之一[44-45]。
本试验发现,在大豆种植过程中,用固氮型根瘤菌、解磷型芽孢杆菌(OP)、解钾型芽孢杆菌 (OK)、固氮-解磷复合型真菌印度梨形孢(OPr)及4种菌剂复配剂(ONPKPr)对大豆进行浸种处理可以提高大豆的产量,尤其是ONPKPr浸种处理,对大豆根瘤数、根瘤干质量和产量提升作用均最为显著。不同菌剂浸种处理对土壤的理化特性具有一定影响,ONPKPr和OPr處理对根际土壤速效磷含量提高极为显著;不同菌剂浸种会影响根际土壤解磷菌在属级水平上的群落组成,但并未改变其在门级水平上的群落组成,主体菌仍然以放线菌门和变形菌门为主,但不同处理会改变放线菌门和变形菌门的比值;冗余分析发现放线菌门在土壤中丰度与土壤有机质含量呈正相关性,变形菌门丰度与全磷、速效钾含量呈正相关性。总之,采用固氮型、解磷型以及它们的符合型菌剂进行大豆浸种,对改良土壤理化特性、优化土壤解磷菌种类、提高大豆产量均具有一定的促进作用。
參考文献:
[1] Liu X W,Yuan Z W,Liu X,et al. Historic trends and future prospects of waste generation and recycling in Chinas phosphorus cycle [J]. Environmental Science & Technology,2020,54(8):5131-5139.
[2]Shannon P,Markiel A,Ozier O. Cytoscape:a software environment for integrated models of biomolecular interaction networks [J]. Genome Research,2003,13(11):2498-2504.
[3]Brito L F,López M G,Straube L,et al. Inorganic phosphate solubilization by rhizosphere bacterium Paenibacillus sonchi:gene expression and physiological functions [J]. Frontiers in Microbiology,2020,11:588605.
[4]Chandran H,Meena M,Swapnil P. Plant growth-promoting rhizobacteria as a green alternative for sustainable agriculture [J]. Sustainability,2021,13(19):1-30.
[5]罗 倩,黄宝灵,唐治喜,等. 新疆盐渍土3种植被类型土壤微生物碳源利用[J]. 应用与环境生物学报,2013,19(1):96-104.
[6]陈定安,魏小武,张 敏,等. 油茶树根际土壤解有机磷细菌的分离、鉴定及解磷能力分析[J]. 农业科学与技术(英文版),2020,21(1):41-47.
[7]常 佳. 施用不同肥料对复垦土壤无机磷形态及玉米品质产量的影响[D]. 太原:山西农业大学,2006:14-31.
[8]张 健,洪坚平,郝晶,等. 不同解磷菌群在石灰性土壤中对油菜产量及品质的影响[J]. 山西农业大学学报(自然科学版),2006,28(2):149-151.
[9]常慧萍,祝凌云,姚丽娟,等. 小麦根际固氮菌、解磷菌及解钾菌的互作效应[J]. 中国土壤与肥料,2008(4):57-59.
[10] 夏觅真,马忠友,曹媛媛,等. 棉花根际固氮菌、解磷菌及解钾菌的相互作用[J]. 中国微生态学杂志,2010,22(2):102-105.
[11]Aggani S L. Development of bio-fertilizers and its future perspective [J]. Soil Science Society of America Journal,2013,2:327-332.
[12]Jayathilake P K S,Reddy I P,Srihari D,et al. Productivity and soil fertility status as influenced by integrated use of n-fixing biofertilizers,organic manures and inorganic fertilizers in onion [J]. Journal of Agricultural Sciences,2006,2(1):46-58.
[13]Asl A N. Effects of nitrogen and phosphate biofertilizers on morphological and agronomic characteristics of sesame (Sesamum indicum L.) [J]. Open Journal of Ecology,2017,7(2):101-111.
[14]鲍士旦. 土壤农化分析[M]. 北京:中国农业出版社,2000.
[15]贺纪正,李 晶,郑袁明. 土壤生态系统微生物多样性-稳定性关系的思考[J]. 生物多样性,2013,21(4):411-420.
[16]Levy A,Salas Gonzalez I,Mittelviefhaus M,et al. Genomic features of bacterial adaptation to plants [J]. Nature Genetics,2018,50(1):138-150.
[17]Vestal J R,White D C. Lipid analysis in microbial ecology [J]. BioScience,1989,39(8):535-541.
[18]Bechtaoui N,Rabiu M K,Raklami A,et al. Phosphate-dependent regulation of growth and stresses management in plants [J]. Frontiers in Plant Science,2021,12:679916.
[19]Philipp O,Hamann A,Osiewacz H D,et al. The autophagy interaction network of the aging model Podospora anserina [J]. BMC Bioinformatics,2017,18(1):196-201.
[20]Manzoor M,Abbasi M K,Sultan T. Isolation of phosphate solubilizing bacteria from maize rhizosphere and their potential for rock phosphate solubilization-mineralization and plant growth promotion [J]. Geomicrobiol J,2017,34(1):81-95.
[21]王莉晶,高晓蓉,孙嘉怡,等. 土壤解磷微生物作用机理及解磷菌肥对作物生长的影响[J]. 安徽农业科学,2008,36(14):5948-5950,5958.
[22]Elhaissoufi W,Ghoulam C,Barakat A,et al. Phosphate bacterial solubilization:a key rhizosphere driving force enabling higher P use efficiency and crop productivity [J]. Journal of Advanced Research,2022,38(9):13-28.
[23]Liang X L,Wagner R E,Li B X,et al. Quorum sensing signals alter in vitro soil virus abundance and bacterial community composition [J]. Frontiers in Microbiology,2020,11:1287.
[24]张春云,王新建,吉 海,等. “光合元”生物菌肥在红枣南疆红上的应用研究[J]. 新疆农业科学,2014,51(9):1644-1651.
[25]刘春燕,周 龙,陈冬立,等. 生物菌肥对桃土壤肥力及地上部的影响[J]. 河南农业大学学报,2020,54(4):597-603.
[26]Gruber N,Galloway J N. An earth-system perspective of the global nitrogen cycle [J]. Nature,2008,451(7176):293-296.
[27]Chen W M,Yang F,Zhang L,et al. Organic acid secretion and phosphate solubilizing efficiency of Pseudomonas sp. PSB12:effects of phosphorus forms and carbon sources [J]. Geomicrobiology Journal,2016,33(10):870-877.
[28]Yu L Y,Huang H B,Wang X H,et al. Novel phosphate-solubilising bacteria isolated from sewage sludge and the mechanism of phosphate solubilisation [J]. Science of The Total Environment,2019,658(25):474-484.
[29]Wei Y Q,Zhao Y,Shi M Z,et al. Effect of organic acids production and bacterial community on the possible mechanism of phosphorus solubilization during composting with enriched phosphate-solubilizing bacteria inoculation [J]. Bioresour Technology,2018,247:190-199.
[30]郜春花,卢朝东,张 强. 解磷菌剂对作物生长和土壤磷素的影响[J]. 水土保持学报,2006,20(4):54-56,109
[31]韦云东,周时艺,陈蕊蕊,等. 生物有机肥、枯草芽孢杆菌对木薯生长及土壤性状的影响[J]. 广东农业科学,2022,49(12):64-73.
[32]柯春亮,戴嘉欣,周登博,等. 利用T-RFLP 技術在施用解磷菌剂土壤中微生物群落多样性分析[J]. 安徽农业大学学报,2017,44(3):471-477.
[33]Kaur G,Reddy M S. Effects of phosphate-solubilizing bacteria,rock phosphate and chemical fertilizers on maize-wheat cropping cycle and economics [J]. Pedosphere,2015,25(3):428-437.
[34]于占东,刘云峰,温 丹,等. 有机肥配施生物菌肥对设施蔬菜土壤改良及面条菜生长、品质的影响[J]. 山东农业科学,2022,54(8):99-103.
[35]Saadouli I,Mosbah A,Ferjani R,et al. The impact of the inoculation of phosphate-solubilizing bacteria Pantoea agglomerans on phosphorus availability and bacterial community dynamics of a semi-arid soil [J]. Microorganisms,2021,9(8):1661.
[36]Etesami H,Jeong B R. Contribution of arbuscular mycorrhizal fungi,phosphate-solubilizing bacteria,and silicon to P uptake by plant [J]. Frontiers in Plant Science,2021,12:699618.
[37]Lee S H,Lee W S,Lee C H,et al. Degradation of phenanthrene and pyrene in rhizosphere of grasses and legumes [J]. Journal of Hazardous Materials,2008,153(1/2):892-898.
[38]Sun T R,Cang L,Wang Q Y,et al. Roles of abiotic losses,microbes,plant roots,and root exudates on phytoremediation of PAHs in a barren soil [J]. J Hazard Mater,2010,176(1/2/3):919-925.
[39]Ranjard L,Dequiedt S,Jolivet C,et al. Biogeography of soil microbial communities:a review and a description of the ongoing French national initiative [J]. Agronomy for Sustainable Development,2010,30(2):359-365.
[40]Fierer N,Bradford M A,Jackson R B,et al. Toward an ecological classification of soil bacteria [J]. Ecology,2007,88(6):1354-1364.
[41]He T,Guan W,Luan Z Y,et al. Spatiotemporal variation of bacterial and archaeal communities in a pilot-scale constructed wetland for surface water treatment [J]. Applied Microbiology and Biotechnology,2016,100(3):1479-1488.
[42]Long X E,Yao H,Huang Y,et al. Phosphate levels influence the utilisation of rice rhizodeposition carbon and the phosphate- solubilising microbial community in a paddy soil [J]. Soil Biology and Biochemistry,2018,118(1):103-114.
[43]Ramirez K S,Craine J M,Fierer N. Consistent effects of nitrogen amendments on soil microbial communities and processes across biomes [J]. Global Change Biology,2012,18(6):1918-1927.
[44]曹書苗,王文科,王 非,等. 放线菌对干旱胁迫下黑麦草生长及抗氧化特性的影响[J]. 西北植物学报,2016,36(4):751-756.
[45]Zhao J,Xue Q H,Shen G H,et al. Evaluation of Streptomyces spp. for biocontrol of gummy stem blight (Didymella bryoniae) and growth promotion of Cucumis melo L.[J]. Biocontrol Science and Technology,2012,22(1):23-37.
收 稿日期:2023-03-28
基金项目:中国农业科学院农田灌溉研究所河南商丘农田生态系统国家野外科学观测研究站开放基金(编号:SQZ2015-03);世界自然基金会与瑞尔保护协会有机农业发展项目(编号:PO2893、PO3042) 。
作者简介:方明棵(1996—),女,广西南宁人,硕士研究生,主要研究方向为有益微生物资源开发与利用。E-mail:fmz169@qq.com。
通信作者:李会贞,研究实习员,主要研究方向为农业水土工程,E-mail:lihuizhen@caas.cn;杨亚珍,副教授,主要研究方向为有益微生物资源开发与利用,E-mail:yyangyazhen@163.com。

