半夏轮作土壤丛枝菌根真菌多样性与环境因子相关性研究
张翔宇 陈晓芳 柳敏 成忠均 李恒谦 查钦

摘要: 解析不同轮作年限半夏土壤丛枝菌根真菌群落多样性与环境因子的相关性,为利用土壤环境因子调控AMF组成与丰度,提高半夏栽培效益提供参考。采用不同年限轮作半夏种植土壤为材料,通过高通量测序和生物信息学分析土壤丛枝菌根真菌群落多样性,并结合环境因子进行相关性分析。结果表明,AMF的多样性和丰度均随着轮作时间的延长而增加,5個样地的15个土壤样品中共注释到了12个科、14个属、63个种的AMF类群,球囊霉属(Glomus)、近明球囊霉属(Claroideoglomus)为优势类群,占总序列数的91.65%;在优势菌群中,球囊霉属的相对丰度与ACP活性极显著负相关,与TK含量显著负相关,近明囊霉属的相对丰度与OM含量显著负相关,与TK含量、CAT活性、PPO活性显著或极显著正相关;非优势菌群中,未分类的球囊霉门的相对丰度与URE活性极显著正相关,与pH值极显著负相关,多孢囊霉属(Diversispora) 的相对丰度与pH值极显著正相关,与AN含量极显著负相关;不同菌群与土壤理化性质和酶活性的关联性差异较大,不同轮作年限土壤环境因子对半夏土壤中AMF群落组成和多样性影响较大。
关键词: 半夏;轮作;丛枝根真菌;环境因子;多样性;相关性
中图分类号:S567.23+9.01;S182 文献标志码:A
文章编号:1002-1302(2024)02-0213-08
中药材半夏[Pinellia ternate(Thunb.)Breit.]具有燥湿化痰、降逆止呕、消痞散结的功效[1]。半夏在我国为广泛分布种,自然居群不径相同。产地沿革考证其产区有陕西、山东、江苏、湖北等地[2]。如今我国半夏种植主产区为甘肃、河北、贵州、湖北等省,贵州赫章是主要半夏种植产区之一[3],所产半夏个大粒圆、色白粉足[4-5]。
植物和土壤微生物之间的相互作用是连接生态系统的关键[6]。土壤微生物量是土壤活性的重要标志[7]。植物为土壤微生物提供一定的营养,促进两者协同进化。土壤微生物可分解有机物并被植物吸收[6]。土壤微生物重要组成部分丛枝菌根真菌(以下简称“AMF”)广泛分布于农田、森林等土壤环境[8]。国内已发现的AMF虚拟种有145个, 隶属于8科12属[9],包括粮食作物、蔬菜和中药材等90%以上陆地维管植物可与AMF形成菌根结构[10]。
AMF与植物根系形成互惠的根系系统[11],增强植物营养和矿质吸收,提高光合速率和生物量[12]。其形成的菌丝网可增加病原菌侵染根系难度[13],AMF可与病原菌竞争生态位抑制其繁殖从而防控土传病害。AMF能诱导植物产生防御酶类,这些酶类是植物抗病性的重要指标[14-15]。免耕能促进AMF生长和提高土壤碱性磷酸酶活性,持续免耕4年的土壤AMF群落结构没有退化[16],提高大粒径团聚体中AMF种群丰度可促进土壤团聚[17],AMF增殖和活性的提高可增强抑病能力[18]。单一作物轮作会抑制根际AMF活性和数量[19],而采用间作方式能够有效提高土壤中AMF的丰富度和多样性,促进AMF的侵染和菌根的形成[20]。
半夏的相关研究主要集中在栽培技术、病虫害防治、轮作障碍因子等,有关半夏种植土壤AMF多样性的研究虽有[21-24],但对采用不同作物轮作土壤AMF多样性与土壤环境因子的相关性研究却鲜见报道。本研究通过高通量测序,对赫章半夏道地产区轮作样地土壤AMF的群落组成及多样性进行分析,并进一步探究不同轮作土壤AMF组成与土壤环境因子的关系,以期为土壤环境因子调控AMF提高半夏栽培效益提供参考。
1 材料与方法
1.1 试验材料
试验用半夏种子采用贵州省赫章县本地选育优势品种赫麻芋1号(贵州省农业农村厅认证品种),挑选直径为1.0~1.5 cm的健康半夏种子用 2 000 倍石灰水浸泡5 h进行消毒处理后漂洗3次,用62.5 g/L精甲·咯菌腈悬浮种衣剂拌种晾干备用。
1.2 试验地概况
田间试验设在贵州省毕节市赫章县双坪乡贵州山地高效农业公司半夏种植区域,选择土层深厚肥沃、排灌良好的沙质土壤为试验基地,划分不同小区连续栽种半夏与不同蔬菜,形成不同轮作茬数的处理样地。
1.3 土壤样本采集
于贵州省赫章县双坪镇赫章县山地高效农业科技有限公司半夏种植基地内,按照随机取样方法,采集未种植(CK)、半夏—蔬菜(白菜)轮作1年(LZ1)、半夏—蔬菜(甘蓝)轮作2年(LZ2)、半夏—蔬菜(萝卜)轮作3年(LZ3)、半夏—蔬菜(玉米)轮作4年(LZ4)的不同样地半夏根际土壤,每个样地按照随机取样法取5份后混合为1个样,每组3个生物学重复,采集的土壤过20目筛后一部分置于-80 ℃下保存,用于土壤微生物DNA提取测序;另一部分室内自然风干后用于土壤理化性质测定。
1.4 理化指标及酶活性测定
对不同样本土壤理化性质和酶活性测定具体方法如下:土壤样品经硫酸-加速剂消解后用凯氏法测定全氮(TN)含量;经NaOH碱熔后用钼锑抗分光光度法测定全磷(TP)含量、用火焰光度计法测定全钾(TK)含量;用玻璃电极法测定pH值;用重铬酸钾氧化-外加热法测定有机质(OM)含量;用碱解扩散法测定碱解氮(AN)含量;用B-0.05 mol/L HCl-0.025 mol/L H2SO4(1/2 H2SO4) 法测定有效磷(OP)含量;用乙酸铵浸提-火焰光度计测定速效钾(AK)含量; 用高锰酸钾滴定法测定过氧化氢酶(CAT)活性;用试剂盒测定脲酶(URE)、蔗糖酶(SC)、 酸性磷酸酶(ACP)、多酚氧化酶(PPO)活性。以上指标测定委托南京卡文思检测技术有限公司负责。
1.5 DNA提取、扩增和高通量测序
根据 FastDNASpin Kit for Soil说明书进行土壤微生物群落总基因组 DNA 抽提。以提取的 DNA 为模板进行Nest-PCR 扩增,一轮引物为AML1F(5′-ATCAACTTTCGATGGT AGGATAGA-3′) 和AML2R(5′-GAACCCAAACACTTTGGTTTCC- 3′);二轮引物为AMV 4-5NF(5′- A A G C T C G T A G T T G A A T T T C G -3′)和AMDGR(5′- C C C A A C T A T C C C T A T T A A T C A T -3′)。PCR反应每个样本3次重复。将同一样本的PCR产物混合后回收,利用Illumina公司的MiSeq PE300平台进行测序。以上相关流程均委托上海美吉生物医药科技有限公司完成。
1.6 数据统计与分析
以97%相似度的 OTU为分类学水平,将所有样本序列按最小样本序列数进行抽平,利用 Mothur 计算α多样性指数,并采用Wilxocon秩和检验进行α多样性的组间差异分析;基于bray-curtis距离算法检验样本间微生物群落结构的相似性;通过R(version 3.3.1)、pheatmap package软件计算环境因子与物种之间的相关性系数(Spearman等级相关系数)数值矩阵获得Heatmap图;用Network软件进行双因素相关性网络分析(相关系数类型:Spearman;相关系数绝对值≥0.5);采用Excel 2017 软件数据处理;使用 SPSS 22.0 进行数据的统计分析。
2 结果与分析
2.1 土壤理化性质及酶活性分析
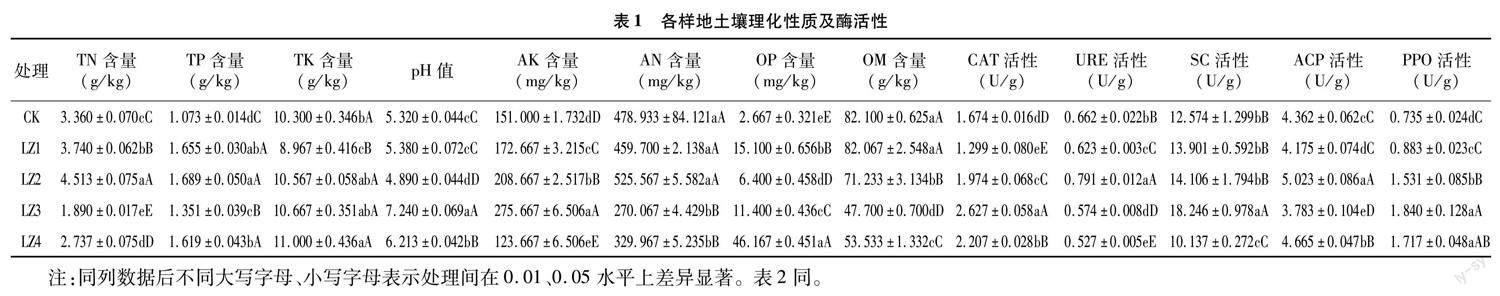
对5个采样地半夏根际土壤基本理化性质和酶活性8项指标进行检测(表1),不同样地土壤理化性质及酶活性存在一定的显著性或极显著性差异。TN、TP、AN、ACP含量随轮作时间的延长呈波浪式降低;TK含量随轮作时间延长而增加;AK、CAT、URE、SC、PPO活性随轮作的延长而先增后降;pH值在CK、LZ1、LZ2土壤呈强酸性,在LZ3呈弱碱性,在LZ4呈弱酸性。
2.2 土壤AMF高通量测序结果及多样性分析
序列经抽平后,采用反映物种丰富度的Shannon指数绘制稀释曲线,随着样品测序深度的增加,15个样品的OTU稀释曲线趋于平缓(图1),表明其测序深度足够,而且各样品测序覆盖度均在99.95%以上,说明本次检测的结果能够客观地代表样本中AMF的多样性。
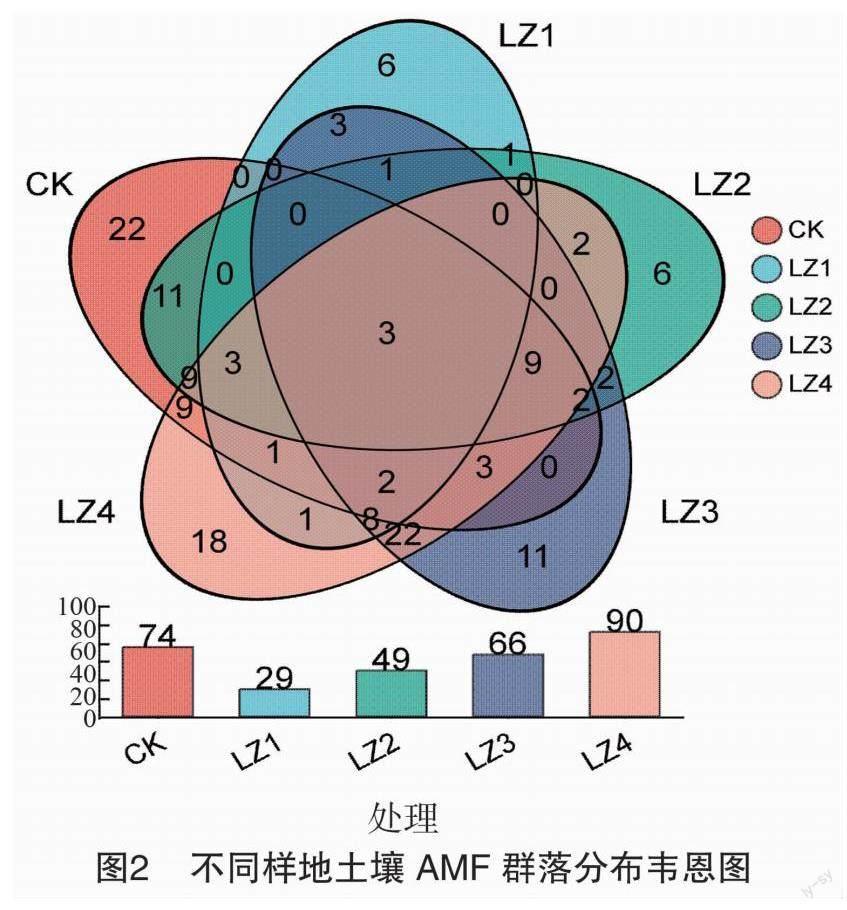
所有样本共聚类到155个OTU,图2韦恩图为样本间独有、共有OTU数量, 下方柱状图为每一样本OTU总数。在轮作年限中,OTU数量上表现为LZ4> LZ3>LZ2>LZ1,轮作越长土壤中AMF的OTU种类越多,轮作4年AMF的OTU达90种(图2)。
对不同样地的α多样性指数分析(表2)表明:LZ4的AMF群落多样性和丰富度均为最高,其次为CK,而轮作一年LZ1为最低。 反映土壤AMF丰富度的ACE 和 Chao 指数分别在(27.501 7±9.118 3)~ (70.624 8±3.566 6)和(18.666 7±3.055 1)~(68.566 7±3.156 5) 之间,反映AMF群落多样性的 Shannon指数在(1.337 5±0.404 3)~(3.055 2± 0.103 5)之间,其中,LZ4样地半夏根际土壤AMF多样性最丰富,Shannon 指数和Chao指数分别为3.055 2±0.103 5和68.566 7±3.156 5。与之相反,LZ1样地AMF多样性最低,Shannon指 數、Chao指数分别为1.337 5±0.404 3和18.666 7± 3.055 1。 反映土壤AMF优势度的 Simpson 指数在(0.074 7± 0.006 1)~(0.346 3±0.169 5)之间,LZ1样地的AMF优势度最高,轮作土壤中AMF群落的优势度均高于对照组(CK)。
由样本土壤AMF群落组间差异检验(图3)可知,不同组间存在一定显著性差异。其中CK与LZ1、LZ2、LZ3之间有极显著差异(P<0.01),CK与LZ4之间无显著差异;LZ1与LZ2之间有显著差异(P<0.05),与LZ3、LZ4之间有极显著差异(P<0.01);LZ2与LZ3之间无显著差异,与LZ4有极显著差异(P<0.01);LZ3与LZ4之间有极显著差异(P<0.01)。以上表明,轮作时间越长土壤中AMF越趋于稳定,与未种植(CK)基本接近,但由于种植半夏与蔬菜的轮作,从而导致土壤中AMF比未种植过半夏的土壤更丰富;半夏土壤AMF的多样性和丰度均随着轮作时间的延长而增加。
2.3 土壤AMF组成及丰度分析
在科的水平,15个样品中共注释到了12个科的AMF类群,将物种丰度占比小于0.01的归入其他(others)(图4),球囊霉科(Glomeraceae)、近明球囊霉科(Claroideoglomeraceae)在5个样地中均有,为主要的优势类群,丰度总占比达91.65%,其中球囊霉科占比63.06%;球囊霉科在CK、LZ1、LZ3中为绝对优势类群,球囊霉科和近明球囊霉科在LZ2、LZ4中的丰度基本接近;而类球囊霉科(Paraglomeraceae)在CK、LZ1、LZ2、LZ4中占有一定的比例,在LZ3土壤样品中未被检出。在属的水平,15 个样品中共注释到了14个属的AMF菌类群(图5),球囊霉属(Glomus)、近明球囊霉属(Claroideoglomus)为主要的优势类群,占总序列数的91.65%,其中球囊霉属占比达63.06%,2个优势属在各样本中的分布规律与科水平一致。在种的水平,15个样品中共注释到了63个种(图6),遗憾的是AMF在种水平很多未被具体分类,说明AMF在种水平的研究还有较大的空间。
2.4 土壤AMF群落结构与土壤环境因子相关性分析
对丰度排名Top10的AMF科与环境因子进行相关性聚类热图分析。结果(图7)表明,无梗囊霉属(Acaulospora)、巨孢囊霉属(Gigaspora)的相对丰度与OM含量显著正相关,与TP含量、OP含量、PPO活性极显著负相关(P<0.01);球囊菌门(Glomeromycota)未分类属的相对丰度与OM含量显著正相关,与TN含量、AN含量、URE活性极显著正相关,与pH值(P<0.001)、OP含量(P<0.01)极显著负相关,与PPO活性显著负相关;盾巨孢囊霉属(Scutellospora)、原囊霉属(Archaeospora)的相对丰度与URE活性显著正相关,与pH值、OP含量显著(P<0.05)或极显著(P<0.01)负相关;近明囊霉属的相对丰度与OM含量显著负相关,与TK含量、CAT活性、PPO活性显著(P<0.05)或极显著(P<0.01)正相关;类球囊霉属(Paraglomus)、球囊霉目(Glomerales)的未分类属的相对丰度与AK含量、SC活性显著(P<0.05)或极显著(P≤0.01)负相关;球囊霉目(Glomerales)未分类属的相对丰度与OP含量显著正相关;球囊霉属的相对丰度与ACP活性极显著负相关,与TK含量显著负相关;多孢囊霉属(Diversispora)的相对丰度与ACP活性、OM含量、TN含量、AN含量、URE活性显著或极显著负相关,与pH值、OP含量、CAT活性、PPO活性显著或极显著正相关。
对AMF属水平群落与环境因子进行双因素Network网络分析。结果(图8)表明,未分类的球囊霉门的相对丰度与URE极显著正相关,与pH值极显著负相关;多孢囊霉属的相对丰度与pH值极显著正相关,与AN极显著负相关。以上结果与聚类热图(图7)相互印证。AMF群落与环境因子的连线为:多孢囊霉属为9条、未分类的球囊霉门为6条、巨孢囊霉属为4条、无梗囊霉属为4条、近明球囊霉属为4条、双型囊霉属(Ambispora)为4条、原囊霉属为3条、盾巨孢囊霉属(Scutellospora)为3条,与环境因子的连线越多,表明该群落与环境因子的关系越密切,受影响因素越多。综上所述,对AMF菌群的生长调节需要考虑多因素环境因子的相互关系,这为采用施肥调整土壤结构从而有目的增加某属AMF菌群的丰度具有指导意义。
3 讨论与结论
土壤pH值、OM含量、TN含量、TP含量、 TK含量等能直观反映土壤肥力,对植物和微生物的生长具有重要影响。安艳发现,半夏连作根际土壤中TN、 TP、 OP、OM含量和CAT、URE活性等降低,AK含量、PPO活性升高[25]。杭烨等发现,单作半夏土壤细菌数量和放线菌数量低于其余6种间作组合,间作可以提高土壤综合肥力[26]。王礼科等发现,随半夏连作年限增加,AK、OP含量下降[27]。本研究结果与上述既相似又有所不同,即均为TN含量、TP含量、OM含量、URE活性下降,但AK含量、OP含量、CAT活性结果不同,其原因可能是不同栽培模式导致土壤环境因子发生规律不一致,本研究连续轮作与连作的区别在于在半夏采收过后种植一茬蔬菜,从而改变了土壤理化性质的变化规律。本研究结果表明,轮作情况下半夏根际土壤TN含量、TP含量、AK含量、AN含量、URE活性、SC活性、ACP活性、OM含量随着轮作时间的延长最终降低;TK含量、OP含量、CAT活性、PPO活性随着轮作时间的延长而增加。
唐成林等发现,种植半夏后土壤中微生物数量增加[28]。施晓峰等发现,大量的 AMF 孢子存在于半夏根际土中,经鉴定得到20种3属,其中球囊霉属16种(80.0%),无梗囊霉属3种(15.0%),盾巨孢囊霉属1种(5.0%)[24]。何志贵发现,不同种植方式土壤真菌群落结构各自聚类,与种植时限无明显关系。种植方式的变换可显著抑制病原真菌而提升有益真菌丰度[29]。刘诗蓉等发现,随着半夏连茬次数的增加,根际土有益微生物丰度减少、有害微生物丰度增加,多样性降低,并认为这是连作障碍形成的重要原因[30]。本研究发现,连续轮作情况下土壤AMF的种类和丰度均上升,Shannon指数从LZ1的(1.337 5±0.404 3)上升LZ4的(3.055 2±0.103 5),说明随着轮作时间的延长,种植半夏土壤中AMF群落多样性越高;球囊霉科、近明球囊霉科为主要的优势菌群,不管是在科水平还是属水平的,所占总序列数比例均为91.65%。
本研究中无梗囊霉属、巨孢囊霉属、球囊菌门未分类属、盾巨孢囊霉属、原囊霉属等的相对丰度与土壤有效磷之间呈现显著或极显著负相关性,说明随着土壤有效磷含量的增加,以上AMF菌群的物种丰度下降,这与Tawaraya等的研究结果类似,即较低的OP会促进 AMF的生长[31]。张海波等发现,在偏碱性石灰土中的AMF多样性高于偏酸性黄壤[32]。本研究LZ3的土壤pH值偏碱性,其土壤中AMF多样性高于偏酸性的LZ1、LZ2,但又低于偏酸性的LZ4,说明偏碱性的土壤中AMF多样性要高于偏酸性土壤并不绝对,还与耕作模式、种植年限等相关。Liang等发现,喀斯特地区AMF多样性与土壤pH值呈负相关,本研究中虽然部分AMF群落与pH值呈现负相关性,但多孢囊霉属却与pH值呈极显著正相关,说明该属的生长更偏向于碱性土壤[33]。在pH值为 5~9的喀斯特地区,土壤碱性与球囊霉属比例正相关,该属可能处于更重要的生态位[34]。本研究中球囊霉属为主要优势菌群,近明球囊霉属次之,这与上述研究结果类似。
土壤微生物和土壤酶共同参与土壤的生物生化过程,土壤酶活性反映其生化反应过程的方向和强度[35-39]。AMF能够增强寄主植物根系中相关酶活提高抗盐能力[40]。菌根能改善土壤OM含量、团粒结构和透气性[41],增强脲酶、蔗糖酶等酶活性而减缓轮作危害[42-43]。AMF通过调节植物根系分泌物降解酚酸类物质[44]。AMF能与土壤其他有益微生物协同作用增强植株抵御能力,其诱发的防御反应可提高植物对病原菌抗性,促进养分、水分的吸收,改善轮作土壤生境状况,缓解轮作障碍的危害[44]。近明球囊霉、根内球囊霉、摩西斗管囊霉等能够促进宿主对营养元素的吸收和促进植物生长和生物量积累,根内根孢囊霉在高溫胁迫下显著提高苍术根茎鲜质量、含水量、根干质量、地下总干质量、挥发油组分数,根内根孢囊霉在盐胁迫下可以增加罗勒对钾的吸收、降低对钠和氯化物的吸收[45-46]。本研究的土壤酶活性与样本AMF群落相关性表明,AMF群落与过氧化氢酶、脲酶、多酚氧化酶、酸性磷酸酶、蔗糖酶活性之间具有一定的相关性。而不同AMF与土壤酶活性之间的相关性有较大区别,如无梗囊霉属、巨孢囊霉属与PPO活性极显著负相关;球囊菌门的未分类属与URE活性极显著正相关,与PPO活性显著负相关;盾巨孢囊霉属、原囊霉属与URE显著正相关;近明囊霉属与CAT、PPO活性显著或极显著正相关;类球囊霉属、球囊霉目的未分类属与SC活性显著负相关;球囊霉属与ACP活性极显著负相关;多孢囊霉属与ACP、URE活性显著或极显著负相关,与CAT、PPO活性显著或极显著正相关。
参考文献:
[1] 国家药典委员会. 中华人民共和国药典[M]. 北京:化学工业出版社,2020:123-125.
[2]石 青,赵宝林. 半夏的本草考证[J]. 陕西中医学院学报,2013,36(2):90-92.
[3]陈铁柱,薛朝金,许文艺,等. 赫章半夏土壤环境质量分析与评价[J]. 时珍国医国药,2010,21(3):713-714.
[4]赵明勇,阮培均,梅 艳,等. 喀斯特温凉气候区半夏高产栽培技术优化研究[J]. 作物杂志,2012(3):93-98.
[5]孙长青,赵泽英,李莉婕,等. 基于GIS的赫章县半夏生态适宜性的评价[J]. 贵州农业科学,2012,40(7):87-91.
[6]蒋 婧,宋明华. 植物与土壤微生物在调控生态系统养分循环中的作用[J]. 植物生态学报,2010,34(8):979-988.
[7]何振立. 土壤微生物量及其在养分循环和环境质量评价中的意义[J]. 土壤,1997,29(2):61-69.
[8]王发园,林先贵,周健民. 丛枝菌根与土壤修复[J]. 土壤,2004,36(3):251-257.
[9]王永明,范洁群,石兆勇. 中国丛枝菌根真菌分子多样性[J]. 微生物学通报,2018,45(11):2399-2408.
[10] He X H,Duan Y H,Chen Y L,et al. A 60-year journey of mycorrhizal research in China:past,present and future directions[J]. Science China Life Sciences,2010,53(12):1374-1398.
[11]Favre P,Bapaume L,Bossolini E,et al. A novel bioinformatics pipeline to discover genes related to arbuscular mycorrhizal symbiosis based on their evolutionary conservation pattern among higher plants[J]. BMC Plant Biology,2014,14(1):1-20.
[12]van Driesche R G,Carruthers R I,Center T,et al. Classical biological control for the protection of natural ecosystems[J]. Biological Control,2010,54(2):S2-S33.
[13]Merrild M P,Ambus P,Rosendahl S,et al. Common arbuscular mycorrhizal networks amplify competition for phosphorus between seedlings and established plants[J]. New Phytologist,2013,200(1):229-240.
[14]Prasad T K.Role of catalase in inducing chilling tolerance in pre-emergent maize seedlings[J]. Plant Physiology,1997,114(4):1369-1376.
[15]Gechev T,Willekens H,van Montagu M,et al. Different responses of tobacco antioxidant enzymes to light and chilling stress[J]. Journal of Plant Physiology,2003,160(5):509-515.
[16]Hu J L,Yang A N,Wang J H,et al. Arbuscular mycorrhizal fungal species composition,propagule density,and soil alkaline phosphatase activity in response to continuous and alternate no-tillage in Northern China[J]. CATENA,2015,133:215-220.
[17]Dai J,Hu J L,Zhu A N,et al. No tillage enhances arbuscular mycorrhizal fungal population,glomalin-related soil protein content,and organic carbon accumulation in soil macroaggregates[J]. Journal of Soils and Sediments,2015,15(5):1055-1062.
[18]侯劭煒,胡君利,吴福勇,等. 丛枝菌根真菌的抑病功能及其应用[J]. 应用与环境生物学报,2018,24(5):941-951.
[19]Wu J H,Shen W S,Lin L M,et al. Testing the technology acceptance model for evaluating healthcare professionals intention to use an adverse event reporting system[J]. International Journal for Quality in Health Care,2008,20(2):123-129.
[20]Bainard L D,Klironomos J N,Gordon A M.Arbuscular mycorrhizal fungi in tree-based intercropping systems:a review of their abundance and diversity[J]. Pedobiologia,2011,54(2):57-61.
[21]沈雪莲. 半夏AM真菌及其共生效应研究[D]. 南京:南京农业大学,2010.
[22]程俐陶,郭巧生,刘作易.半夏丛枝菌根真菌侵染模式及侵染率动态变化[J]. 贵州农业科学,2009,37(2):37-39.
[23]程俐陶,郭巧生,刘作易. 栽培及野生半夏丛枝菌根研究[J]. 中国中药杂志,2010,35(4):405-410.
[24]施晓峰,黄晶晶,史 亚,等. 半夏丛枝菌根真菌多样性研究[J]. 陕西中医药大学学报,2017,40(3):75-81.
[25]安 艳. 半夏连作障碍影响因子研究[D]. 兰州:甘肃农业大学,2018.
[26]杭 烨,罗夫来,赵 致,等. 半夏间作不同作物对土壤微生物、养分及酶活性的影响研究[J]. 中药材,2018,41(7):1522-1528.
[27]王礼科,罗夫来,王华磊,等. 半夏不同连作年限土壤酶活性、微生物及化感物质的分析[J]. 中药材,2021,44(4):798-801.
[28]唐成林,王 觉,罗夫来,等. 半夏茬后土壤微生物数量变化及其化感作用初探[J]. 河南农业科学,2016,45(12):135-137.
[29]何志贵. 半夏连作障碍发生机制与轮作修复研究[D]. 杨凌:西北农林科技大学,2019.
[30]刘诗蓉,王红兰,孙 辉,等. 半夏连作对根际土壤微生物群落的影响研究[J]. 中草药,2022,53(4):1148-1155.
[31]Tawaraya K,Saito M,Morioka M,et al. Effect of phosphate application to arbuscular mycorrhizal onion on the development and succinate dehydrogenase activity of internal hyphae[J]. Soil Science and Plant Nutrition,1994,40(4):667-673.
[32]张海波,梁月明,冯书珍,等. 土壤类型和树种对根际土丛枝菌根真菌群落及其根系侵染率的影响[J]. 农业现代化研究,2016,37(1):187-194.
[33]Liang Y M,He X Y,Chen C Y,et al. Influence of plant communities and soil properties during natural vegetation restoration on arbuscular mycorrhizal fungal communities in a karst region[J]. Ecological Engineering,2015,82:57-65.
[34]米屹东,李信茹,刘秀明,等. 喀斯特地区丛枝菌根真菌多样性研究进展[J]. 地球与环境,2020,48(5):631-641.
[35]刘松涛,田春丽,曹雯梅,等. 基于不同土壤质地棉花根际微生物和酶活性特征分析[J]. 中国农业科技导报,2020,22(2):73-79.
[36]李海云,张建贵,姚 拓,等. 退化高寒草地土壤养分、酶活性及生态化学计量特征[J]. 水土保持学报,2018,32(5):287-295.
[37]Evelin H,Kapoor R. Arbuscular mycorrhizal symbiosis modulates antioxidant response in salt-stressed Trigonella foenum-graecum plants[J]. Mycorrhiza,2014,24(3):197-208.
[38]孙吉庆,刘润进,李 敏. 丛枝菌根真菌提高植物抗逆性的效应及其机制研究进展[J]. 植物生理学报,2012,48(9):845-852.
[39] 冯 翠,衣政伟,钱 巍,等. 不同种植模式下番茄根际土壤养分和真菌多样性分析[J]. 江苏农业学报,2022,38(2):462-468.
[40]Zhao M,Li M,Liu R J. Effects of arbuscular mycorrhizae on microbial population and enzyme activity in replant soil used for watermelon production[J]. International Journal of Engineering,Science and Technology,2010,2(7):17-22.
[41]Xun F F,Xie B M,Liu S S,et al. Effect of plant growth-promoting bacteria (PGPR) and arbuscular mycorrhizal fungi (AMF) inoculation on oats in saline-alkali soil contaminated by petroleum to enhance phytoremediation[J]. Environmental Science and Pollution Research,2015,22(1):598-608.
[42]Zeng R S,Mallik A U. Selected ectomycorrhizal fungi of black spruce (Picea mariana) can detoxify phenolic compounds of Kalmia angustifolia[J]. Journal of Chemical Ecology,2006,32(7):1473-1489.
[43]李 亮,蔡柏巖. 丛枝菌根真菌缓解连作障碍的研究进展[J]. 生态学杂志,2016,35(5):1372-1377.
[44]赵金莉,贺学礼. AM真菌对白芷抗旱性和药用成分含量的影响[J]. 西北农业学报,2011,20(3):184-189.
[45]杨 敏,张 杰,张德全,等. 丛枝菌根真菌对掌叶大黄产量及次生代谢产物的影响[J]. 中国实验方剂学杂志,2018,24(10):33-37.
[46]张 霁,刘大会,郭兰萍,等. 不同温度下丛枝菌根对苍术根茎生物量和挥发油的影响[J]. 中草药,2011,42(2):372-375.
[47]Prasad A,Kumar S,Khaliq A,et al. Heavy metals and arbuscular mycorrhizal (AM) fungi can alter the yield and chemical composition of volatile oil of sweet basil (Ocimum basilicum L.)[J]. Biology and Fertility of Soils,2011,47(8):853-861.
收 稿日期:2023-02-08
基金项目:国家科技支撑计划(编号:2015BAI05B03);贵州省人才基地项目(编号:RCJD2020-21);贵州省高层次创新型人才项目(编号:毕科人才合字[2021]05号);毕节市揭榜挂帅项目(编号:毕科合重大专项字[2021]3号);毕节市科技局联合基金项目(编号:毕科联合字yz[2021]5号)。
作者简介:张翔宇(1986—),男,贵州道真人,硕士,副研究员,研究方向为药用植物资源工程。E-mail:304626335@qq.com。
通信作者:陈晓芳,硕士,副教授,研究方向为特色资源分子生物学,E-mail:672409415@qq.com;查 钦,硕士,副研究员,研究方向为药用植物资源开发与利用,E-mail:914282286@qq.com。

