生物有机肥与AM真菌配施对连作番茄品质、土壤性质及真菌群落结构的影响
陈军 郑青松

摘要: 基于种植番茄6年的连作土,采用棚内划区试验,设置不施化肥(CK1)、常规施肥(CK2)、常规施肥下增施AM真菌(AM)、普通生物有机肥(CF)、新型生物有机肥(NF)及AM真菌分别配施普通生物有机肥(ACF)、新型生物有机肥(ANF),探索生物有机肥与AM真菌配施对连作番茄品质、土壤性质及真菌群落结构的影响。结果表明,与CK1相比,在连作土中常规施肥处理(CK2)的番茄品质、土壤性质及真菌群落结构变化较小。与CK2相比,AM真菌-生物有机肥相关处理(AM、CF、NF、ACF、ANF)均略增加了pH值,提高了有机质(OM)、微生物量碳、速效养分(AN、AP、AK)、交换性镁(EMg)及交换性钙(ECa)含量,提升了可溶性糖、可溶性固形物及维生素C等品质参数,各指标均以AM真菌配施生物有机肥处理(ACF、ANF)的效果较佳。Illumina HiSeq测序结果表明,AM真菌-生物有机肥相关处理均降低了真菌多样性和丰富度。群落结构分析结果表明,与CK1、CK2相比,轮枝菌属(Gibellulopsis)、镰刀菌属(Fusarium)、腐质霉属(Humicola)的相对丰度显著降低,斗管囊霉属(Funneliformis)的相对丰度显著增加,整体以ANF存在极值。相关分析及RDA结果表明,除pH值外,其他土壤因子与果实品质参数均存在密切关系,且OM、MBC含量是影响斗管囊霉属的主要土壤因子,而ECa是决定轮枝菌属、镰刀菌属、腐质霉属丰度的主要土壤因子。综上,AM真菌、生物有机肥均可提高连作番茄品质、改善土壤性质及调控土壤真菌群落结构,以AM真菌配施以新型生物有机肥更适合番茄连作土的施用。
关键词: 番茄;生物有机肥;AM真菌;品质;土壤性质;真菌群落
中图分类号:S641.206 文献标志码:A
文章编号:1002-1302(2024)02-0245-08
土壤微生物群落是土壤生态的重要组成部分,在许多过程中发挥着至关重要的作用,包括C、N、P和S土壤循环及增加土壤养分有效性[1]。土壤物理化学性质与微生物丰度相互影响,微生物可以促进养分元素的周转,而良好的环境可以促进微生物的增殖和代谢[2]。连作会导致土壤微生物群落结构发生变化、土壤理化性质恶化及病原微生物、有益微生物丰度失衡,土壤性质和土壤微生物种群的变化会直接或间接影响连作系统的作物产量和品质[3]。连作的一个重要因素涉及土壤微生物多样性的变化,土壤中的植物和动物残留物可通过微生物降解转化为土壤有机质,并且微生物会影响植物直接吸收和间接吸收养分[4]。此外,由于土壤微生物对环境压力或自然扰动导致的细微环境差异敏感,因此可作为土壤质量的表征指标。之前的研究发现,相对于土壤细菌群落,连作后真菌多样性的变化更为明显[5],而特定病原真菌的增殖会引起蔬菜作物的土传疾病。
AM真菌是球囊菌亚门(Glomeromycota)的活體专性共生菌根真菌,AM真菌可与绝大部分陆地维管束植物构建共生关系[6]。AM真菌是土壤中生物量较大、作用强烈的有益功能真菌。有研究发现,AM真菌可缓解典型非生物胁迫、降低有机污染物、重(类)金属元素毒害及提高作物抗病性等[7]。AM真菌具有致密的外延菌丝,可分泌磷酸酶水解酶和球囊霉素相关蛋白以增加土壤磷有效性和可溶解性有机碳的含量[8]。外延菌丝比植物根系更细,可增加养分觅食区域及摄取能力,且内生菌丝嵌入细胞形成丛枝周膜可激活高亲和矿质养分(N、P、K)转运蛋白的转录水平,从而改善宿主的营养利用状况[9]。此外,大量研究发现,AM真菌在调节土壤生物学特性方面发挥着重要作用。在连作土壤中,施用AM真菌增加了花生根系发育及连作土壤微生物总量,增加了细菌、放线菌数量,从而提高了细菌/真菌、放线菌/真菌的比例[10]。
番茄(Solanum lycopersicum L.)是在全球广受欢迎的民生蔬菜之一,为保证其四季正常供应,大棚集约化种植已成为番茄种植的主要方式,这意味着设施一旦建成,几年甚至十几年的固定土块种植成为番茄生产的栽培区域[11]。施用有机肥、根际促生菌(PGPR)是番茄生产的常规栽培措施,然而为中和化肥导致的土壤酸化,大多数有机肥呈碱性,而碱性环境不利于PGPR增殖[12]。生物有机肥作为多功能肥料,具有高效、环保等特点,结合了PGPR、有机肥和化肥的优点,更符合植物对养分的需求,在预防土传病害、提高土壤肥力及促进作物品质形成等方面表现良好[13]。目前关于生物有机肥对连作土的研究主要集中于土壤微生物数量、产量及土壤改良效果,关于更深层次的群落特征的研究较少,且关于生物有机肥与AM真菌组合配施的研究亦鲜有涉及。本研究探索了普通生物有机肥、新型生物有机肥与AM真菌配施对番茄品质与土壤性质的效果,并基于Illumina HiSeq分析了土壤真群落变化的影响。研究结果可为番茄的可持续化生产提供理论依据。
1 材料与方法
1.1 供试地点与供试材料
试验于2022年4—8月在苏州农业职业技术学院番茄大棚中进行,该大棚已连作6年。供试番茄品种为中杂9号,供试化学肥料为番茄专用肥(含N、P2O5、K2O分别为15%、10%、20%),购自徐州苏源生物科技有限公司。
供试普通生物有机肥采用牛粪为原材料发酵制成,其主要成分如下:有效活菌数2.5×108 CFU/g, 有机质含量45%,有机碳含量10%,含蜡样芽孢杆菌和沙雷氏菌,购自南京宁粮生物科技肥料有限公司。供试新型生物有机肥原材料采用鸡羊粪便制成,含N、P2O5、K2O分别为6%、5%、12%,有效活菌数为2.5×108 CFU/g,氨基酸含量为2%,有机质含量为45%,包含链霉放线菌、芽孢杆菌属细菌、黑曲霉菌,由江苏省有机固体废弃物创新中心研发[14]。
供试AM真菌为摩西斗管囊霉(Funneliformis mosseae),购自北京丛枝菌根真菌资源库(BGC), 接种物为孢子、外延菌丝和侵染宿主根段的细沙与土壤混合基质,孢子密度为80个/g。 蔬菜棚内土壤为黄褐土,其pH值为5.86,有机质含量为20.45 g/kg, 碱解氮、有效磷、速效钾含量分别为70.21、18.78、118.65 mg/kg。
1.2 试验设计
试验采用随机区组设计,共设7个组合处理:连作土不施化肥处理(CK1处理);连作土常规施肥处理(CK2处理);在CK2处理条件下分别施用AM真菌处理(AM处理)、普通生物有机肥处理(CF处理)、新型生物有机肥处理(NF处理)、AM真菌配施普通生物有机肥处理(ACF处理);AM真菌配施新型生物有机肥处理(ANF处理)。每个处理重复3次,共21个小区,棚内小区均为长方形(长×宽=5 m×4 m),小区之间采用40 cm宽的深沟间隔。
在施肥处理过程中,番茄苗移栽前撒施 600 kg/hm2 番茄专用肥,生物有机肥处理的施用量皆为3 750 kg/hm2,AM真菌处理的施用量皆为 1 875 kg/hm2,采用旋耕机按30 cm深度耕作并覆土起垄。移栽番茄苗为并排同穴,1穴2株,种植密度为37 500株/hm2。在试验过程中按照优质番茄生产规程进行,试验周期为133 d。
1.3 样品采集及测定分析
1.3.1 番茄果实品质的测定 在培育的第133天,选取大小较为均匀一致的成熟番茄果实进行品质参数的测定,其中维生素C、可溶性糖、可溶性蛋白及有机酸含量分别采用二氯酚靛酚滴定法、蒽酮比色法、考马斯亮蓝G-250法及酸碱中和法[15]测定;可溶性固形物含量用手持式折光仪(LYT-330,上海淋誉公司)测定。
1.3.2 土壤样品采集与处理 在培育的第87天,去除番茄0.5 cm表层土壤,用铁铲将番茄根系完整挖出,去除距离根系较远的外围土壤,将各处理根际土壤混合后分为2个部分:一部分保存于-80 ℃环境,用于土壤Illumina HiSeq测序分析,另一部分自然风干后用于土壤理化性质的分析。
1.3.3 土壤理化性质测定 番茄连作土壤相关指标的测定参照鲁如坤的方法[16]。采用pH计(FE20- Five Easy Plus,Switzerland)进行土壤pH值的测定(水 ∶ 土=2.5 ∶ 1),土壤交换性钙(ECa)、交换性镁(EMg)含量采用NH4OAc交换-原子吸收分光光度法测定;采用K2Cr2O7氧化还原滴定法测定土壤有机质(OM)含量;微生物生物量碳(MBC)含量采用三氯甲烷熏蒸提取法测定;有效氮(AN)、有效磷(AP)、速效钾(AK)含量分别采用碱解扩散法、碳酸氢钠浸提-分光光度法、NH4OAc浸提-火焰光度法测定。
1.3.4 真菌群落结构分析 准确称取500 mg土壤样品,用土壤DNA试剂盒(Sigma-Aldrich,Germany)提取基因组DNA,用0.8%琼脂糖凝胶测定基因组DNA完整性以获得高质量DNA提取物的等分试样(40 μL)用于进一步分析。通过PCR从微生物中扩增18S rRNA基因的真菌内转录间隔区(ITS),扩增反应条件:95 ℃ 2 min;95 ℃ 15 s,50 ℃ 20 s,35个循环;72 ℃延伸10 min。反应体积为 50 μL,反应液包含2 μL(30 ng)模板DNA,2 μL ITS1-F-正向引物(5′- C T T G G T C A T T T A G A G G A A G T A -3′)、2μL ITS2-R-反向引物(5′- T G C G T T C T T C A T C G A T G -3′)、4 μL dNTPs(2.5 mmol/L)、5 μL 10× Pyrobest緩冲液、0.3 μL TaKaRa Pyrobest DNA聚合酶(2.5 U/μL)和34.7 μL ddH2O。通过2.0%琼脂糖凝胶电泳获取PCR产物,并用QIA quick凝胶提取试剂盒(QIAGEN,Crawley,UK)进行纯化,用QuantiFluor(Promega,USA)对DNA进行定量分析。Illumina HiSeq数据的读取、质控及文库建立参照文献[17]所述,用Mothur软件统计每个样本的真菌α-多样性指数。借助R软件对Illumina HiSeq测序数据与土壤因子进行冗余分析(RDA)。以上Illumina HiSeq分析委托北京诺禾致源科技股份有限公司完成。
1.4 数据处理
数据用WPS Excel 2016进行常规计算处理,不同处理间的试验数据用DPS 14.0处理系统中的邓肯氏法进行方差分析和多重比较,用Origin 10进行图形绘制,图表中数据为平均值±标准差。
2 结果与分析
2.1 生物有机肥与AM真菌对连作土种植番茄品质的影响
由表1可知,各处理的可溶性糖含量呈CK1<CK2<NF<CF<AM<ACF<ANF,与ANF相比,其他处理的可溶性糖含量较其显著降低0.52~1.95百分点;各处理可滴定酸含量与可溶性糖含量趋势基本相反,即CK1处理的可滴定酸含量最高,显著高于其他处理;各处理的可溶性糖/可滴定酸(糖酸比)与可溶性糖含量趋势基本一致,以CK1最低,与CK2无显著差异但显著小于其他AM真菌和/或生物有机肥处理。各处理维生素C、可溶性蛋白及可溶性固形物含量整体表现为CK1<CK2<CF<NF、AM<ACF<ANF,且上述3个指标中,ANF处理均显著大于CK1、CK2处理。
2.2 生物有机肥与AM真菌对番茄连作土壤理化性质的影响
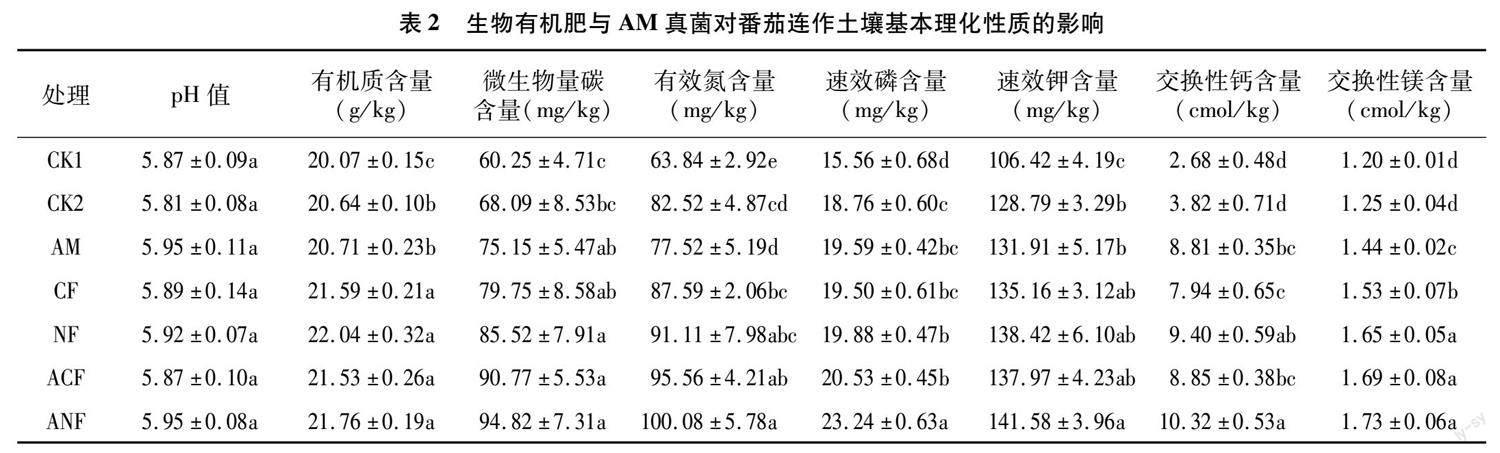
由表2可知,AM真菌处理(AM)、普通生物有机肥处理(CF)、新型生物有机肥处理(NF)、AM真菌-生物有机肥处理(ACF、ANF)与对照处理(CK1、CK2)的土壤pH值、有机质(OM)含量、微生物生物量碳(MBC)含量、交换性钙(ECa)含量、交换性镁(EMg)含量、土壤有效养分(AN、AP、AK)含量共8个土壤指标均存在一定差异。由表2可以看出,与CK1相比,CK2的pH值略微下降,其余指标(OM含量、MBC含量、AN含量、AP含量、AK含量、ECa含量、EMg含量)均不同程度地提高,其中OM含量、AN含量、AP含量、AK含量的CK2处理显著高于CK1处理。与CK2处理相比,AM真菌-生物有机肥处理(AM、CF、NF、ACF、ANF)的OM含量、MBC含量、AN含量、AP含量、AK含量、ECa含量及EMg含量分别提高了0.34%~6.78%、10.37%~39.26%、-6.06%~21.28%、3.94%~23.88%、2.42%~9.93%、107.85%~170.16%、15.20%~ 38.40%,且各处理整体呈CK2<AM、NF、CF<ACF< ANF。以上结果表明,AM真菌、生物有机肥处理对土壤理化性质有显著影响,二者结合处理(ACF、ANF)的效果更佳,尤其表现在AM真菌与新型生物有机肥处理(ANF)。
2.3 生物有机肥与AM真菌对番茄连作土壤真菌多样性的影响
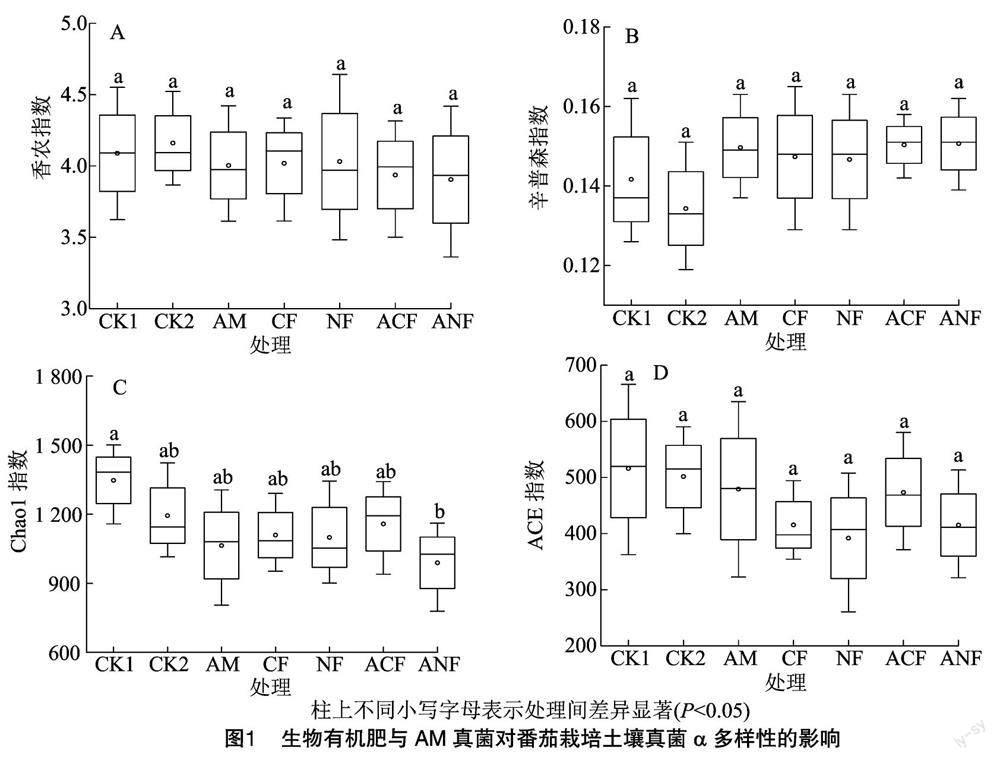
由图1-A可知,各处理的香农指数表现为CK1<ANF<ACF<AM<CF<NF<CK2,各处理的辛普森指数表现为CK2<CK1<NF<CF<AM<ACF<ANF,但各处理间香农指数、辛普森指数皆无显著差异(图1-A、图1-B)。各处理的丰富度指数(Chao1、ACE)整体上表现为AM真菌-生物有机肥处理(AM、CF、NF、ACF、ANF)低于CK1、CK2,其中ANF处理的Chao1指数显著低于CK1处理(图1-C),而各处理ACE指数的波动较小,两两处理间均无明显差异(图1-D)。以上结果表明,在番茄连作土中施用AM真菌、普通生物有机肥、新型生物有机肥处理均可对番茄连作土壤真菌多样性及丰富度产生影响,并且可降低土壤真菌群落的丰富度。
2.4 生物有机肥与AM真菌对番茄连作土壤真菌群落分类与组成的影响
2.4.1 生物有机肥与AM真菌对番茄连作土壤真菌 门水平群落结构特征的影响 本研究分析了AM 真菌处理(BC)、单一生物有机肥处理(CF、NF)、AM真菌-生物有机肥组合处理(ACF、ANF)与不施AM真菌+不施生物有机肥处理(CK)7个处理共21个土壤样品,经过DNA提取、纯化及Illumina HiSeq PE 2500平台测序共获得111 308个待分析数据,基于97%序列相似性得到3 107个OTU。基于RDP数据库对基因序列及QIIME进行物种分类注释(门到属)发现,7个相关处理的土壤中共得到5门、15纲、72目、180科、299属。所有土壤样品中的主要门类包括子囊菌门(66.37%~86.81%)、担子菌门(1.72%~10.75%)、接合菌门(1.82%~7.27%)、壶菌门(0.94%~9.21%)和球囊菌门(0.61%~9.43)(图2)。
2.4.2 生物有机肥与AM真菌对番茄连作土壤真菌属水平群落结构特征 图3显示了真菌平均相对丰度大于1%的32个属,其中在属水平上已鉴定的有22个属。已知的真菌属中,相对丰度较高的前10种优势属分别为假性阿利什霉属(8.86%~12.07%)、曲霉属(5.81%~7.72%)、镰刀菌属(1.53%~9.99%)、支顶孢属(2.45%~4.16%)、腐质霉属(1.48%~5.41)、被孢霉属(1.64%~4.58%)、毛壳菌属(1.79~4.47%)、黏球菌属(2.01%~3.51%)、赤霉属(1.24%~4.28%)、明梭孢属(1.25%~3.18%)。
2.4.3 生物有机肥与AM真菌处理下的主要真菌属丰度差异 经施用AM真菌菌剂、不同生物有机肥处理后,相对丰度大于1%的属中,曲霉属、斗管囊霉属、小囊菌属、轮枝菌属、镰刀菌属、赤霉属、被孢霉属、腐质霉属、毛壳菌属的相对丰度均发生显著变化(P<0.05),这些属主要归属于子囊菌门、接合菌门和担子菌门。上述9个属的总丰度最高的为CK1处理(34.86%),最小的总丰度出现在ANF处理(23.20%)。但各处理不同属丰度的规律不一致,其中处理间的镰刀菌属相对丰度差异最大(P=0.005 2),而曲霉属、毛壳菌属、小囊菌属、赤霉属丰度的极值均出现在AM真菌、生物有机肥相关处理。值得注意的是,在斗管囊霉属中,相关AM真菌、生物有机肥处理(AM、CF、BF、ACF、ANF)的相对丰度均显著大于CK1、CK2处理,而轮枝菌属、镰刀菌属、腐质霉属的相对丰度则反之(表3)。
2.5 生物有机肥与AM真菌处理下土壤因子与品质、真菌群落的关系
2.5.1 土壤因子与品质参数的相关性分析 由表4 可知,pH值与相关品质参数间均无明显相关关系,而土壤有机质(OM)含量、微生物量碳(MBC)含量、有效氮(AN)含量、速效磷(AP)含量、速效钾(AK)含量、交换性钙(ECa)含量、交换性镁(EMg)含量与可溶性糖含量、可滴定酸含量、糖酸比、维生素C含量、可溶性蛋白含量、可溶性固形物含量间均存在显著(P<0.05)或极显著(P<0.01)的相关关系。
2.5.2 土壤因子与土壤真菌属特征的冗余分析 冗余分析(RDA)结果表明,土壤因子在塑造连作土真菌群落相关菌属丰度方面发挥着重要作用,RDA的前2个轴分别解释了总变异的20.44%、48.27%,二者可解释大部分(68.71%)的RDA状态。由RDA分布可知,CK1、CK2与AM真菌、生物有机肥相关处理(AM、CF、NF、ACF、ANF)之间在9个主要真菌属存在差异。其中有机质含量、微生物量碳含量是决定NF、ACF、ANF处理样本斗管囊霉属的主要土壤因子。同理,交换性钙含量是CK1、CK2处理的镰刀菌属、赤霉属、腐质霉属的主要土壤因子(图4)。
3 讨论
大量研究结果表明,连作会导致土壤微生物群落结构发生变化、土壤理化性質恶化及病原微生物与 有益微生物丰度失衡,从而直接或间接影响连作系统中作物的产量和品质[18]。土壤性质如速效养分含量、微生物量、有机质含量及pH值等是反映土壤肥力水平及健康状况的重要指标[19]。施用生物有机肥、AM真菌是缓解大棚作物连作障碍的常规措施之一,但不同生物肥的功能菌存活率、肥效及最终功能强度均存在差异。在本研究中,相比于不施肥处理(CK1),常规施肥处理(CK2)的pH值较低,其他速效养分(AN、AK、AP)含量、有机质 (OM) 含量、微生物量碳(MBC)含量及交换性参数(ECa、EMg)均有所增加;而与CK2处理相比,AM真菌、生物有机肥处理(AM、CF、NF、ACF、ANF)的上述土壤因子参数整体上进一步提高。这与前人的研究结果趋于一致,即AM真菌、生物有机肥均可提高土壤肥力、促进土壤交换能力[20]。整体来看,AM真菌-生物有机肥处理(ACF、ANF)具有较大值,尤其表现在ANF处理,表明AM真菌结合生物有机肥具有叠加效应。
长期连作会使土壤中的酚酸类物质、病原菌累积,从而改变微生态环境,土壤微生物结构由“细菌型”向“真菌型”转变,显著抑制有益菌群的生长与繁殖,加重连作障碍[21]。本研究结果表明,与CK1、CK2处理相比,AM处理真菌、生物有机肥处理均对真菌群落α多样性指数产生了一定影响,整体而言香农指数、Chao1指数、ACE指数降低,辛普森指数升高,其中与CK1处理相比,ANF处理的丰富度指数(Chao1)显著降低,表明ANF可显著降低土壤真菌群落的丰富度。在真菌门水平结构中,子囊菌门、接合菌门和担子菌门是连作番茄土壤的优势门,其中子囊菌门(66.37%~86.81%)是主要的优势门。真菌在自然环境中扮演着分解者角色,许多真菌存在于陆地、海洋和淡水栖息地中[22]。在目前的分类中,大多数真菌主要归属于接合菌门、担子菌门及子囊菌门,其中以担子菌门最高,其变化更能反映土壤的健康状况。
本研究中,在相对丰度大于1%的32个属中,9个属(曲霉属、斗管囊霉属、小囊菌属、轮枝菌属、镰刀菌属、赤霉属、被孢霉属、腐质霉属、毛壳菌属)经过AM真菌、生物有机肥处理后的相对丰度均发生显著变化(P<0.05)。这9个真菌属的功能主要包括土壤土传病害发生、系统防御和有机腐质分解。大多数土传病害是由土壤真菌引起的,土传病害病原菌数量的增加会加剧连作障碍;本研究中,轮枝菌属、镰刀菌属、腐质霉属的相对丰度在相关AM真菌、生物有机肥处理整体显著降低。镰刀菌属、轮枝菌属含有多种致病种,可导致植物病害发生,如层生镰刀病原菌(Fusarium proliferatum)、大丽轮枝菌(Verticillim dahliae)在作物生长过程中感染植物根系并产生霉菌毒素[23]。腐质霉属可产生醋酸纤维素脱乙酰酶,从而降解土壤中的生物质残体,增加土壤中的腐生有机质含量[24],可能在一定程度上为土壤中的真菌繁殖提供基础物质。
产生连作障碍的因素包含土壤生境劣变、化感物质累积、土传病原真菌增殖等,这些因素都会显著影响作物品质,使产收减少[11]。在本研究中,经过AM真菌、生物有机肥处理后,斗管囊霉属的相对丰度显著提高。斗管囊霉属是土壤中重要的AM真菌功能菌群之一,对植物养分吸收、生长发育、缓解环境胁迫及改善土壤特性等具有积极作用[25]。前人研究发现,AM真菌可与镰刀菌(Fusarium solani)、青枯病病菌(Ralstonia solanacearum)等病原菌竞争植物析出的脂类物质[26]。此外,接种AM真菌后能减少由病原体引起的根系损伤,诱导根系分泌特定的次生抑菌物质,从而抑制病原体的繁殖,AM真菌还可以诱导植物防御系统,提高防御性酶活力,多重机制以降低病原菌对宿主带来的损伤[9,27]。前人研究发现,土壤肥力水平与微生物丰度密切相关,因此轮枝菌属、镰刀菌属和腐质霉属丰度降低,而斗管囊霉属丰度增加可能会影响土壤健康水平。
本研究结果表明,AM真菌-生物有机肥相关处理(AM、CF、NF、ACF、ANF)的可溶性糖含量、糖酸比、维生素C含量、可溶性蛋白含量、可溶性固形物含量较高,可滴定酸含量较低,任一指标中ACF、ANF均显著优于CK1、CK2处理,且ANF整体优于ACF处理。前人研究表明,生物有机肥原材料选取、发酵条件等制备工艺的差异使得不同生物有机肥的施用效果存在显著差异[28]。对于连作土中的番茄品质而言,以鸡羊粪为基质采用链霉放线菌、芽孢杆菌属细菌、黑曲霉菌发酵的有机肥更适合番茄连作土的施用。此外,相关分析表明,除pH值外,其他土壤因子与品质参数均存在密切关系。冗余分析可用来描述土壤因子和微生物群落分布之间的关系,土壤性质与微生物代谢之间存在着密切关系。本研究中冗余分析结果表明,MBC、OM是决定斗管囊霉属的主要土壤因子;交换性钙是决定轮枝菌属、镰刀菌属和腐质霉属的主要土壤因子。
4 结论
本研究结果表明,在连作土中,与不施肥处理(CK1)相比,常规施肥处理(CK2)的番茄品质、土壤性质、真菌群落结构变化较小。与CK2相比,相关AM真菌-生物有机肥处理(AM、CF、NF、ACF、ANF)均略微增加了pH值,提高了有机质含量、微生物量碳含量、速效养分(AN、AP、AK)含量、交换性镁及交换性钙含量,改善了番茄可溶性糖含量、糖酸比、维生素C含量、可溶性蛋白含量、可溶性固形物含量等。高通量分析结果表明,与对照(CK1、CK2)相比,相关AM真菌-生物有机肥处理降低了真菌多样性和丰富度。群落结构表明,相关AM真菌-生物有机肥施用处理后9属(曲霉属、斗管囊霉属、小囊菌属、轮枝菌属、镰刀菌属、赤霉属、被孢霉属、腐质霉属、毛壳菌属)相对丰度发生显著变化,且与对照处理相比,轮枝菌属、镰刀菌属、腐质霉属相对丰度显著降低,斗管囊霉属相对丰度显著增加。相关分析表明,除pH值外,其他土壤因子与果实品质参数均存在密切关系, RDA结果进一步表明,OM、MBC与斗管囊霉属密切相关,而ECa是影响轮枝菌属、镰刀菌属、腐质霉属丰度的主要土壤因子。
參考文献:
[1] Lv C,Wang C,Cai A,et al. Global magnitude of rhizosphere effects on soil microbial communities and carbon cycling in natural terrestrial ecosystems[J]. Science of the Total Environment,2023,856:158961.
[2]Aqeel M,Ran J,Hu W,et al. Plant-soil-microbe interactions in maintaining ecosystem stability and coordinated turnover under changing environmental conditions[J]. Chemosphere,2023,318:137924.
[3]周倩怡,李 屹,韩 睿,等. 根际促生菌缓解园艺作物连作障碍的研究进展[J]. 生态学杂志,2022,41(9):1845-1852.
[4]杨肖芳,郭 瑞,姚燕来,等. 微生物菌剂对连作地块草莓生长、土壤养分及微生物群落的影响[J]. 核农学报,2023,37(6):1253-1262.
[5]李 洁,李杏春,郭良栋. 真菌群落构建机制研究进展[J]. 菌物学报,2023,42(1):13-25.
[6]王亚妮,申晓晨. 丛枝菌根真菌与赤霉素对盐胁迫下番茄生长及生理生化的影响[J]. 江苏农业科学,2022,50(20):174-182.
[7]Shi J,Wang X,Wang E. Mycorrhizal symbiosis in plant growth and stress adaptation:from genes to ecosystems[J]. Annual Review of Plant Biology,2023,74:569-607.
[8]Gao W Q,Wang P,Wu Q S. Functions and application of glomalin-related soil proteins:a review[J]. Sains Malaysiana,2019,48(1):111-119.
[9]曹本福,姜海霞,刘 丽,等. 丛枝菌根菌丝网络在植物互作中的作用机制研究进展[J]. 应用生态学报,2021,32(9):3385-3396.
[10] 索炎炎,张 翔,司贤宗,等. 丛枝菌根真菌和根瘤菌对连作花生养分吸收及土壤微生物特性的影响[J]. 中国土壤与肥料,2023(2):106-112.
[11]程国亭,王延峰,姜文婷,等. 设施番茄土壤障碍综合防控研究进展[J]. 中国蔬菜,2023(2):16-24.
[12]Gao F,Li H,Mu X,et al. Effects of organic fertilizer application on tomato yield and quality:a meta-analysis[J]. Applied Sciences,2023,13(4):2184.
[13]张 奇,张振华,陈雅玲,等. 施用生物有机肥对土壤特性、作物品质及产量影响的研究进展[J]. 江苏农业科学,2020,48(15):71-76.
[14]Deng X,Zhang N,Li Y,et al. Bio-organic soil amendment promotes the suppression of ralstonia solanacearum by inducing changes in the functionality and composition of rhizosphere bacterial communities[J]. New Phytologist,2022,235(4):1558-1574.
[15]曹建康,姜微波,赵玉梅. 果蔬采后生理生化实验指导[M]. 北京:中国轻工业出版社,2007.
[16]鲁如坤. 土壤农业化学分析方法[M]. 北京:中国农业科技出版社,2000:296-302.
[17]Wang J,He Q,Niu W,et al. Alternate drip irrigation regulates the soil fungal community structure and metabolic function based on root-fungus interactions[J]. Land Degradation and Development,2023,34(4):1133-1144.
[18]孙子欣,蔡柏岩. 连作对土壤微生物菌群影响及修复研究进展[J]. 作物杂志,2022(6):7-13.
[19]王贻莲,杨 凯,陈 凯,等. 调理剂联合微生物菌剂对小油菜连作土壤修复及产量的影响[J]. 北方园艺,2022(20):84-91.
[20] Chen H,Zhao J,Jiang J,et al. Effects of inorganic,organic and bio- organic fertilizer on growth,rhizosphere soil microflora and soil function sustainability in chrysanthemum monoculture[J]. Agriculture,2021,11(12):1214.
[21]李 亮,蔡柏岩. 丛枝菌根真菌缓解连作障碍的研究进展[J]. 生态学杂志,2016,35(5):1372-1377.
[22]Bollmann G A,Malone J G,Arora S. Diversity,detection and exploitation:linking soil fungi and plant disease[J]. Current Opinion in Microbiology,2022,70(1):102199.
[23]张 亮,盛 浩,袁 红,等. 根际促生菌防控土传病害的机理与应用进展[J]. 土壤通报,2018,49(1):220-225.
[24]Li F,Guo Y,Wang Z,et al. Influence of different phytoremediation on soil microbial diversity and community composition in saline-alkaline land[J]. International Journal of Phytoremediation,2022,24(5):507-517.
[25]Tang C,Sun B,Zeeshan M,et al. Funneliformis mosseae-induced changes of rhizosphere microbial community structure enhance Capsicum annuum L. plant growth and fruit yield[J]. Soil Science Society of America Journal,2023,87(4):813-821.
[26]Hage A K,Krammer J,Steinkellner S. The intercropping partner affects arbuscular mycorrhizal fungi and Fusarium oxysporum f. sp. lycopersici interactions in tomato[J]. Mycorrhiza,2013,23:543-550.
[27]Weng W,Yan J,Zhou M,et al. Roles of arbuscular mycorrhizal fungi as a biocontrol agent in the control of plant diseases[J]. Microorganisms,2022,10(7):1266.
[28]楊天杰,王玉鑫,王佳宁,等. 不同基质生物有机肥防控番茄土传青枯病及促生效果研究[J]. 土壤,2021,53(5):961-968.
收 稿日期:2023-06-19
基金项目:苏州市科技计划(编号:SNG2020062);苏州农职院科技培育项目(编号:PY2104);苏州农职院科技创新与服务团队专项(编号:KJFW2102)。
作者简介:陈 军(1976—),男,江苏盐城人,硕士,副教授,主要从事设施蔬菜生产技术研究。E-mail:chenjun@szai.edu.cn。
通信作者:郑青松,博士,副教授,主要从事作物环境生物学和园艺植物果实发育研究。E-mail:qszheng@njau.edu.cn。

