生地低聚糖雾化吸入后小鼠体内药动学研究
林佳丽,徐光临,时潇丽,刘 力
(上海中医药大学附属曙光医院药学部,上海 201203)
慢性阻塞性肺疾病是世界重大公共卫生问题,全球每年死亡病例超过300 万例,预计到2030 年将成为第三大死因[1-4]。生地低聚糖是生地黄经特定提取分离及纯化工艺得到的部位,以水苏糖为主要成分(含量高达40%)[5-6],它来源于上海中医药大学附属曙光医院的院内制剂生地注射液,临床上用于治疗慢性阻塞性肺疾病,疗效显著[7],对模型大鼠的气流限制有明显缓解作用,可用于延缓补全进行性发展,同时也证实了水苏糖是其主要药效物质[8-10]。
肺组织给药其有起效快、防止肝脏首过效应、减少全身不良反应的优势,在治疗呼吸系统疾病中显示出较大的应用潜力[11-13]。雾化吸入是治疗呼吸系统疾病的重要手段[14],故本实验采用该方法给予小鼠生地低聚糖,并研究该成分体内药动学,旨在为经肺组织给药治疗慢性阻塞性肺疾病的新药开发提供依据。
1 材料
1.1 仪器 安捷伦1260 高效液相色谱仪(美国安捷伦公司); Triple-Quad 4500 质谱仪 (美国AB SCIEX 公司); NE-C25S 型压缩雾化器(日本欧姆龙株式会社)。
1.2 试剂与药物 生地低聚糖(上海中医药大学附属曙光医院制剂实验室自制,为白色粉末,无臭,味甜,水苏糖含量为43.79%)。水苏糖(批号12031-202002,纯度89.9%)、耐斯糖 (批号111891-201704,纯度92.2%) 对照品(中国食品药品检定研究院); 乙腈、甲醇为色谱纯; 水为超纯水。
1.3 动物 SPF 级BALB/c 小鼠,雄性,体质量22~25 g,购自上海市计划生育科学研究所实验动物经营部,动物生产许可证号SCXK (沪) 2018-0006。本实验经上海中医药大学动物伦理委员会批准(伦理号PZSHUTCM220919008)。
2 方法与结果
2.1 色谱条件 Shodex Asahipak NH2P-50 4E 色谱柱(250 mm×4.6 mm,5 μm),Asahipak NH2P-50G 4A 保护柱(10 mm×4.6 mm); 流动相水(A) -乙腈(B),梯度洗脱 (0 ~15.10 min,75% ~55%B); 体积流量900 μL/min; 柱温25 ℃; 进样量10 μL。
2.2 质谱条件 电喷雾离子源(ESI); 负离子扫描; 多反应监测 (MRM) 模式; 离子源温度550 ℃,水苏糖其他质谱参数见表1。

表1 水苏糖质谱参数Tab.1 Mass spectrometry parameters for stachyose
2.3 溶液制备
2.3.1 内标溶液 精密量取耐斯糖对照品适量,置于10 mL 量瓶中,超纯水溶解并定容至刻度,得质量浓度为200 μg/mL 的贮备液,稀释至20 μg/mL,即得,置于4 ℃冰箱中保存。
2.3.2 对照品溶液 精密称取水苏糖对照品适量,置于2 mL 量瓶中,超纯水溶解并定容至刻度,即得(该成分质量浓度为1 mg/mL),置于4 ℃冰箱中保存。
2.4 分组、给药与样品采集 66 只小鼠随机分为11 组,每组6 只,置于雾化系统[由欧姆龙压缩雾化器(工作气体流量≥4 L/min,喷雾速率≥0.2 mL/min,雾粒中位粒径2.2 μm,≤5 μm 的雾粒占比大于60%) 和小鼠雾化箱(32 cm×21.5 cm×17 cm) 组成,雾化后的药液通过导气管进入雾化箱]中,给药前自由活动,给药时口鼻吸入50 mg/mL生地低聚糖溶液6 mL,持续20 min,给药结束后静置5 min 以保证雾滴充分吸入,于0、0.16、0.33、0.67、1、2、4、8、12、18、24 h 眼球采血后脱颈椎处死并取肺组织,全血置于肝素钠离心管中,4 ℃、12 000 r/min 离心15 min,弃去沉淀,吸取上层血浆,肺组织在-20 ℃下保存。
2.5 样品处理
2.5.1 血浆 精密吸取小鼠血浆100 μL,置于1.5 mL 离心管中,精密加入300 μL 乙腈、5 μL 内标溶液,涡旋振荡5 min,4 ℃、12 000 r/min 离心15 min,取上清液,加入100 μL 超纯水,涡旋振荡5 min 后再离心15 min,取上清液待测。
2.5.2 肺组织 精密称取小鼠肺组织100 mg,加入3 倍量生理盐水制成匀浆,精密吸取100 μL,加入300 μL 乙腈、5 μL 内标溶液,涡旋振荡5 min,4 ℃、12 000 r/min 离心15 min,取上清液,加入100 μL 超纯水,涡旋振荡5 min 后再离心15 min,取上清液待测。
2.6 方法学考察
2.6.1 专属性试验 取空白血浆、加入对照品(300 ng/mL) 和内标的空白血浆、给药8 h 后血浆样品各100 μL,按 “2.5” 项下方法处理,在“2.1” “2.2” 项条件下进样测定; 取空白肺组织匀浆、加入对照品(300 ng/mL) 和内标的空白肺组织匀浆、给药8 h 后肺组织匀浆各100 μL,按“2.5” 项下方法处理,在“2.1” “2.2” 项条件下进样测定,结果见图1。由此可知,水苏糖与内标可实现完全分离,未受到血浆和肺组织中内源性杂质干扰,表明该方法专属性良好。

图1 水苏糖LC-MS/MS 色谱图Fig.1 LC-MS/MS chromatograms of stachyose
2.6.2 线性关系考察 取空白血浆100 μL,加入对照品溶液5 μL,制成质量浓度分别为50、100、300、1 500、3 000、6 000、12 000、36 000 ng/mL的溶液,按 “2.5” 项下方法处理,在 “2.1”“2.2” 项条件下各进样10 μL 测定; 取空白肺组织匀浆100 μL,加入对照品溶液5 μL,制成质量浓度分别为50、100、300、1 500、3 000、6 000、12 000、36 000 ng/mL 的溶液,按“2.5” 项下方法处理,在“2.1” “2.2” 项条件下各进样10 μL测定。以对照品质量浓度为横坐标(X),对照品、内标峰面积比值为纵坐标(Y) 进行回归,并以S/N=10 为定量限,结果见表2,可知在各自范围内线性关系良好。

表2 水苏糖线性关系Tab.2 Linear relationships of stachyose
2.6.3 准确度、精密度试验 制备水苏糖质量浓度为分别150、18 000、27 000 ng/mL 的质控样品,平行6 份,按“2.5” 项下方法处理,同一天内在“2.1” “2.2” 项条件下进样测定,计算日内精密度和准确度; 同法连续测定3 d,每天1 次,计算日间精密度和准确度,结果见表3,可知均符合生物样品分析要求。

表3 水苏糖准确度、精密度试验结果(n=6)Tab.3 Results for accuracy and precision tests of stachyose (n=6)
2.6.4 提取回收率、基质效应试验 制备水苏糖质量浓度分别为150、18 000、27 000 ng/mL 的质控样品,平行6 份,按“2.5” 项下方法处理,同一天内在“2.1” “2.2” 项条件下进样测定水苏糖、内标峰面积A1、B1; 取空白血浆和肺组织适量,加入等量对照品、内标溶液使其达到与质控样品相同的质量浓度,按“2.5” 项下方法处理,同一天内在“2.1” “2.2” 项条件下进样测定两者峰面积A2、B2,计算提取回收率A1/A2、B1/B2。分别取空白样品适量、水100 μL,加入等量对照品、内标溶液使其达到与质控样品相同的质量浓度,按“2.5” 项下方法处理,在“2.1” “2.2” 项条件下进样测定,计算基质效应,结果见表4,可知均符合生物样品分析要求。
表4 水苏糖提取回收率、基质效应试验结果(±s,n=6)Tab.4 Results for extraction recovery and matrix effect tests of stachyose (±s,n=6)

表4 水苏糖提取回收率、基质效应试验结果(±s,n=6)Tab.4 Results for extraction recovery and matrix effect tests of stachyose (±s,n=6)
样品成分理论质量浓度/(ng·mL-1)提取回收率/%RSD/%基质效应/%RSD/%血浆水苏糖15046.81±1.733.7123.1±3.422.8 18 00051.46±5.159.8116.6±6.095.2 27 00047.60±1.954.1115.9±9.468.2内标1 00056.47±3.486.2103.61±6.556.3肺组织水苏糖15063.06±4.497.196.67±5.856.1 18 00058.81±3.235.5106.0±3.693.5 27 00057.34±4.157.2105.1±5.455.2内标1 00056.49±3.085.597.71±7.107.3
2.6.5 稳定性试验 制备水苏糖质量浓度分别为150、18 000、27 000 ng/mL 的质控样品,平行6份,按“2.5” 项下方法处理,在“2.1” “2.2”项条件下进样测定,分别在室温下放置4 h、4 ℃自动进样器中放置24 h、-20 ℃下放置30 d、连续3 d 在-20 ℃下反复冻融3 次,按“2.5” 项下方法处理,在“2.1” “2.2” 项条件下进样测定,结果见表5,可知均符合生物样品分析要求。
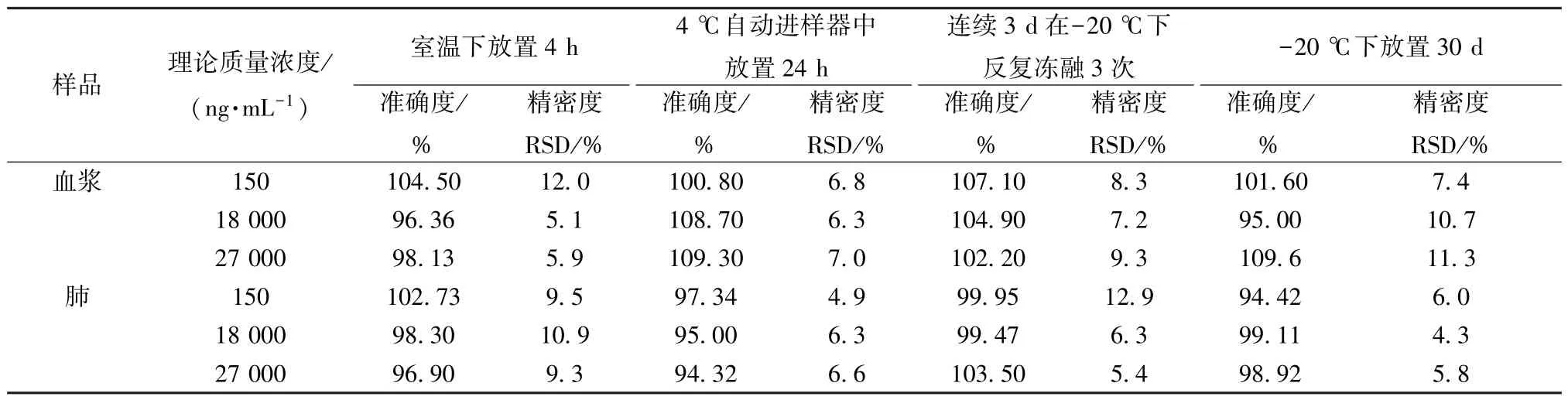
表5 水苏糖稳定性试验结果(n=6)Tab.5 Results for stability tests of stachyose (n=6)
2.7 体内药动学研究 血药浓度-时间曲线见图2,再采用DAS 3.1.1 软件中的非房室模型计算主要药动学参数,结果见表6。由此可知,给药后在血浆中有一段吸收入血的时间,而在肺组织中的药物浓度达峰值,随后缓慢消除。
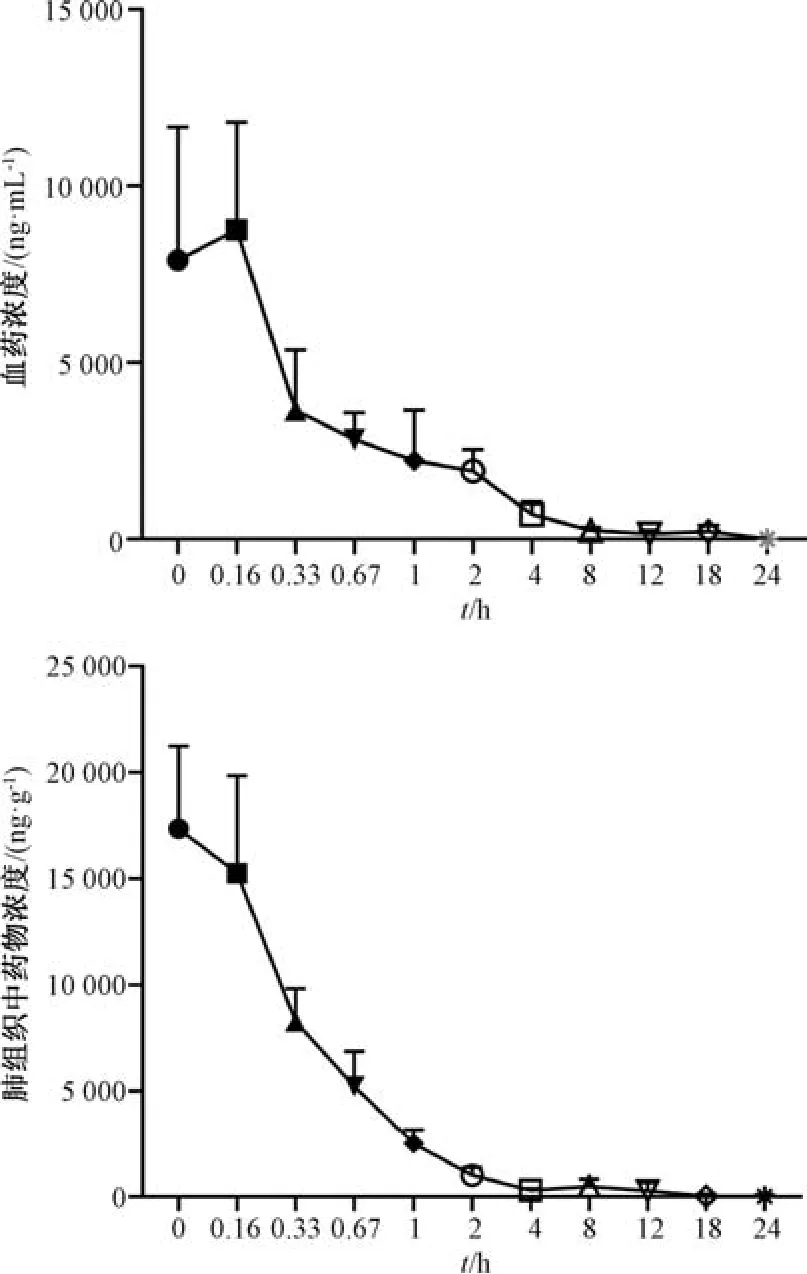
图2 生地低聚糖在小鼠血浆和肺组织中的药物浓度-时间曲线Fig.2 Drug concentration-time curves for R.glutinosa oligosaccharides in mouse plasma and lung tissue
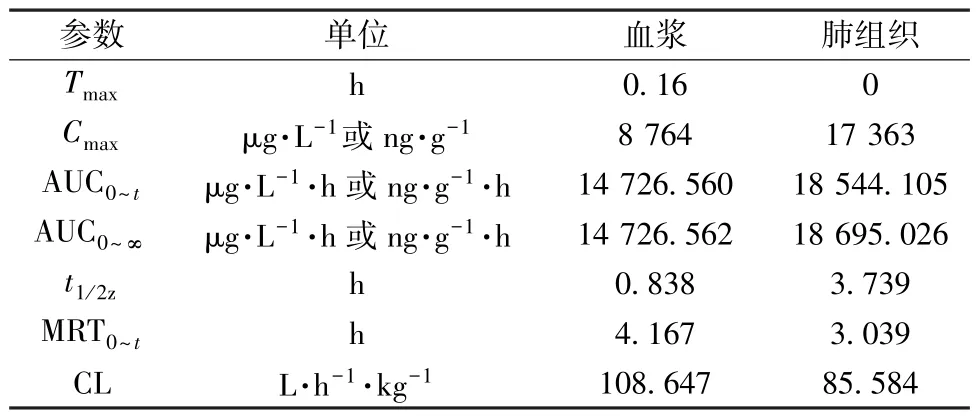
表6 生地低聚糖主要药动学参数Tab.6 Main pharmacokinetic parameters for R.glutinosa oligosaccharides
3 讨论与结论
方法学结果表明,样品提取回收率较低,故本实验采用乙腈沉淀法除蛋白。虽然水苏糖和内标在乙腈中的溶解度较低,部分会随蛋白沉淀,导致在提取步骤有损失,但质控样品提取回收率不具有统计学意义,RSD 均在10%以内,不影响药物测定,故本实验未探讨如何提高两者提取回收率,但在后续实验中将对样品前处理技术进行改进。
雾化吸入可将药物直接送达肺组织,起效快速,用药量少[15-16]。课题组前期分别考察生地低聚糖质量浓度在3、6、12、24、50 mg/mL 时的雾化效果,发现雾化吸入后在小鼠血浆和肺组织中均能测得药物,而且其含量随着雾化质量浓度增加而升高。为了便于药动学实验中不同采血时间点的血药浓度检测,本实验选择最高质量浓度的生地低聚糖溶液作为雾化溶液。另外,药物沉积位置与雾化颗粒直径相关,在0.5 ~10 μm 时可直达肺组织[17],本实验采用欧姆龙压缩雾化器,雾化后颗粒粒径在2.2 μm 左右,可满足肺组织给药需求。
药物经雾化吸入后,在肺组织、气道中起到药效作用[17-19]。药动学研究结果表明,生地低聚糖雾化吸入后能较快地吸收入血,而且全身循环后消除较快; 与血浆比较,肺组织中药物含量在雾化给药结束后即达峰值,半衰期在4 h 左右,表明此时生地低聚糖可迅速分布到该器官中,随后滞留一段时间; 全身性不良反应与药物高浓度暴露有关,故前者可随后者Cmax降低而减少[20]。本实验发现,雾化吸入后肺组织中药物Cmax低于血浆中,表明生地低聚糖进入体循环浓度降低。
综上所述,小鼠雾化吸入生地低聚糖后药物迅速分布到肺组织,而且滞留时间较长,从而实现对该器官疾病快速、靶向治疗的目的,并可为经雾化吸入治疗慢性阻塞性肺疾病的相关新药开发提供依据。

