神经酸口服给药后在大鼠体内药动学研究
黄和飞,阳 剑,李 霁,徐湘婷,李孟莲,李 波,吕小波*,张 玲*
(1.昆明医科大学药学院,云南省天然药物药理重点实验室,云南 昆明 650500; 2.昆明和合医学检验所,云南 昆明 650106)
蒜头果MalaniaoleiferaChunet S.Lee 为铁青树科蒜头果属植物,是我国特有、云南省特色植物,其果实所含的神经酸含量高达60% 以上,是目前该成分含量最高的植物[1-5]。神经酸是一种长链单不饱和omega-9 脂肪酸,最早在哺乳动物神经组织中发现[3-8],为大脑、神经发育及其正常功能维持所必需的营养物质,在体内合成极少,主要靠体外摄取补充[7],具有促进神经细胞增殖和分化、延缓大脑老化、增强学习记忆能力、调节血脂血糖、提高免疫等功能,也是大脑神经组织和神经细胞的核心成分[1-10],同时抑郁、注意力缺陷障碍等神经系统疾病也与体内该成分含量相关[6,11-12],在医学领域研究价值很高。目前,对植物型神经酸的研究尚处于起步阶段,主要涉及其药理活性、提取、分离、制备等方面,尚未涉及药动学,故本实验建立LC-MS/MS 法考察神经酸口服给药后在大鼠体内的药动学,以期为后续相关药物开发提供理论依据。
1 材料
1.1 仪器 8050CL 高效液相色谱串联质谱仪(日本岛津公司); 医用高速离心机(湖南湘仪实验室仪器开发有限公司); MD200-2 氮吹仪 (杭州奥盛仪器有限公司);XA105 电子天平(十万分之一,瑞士梅特勒-托利多公司);多管涡旋振荡器(杭州米欧仪器有限公司)。
1.2 试剂与药物 神经酸对照品(纯度≥95%,白色片状结晶) 由云南医科万正生物科技股份有限公司提供; 神经酸对照品(纯度≥99%) 购于美国Sigma 公司。甲醇(色谱纯)、乙酸乙酯(分析纯) (德国Merck 公司); 水为蒸馏水(广州屈臣氏食品饮料有限公司)。
1.3 动物 SPF 级SD 大鼠,雌雄各半,体质量180 ~220 g,来源于昆明医科大学实验动物学部,实验动物生产许可证号SCXK (滇) K2020-0004。
2 方法
2.1 溶液制备
2.1.1 标准工作液 精密称取神经酸对照品5 mg,转移到10 mL量瓶中,加入8 mL 甲醇,超声溶解10 min 后定容至刻度,即得(质量浓度为500 μg/mL),取适量,流动相逐步稀释至0.625、1.25、2.50、5.00、10.00、20.00、40.00 μg/mL。
2.1.2 含药血浆对照品溶液 取“2.1.1” 项下标准工作液各100 μL,加到900 μL 大鼠空白血浆中,即得(外源性神经酸质量浓度分别为0.062 5、0.125、0.25、0.5、1.0、2.0、4.0 μg/mL,血浆随行质控样品中其低、中、高质量浓度分别为0.12、0.40、2.0 μg/mL)。
2.1.3 供试品溶液 称取360 mg 神经酸对照品至烧杯中,加入食用菜籽油搅拌均匀至30 mL,得到120 mg/10 mL 高剂量油溶液,取15 mL,加入15 mL 食用菜籽油,混匀,即得60 mg/10 mL 中剂量油溶液,同法得到30 mg/10 mL低剂量油溶液。
2.2 LC-MS/MS 分析条件
2.2.1 色谱 SUPELCO Ascentis Express F5 C18反向色谱柱(10 cm×2.1 mm,2.7 μm); 流动相水-甲醇(含0.1% 甲酸) (17 ∶83); 体积流量0.35 mL/min; 柱温25 ℃; 进样量20 μL。
2.2.2 质谱 电喷雾离子源(ESI); 正离子扫描; 多反应监测(MRM) 模式; 雾化气体积流量3 L/min; 加热气体积流量10 L/min; 接口温度300 ℃; DL 温度250 ℃; 加热块温度400 ℃; 干燥器体积流量10 L/min,其他参数见表1。

表1 神经酸质谱条件
2.3 分组、给药与采血 参考文献[13-15] 报道,24 只大鼠随机分为4 组,分别为对照组(食用菜籽油) 及神经酸低、中、高剂量组(30、60、120 mg/kg),禁食16 h 后以10 mL/kg 剂量灌胃给药,于给药前及给药后0.5、1、1.5、2、4、6、8、10、12、14、24、36 h 眼眶取血各300 μL (其间每4 h 灌胃给予生理盐水),4 000 r/min 离心15 min,取上层血浆,在-80 ℃下保存。
2.4 样品前处理 取“2.1.2” 项下含药血浆对照品溶液或“2.3” 项下血浆样品100 μL,置于1.5 mL 离心管中,加入800 μL 乙酸乙酯,涡旋混匀5 min 后离心10 min,取700 μL上清,N2吹干,100 μL 甲醇复溶后振荡混匀1 min,高速离心10 min,取上清液进行分析。
2.5 数据处理 通过DAS 2.0 软件中的拟合一室模型计算主要药动学参数,SPSS 23.0 软件进行组间方差分析。P<0.05 表示差异具有统计学意义。
3 结果
3.1 方法学考察
3.1.1 专属性试验 取按“2.4” 项下方法前处理的空白血浆、含药血浆对照品溶液 (0.12 μg/mL)、含药血浆(24 h,30 mg/kg) 适量,在“2.2” 项条件下进样测定,结果见图1。由此可知,血浆中神经酸出峰时间一致,均在3.7 min 左右,并且其色谱峰分离度和峰型均良好; 空白血浆中可见内源性神经酸色谱峰,其质量浓度低于30 ng/mL,对测定不会造成实质性干扰,表明该方法专属性良好。

图1 神经酸专属性色谱图
3.1.2 基质效应试验 取不同体质量大鼠的空白血浆6份,按“2.4” 项下方法前处理,提取空白基质,加入神经酸,制成低、中、高质量浓度,即 0.12、0.40、2.0 μg/mL,混匀,在“2.2” 项条件下进样测定,以神经酸在空白基质血浆中的响应峰面积与不含基质甲醇中的响应峰面积比值为基质因子,测得3 个质量浓度下分别为90.83% ~ 114.17%、93.05% ~ 104.53%、91.24% ~107.30%,总基质因子为99.47%,在(100±15)% 以内;RSD 分别为8.82%、4.16%、5.58%,总RSD 为6.19%,均小于15%,符合2020 年版《中国药典》[16]所规定的生物样品定量分析方法验证指导原则。
3.1.3 线性关系考察 按“2.1.2” 项下方法制备标准工作液,在“2.2” 项条件下各进样20 μL 测定。以对照品峰面积为纵坐标(Y),质量浓度为横坐标(X) 进行回归,得方程为Y=31 684.8X+5.273 31 (r=0.999 4),在0.062 5~4.00 μg/mL 范围内线性关系良好。再按3 倍信噪比确定检测限为0.31 ng/mL,10 倍信噪比确定定量限为1 ng/mL,并且最低限定量低于Cmax的1/20 ~1/10,在3 ~5个t1/2后仍能检测,符合相关要求。
3.1.4 精密度、加样回收率试验 取不同时间段3 批样品溶液(“3.1.2” 项下低、中、高质量浓度),平行5 份,采用同一台仪器于同一天内在“2.2” 项条件下进样测定,计算日内精密度; 同法测定3 d,每天1 次,计算日间精密度。取大鼠含药血浆适量,分别加入“3.1.2” 项下低、中、高质量浓度样品溶液,按“2.4” 项下方法前处理,在“2.2” 项条件下进样测定3 次,计算回收率。结果,低、中、高质量浓度下日内精密度RSD 分别为3.44%、2.82%、3.54%,日间精密度RSD 分别为5.12%、4.42%、5.32%,均小于15%,表明该方法精密度良好; 神经酸平均加样回收率分别为(96.67±5.00)%、(95.75±0.75)%、(105.15±4.25)%,均在(100±15)%以内。
3.1.5 稳定性试验 分别考察在4 ℃、室温、-80 ℃下放置1、3、6、9、12、24、48、72 h,以及在-80 ℃至室温下反复冻融5 次时含药血浆稳定性,平行3 份。结果,含药血浆在4 ℃下稳定性良好,RSD 为2.67%; 室温下神经酸含量RSD 为6.30%,可稳定放置24 h; 48、72 h 神经酸含量略有下降; 反复冻融3 次后神经酸含量RSD 为9.55%,但第4~5 次时其含量逐渐降低,RSD 升高。
3.2 体内药动学研究 单次灌胃给予30、60、120 mg/kg神经酸后,大鼠体内代谢过程均符合一室模型,给药前,大鼠血浆中神经酸含量RSD 为38.73%,但对照组及各剂量组无显著性差异(P>0.05); 对照组在不同时间点的神经酸含量也无显著性差异(P>0.05),血药浓度-时间曲线见图2。

图2 神经酸血药浓度-时间曲线(±s,n=6)
采用基线校正法[17-19],DAS 2.0 软件中的拟合一室模型计算主要药动学参数,结果见表2,可知AUC0~36h、AUC0~∞、Cmax均随神经酸剂量增加而升高 (P<0.01);Tmax、t1/2、MRT 分别为10.44、5.24、12.52 h,不同剂量组之间无显著性差异(P>0.05)。图3 显示,AUC0~36h、AUC0~∞、Cmax呈线性相关,R2分别为0.950 6、0.954 9、0.998 6。

图3 AUC0 ~36 h (A)、AUC0 ~∞ (B)、Cmax (C) 与神经酸剂量的线性关系
表2 神经酸主要药动学参数(±s,n=6)
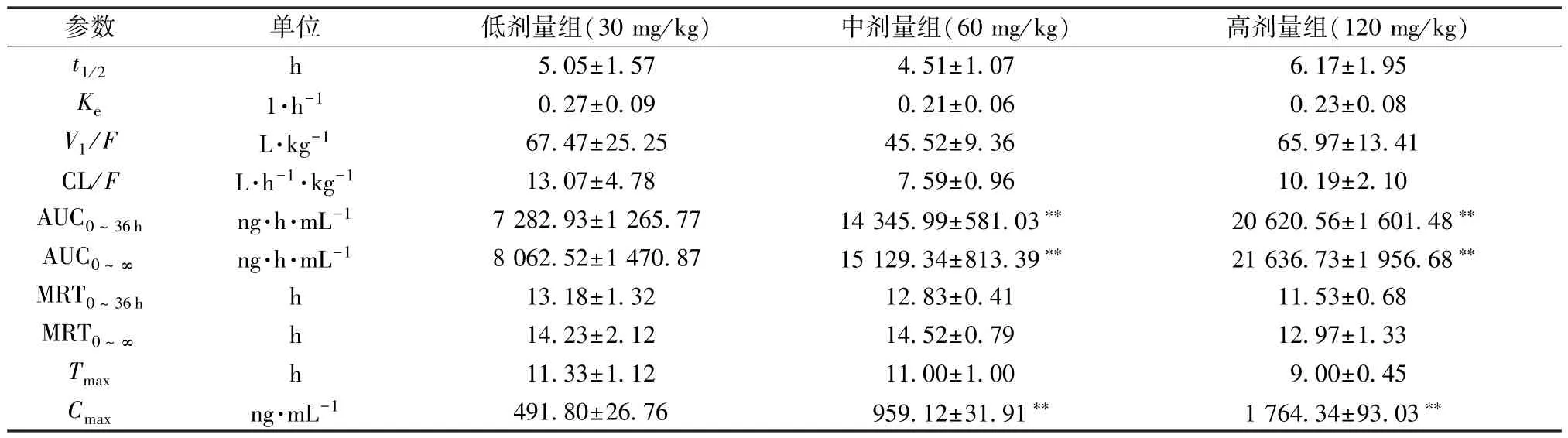
表2 神经酸主要药动学参数(±s,n=6)
注: 与低剂量组(30 mg/kg) 比较,**P<0.01。
参数单位低剂量组(30 mg/kg)中剂量组(60 mg/kg)高剂量组(120 mg/kg)t1/2h5.05±1.574.51±1.076.17±1.95 Ke1·h-10.27±0.090.21±0.060.23±0.08 V1/FL·kg-167.47±25.2545.52±9.3665.97±13.41 CL/FL·h-1·kg-113.07±4.787.59±0.9610.19±2.10 AUC0 ~36 hng·h·mL-17 282.93±1 265.7714 345.99±581.03**20 620.56±1 601.48**AUC0 ~∞ng·h·mL-18 062.52±1 470.8715 129.34±813.39**21 636.73±1 956.68**MRT0 ~36 hh13.18±1.3212.83±0.4111.53±0.68 MRT0 ~∞h14.23±2.1214.52±0.7912.97±1.33 Tmaxh11.33±1.1211.00±1.009.00±0.45 Cmaxng·mL-1491.80±26.76959.12±31.91**1 764.34±93.03**
4 讨论与结论
本实验采用乙酸乙酯进行液液萃取,提取率较高,并建立LC-MS/MS 法测定大鼠血浆中神经酸血药浓度,其稳定性良好,符合定量分析要求[15-16,19-20]。文献[11-12,21-22] 报道,人乳、血浆(清) 中含有内源性神经酸,但个体有差异; 本实验采用大鼠混合空白血浆作为基质绘制标准曲线,排除了基底值干扰和基质效应,同时在药动学研究中采用基线校正法[17-19],以对照组进行对点校正,即各剂量组血药浓度在所有采样时间点均减去对应时间点对照组血浆样品浓度平均值,以排除溶剂、节律等可能产生的影响。
药动学结果显示,单次给予大鼠神经酸后血药浓度对数-时间曲线具有双峰现象,高剂量下更明显,可能与胃排空时间和/或肝肠循环有关。另外,神经酸药动学符合一室模型,在30~120 mg/kg 口服剂量范围内AUC、Cmax与剂量呈线性相关,即呈现剂量依赖性。
综上所述,本实验开展神经酸在大鼠体内药动学的研究,可为该成分进一步药效学机制考察及安全性评价提供参考,为防治神经系统疾病相关药物开发提供思路,同时也为云南省特色植物蒜头果开发利用、打造优势产品奠定理论基础。

