LC-MS/MS 法同时测定活血止痛胶囊/片中16 种真菌毒素及污染状况分析
史 达,陈 洁,张 玲,胡紫艳,曹 玉*
(1.南京市食品药品监督检验院,江苏 南京 211198; 2.南京医科大学药学院,江苏 南京 211112)
活血止痛胶囊/片均由三七、土鳖虫等6 味药材组成,具有活血散瘀、消肿止痛的功效[1]。真菌毒素是真菌产生的具有生物体内蓄积效应的有害次生代谢物,具有人体造血系统、免疫系统、生殖系统等毒性以及致癌和致畸作用[2-4]。据已有文献研究,处方中三七与土鳖虫均有玉米赤霉烯酮、黄曲霉毒素、伏马毒素、杂色曲霉毒素等真菌毒素残留现象[5-9]。同时,活血止痛胶囊及活血止痛片制备工艺均为全粉入药,2020 年版《中国药典》 通则“9305 中药中真菌毒素测定指导原则” 规定,处方中含有易污染的药材及生粉投料的中成药品种应注意相关真菌毒素的测定。
2020 年版《中国药典》 仅对处方中土鳖虫规定黄曲霉毒素限度,活血止痛胶囊规定项下及活血止痛片剂执行标准[10]均未规定真菌毒素残留限度。目前较为成熟的测定方法有液相色谱法[11]、酶联免疫法[12]及液相色谱质谱联用法[13-15]; 真菌毒素常用的前处理方法包括QuEChERS 净化[13]、液液萃取[16]、固相萃取[17]、免疫亲和净化[18]等。本实验通过对比QuEChERS 净化、固相萃取净化、免疫亲和柱净化这3 种前处理方法,建立高效液相色谱-串联质谱(LC-MS/MS) 法准确、灵敏、快速筛查活血止痛胶囊和活血止痛片剂中16 种真菌毒素,以期为合理评价活血止痛制剂质量及为该类中成药安全监管提供数据支撑与技术参考。
1 材料
1.1 仪器 Agilent 1290 液相色谱仪、Agilent 6470 三重四级杆质谱(美国Agilent 公司); CPA225D 十万分之一电子天平(德国Sartorius 公司); Milli-Q 纯水仪(美国Merck公司); KQ-250B 型超声波清洗器(昆山市超声仪器有限公司,功率250 W,频率30 kHz); 涡旋混匀器 (德国Wiggens 公司); N-EVAP24 型氮吹仪(美国Organomation公司); Oasis Prime HLB 固相萃取柱、Oasis HLB 固相萃取柱(美国Waters 公司)。
1.2 试剂与药物 黄曲霉毒素B1、B2、G1、G2对照品溶液(25 μg/mL),黄曲霉毒素M1、M2对照品溶液(10 μg/mL),伏马毒素对照品溶液(50 μg/mL),HT-2 毒素对照品溶液(100 μg/mL),T-2 毒素对照品溶液(100 μg/mL),杂色曲霉毒素对照品溶液(50 μg/mL),脱氧雪腐镰刀菌烯醇对照品溶液 (100 μg/mL),赭曲霉毒素A 对照品溶液(10 μg/mL),玉米赤霉烯酮对照品溶液 (100 μg/mL),桔青霉毒素对照品溶液(100 μg/mL),真菌毒素六合一复合免疫亲合柱(黄曲霉毒素、赭曲霉毒素、玉米赤霉烯酮、脱氧雪腐镰刀菌烯醇、伏马毒素、T-2 毒素,6 mL),均购自青岛普瑞邦生物工程有限公司。QuEChERS 试剂1(MgSO46 g、CH3COONa 1.5 g,货号 5982-5755)、QuEChERS 试剂2 (PSA 800 mg、MgSO41 200 mg,货号5982-6666)、QuEChERS 试剂3 (PSA 400 mg、MgSO41 200 mg,货号5982-5058)、QuEChERS 试剂4 (Carbon S 90 mg、C18300 mg、PSA 300 mg、SiO2300 mg、MgSO4900 mg,货号5610-2056)、QuEChERS 试剂5 (PSA 150 mg、C18EC 150 mg、MgSO41 200 mg,货号5982-5156) 购自美国Agilent 公司。甲醇、乙腈为色谱纯 (美国Honeywell 公司); 甲酸、甲酸铵、乙酸铵为色谱纯(上海阿拉丁生化科技股份有限公司); 水为超纯水(实验室自制)。活血止痛胶囊、活血止痛片均为市售,共40 批,来源于6 家生产企业,具体见表1。

表1 样品信息
2 方法与结果
2.1 LC-MS/MS 条件
2.1.1 色谱 Agilent RRHD Eclipse Plus C18色谱柱(2.1 mm×50 mm,1.8 μm); 流动相水(含有0.1% 甲酸和2 mmol/L 甲酸铵,A) -乙腈 (B),梯度洗脱 (0 ~3 min,90%A; 3 ~8 min,90% ~60%A; 8 ~12 min,60% ~30% A;12~14 min,30% ~10% A; 14 ~15 min,10% A; 15 ~15.1 min,10% ~90% A; 15.1 ~18 min,90% A); 体积流量0.3 mL/min; 柱温35 ℃; 进样量3 μL。
2.1.2 质谱 电喷雾离子源(ESI),正、负离子扫描; 离子源温度350 ℃; 毛细管电压3 500 V (+)、2 500 V (-);鞘气体积流量12 L/min,温度350 ℃; 雾化器压力45 psi(1 psi=6.895 kPa); 采集模式,动态多反应离子监测模式(DMRM)。其他质谱参数见表2,MRM 色谱图见图1。

图1 各真菌毒素MRM 色谱图

表2 各真菌毒素质谱参数
2.2 溶液制备
2.2.1 对照品溶液 精密吸取黄曲霉毒素B1、B2、G1、G2,黄曲霉毒素M1、M2,伏马毒素B1、B2、B3,赭曲霉毒素A,玉米赤霉烯酮,T-2 毒素,HT-2 毒素,脱氧雪腐镰刀菌烯醇,桔青霉毒素,杂色曲霉毒素对照品溶液适量,置于20 mL 量瓶中,乙腈稀释至刻度,制成含黄曲霉毒素B1、B2、G1、G2、M1、M2,桔青霉毒素80 ng/mL,伏马毒素B1、B2、B3,T-2 毒素800 ng/mL,玉米赤霉烯酮200 ng/mL,赭曲霉毒素A、杂色曲霉毒素160 ng/mL,HT-2 毒素、脱氧雪腐镰刀菌烯醇2 000 ng/mL 的贮备液,密封,在-20 ℃下保存。精密吸取0.5 mL,置于10 mL 量瓶中,50%乙腈稀释至刻度,逐级稀释,即得(含黄曲霉毒素B1、B2、G1、G2、M1、M2,桔青霉毒素0.1、0.2、0.4、1、2、4 ng/mL,伏马毒素B1、B2、B3,T-2 毒素1、2、4、10、20、40 ng/mL,玉米赤霉烯酮0.25、0.5、1、2.5、5、10 ng/mL,赭曲霉毒素A、杂色曲霉毒素0.2、0.4、0.8、2、4、8 ng/mL,HT-2 毒素、脱氧雪腐镰刀菌烯醇2.5、5、10、25、50、100 ng/mL,编号S1~S6)。
2.2.2 供试品溶液
2.2.2.1 QuEChERS-HLB 净化法 取本品约5 g,精密称定,置于50 mL 离心管中,精密加入提取液(80% 乙腈-15%水-5%甲酸) 20 mL,涡旋振荡2 min,加入QuEChERS提取试剂盒(含PSA 150 mg、C18150 mg、MgSO41 200 mg)涡旋振荡5 min,10 000 r/min 离心5 min。精密量取上清液5 mL,加水稀释至10 mL,摇匀,10 000 r/min 离心5 min,精密量取3 mL,缓慢通过已处理好的Oasis HLB 固相萃取柱(3 mL/150 mg,依次用甲醇、水各3 mL 洗脱) 直至有适量空气通过,收集洗脱液,用3 mL 含0.2%甲酸的乙腈洗脱,收集合并洗脱液,40 ℃氮气缓慢吹至近干,加入50%乙腈(含0.2%甲酸) 定容至1.5 mL,0.22 μm 微孔滤膜过滤,取续滤液,即得。
2.2.2.2 Prime HLB -IAC 净化法 取本品约5 g,精密称定,置于50 mL 离心管中,精密加入提取液(80% 乙腈-15%水-5%甲酸) 20 mL,涡旋振荡2 min,10 000 r/min 离心5 min。精密量取上清液5 mL,缓慢通过Oasis Prime HLB固相萃取柱,1 mL 乙腈洗脱柱子,接净化液加PBS 磷酸缓冲液配方(8.0 g NaCl、l.2 g Na2HPO4、0.2 g KH2PO4、0.2 g KCl,加990 mL 水溶解,盐酸调节pH 值至7.0,再加水稀释至1 000 mL) 稀释至40 mL,稀释液以重力自然速度通过免疫亲合柱,20 mL 水洗脱,弃去洗脱液,使空气进入柱子,将水挤出柱子后再用1.5 mL 乙腈(含0.2%甲酸)、0.5 mL 水依次洗脱(乙腈洗脱时稍作停留),收集洗脱液,0.22 μm 微孔滤膜过滤,取续滤液,即得。
2.2.2.3 QuEChERS 净化法 取本品约5 g,精密称定,置于50 mL 离心管中,精密加入提取液(80% 乙腈-15% 水-5%甲酸) 20 mL,涡旋振荡2 min,加入6 g MgSO4、1.5 g CH3COONa 涡旋振荡2 min,10 000 r/min 离心5 min,精密吸取上清液10 mL,置于50 mL 离心管中,加入QuEChERS提取试剂(PSA 150 mg、C18150 mg、MgSO41 200 mg),涡旋5 min,10 000 r/min 离心5 min,取上清液5 mL,40 ℃氮气缓慢吹至近干,50% 乙腈 (含0.2% 甲酸) 定容至1 mL,0.22 μm 微孔滤膜过滤,取续滤液,即得。
2.2.3 基质效应 取未检出16 种真菌毒素的活血止痛胶囊(批号190328) 作为空白基质,按“2.2.2.1” 项下方法制备空白基质溶液,将“2.2.1” 项下贮备液分别用空白基质溶液、50%乙腈逐级稀释,以各真菌毒素质量浓度为横坐标(X),峰面积为纵坐标(Y) 进行回归,分别以空白基质、50%乙腈制备标准曲线的斜率的比值对基质效应(ME) 进行评估[17,19],以ME>100%为基质增强效应,ME<100%为基质抑制效应,ME 85% ~115% 为基质效应不明显。结果,黄曲霉毒素B2、T-2 毒素、脱氧雪腐镰刀菌烯醇毒素均有明显的基质抑制效应,而黄曲霉毒素M1、黄曲霉毒素M2、伏马毒素B1、伏马毒素B3、HT-2 毒素存在明显基质增强效应,见图2。

图2 各真菌毒素基质抑制效应(A)、基质增强效应(B)
2.3 方法学考察
2.3.1 线性关系考察 取“2.2.3” 项下基质空白溶液适量,按“2.2.1” 项下方法制备对照品溶液S1 ~S6,在“2.1” 项条件下进样测定。以对照品质量浓度为横坐标(X),峰面积响应值为纵坐标(Y) 进行回归,并以S/N =10 时的质量浓度为定量限,S/N=3 时的质量浓度作为检测限,结果见表3,可知各真菌毒素在各自范围内线性关系良好。

表3 各真菌毒素线性关系
2.3.2 精密度试验 取“2.3.1” 项下对照品溶液S2,在“2.1 “项条件下进样测定6 次,测得黄曲霉毒素B1、B2、G1、G2、M1、M2,伏马毒素B1、B2、B3,赭曲霉毒素A,玉米赤霉烯酮,脱氧雪腐镰刀菌烯醇,T-2 毒素,HT-2 毒素,桔青霉毒素,杂色曲霉毒素峰面积RSD 分别为2.39%、2.68%、4.76%、2.70%、5.28%、3.84%、2.12%、5.87%、4.36%、7.91%、7.29%、5.77%、3.82%、3.77%、4.11%、3.48%,表明仪器精密度良好。
2.3.3 稳定性试验 精密称取本品(批号190328) 5 g,按“2.2.2.1” 项下方法制备供试品溶液,室温下于0、2、4、8、12、24 h 在“2.1” 项条件下进样测定,测得黄曲霉毒素B1、B2、G1、G2、M1、M2,伏马毒素B1、B2、B3,赭曲霉毒素A,玉米赤霉烯酮,脱氧雪腐镰刀菌烯醇,T-2毒素,HT-2 毒素,桔青霉毒素,杂色曲霉毒素峰面积RSD分别为2.39%、1.67%、2.87%、2.93%、1.72%、1.41%、5.18%、9.32%、8.31%、11.06%、9.32%、9.05%、1.97%、3.58%、8.11%、6.13%,表明溶液在24 h 内稳定性良好。
2.3.4 重复性试验 精密称取本品(批号190328) 5 g,平行6 份,按“2.2.2.1” 项下方法制备供试品溶液,在“2.1” 项条件下进样测定,测得黄曲霉毒素B1、B2、G1、G2、M1、M2,伏马毒素B1、B2、B3,赭曲霉毒素A,玉米赤霉烯酮,脱氧雪腐镰刀菌烯醇,T-2 毒素,HT-2 毒素,桔青霉毒素,杂色曲霉毒素含量RSD 分别为1.78%、1.88%、3.11%、4.85%、3.89%、1.88%、6.20%、5.50%、10.76%、8.46%、6.39%、3.81%、1.22%、7.93%、3.91%、2.33%,表明方法重复性良好。
2.3.5 加样回收率试验 精密称取本品(批号190328)5 g,按低、中、高质量浓度水平分别精密加入对照品溶液50、125、500 μL,平行3 份,按“2.2.2.1” 项下方法制备供试品溶液,在“2.1” 项条件下进样测定,计算回收率,结果见表4。
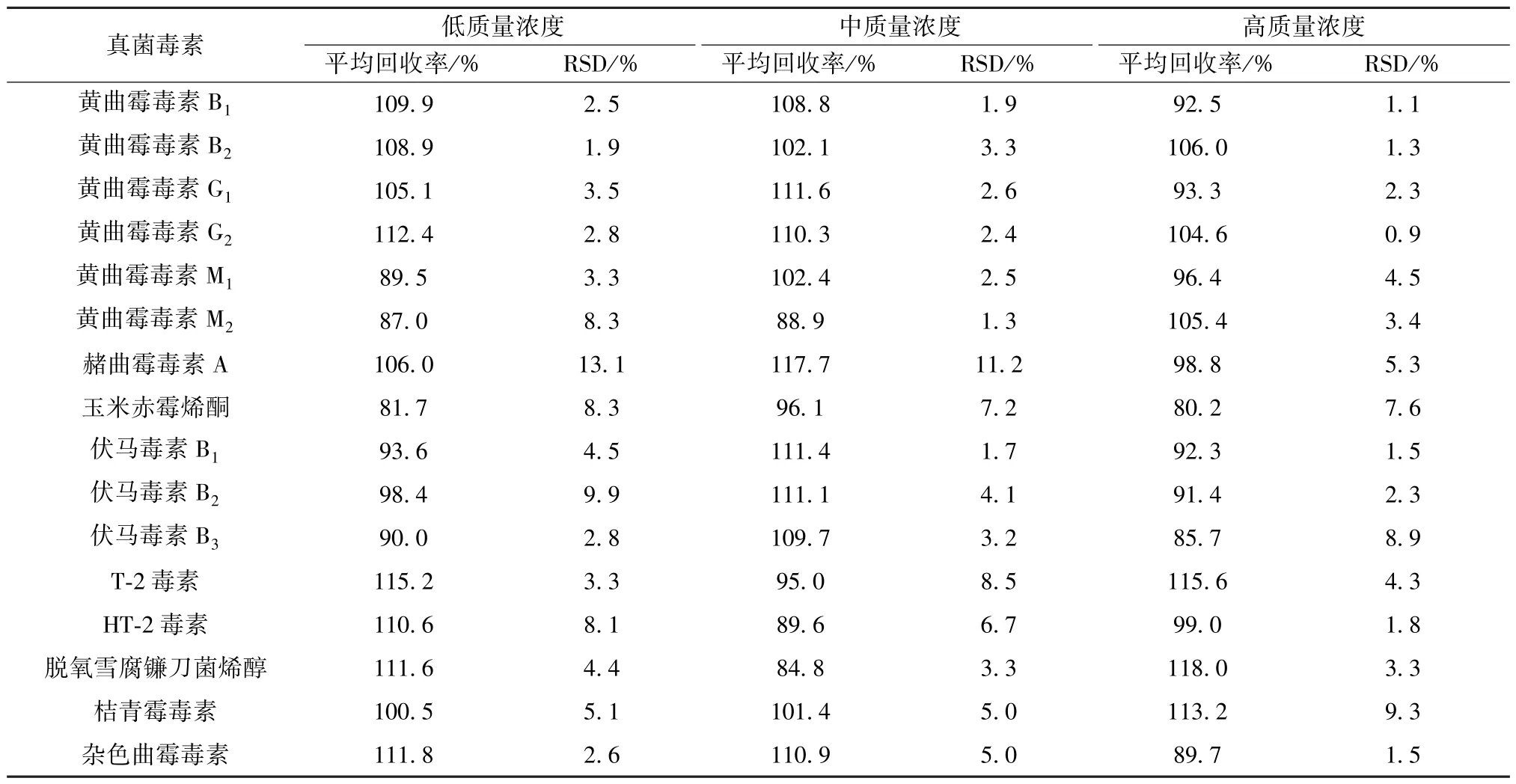
表4 各真菌毒素加样回收试验结果(n=3)
2.4 样品含量测定 取 40 批样品,各 2 份,按“2.2.2.1” 项下方法制备供试品溶液,在“2.1” 项条件下进样测定,以基质匹配标准曲线法测定含量。结果,检出黄曲霉毒素B1、G1、伏马毒素B1、B2、赭曲霉毒素A、杂色曲霉毒素,检出率分别为20%、32.5%、57.5%、25%、42.5%、27.5%,其中黄曲霉毒素B1、G1检出量分别为1.96~10.26、2.16~20.41 μg/kg,伏马毒素B1、B2检出量分别为22.45~812.2、12.52 ~913.8 μg/kg,赭曲霉毒素A检出量为2.75 ~12.50 μg/kg,杂色曲霉毒素检出量为2.99~32.78 μg/kg,表明真菌毒素残留较严重,存在潜在用药安全隐患。
3 讨论
3.1 色谱条件、提取溶剂选择 乙腈较甲醇洗脱能力强,柱效更高,甲酸铵较乙酸铵各真菌毒素响应更好,加入0.10%甲酸可明显提高部分毒素离子化效率,故最终选择乙腈-甲酸铵(2 mmol/L,0.10%甲酸) 作为流动相。甲醇虽比乙腈有更好的溶解性,但乙腈具有更好的选择性,可有效避免过多提取脂肪、色素等杂质成分,并且一定比例水及甲酸可使部分水溶性、酸敏感性真菌毒素(伏马毒素、赭曲霉毒素) 有更好响应,同时还可使样品保持较高渗透性,故最终选择80% 乙腈-15% 水-5% 甲酸系统作为提取溶剂。
3.2 净化方式优化 活血止痛胶囊/片存在基质效应,同位素内标能够最大程度减少基质效应的干扰,但其定制繁琐,价格昂贵,而合适的提取净化方式也能有效减少基质效应,本实验参考文献[13-14],比较不同净化方式选择最优去除干扰物方式,发现仅以QuEChERS 提取净化活血止痛基质,伏马毒素、脱氧雪腐镰刀菌烯醇、赭曲霉毒素A 和HT-2 毒素回收率较差,但加入PSA、MgSO4试剂后有助于水相与有机相分层,而加入carbon S、SiO2等可导致黄曲霉毒素、伏马毒素、杂色曲霉毒素、赭曲霉毒素A 等响应值偏低,并且过多PSA 也会影响伏马毒素回收率,最终选择PSA 150 mg、C18150 mg、MgSO41 200 mg 为提取试剂。进一步研究不同净化方式组合,发现基质经过QuEChERS 提取并过Oasis HLB 固相萃取柱净化或者直接通过Oasis Prime HLB 固相萃取柱与免疫亲合柱串联净化可满足目标真菌毒素回收率要求,但免疫亲合柱中不含有杂色曲霉毒素、HT-2 毒素和桔青霉毒素等抗体导致该部分毒素回收率较差[20-24]。考虑到活血止痛胶囊/片中杂色曲霉毒素有较高的检出率,因此本实验为合理考察活血止痛胶囊/片中16 种真菌毒素残留情况,最终选择更经济、适合高通量真菌毒素筛查的QuEChERS 提取组合Oasis HLB 固相萃取柱净化作为提取净化方式。
4 结论
本实验采用LC-MS/MS 法,从40 批活血止痛胶囊/片中检出黄曲霉毒素B1、G1,伏马毒素B1、B2,赭曲霉毒素A,杂色曲霉毒素,提示该类中药品种存在潜在的真菌毒素污染风险,患者口服用药后有较大安全隐患,故应加强其来源药材、加工、储存等环节的监管。另外,该方法快速简便,准确灵敏,可为合理评价活血止痛胶囊/片中真菌毒素残留风险提供技术支撑,并为安全监管提供参考依据。

