共价有机骨架在高性能锂离子电池负极材料中的应用
张晋恺,李佳莉,刘晓明,母 瀛
(吉林大学化学学院, 长春 130012)
近几十年来,随着经济的飞速发展和科技的日新月异,能源危机和环境污染也逐渐成为当今人类社会面临的严峻问题[1~3]. 为了应对这两大问题,人们正在致力于使用太阳能、 风能、 潮汐能和地热能等无污染且可再生的能源代替传统的化石燃料能源[4,5]. 然而,这些能源都不具有持续性,且转运十分困难,这就使得想按需获得这些能源必须依靠适当的储能设备[6]. 锂离子电池(LIBs)作为一种电化学储能设备,具有工作电压高、 能量密度大、 自放电率低、 使用寿命长及无记忆效应等诸多优点[7~10]. 基于这些优势,LIBs广泛应用于手机、 笔记本电脑、 智能家电和智能相机等便携式移动设备,极大提升了人们的生活质量[11~13]. 但是,随着LIBs 在人类社会中的应用越来越广泛,如混合动力汽车、 完全电动汽车等大型设备[14,15],甚至在深空探测和同步卫星等尖端科技领域也有所应用[16,17],传统的LIBs已经逐渐难以满足人们的需求,开发更高性能的LIBs也成为了目前人们亟待解决的问题.
负极材料是LIBs的一个重要组成部分,从LIBs储能机制来看,充满电时负极能够嵌入的Li+越多,电池所能够储存的能量也就越大. 基于此,研发高性能的负极材料成为了提升LIBs 性能的有效策略[18,19]. 目前,广泛应用于LIBs的负极材料是石墨材料,石墨作为一类嵌入型负极材料具有化学稳定性和热稳定性较高、 资源储量丰富、 嵌锂电位低及导电能力强等诸多优势[20]. 然而,石墨负极的理论比容量较低,即便完全实现其理论容量也仅能达到372 mA·h/g,这对LIBs的性能产生了极大制约. 因此,又相继研发了多种其它类型的负极材料,其中包括硅、 锗等合金化型负极材料[21]以及过渡金属氧化物、 过渡金属硫化物等转化型负极材料[22],这些材料确实在理论容量方面得到了非常大的提升,此外,在避免形成锂枝晶、 电子传输能力增强、 理化性质稳定等方面,这几种无机负极材料均表现出了非常优异的性质,在LIBs的性能改进方面取得了显著的成就[23~25]. 但这些无机材料普遍具有矿产资源有限、 合成及回收成本高、 种类和结构相对单一等缺陷,这使得人们开始寻找其它种类的负极材料. 有机材料具有资源丰富、 绿色环保、 分子结构灵活多样等诸多优势,在研发高性能的LIBs领域有着极为重要的实际意义[26].
共价有机骨架(COFs)是一类以轻质元素构成、 通过共价键链接而形成的规则有序的有机晶体聚合物[27,28]. 这类有机材料具有较大的比表面积、 定向的孔道结构以及较高的化学稳定性,在物质吸附、 光电催化、 传感器等领域具有十分广泛的应用[29]. 由于COFs包含很多电化学活性位点,因此,作为LIBs负极材料时可以嵌入更多的Li+; 并且COFs具有的规则定向的孔道结构,有利于Li+的扩散和传输; 此外,COFs的分子量较大,这使得COFs拥有类似有机高分子材料的难溶解性,不溶于电解液,能够提升LIBs的使用寿命. 基于以上因素,COFs作为LIBs电极这一储能领域材料时能够展现出色的性能[30,31].虽然COFs在LIBs电极领域的应用大多数是作为正极材料[32~37],但截至目前,也已经有很多COFs应用于LIBs 负极材料的相关报道,如Yang 等[38]将碳纳米管在COF 材料上原位生长后制成电极,以提升其电化学性能; Zhai等[39]和Zhao等[40]均提出了COFs在作为LIBs负极材料时的“超锂化”现象; Lei等[41]采用球磨剥离等方法对COF材料进行精加工后,发现可以暴露出更多的电化学活性位点,从而使电极的储锂性能得到极大提升; Zhao等[42]和Xu等[43]分别设计了以N=N和C=C为连接单元的COF材料,并将它们应用于LIBs负极. 研究表明,其具有较优越的电化学性能; Sun等[44]研究了活性位点数目对Li+的电导率及迁移数的影响.
根据目前已有的理论,苯环及含N杂原子的芳环都具有电化学活性,甚至能够实现“超锂化”. 为了探究和比较苯环及含N芳环的电化学性能,本文合成了两种结构相近的COF材料,测试了它们作为LIBs负极材料时的储锂性能、 超大电流密度以及极端温度下的工作能力,并且基于两种材料结构上的差异对它们的电化学性能进行了对比.
1 实验部分
1.1 试剂与仪器
2,4,6-三(4-氨基苯基)-1,3,5-三嗪(TAT,纯度98%)、 1,3,5-三(4-氨苯基)苯(TAB,纯度97%)、苯并[1,2-b∶3,4-b'∶5,6-b'']三噻吩-2,5,8-三甲醛(BTT,纯度97%)、N-甲基吡咯烷酮(NMP,纯度99%)、 邻二氯苯(o-DCB,纯度98%)、 正丁醇(n-BuOH,纯度99.5%)和碳纳米管(CNT,外径: 100~200 nm,长度: 1~10 µm 螺旋状多壁碳纳米管,3A 原装),安徽泽升科技股份有限公司; 醋酸(HAc,纯度99.7%),阿法埃莎(中国)化学有限公司; 四氢呋喃(THF),分析纯,天津天泰化学品有限公司; 聚偏氟乙烯(PVDF,Mw=534000),法国阿科玛公司; 隔膜(Celgard 2400),深圳市博纳普自动化科技有限公司; 基础电解液[1 mol/L六氟磷酸锂(LiPF6)+碳酸乙烯酯(EC)/碳酸二甲酯(DMC)(体积比1∶1)+氟代碳酸乙烯酯(FEC)(体积分数5%)],电池级,多多化学试剂公司; 铜箔(Cu,电池级),郑州景弘新能源科技有限公司; 金属锂片(Li,电池级),天津中能锂业有限公司.
Nicolet is5 型傅里叶变换红外光谱仪(FTIR),美国赛默飞世尔科技公司; SU8020 型冷场场发射扫描电子显微镜(SEM),日本株式会社; STA 7300 型热重差热综合热分析仪(TG),日本日立电子;Empyrean型X射线衍射仪(PXRD),荷兰帕纳科公司; ASAP 2020 Plus HD88型全自动多功能气体吸附仪(BET),美国麦克仪器公司; CT2001A型蓝电电池测试系统,武汉蓝电电子股份有限公司; CHI-760E型电化学工作站,上海辰华仪器有限公司.
1.2 实验过程
1.2.1 COF-1 和COF-2 的合成 向Pyrex 管(25 mL)中加入TAT(0.354 g,1 mmol)和BTT(0.33 g,1 mmol),再加入溶剂邻二氯苯(10 mL)、 正丁醇(10 mL)和催化剂醋酸溶液(2 mL,6 mol/L). 将装有混合物的Pyrex 管超声震荡20 min,使混合物均匀分散; 然后用液氮和真空泵对其进行反复3 次的冷冻-脱气循环; 最后将Pyrex 管在冷冻且真空条件下,用火焰将其密封. 将混合物置于120 ℃烘箱中持续加热72 h 后,有橙黄色固体生成; 将固体用THF 反复洗涤并过滤,直至滤液澄清且无色时,将固体粉末收集并置于60 ℃真空干燥箱中加热烘干; 最终得到橙黄色固体粉末COF-1(0.55 g,产率87%).
采用上述相同方法,只是用TAB(0.351 g,1 mmol)取代TAT,最终得到橙黄色固体粉末COF-2(0.55 g,产率88%). 合成过程如Scheme 1所示.
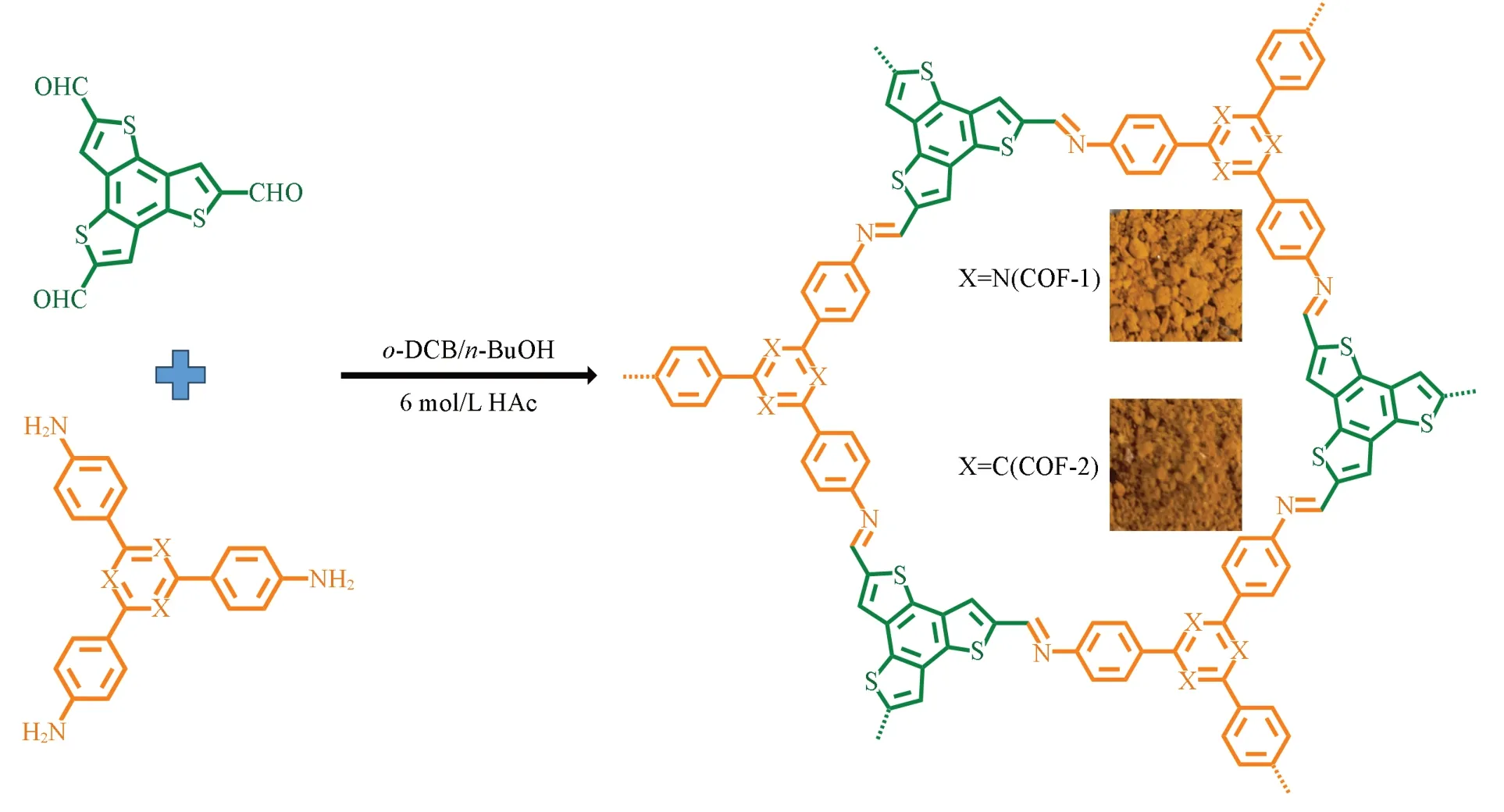
Scheme 1 Synthesis routes and optical photographs of COF-1 and COF-2
1.2.2 电化学性能测试 将活性物质(COF-1/COF-2)、 导电剂(CNT)和黏结剂(PVDF)按质量比5∶4∶1混合,并充分研磨至细腻均匀; 之后向混合物中滴加分散剂(NMP)至黏度适中,继续研磨直至将固体粉末制成均匀的浆料; 将浆料均匀地涂抹在铜箔上,并在60 ℃真空烘箱中干燥12 h; 用切片机将烘干后涂有浆料部分的铜箔切割为小圆片,作为制备好的测试电极待用,其中活性物质的面载量约在0.4~0.6 mg/cm2. 此外,还制备了单独的CNT 电极和活性物质电极用作对照,制备方式与上述过程基本相同,仅在质量比上存在区别[CNT电极: CNT/PVDF 质量比为8∶2,活性物质电极: COF-1(COF-2)/PVDF质量比为8∶2].
扣式半电池的制作在氩气气氛且水氧值小于1×10-6的手套箱中进行,其组装程序需要按照严格且规范的步骤来进行,具体顺序依次为正极壳-正极(含活性物质一面朝上)-电解液(0.1~0.15 mL)-隔膜-电解液(0.1~0.15 mL)-负极(Li)-不锈钢垫片-负极壳,在盖好负极壳后用电池封装机将组装完毕的电池彻底密封. 在该半电池中,正极(测试电极)为涂有活性物质的铜箔电极,负极(参比电极、 对电极)为金属锂片. 制作完毕的电池需要静置12 h以上,使电解液充分浸润隔膜和电极材料,然后再进行各项电化学性能测试.
2 结果与讨论
2.1 样品的结构及形貌表征
为了确认两种COF材料的结构以及判断缩合反应发生的情况,对所合成的样品及用到的原料进行了FTIR测试. 图S1(A)和(B)(见本文支持信息)分别为COF-1和COF-2与原料的FTIR光谱对照图,可见,分别在1618和1633 cm-1处新增了一个吸收带,对应亚胺键的特征峰. 由此可知,TAT和BTT,TAB和BTT之间发生了酮胺缩合反应[45,46].
图S2(A)和(B)(见本文支持信息)分别为COF-1和COF-2的热重分析(TGA)曲线. 可知,COF-1和COF-2在N2气气氛下的热分解温度约分别为535和525 ℃(两种材料在300 ℃附近出现非常微小的质量损失,可能是残余溶剂的挥发或吸附杂质的分解). 此外,当温度达到800 ℃时,COF-1和COF-2依然能保留初始质量的62%和67%. 以上结果说明两种COF材料具有非常高的热稳定性,并且在惰性气氛下的热分解温度远高于LIBs的使用温度. 因此,从热稳定性角度来讲,COF-1和COF-2均适合用作LIBs的电极材料.
粉末X 射线衍射被用来分析两种COF 材料的结晶度,采用CuKα射线在2.5°~40°范围内进行测试,并将测试结果用Materials Studio 软件进行模拟,获得了模拟曲线、 Pawley 精修曲线以及它们之间的差异值[图S3(A)和(D),见本文支持信息],测试结果显示,所制备样品均显示出很高的结晶度,表明合成了两种COF材料. 可看出,COF-1和COF-2的衍射峰位置大致相同,在2θ=4.77°处有一个最强的衍射峰,归属于(100)晶面,此外,在2θ=8.25°,9.53°和25.49°处也存在多个不同强度的衍射峰,它们分别对应于(110),(200)和 (001)晶面. 此外,通过精修曲线与模拟值的对比可见,两种COF 均为AA 型堆积[图S3(B)和(C)分别为COF-1 的正视图和侧视图,图S3(E)和(F)分别为COF-2 的正视图和侧视图],其中,COF-1的晶格参数为a=b=2.141 nm,c=0.350 nm,α=β=90°,γ=120°,Rwp=4.19%,Rp=9.33%; COF-2 的晶格参数为a=b=2.141 nm,c=0.350 nm,α=β=90°,γ=120°,Rwp=4.09%,Rp=8.61%.
为了检测两种COF材料的孔隙率,在77 K温度下采用多功能气体吸附仪对它们进行了N2气吸附-脱附测试. 由图S4(A)和(C)(见本文支持信息)可以看到,两种COF均在低压区(p/p0=0~0.1)显示出对N2气吸附量的快速增加,这符合Ⅰ型等温线的特征,表明两种COF 材料均为微孔材料. 并且COF-1 和COF-2均具有较大的BET比表面积,分别为657和975 m2/g. 基于非定域密度泛函理论(NLDFT)对N2气吸附-脱附等温线进行拟合[图S4(B)和(D)],计算出COF-1和COF-2的孔径均主要分布在1.18 nm,属于典型的微孔结构,与Ⅰ型吸附-解吸等温线的结果一致. 此外,还在p/p0=0.99时,测得COF-1和COF-2单点吸附总的孔体积分别为0.44和0.57 cm3/g.
图S5(A)和(B)(见本文支持信息)为COF-1的SEM照片,图S5(C)和(D)为COF-2的SEM照片. 可以看出,两种COF的形貌均为聚集在一起的棒状结构. 选择较大倍数观察时,可以看到COF-1的棒状结构表面有许多粗糙的纳米级小颗粒,COF-2的棒状结构表面十分平整且光滑.
2.2 样品的电化学性能
为了监测两种材料发生嵌锂以及脱锂反应的电位,对其进行了循环伏安(CV)测试. 由图1(A)和(C)可见,在首次负向扫描过程中,两组CV 曲线均在约1.7~0.5 V 范围内存在多个不可逆的还原峰,这可能与固体电解质界面膜(SEI)的形成、 电解液的分解以及电极与电解质之间不可逆的电化学反应相关; 而在0.5~0.02 V之间,两组CV曲线显示出宽且尖锐的还原峰,并且该电势范围下的还原峰在后续的循环中依旧清晰可见,这可能对应着COF中苯环骨架与Li+结合的过程[47,48]. 在随后的首次正向扫描中,位于0.3 和1.0 V附近的COF-1和COF-2的CV曲线显示出两组氧化峰,这应该与苯环的脱锂以及酮胺缩合所生成的亚胺结构的脱锂相关[49]. 从第2次循环开始,两组CV曲线的重合度较高,表明材料具有较高的电化学可逆性能. 此外,从第2 次负向扫描开始,相比于COF-2,COF-1 的CV 曲线在1.2~0.7 V之间多出一个较明显的还原峰,并且该还原峰存在对应的氧化峰(1.0~1.5 V),通过对比两种COF 材料结构上的差异,可以大致推断这一组氧化-还原峰应该是三嗪环中C=N 的脱锂-嵌锂所致[38,41,42]. 由此也可以推测出,含氮杂原子的三嗪环的电化学活性要高于苯环.
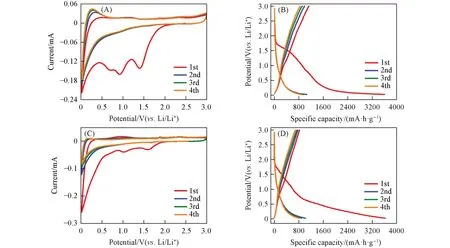
Fig.1 CV curves(A, C) and charge-discharge curves(B, D) of the primary four cycles of COF-1(A, B) and COF-2(C, D)(A,C) Scan rate: 0.2 mV/s; (B,D) current density: 100 mA/g.
图1(B)和(D)是在0.02~3 V范围内,以100 mA/g的电流密度下测得的COF-1和COF-2的前4次充放电曲线. 可以看到,在COF-1的首次放电曲线中,在1.7~1.5 V之间有一个较短的电压平台,与CV曲线1.5 V 附近的还原峰相对应,这可能与SEI 膜的形成有关[39,50]. 在两种COF 的放电曲线中,在0.5 V以下均存在一段较为平缓的斜坡,对应CV曲线中0.5 V以下尖锐的还原峰,是容量的主要贡献部分. 此外,在第2至第4次循环间,两组充放电曲线重合程度较高,与CV曲线得到的结果一致; 并且两组充放电曲线中并无明显的电压平台,这与绝大多数有机电极材料类似,归因于多重Li+的嵌入-脱出过程[51]. 从具体数据来看,COF-1 和COF-2 的首次充放电比容量分别为1126/3607 mA·h/g 和824/3629 mA·h/g,对应的首次库仑效率(CE)分别为31%和23%. 与其它负极材料类似,SEI 膜的形成是造成首次CE 值较低的重要原因,此外,放电时嵌入活性基团中的Li+在充电过程中无法可逆地脱出也是造成CE 值大大降低的因素. 在经过4 次循环以后,COF-1 和COF-2 的充放电比容量分别为844/884 mA·h/g 和687/802 mA·h/g,CE 分别为95%和86%. 从CE 和充电比容量来看,含有三嗪环的COF-1相比于芳香环均为苯环的COF-2,无论在可逆性能还是储锂能力方面都更具优势.
倍率性能是评估LIBs 电化学性能的一项重要指标,可以用来衡量LIBs 在不同电流密度下工作时的容量保持能力. 为了测试两种COF材料的倍率性能,对分别以COF-1和COF-2为测试电极的扣式电池在0.1~10 A/g电流密度区间选取多个电流密度值,并进行多次的充放电测试. 由图2(A)和(C)可以看出,随着电流密度逐渐增大,在每个电流密度下的10次循环内,COF-1和COF-2的比容量均能保持稳定,体现出优异的倍率稳定性. 从具体数据来看,当电池在0.1,0.2,0.4,1,2,4和10 A/g电流密度下工作时,COF-1 的充电比容量(相对于初始0.1 A/g 电流密度时的容量保持率)分别为737,542(74%),442(60%),349(47%),296(40%),249(34%)和180(24%) mA·h/g; COF-2的充电比容量分别为712,489(69%),405(57%),317(45%),265(37%),213(30%)和166(23%) mA·h/g; 当将电流密度瞬间调回至0.1 A/g时,COF-1和COF-2的充电比容量立即上升到641(87%)和454(64%) mA·h/g. 通过对比来看,含有三嗪环结构的COF-1的倍率性能要优于苯环结构的COF-2. 继续在0.1 A/g的电流密度下循环30次,可以看出,两种材料的充放电比容量都十分稳定,至测试结束时,COF-1和COF-2的充电比容量分别为650和532 mA·h/g. 总体看,两种COF具备在极大电流密度工作时的容量保持能力以及后续的循环稳定性,体现出了优异的倍率性能.
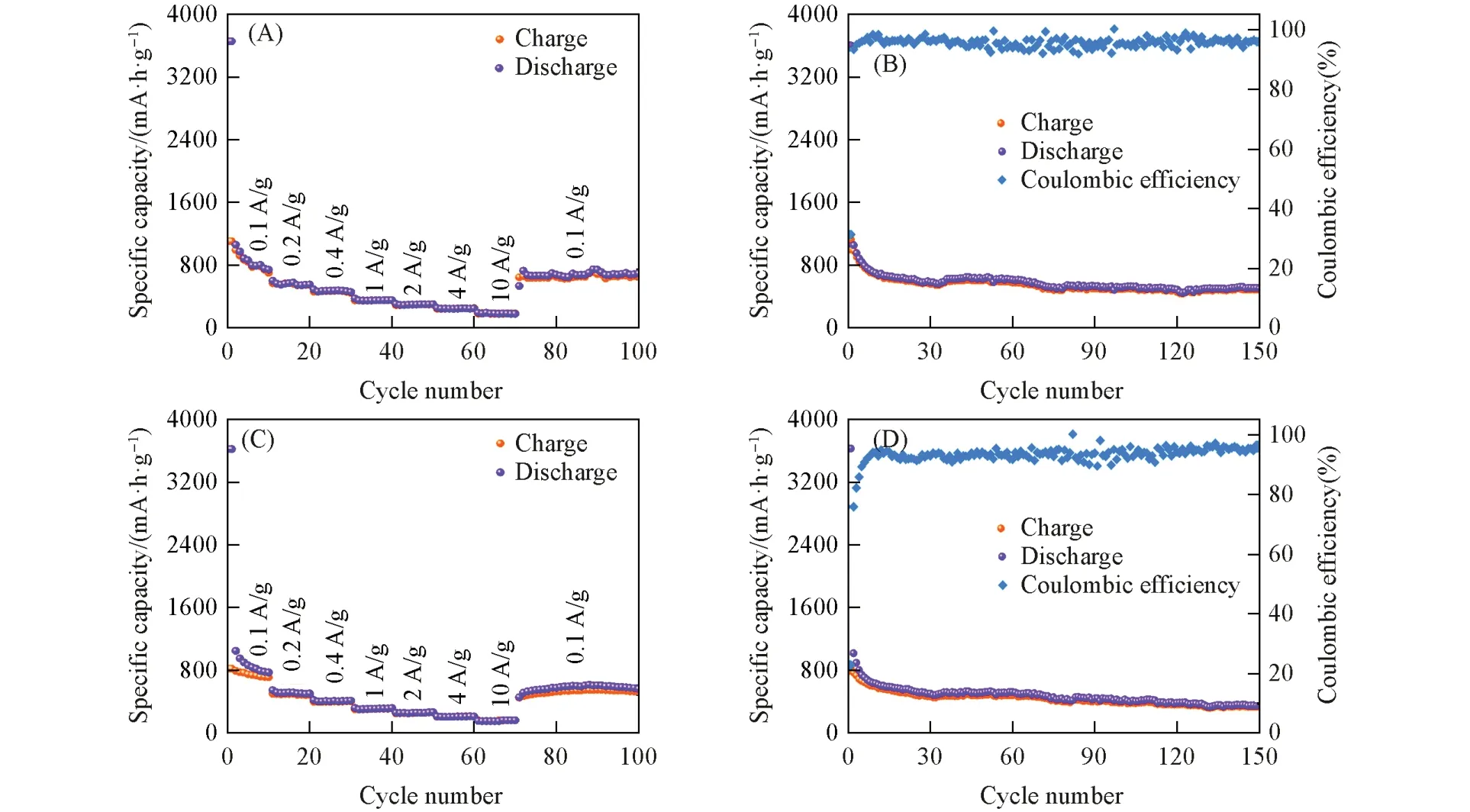
Fig.2 Rate performance of COF-1(A) and COF-2(C), the cycle stability of COF-1(B) and COF-2(D)at current density of 100 mA/g
循环稳定性是LIBs 的另一项重要性能,可以用来评估电池在长期使用后的容量保持能力. 以100 mA/g电流密度对COF-1和COF-2进行了长循环测试[图2(B)和(D)]. 可见,两种COF在约前30次循环内,比容量呈现较为明显的下降趋势,而后下降幅度明显减小. COF-1的首次、 第30次、 第100次和第150 次的充电比容量(相对于首次循环的容量保持率)分别为1126,561(50%),493(44%)和484(43%) mA·h/g; COF-2 的相应充电比容量分别为824,468(57%),389(47%)和327(40%) mA·h/g.可以看出,两种COF在经过30次循环后,比容量下降幅度较小,并且CE值都能达到95%以上,显示出良好的可逆性能,然而由于开始时容量损失太过严重,使得它们的循环稳定性受到了很大程度的影响.
有机类电极材料会随着充放电过程的进行,不断激发其电化学活性位点,使其比容量逐渐提升[52,53]. 而COF-1和COF-2的容量非但没有提升,反而在经过150次循环后下降了50%以上. 为了探究其原因,将单独的COF材料(不添加CNT)和单独的导电材料(仅有CNT)作为测试电极,金属锂片作参比电极和对电极,组装成扣式电池进行循环稳定性测试(图3). 可以看出,两种COF在单独作为电极材料时,比容量呈现明显的上升趋势,经过400 次循环后,COF-1 的充电比容量为45 mA·h/g,是初始充电比容量(23 mA·h/g)的2倍[图3(A)],COF-2的充电比容量为31 mA·h/g,也达到了初始充电比容量(16 mA·h/g)的2 倍[图3(B)]; 而CNT 单独作为电极材料时,经过200 次循环后的充电比容量为75 mA·h/g,是初始充电比容量(85 mA·h/g)的88%[图3(C)]. 由此可以判断,所制备的COF材料与很多有机类电极材料类似,本身也存在电化学活性位点激活带来的储锂性能提升,只是CNT与COF混合以后,可能形成了缠绕在一起的结构,覆盖了COF表面的部分活性位点,阻碍了激活过程的进行. 但即便如此,还是能够看出COF 与CNT 混合后,由于导电能力的增强,使其储锂性能远远高于COF 或CNT单独使用.
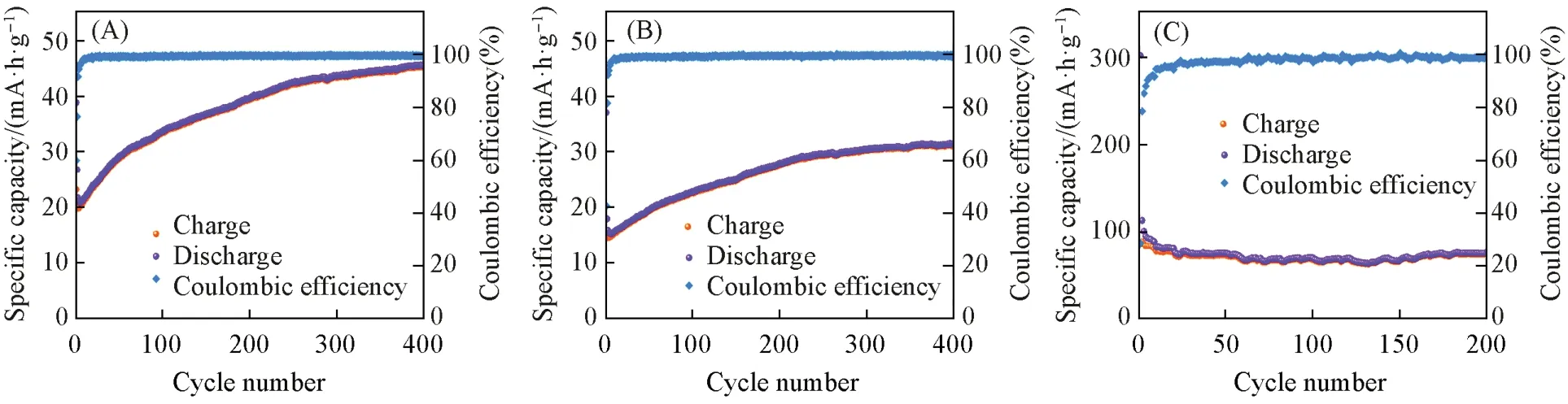
Fig.3 Cyclic stability of single active substance electrode(COF-1)(A), single active substance electrode(COF-2)(B) and conductive electrode(CNT)(C) at current density of 100 mA/g
因此综合来看,在活性物质(COF)中添加导电剂(CNT)仍然是有利的. 此外,还发现经过倍率充放电测试的电池在第100次循环时,表现出的充电比容量(COF-1: 650 mA·h/g,COF-2: 532 mA·h/g)要明显高于在100 mA/g 恒定电流密度下循环100 次时的充电比容量(COF-1: 493 mA·h/g,COF-2: 389 mA·h/g). 这可能是由于在大电流工作时,离子的穿梭速率很高,使COF材料中的电化学活性位点更容易被激活从而提升了它们的储锂性能.
为了检验两种COF电极材料是否在大电流条件下运行时,确实有利于储锂性能的提升,以5 A/g的超大电流密度对COF-1和COF-2进行了长达2000次的长循环测试(图4). 可以看出,两种材料的比容量呈现非常明显的上升趋势,其中,COF-1在经过约1200次循环后,容量达到峰值(606 mA·h/g),近似为初始充电比容量(126 mA·h/g)的5倍,在后续的循环过程中,电池的比容量趋于稳定,至第2000次测试结束时,COF-1的充电比容量为572 mA·h/g; COF-2在测试过程中容量一直保持上升的状态,其充电比容量最大时达到了343 mA·h/g,为初始充电比容量(109 mA·h/g)的3倍以上. 对单独的COF材料所进行的恒流充放电测试、 倍率性能测试与恒流循环测试后的容量值,以及超大电流密度下的长循环测试结果进行对比,可以判断出这两种COF材料确实存在电化学活性位点被激活的潜能. 此外,在超大的电流密度5 A/g下测试时,COF-1和COF-2分别能表现出606和343 mA·h/g的高充电比容量,可以看出,这两种材料在超大电流密度下工作时,展现出了优异的电化学性能,是非常有应用潜力的LIBs负极材料.
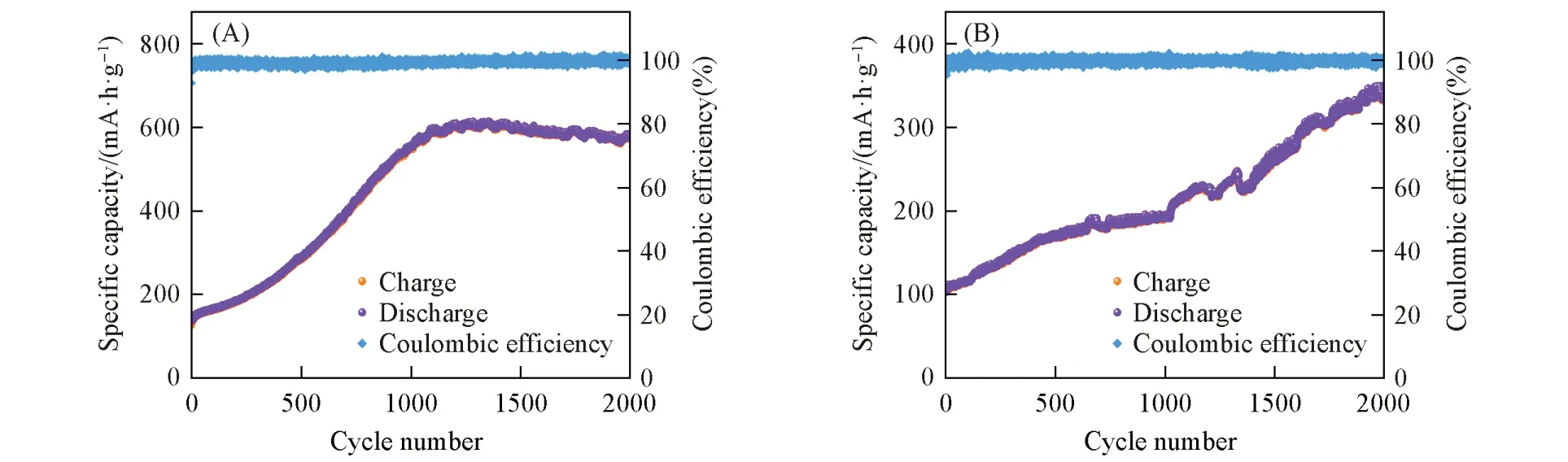
Fig.4 Long-term cycling performance of COF-1(A) and COF-2(B) at current density of 5 A/g
通过两种材料容量值的对比还可得出: 无论是电化学活性基团的激活速率还是自身的储锂性能,芳香环中含有N杂原子的COF-1都要比不含N杂原子的COF-2更具优势.
此外,为了更好地阐述以5 A/g 超大电流密度测试时两种COF 材料的容量上升现象(图4),将COF-1和COF-2分别在5 A/g的电流密度下循环200次和1000次,并分别进行了CV测试(图S6,见本文支持信息). 可以看出,两种COF材料经过1000次循环后,CV曲线围成的面积明显大于第200次循环时,这可以充分说明随着充放电过程的进行,COF-1和COF-2的电化学活性基团被不断激活(具体表现为氧化还原峰的增强),进而展现出了更佳的储锂性能.
为评估COF-1和COF-2的电化学反应动力学,分别对两种材料在循环前及100次循环后进行了交流阻抗(EIS)测试(频率范围: 100000~0.01 Hz),根据测试结果绘制了奈奎斯特图[图5(A)~(D)]并对其进行了阻抗拟合(图5插图),拟合结果列于表1. 可以看出,奈奎斯特图均由中高频区的半圆和低频区的倾斜直线构成,其中,半圆部分反映的是极化电阻,包括了电解质传输电阻(Rs)和电荷转移电阻(Rct); 而倾斜直线部分代表着扩散电阻,也称为Warburg 阻抗(Wo-R),主要与Li+在电极材料中的扩散相关[54]. 此外,拟合曲线与原始数据点的重合程度很高,结合表1 中数据,各部分器件的误差均低于5%且总方差值非常小,这些均表明拟合结果非常具有可靠性. 从两种COF材料循环前后各部分阻抗数值的对比结果来看,循环后电极的Rct和Wo-R值远小于初始时,这说明COF-1和COF-2在循环过程中电化学活性位点被激活,反应动力学性质得到了提升,对于电荷转移及Li+的扩散起到了很大的积极作用[55,56],也充分反映出具有规则结构、 较大比表面积以及脱嵌Li+活性基团的COF材料在作为LIBs电极材料时的性能优越性. 而且,循环前COF-1 的Rct和Wo-R均明显小于COF-2; 100 次循环后,COF-1 的Rct与COF-2 数值接近,但Wo-R明显小于COF-2,这些结果表明,COF-1 的电化学反应动力学要优于COF-2,这也从另一方面解释了COF-1在作为LIBs负极材料时性能要优于COF-2.
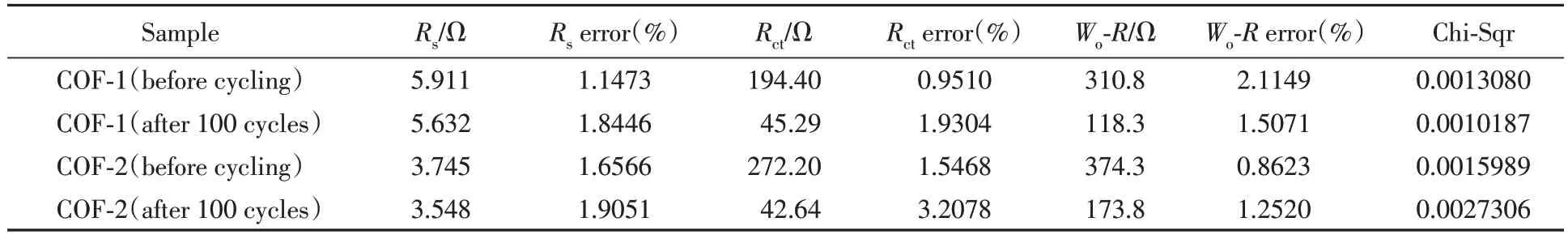
Table 1 Impedance values and error of each part and Chi-Squared obtained from the fitting curve of EIS of COF-1 and COF-2
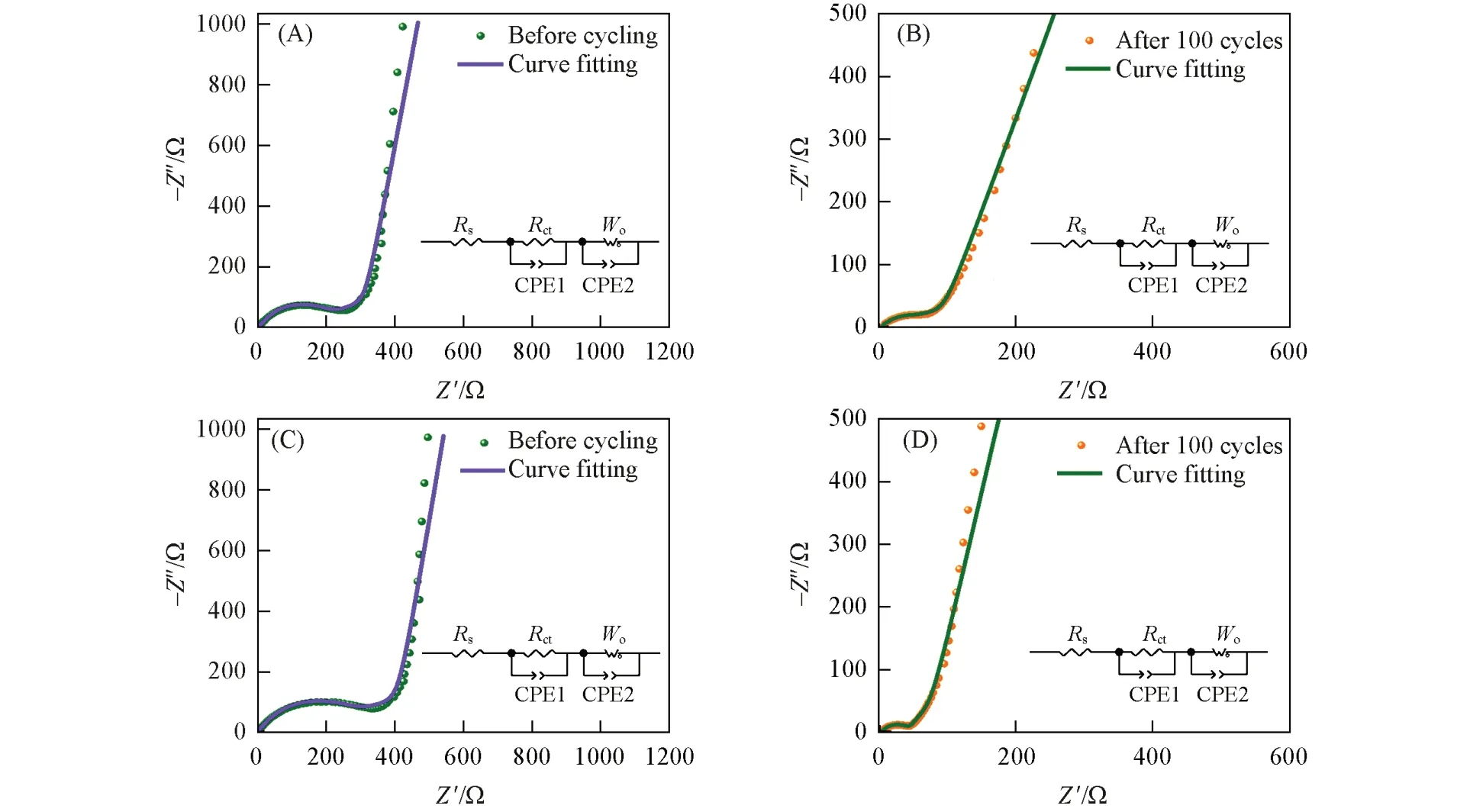
Fig.5 Nyquist plots and impedance fitting curves of COF-1(A, B) and COF-2(C, D) before cycling(A, C) and after 100 cycles(B, D)Insets: the equivalent circuit diagrams.
将以COF-1 和COF-2 为电极材料的LIBs 分别置于50 和-15 ℃环境中,在100 mA/g 电流密度下对其进行循环充放电测试,从而评估它们在极端温度环境下的工作性能[图6(A)和(B)]. 可以看出,两种材料在50 ℃时表现出非常高的容量且具有很强的循环稳定性,经过40次循环后,COF-1和COF-2的充电比容量分别为2101和1760 mA·h/g. 表明两种COF材料不仅拥有在极端高温环境下的稳定运行能力,且电化学性能要比室温时更加优越. 值得关注的是,在高温环境下以100 mA/g的电流密度测试时,两种COF材料在前30次循环中均未出现室温环境测试时容量急剧下降的现象[图2(B)和(D)],这可能是因为高温时Li+能够快速地在活性基团中嵌入和脱出,有利于活性位点的激活. 通过-15 ℃下的测试结果对比,发现两种材料的比容量明显降低,至第40次循环时,COF-1和COF-2的充电比容量分别为218和172 mA·h/g. 这应该是由于低温时Li+在活性基团中的插入率下降以及电荷在电解液中传输被抑制所致[48,53]. 综上,两种COF均能够在极端高温和低温环境中稳定运行,是非常理想的LIBs负极材料.
3 结 论
通过酮胺缩合反应合成了两种COF 材料. 这两种材料拥有较高的热稳定性和较大的比表面积,体现了优异的化学性质. 作为LIBs负极材料时,它们均表现出较高的可逆容量、 良好的循环性能、 优异的倍率性能以及在极端温度和超大电流密度下稳定运行的能力. 此外,这两种COF材料自身都具有电化学活性基团被激活的潜能,在大电流密度及高温条件下工作时,这种潜能会被很好地激发出来.通过对比两种材料的性能发现,相比于芳香环都是苯环的COF-2,含有多个C=N 的三嗪环结构的COF-1具有更强的储锂能力、 倍率性能以及电化学反应动力学等性质. COF-1和COF-2共价有机骨架是非常理想的LIBs负极材料,在实际应用领域存在着极大的潜力和可能性; 含有N杂原子的COF电化学性能更佳,为未来设计有机电极材料提供了思路和启示.
支持信息见http://www.cjcu.jlu.edu.cn/CN/10.7503/cjcu20230523.