免疫监控指导治疗脐血移植后急性移植物抗宿主病一例并文献复习
吴正宙?詹丽萍?阙丽萍?吴晓君?徐宏贵?黄科


【摘要】目的 探討以皮疹为主要表现的急性移植物抗宿主病(aGVHD)在免疫监控指导下的精准诊疗效果。方法 回顾1例因高危急性髓系白血病接受非血缘脐血移植、其后出现顽固性皮疹的患儿的临床资料及诊治过程,以“造血干细胞移植”“免疫重建”和“急性移植物抗宿主病”的中英文为检索词,对以下数据库的相关论文进行检索:PubMed、Web of Science、CNKI、万方数据知识服务平台,收集检索到的病例资料并进行分析。结果 该例1岁9月龄女性患儿成功获得造血重建,移植后22 d患儿头部、后颈部出现密集红色丘疹(面积约19%)、瘙痒明显,口服他克莫司、外用激素类药物后皮疹无好转(面积>90%),此时监测CD3+细胞、CD8+细胞、CD3+CD69+细胞、CD3+HLA-DR+细胞比例明显升高,调节性T细胞(Treg)比例下降。免疫指标支持T淋巴细胞活化,考虑Ⅱ度aGVHD(皮肤3级),遂予加强免疫抑制治疗方案。期间患儿皮疹有消退,但仍反复,并伴皮肤明显脱屑,复查CD3+细胞、CD8+细胞、CD3+HLA-DR+细胞比例仍偏高,遂再次调整治疗方案、加强抗排斥,患儿皮肤aGVHD好转。定期监测原发病完全缓解、植入比例100%、免疫重建稳定,随访至移植后32个月,患儿无病存活。检索到相关文献9 篇,均论证了早期CD3+细胞、CD8+细胞、活化T淋巴细胞比例升高以及Treg下调与aGVHD发生相关。结论 对异基因造血干细胞移植术后患者的免疫状态进行动态监测,有利于评估其免疫重建情况及疾病状态(如aGVHD),有助于制定合理的免疫抑制治疗方案,使患者获得良好预后。
【关键词】造血干细胞移植;脐血;急性移植物抗宿主病;免疫监控;免疫重建
Treatment of acute graft-versus-host disease after umbilical cord blood transplantation under the guidance of immune monitoring: a case report and literature review Wu Zhengzhou, Zhan Liping, Que Liping, Wu Xiaojun, Xu Honggui, Huang Ke. Department of Pediatrics, Sun Yat-sen Memorial Hospital, Sun Yat-sen University, Guangzhou 510120, China
Corresponding author, Huang Ke, E-mail: hke@mail.sysu.edu.cn
【Abstract】Objective To explore the effect of the precise diagnosis and treatment of a case of acute graft-versus-host disease (aGVHD) with rash as the main manifestation under the guidance of immune monitoring. Methods Clinical data and diagnosis and treatment of a child with high-risk acute myeloid leukemia who developed intractable rash after receiving unrelated umbilical cord blood transplantation were retrospectively analyzed. Using the keywords of “hematopoietic stem cell transplantation”“immune reconstitution” and “acute graft-versus-host disease”, relevant literatures were searched from PubMed, Web of Science, CNKI and Wanfang databases, and relevant cases were collected and analyzed. Results Hematopoietic reconstruction was successfully achieved in this 1 year 9 months old girl. On day 22 after transplantation, the skin of head and back neck of the patient showed dense red papules (approximately 19% in area), with obvious itching. Under the treatment of oral tacrolimus and topical hormone drugs, the rash was not alleviated (area>90%). Meanwhile, the proportion of CD3+ cells, CD8+ cells, CD3+CD69+cells and CD3+HLA-DR+cells was significantly increased, and the proportion of Treg cells was decreased. The immune indexes supported T lymphocyte activation, then diagnosis of gradeⅡaGVHD (skin grade 3) was made, and the immunosuppressive regimen was strengthened. During this period, the skin rash of the child subsided, but recurred, and accompanied by obvious skin desquamation. The proportion of CD3+ cells, CD8+ cells, and CD3+HLA-DR+cells remains relatively high, supporting the diagnosis of aGVHD. Therefore, the anti-GVHD regimen was adjusted and strengthened, and the aGVHD of the childs skin was mitigated. Regular monitoring showed that the primary disease was completely relieved, the implantation rate was 100%, and the immune reconstitution was stable. During 32-month follow-up after transplantation, the child obtained disease-free survival. Nine relevant literatures were retrieved, all of which demonstrated that the increased proportion of early CD3+ cells, CD8+ cells, activated T lymphocytes and Treg downregulation were associated with the occurrence of aGVHD. Conclusion The dynamic monitoring of the immune status of patients after allogeneic hematopoietic stem cell transplantation is helpful to evaluate their immune reconstitution and disease status (such as, aGVHD), thereby assisting clinicians to formulate a reasonable immunosuppressive regimen and bring favorable prognosis to patients.
【Key words】Hematopoietic stem cell transplantation; Cord blood; Acute graft-versus-host disease; Immune monitoring;
Immune reconstitution
急性移植物抗宿主病(aGVHD)是异基因造血干细胞移植(allo-HSCT)后的主要并发症和非复发死亡的主要原因[1-2]。其发生机制为抗原提呈细胞激活供者来源的同种异体反应性T 淋巴细胞,发生同种异基因免疫反应,攻击受者自身组织,引起组织细胞损伤与器官功能障碍[3-4]。allo-HSCT术后aGVHD的发生率高达30%~60%,经典aGVHD发生在移植后100 d 内,以斑丘疹、胃肠道症状或瘀胆型肝炎为临床表现[5]。目前aGVHD的诊断需根据病史、临床表现、病理检查结果进行综合判断。但aGVHD的临床表现并没有特异性,易与药物疹、感染相关皮疹、预处理所致胃肠道毒性反应、肠炎、病毒性肝炎等相混淆,不利于早期诊断与及时治疗。本文报道1例以皮疹为主要表现的aGVHD患儿在免疫监控指导下的精准诊疗过程,同时进行文献复习,旨在为临床医师在移植患者的术后管理方面提供经验参考。
对象与方法
一、1例以顽固性皮疹为主要表现的aGVHD患儿临床资料的收集
收集2019年8月在我院因高危急性髓系白血病(AML)接受非血缘脐血移植后出现以顽固性皮疹为主要表现的1例aGVHD患儿的临床资料,并对其在免疫监控指导下的精准诊疗过程进行总结分析。本研究通过我院医学伦理委员会批准(批件号:SYSKY-2023-251-01),并豁免知情同意。
二、文献检索
以“造血干细胞移植”“免疫重建”和“急性移植物抗宿主病”的中英文为检索词,对以下数据库截至2023年6月收录的论文进行检索:PubMed、Web of Science、CNKI、万方数据知识服务平台,收集检索到的病例资料并进行分析,总结在allo-HSCT术后免疫重建过程中各免疫细胞亚群与aGVHD的关联特点。
结果
一、1例以顽固性皮疹为主要表现的aGVHD患儿的病历资料
1.一般情况
患儿女,1岁9月龄,因“确诊AML 4月余,拟行造血干细胞移植术”于2019年8月19日入我院治疗。4月余前患儿因“咳嗽1个月,发热20 d,发现白细胞升高1周”于2019年4月1日首次入住我院,完善MICM检查确诊为AML(AML-M5,伴TET2、TP53突变,WT1高表达),予NOPHO-AML 2004 方案AIET(阿糖胞苷 200 mg/m2 第1~4日,伊达比星 12 mg/m2 第2、4、6日,依托泊苷100 mg/m2第1~4日,6-硫鸟嘌呤100 mg/m2 1次/
12 h、第1~4日)、AM(阿糖胞苷 100 mg/m2第1~5日,米托蒽醌 10 mg/m2第1~3日)、HA1M(阿糖胞苷1 g/m2 1次/12 h、第1~3日,米托蒽醌10 mg/m2
第3~5日)化学治疗。期间脑脊液检查未见异常,监测骨髓形态、流式细胞学均提示白血病完全缓解,但仍可检测到TET2基因、TP53基因等突变位点,诊断高危AML。拟行allo-HSCT治疗,干细胞来源为人类白细胞抗原(HLA)高分配型8/10相合非血缘脐血。患儿系G1P1试管婴儿,足月剖宫产出,出生后无窒息、抢救史。其患有“先天性甲状腺功能减退症”,规律口服优甲乐治疗,定期监测甲状腺功能正常。其父母非近亲结婚,身体均健康。
入院体格检查:生命体征平稳,体质量12.5 kg(+0.9 SD)。神志清晰。全身皮肤黏膜无苍白、黄染、皮疹及出血点。浅表淋巴结未扪及肿大。咽无充血,双侧扁桃体无肿大、异常分泌物。双肺呼吸音粗,未闻及干、湿啰音。心脏听诊无异常。肝、脾肋下未触及。
2.实验室及辅助检查
胸部CT:双肺散在炎症。骨髓细胞形态:白血病治疗后完全缓解骨髓象。流式细胞检测(骨髓):微小残留病变(MRD)<0.01%。骨髓WT1基因定量:WT1表达分数65.53%,结果显示高表达(正常值<55%)。头颅及全脊柱MRI平扫+增强、脑脊液检查等提示无髓外浸润。其他相关检查无异常。
3.治疗经过
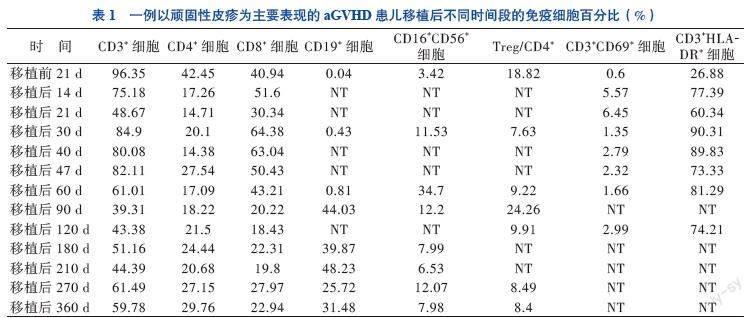
入院后评估原发病为完全缓解状态,无移植禁忌证,按计划行allo-HSCT。由于患儿骨髓WT1基因仍高表达,故于2019年8月17日至21日予地西他滨20 mg/(m2·d)去甲基化治疗,过程顺利。入院后第8日开始行清髓性预处理化学治疗:氟达拉滨30 mg/(m2·d) 移植前8~4 d,白消安每次0.8 mg/kg、1次/6 h、移植前4~7 d,环磷酰胺60 mg/(kg·d) 移植前2~3 d。预处理结束后第2日输注脐血44.4 mL(总有核细胞数11.06×107/kg,CD34+细胞数11.5×105/kg)。予他克莫司(FK506)、吗替麦考酚酯预防GVHD。移植前胸部CT提示肺炎,预处理期间予头孢哌酮舒巴坦抗菌、百炎净+氟康唑预防真菌、更昔洛韦预防病毒感染。移植后1、2、3、6、9、12个月抽取患儿外周血检测淋巴细胞亚群、调节性T细胞(Treg)、T淋巴细胞活化状态、胸腺细胞输出功能(CD4+CD45RA+细胞、CD4+CD45RA+PTK-7+细胞),以判断患儿免疫重建状态,且在患儿调整免疫抑制剂期间增加检测频率以协助判断免疫耐受情况,见表1、2。
4.植入情况及合并症
移植后12 d中性粒细胞植入,移植后35 d血小板植入,移植后14 d查植入比例为100%,呈完全脐血供者嵌合状态。移植早期曾出现中性粒细胞缺乏伴发热,予抗感染治疗后好转。移植后22 d患儿头颈部出现密集红色丘疹(面积约19%),瘙痒明显,无发热、腹泻,查T淋巴细胞活化状态提示早期活化T淋巴细胞(CD3+CD69+细胞)比例较移植前升高10倍,考虑为aGVHD, 采用改良的Glucksberg 标准进行评分,诊断为Ⅰ度aGVHD(皮肤1级)[5-6]。予外涂糠酸莫米松软膏及口服FK506治疗,期间監测血药浓度为11.4~15.1 mmol/L,
皮疹较前消退。移植后27 d患儿身体的皮疹明显增多,主要分布在头颈部、躯干、臀部及双侧大腿,皮疹性质同前,双手掌、脚底明显充血(面积>90%),结合CD3+细胞、CD8+细胞、晚期活化T淋巴细胞(CD3+HLA-DR+细胞)、Treg比例的变化情况与临床表现相符,诊断为Ⅱ度aGVHD(皮肤3级)。遂在原口服FK506的基础上静脉滴注甲泼尼龙2 mg/(kg·d)治疗。治疗3 d后患儿皮疹无消退且有进展趋势,考虑有启动二线治疗的必要性,结合近期炎症因子TNF-α为23.80 pg/mL,较参考值(0~8.1 pg/mL)上限升高2倍,遂加用2针TNF受体拮抗剂(0.4 mg/kg、2次/周,10月3日、10月6日使用),并根据我院移植中心GVHD的治疗经验,加用甲氨蝶呤(8 mg/m2、1次/周,共2次,10月4日、10月10日使用),期间甲泼尼龙逐渐减量。移植后36 d患儿皮肤评分仍为3级,炎症因子IL-2受体(IL-2R)为2 512 U/mL(223~710 U/mL),遂加口服芦可替尼(1.25 mg、2次/日)。移植后40 d皮疹面积仍>50%,复查CD3+细胞、CD8+细胞、CD3+HLA-DR+细胞比例无明显下降,查IL-2R 1 650 U/mL,予最大口服剂量
0.166 mg/(kg·d)后监测FK506血药浓度仍偏低(血药峰浓度6 mmol/L),遂停用FK506,改口服环孢素(CsA),期间监测血药浓度130~235 ng/mL,同时芦可替尼加量(2.5 mg、2次/日)。调整治疗方案5 d后,患儿面部、胸前皮疹较前减少,但后背、双下肢皮疹消退仍较慢,基底皮肤充血较明显,伴皮肤明显脱屑。移植后48 d患儿全身皮疹再次增多,呈网状红褐色斑丘疹、皮肤明显脱屑。在免疫抑制较强的情况下,患儿发生感染的风险显著增加。复查CD3+细胞、CD8+细胞、CD3+HLA-DR+细胞比例仍明显偏高,支持免疫性皮肤损伤。遂请皮肤科会诊,考虑为移植后皮肤反应,建议加强外用药,予丙酸氟替卡松软膏+FK506软膏治疗,其后患儿皮疹逐渐消退。
5.治疗结果、随访及转归
患儿于移植后50 d病情稳定出院,无新发皮疹,头面部、臀部皮疹消退,后背、腹部、双下肢可见陈旧性皮疹,颜色变淡,可见明显皮屑,无其他不适。出院时免疫抑制方案为口服甲泼尼龙片(4 mg,每日晨服1次),CsA口服液(0.28 mL,1次/12 h)、口服芦可替尼(2.5 mg、2次/日)。移植后60 d患儿皮疹基本消退,此时查CD3+细胞比例恢复正常,CD8+细胞轻度升高,虽然CD3+HLA-DR+细胞比例仍偏高,但Treg较1个月前上升20%,评估皮肤aGVHD控制良好,且患儿为高危AML,为减少复发风险,予停用甲泼尼龙片,CsA、芦可替尼逐渐减量。免疫抑制剂减量期间,患儿皮疹无复发、血象稳定,监测不同时间段的免疫细胞绝对值逐渐恢复正常,见表2。定期监测原发病完全缓解、植入比例100%,随访至移植后32个月,患儿无病存活。
二、文献检索结果
检索到相关中英文文献9 篇,其中临床研究 7 篇、综述2篇,主要描述及论证了儿童和成人患者接受allo-HSCT治疗后,在其适应性免疫重建中免疫细胞亚群与aGVHD的关系,见表3。
讨论
allo-HSCT是目前治疗多种难治性恶性血液病的最有效方法,其成功的关键环节之一是移植后免疫系统重建(IR)[7-9]。IR受多种因素影响,这些因素影响着免疫恢复的速度和模式[10-13]。IR包括固有IR与适应性IR[8]。固有免疫系统的粒细胞、NK细胞、NKT淋巴细胞等的重建在移植术后20~30 d内迅速发生,一般数周至数个月即可完成;适应性免疫系统的淋巴细胞(包含T淋巴细胞和B淋巴细胞)的重建速度则较慢,一般需1至2年。相对于外周血干细胞移植(PBSCT)而言,非血缘脐血移植(UCBT)在移植术后3个月内淋巴细胞总数较低,提示IR延迟,这与脐带血中总有核细胞数量少有关。在移植术后9个月,UCBT患者的淋巴细胞重建较PBSCT患者快,这可能是因为脐带血中富含可重建造血的最原始干细胞,免疫重建能力更强[14]。Ando等[15]的研究显示,allo-HSCT后28 d内,PBSCT患者体内的总淋巴细胞、CD4+细胞亚群、CD8+细胞、NKT细胞和NK细胞计数高于UCBT患者;在移植术后100 d,UCBT患者中的总淋巴细胞以及B淋巴细胞、CD4+细胞亚群和NK细胞数开始显著升高,与之相反的是,CD8+细胞数则明显下降。此外,也有文献报道PBSCT术后CD8+细胞恢复更快,而UCBT术后则是Treg和CD4+细胞恢复更快[14]。本例AML患儿脐血移植后免疫重建情况与此相似。
对移植后患者的免疫状态进行动态监测有利于评估其免疫功能重建恢复情况及疾病状态。相关研究表明,发生Ⅲ~Ⅳ度aGVHD患者在移植后1~3个月其体内的CD3+细胞明显高于未发生aGVHD患者[16]。CD8+细胞的过早恢复是发生aGVHD的高危因素[17]。本例患儿在移植后1个月内,CD3+细胞、CD8+细胞明显升高,预示着发生aGVHD高风险,这与其后续的临床进展過程相符。Paz Morante等[18]发现,在aGVHD发生早期,aGVHD患者的CD3+CD69+细胞比例较未发生aGVHD者明显升高,故移植后定期监测CD3+CD69+细胞可早期预警aGVHD。Treg是抑制移植排斥反应的重要亚群,在aGVHD患者中Treg显著下降,通过监测移植后Treg的数量和比值有助于了解aGVHD治疗效果、指导用药[19-20]。UCBT患者移植后Treg的快速重建较PBSCT患者具有明显优势,且在移植后9~18个月UCBT 患者的Treg可维持较高水平,预示预后更好[14]。本例患儿的Treg在移植后9个月即恢复至较高水平,对控制aGVHD起到非常重要的作用。通过检测胸腺初始性T细胞(CD4+CD45RA+细胞、CD4+CD45RA+PTK-7+细胞)在移植后患者体内的含量,可以预估患者CD4+细胞重建是否会出现迟缓,以协助调整免疫抑制剂用量[21]。本例患儿的CD4+CD45RA+PTK-7+细胞在移植后180 d升高至移植前的2.5倍,是其体内CD4+细胞重建稳定的有效信号。
移植后IR是allo-HSCT成功的關键,而aGVHD是影响移植后IR的主要因素。及早有效地控制aGVHD,是促进患者移植后IR及获得良好生存预后的保障。虽然目前移植后IR及GVHD的机制仍未完全清楚,但移植后免疫细胞的恢复情况与临床之间的相关性却可以为移植患者的术后管理提供参考。虽然本例AML患儿在脐血移植早期IR遭受了aGVHD的打击,但通过密切监测其IR情况,并及时调整免疫抑制剂方案,使aGVHD得到有效控制,其免疫细胞也得以快速恢复,最终获得较好的预后。
参 考 文 献
[1] Deeg H J. How I treat refractory acute GVHD[J]. Blood, 2007, 109(10): 4119-4126.
[2] Ponce D M, Politikos I, Alousi A, et al. Guidelines for the prevention and management of graft-versus-host disease after cord blood transplantation[J]. Transplant Cell Ther, 2021, 27(7): 540-544.
[3] Socié G, Kean L S, Zeiser R, et al. Insights from integrating clinical and preclinical studies advance understanding of graft-versus-host disease[J]. J Clin Invest, 2021, 131(12): e149296.
[4] Malard F, Holler E, Sandmaier B M, et al. Acute graft-versus-host disease[J]. Nat Rev Dis Primers, 2023, 9(1): 27.
[5] 中华医学会血液学分会干细胞应用学组. 中国异基因造血干细胞移植治疗血液系统疾病专家共识(Ⅲ)——急性移植物抗宿主病(2020年版)[J]. 中华血液学杂志, 2020, 41
(7): 529-536.
Stem Cell Application Group, Chinese Society of Hematology, Chinese Medical Association.Chinese consensus of allogeneic hematopoietic stem cell transplantation for hematological disease (Ⅲ)——acute graft-versus-host disease (2020)[J]. Chin J Hematol, 2020, 41(7): 529-536.
[6] Schoemans H M, Lee S J, Ferrara J L, et al. EBMT-NIH-CIBMTR Task Force position statement on standardized terminology & guidance for graft-versus-host disease assessment[J]. Bone Marrow Transplant, 2018, 53(11): 1401-1415.
[7] Yanir A, Schulz A, Lawitschka A, et al. Immune reconstitution after allogeneic haematopoietic cell transplantation: from observational studies to targeted interventions[J]. Front Pediatr, 2022, 9: 786017.
[8] Ogonek J, Kralj Juric M, Ghimire S, et al. Immune reconstitution after allogeneic hematopoietic stem cell transplantation[J]. Front Immunol, 2016, 7: 507.
[9] Belinovski A R, Pelegrina P D, Lima A C M, et al. Immune reconstitution after allogenic stem cell transplantation: an observational study in pediatric patients[J]. Hematol Transfus Cell Ther, 2023, 45(2): 235-244.
[10] Elfeky R, Lazareva A, Qasim W, et al. Immune reconstitution following hematopoietic stem cell transplantation using different stem cell sources[J]. Expert Rev Clin Immunol, 2019, 15(7): 735-751.
[11] Sugiyanto M, Gosal S, Kosim A, et al. Impact of the source of hematopoietic stem cells on immune reconstitution after transplantation: a systematic review[J]. Eur J Haematol, 2023, 111(1): 4-14.
[12] Teshima T, Boelens J J, Matsuoka K I. Novel insights into GVHD and immune reconstitution after allogeneic hematopoietic cell transplantation[J]. Blood Cell Ther, 2023, 6(2): 42-48.
[13] Stern L, McGuire H, Avdic S, et al. Mass cytometry for the assessment of immune reconstitution after hematopoietic stem cell transplantation[J]. Front Immunol, 2018, 9: 1672.
[14] 黄盼盼, 张爱梅, 张翠萍, 等. 外周血干细胞移植与非血缘脐带血移植的患者免疫重建规律的比较[J]. 中华检验医学杂志, 2021, 44(12): 1138-1144.
Huang P P, Zhang A M, Zhang C P, et al. Comparison of immune reconstitution after peripheral blood stem cell transplantation and umbilical cord blood transplantation[J]. Chin J Lab Med, 2021, 44(12): 1138-1144.
[15] Ando T, Tachibana T, Tanaka M, et al. Impact of graft sources on immune reconstitution and survival outcomes following allogeneic stem cell transplantation [J]. Blood Adv, 2020, 4(2): 408-419.
[16] 沈耀耀, 劉跃均, 吴德沛, 等. 异基因造血干细胞移植后免疫重建的临床研究及急性移植物抗宿主病的危险因素分析[J]. 白血病·淋巴瘤, 2015, 24(6): 346-351.
Shen Y Y, Liu Y J, Wu D P, et al. Immune reconstitution after allogeneic hematopoietic stem cell transplantation and analysis of risk factors for acute graft-versus-host disease[J]. J Leuk Lymphoma, 2015, 24(6): 346-351.
[17] Podgorny P J, Liu Y, Dharmani-Khan P, et al. Immune cell subset counts associated with graft-versus-host disease[J]. Biol Blood Marrow Transplant, 2014, 20(4): 450-462.
[18] Paz Morante M, Briones J, Canto E, et al. Activation-associated phenotype of CD3 T cells in acute graft-versus-host disease[J]. Clin Exp Immunol, 2006, 145(1): 36-43.
[19] Giaccone L, Faraci D G, Butera S, et al. Biomarkers for acute and chronic graft versus host disease: state of the art[J]. Expert Rev Hematol, 2021, 14(1): 79-96.
[20] Magenau J M, Qin X, Tawara I, et al. Frequency of CD4+CD25(hi)FOXP3+ regulatory T cells has diagnostic and prognostic value as a biomarker for acute graft-versus-host-disease[J]. Biol Blood Marrow Transplant, 2010, 16(7): 907-914.
[21] Servais S, Hannon M, Peffault de Latour R, et al. Reconstitution of adaptive immunity after umbilical cord blood transplantation: impact on infectious complications[J]. Stem Cell Investig, 2017, 4: 40.
[22] Dekker L, de Koning C, Lindemans C, et al. Reconstitution of T cell subsets following allogeneic hematopoietic cell transplantation[J]. Cancers, 2020, 12(7): 1974.
[23] de Koning C, Prockop S, van Roessel I, et al. CD4+ T-cell reconstitution predicts survival outcomes after acute graft-versus-host-disease: a dual-center validation[J]. Blood, 2021, 137(6): 848-855.
[24] Khandelwal P, Lane A, Chaturvedi V, et al. Peripheral blood CD38 bright CD8+ effector memory T cells predict acute graft-versus-host disease[J]. Biol Blood Marrow Transplant, 2015, 21(7): 1215-1222.
[25] van der Maas N G, Berghuis D, van der Burg M, et al. B cell reconstitution and influencing factors after hematopoietic stem cell transplantation in children[J]. Front Immunol, 2019, 10: 782.
[26] Waller E K, Logan B R, Fei M, et al. Kinetics of immune cell reconstitution predict survival in allogeneic bone marrow and G-CSF-mobilized stem cell transplantation[J]. Blood Adv, 2019, 3(15): 2250-2263.
(收稿日期:2023-05-26)
(本文编辑:洪悦民)

