佛山地区矮小症患儿病因分析及建立矮小症快速诊断模型的研究
黄子华,林秀雯,李燕华,周少雄,刘 玲,刘玉华
佛山复星禅诚医院:1.检验科;2.儿童保健科,广东佛山 528000
矮小症主要是指患儿与相同生活环境、种族、年龄、性别的其他儿童相比,平均身高小于2个标准差或者处于第3百分位以下[1],目前已成为儿科门诊常见的内分泌疾病之一。在临床诊断方面,由于矮小症患儿通常伴有生长激素缺乏,所以临床上一般采用生长激素激发试验来评估矮小症。但生长激素激发试验操作复杂,需要多次采集患儿血液,患儿依从性降低,而且容易导致不良反应[2]。有研究指出,儿童的生长发育主要受生长激素-类胰岛素生长因子(GH-IGFs)轴的调控,该轴的主要成分包括生长激素、IGFs和IGF结合蛋白(IGFBP)及相关酶,检测GH-IGFs轴成分的活性和抗原含量可作为诊断矮小症的参考指标[3-4]。但该途径不够全面,指标结果解读困难,需要建立一个适用于门诊快速筛查的诊断模型。为此,本研究对佛山地区矮小症患儿病因进行分析,并建立矮小症快速诊断模型,以期为临床诊断矮小症提供参考。现报道如下。
1 资料与方法
1.1一般资料 选取2021年2月至2023年2月来本院儿科门诊首次就诊的150例矮小症患儿为试验组,选取同期在本院进行健康体检的健康儿童150例作为对照组。试验组中男孩81例,女孩69例;年龄5~12岁,平均(9.04±1.84)岁。对照组中男孩79例,女孩71例;年龄5~12岁,平均(9.11±1.79)岁。两组性别、年龄比较,差异无统计学意义(P>0.05)。本研究已获得本院医学伦理委员会批准(CYIRB-LCYJ-2021016)。所有参与研究的儿童家属对检查项目均知情同意,且依从性良好。
试验组纳入标准:(1)年龄5~12岁;(2)均符合中华医学会《矮身材儿童诊治指南》中的诊断标准[5];(3)资料齐全。对照组纳入标准:(1)年龄5~12岁;(2)在本院体检健康者。排除标准:(1)存在先天性疾病者;(2)存在神经或意识障碍性疾病者;(3)存在脑部疾病者;(4)因抵抗情绪拒绝参加研究者。
1.2方法
1.2.1资料收集 对两组研究对象的基本情况进行收集,包括:(1)出生时的基本状况,如胎龄、出生体质量、是否发生宫内窘迫、窒息、缺氧等不良妊娠结局;(2)出生后的生长发育情况,包括喂养情况、营养状态、既往疾病史、饮食结构、家庭遗传病史以及家庭背景等;(3)入院后,记录所有儿童的体格检查结果,包括肢体是否异常、面部检查、身高、体质量、坐高、骨龄、第二性征等。
1.2.2指标检测 采集所有研究对象空腹静脉血3~5 mL,以3 500 r/min离心处理15 min(离心半径10 cm)后,置于-20 ℃的低温冰箱中保存待测。采用美国贝克曼库尔特UniCel DxI800全自动免疫发光分析仪检测血清胰岛素样生长因子1(IGF-1)、胰岛素样生长因子结合蛋白3(IGFBP-3)、碱性磷酸酶(ALP)、25-羟维生素D[25(OH)D]水平,配套IGF-1测定试剂盒、IGFBP-3酶联免疫分析试剂盒、ALP测定试剂盒、25(OH)D测定试剂盒,所有检测步骤均按照相关仪器及配套试剂盒说明书执行。对两组研究对象进行分批检测,每批包括试验组30例和对照组30例,一共检测5批。检测结束后收集检测结果,并采用双录入校对的方式整理成电子数据库。
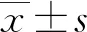
2 结 果
2.1佛山地区矮小症患儿的发病原因分析 纳入的150例矮小症患儿发病原因一共有12种,其中生长激素缺乏、特发性身材矮小是矮小症发病的主要原因,分别占58.0%(87/150)和27.3%(41/150),其次Tuner综合征占2.7%(4/150)、垂体占位性病变占3.3%(5/150)、甲状腺功能减退占2.7%(4/150)、小于胎龄占2.0%(3/150),性早熟、先天性疾病、家族遗传矮小、软骨发育不良、巴特综合征、其他染色体异常均分别占0.7%(1/150)。
2.2两组研究对象基本情况比较 两组研究对象年龄、性别、补钙、运动情况比较,差异均无统计学意义(P>0.05);试验组体质量指数、父亲身高、母亲身高、出生体质量均低于对照组(P<0.05),营养不良发生率高于对照组(P<0.05)。见表1。

表1 两组研究对象基本情况比较[n(%)或
2.3两组研究对象实验室指标检测结果比较 试验组IGF-1、IGFBP-3、ALP、25(OH)D水平均低于对照组,差异均有统计学意义(P<0.05)。见表2。

表2 两组研究对象实验室指标检测结果比较
2.4矮小症快速诊断模型的构建及诊断效能分析 以是否是矮小症(否=0,是=1)为因变量,以表1、表2中P<0.05的指标为自变量,并进行赋值,营养不良:是=0、否=1,体质量指数、父亲身高、母亲身高、出生体质量、IGF-1、IGFBP-3、ALP、25(OH)D均以原值输入,进行多因素Logistic逐步回归分析,结果显示体质量指数低、父亲身高矮以及IGF-1、IGFBP-3、ALP、25(OH)D水平降低均是矮小症发生的独立危险因素(P<0.05),见表3。构建诊断模型:LN[P/(1-P)]=0.419×X体质量指数+0.537×X父亲身高+0.269×XIGF-1+0.833×XIGFBP-3+0.741×XALP+0.582×X25(OH)D-2.317。ROC曲线分析结果显示构建的诊断模型对矮小症具有一定的诊断效能(AUC=0.720,95%CI:0.635~0.804,P<0.001),见图1。

图1 诊断模型诊断矮小症的ROC曲线

表3 多因素Logistic逐步回归分析矮小症发生的影响因素
3 讨 论
临床认为,矮小症的发生原因很多,如个人体质差异、胎儿阶段宫内发育不良、营养缺乏、内分泌疾病、生长激素异常等均可能导致矮小症的发生[1,6]。本研究结果显示,入组的150例矮小症患儿病因主要为生长激素缺乏(58.0%)、特发性身材矮小(27.3%),与国内相关研究[7]报道一致。生长激素缺乏导致的矮小症以男孩居多,是由于垂体前叶分泌的生长激素不足,导致生长发育迟缓,患儿表现出矮小、骨龄落后等症状,但智力通常正常[8-9]。特发性身材矮小是一种病因尚不明确的矮小症,与遗传或内在因素密切相关,有报道指出可能与软骨发育重要基因矮小同源盒(SHOX)有关[10-11]。这类患儿通常在出生时体格指标正常,而且无全身疾病、染色体异常、内分泌系统异常等指征,但在生长发育过程中身高明显低于同龄人群[12-13]。另外,本研究通过对比两组研究对象的基本情况发现,试验组体质量指数、父亲身高、母亲身高、出生体质量均低于对照组,营养不良发生率高于对照组,提示人口学因素、营养状况也是影响矮小症发生的重要因素。桑妙玉等[14]调查研究也指出,矮小症的发生与营养摄入、种族遗传、地域差异等因素有关。
从生化角度来看,已有研究证实GH-IGFs内分泌轴的调控与儿童的生长发育密切相关,IGF-1可通过介导生长激素促进软骨细胞有丝分裂,进而促进儿童生长发育,而二者分泌水平降低可导致儿童生长发育迟缓[15]。此外,IGF-1水平可以反映生长激素分泌水平,而IGFBP-3与IGF-1结合可以调控IGF-1在血液中的游离浓度,促进IGF-1持续发挥生物活性[16]。本研究结果显示,试验组IGF-1、IGFBP-3、ALP水平均低于对照组(P<0.05),表明矮小症患儿与健康儿童GH-IGFs分泌轴成分水平存在差异。张穗洪等[17]研究也指出,IGF-1、IGFBP-3水平降低是导致儿童矮小症的危险因素,可作为诊断矮小症的有效指标,与本研究结果相似。干冬梅[18]研究指出,血清IGF-1单次检测就可以为临床诊断矮小症提供可靠的实验室依据。但也有研究认为,IGF-1、IGFBP-3对矮小症的诊断灵敏度仅为35%和12%,二者单独诊断矮小症的价值不高[19]。基于此,本研究通过多因素Logistic逐步回归分析拟合的诊断模型中包括了体质量指数、父亲身高、IGF-1、IGFBP-3、ALP、25(OH)D共6个参数,通过绘制ROC曲线,显示拟合的诊断模型对矮小症具有一定的诊断价值(AUC=0.720,95%CI:0.635~0.804,P<0.001),提示该诊断模型可作为临床诊断矮小症的参考工具,在临床诊断方面应当综合考虑人口学因素、营养状况以及相关生化指标,以提高矮小症的诊断准确率,为规范临床诊治提供指导依据。
综上所述,生长激素缺乏、特发性身材矮小是矮小症发病的主要原因,基于GH-IGFs轴拟合的诊断模型对矮小症具有一定的诊断价值。

