遵义市食源性沙门菌分子分型及耐药研究*
韦德琴,朱 琳
贵州省遵义市疾病预防控制中心检验科,贵州遵义 563000
沙门菌广泛存在于自然界,是全球食源性腹泻病最常见的病原菌之一,可引起胃肠炎、类伤寒、败血症、局部化脓性感染等疾病。据世界卫生组织报告,沙门菌造成的食物污染给世界各国带来了巨大经济损失,并且严重威胁着人们的身体健康和生命安全。由于沙门菌种类多达2 600多种型别[1],传统分型鉴定技术需要实验室保存250多种不同的高质量分型血清和350种不同的抗原[2],并且要求实验人员经验丰富,技术水平高,除此之外该试验周期长、精确度差,加大了社会各检疫部门对食品中沙门菌的防治及监控的难度。脉冲场凝胶电泳(PFGE)是基于分子的快速分型方法,可提供更快、差异性更明显和更准确的沙门菌分型,克服了传统血清分型的局限性,目前被认为是细菌分型的“金标准”,已被公共卫生部门和食品监管机构用于疫情调查和溯源分析。目前,抗菌药物联合应用是临床治疗沙门菌病的主要措施,由于抗菌药物的滥用出现了许多多重耐药细菌、泛耐药细菌以及全耐药超级细菌,沙门菌作为重要的致病菌,其耐药性不容忽视[3]。本研究对遵义市食品来源的21株沙门菌进行血清分型、PFGE分子分型和药敏试验,为食源性沙门菌监测与溯源提供理论依据,同时为沙门菌感染病例合理使用抗菌药物、规避引发耐药提供帮助。
1 材料与方法
1.1一般材料 本试验分析的21株沙门菌均分离自遵义市2020-2022年红花岗区、务川县、凤冈县、余庆县、道真县、赤水市、绥阳县、桐梓县、湄潭县、仁怀市10个区县食品风险监测项目标本。PFGE试验标准菌株为沙门菌H9812,取自贵州省疾病预防控制中心细菌科。药敏试验质控菌株ATCC25922、ATCC27853均取自贵州省疾病预防控制中心细菌科。
1.2仪器与试剂 沙门菌显色平板、营养琼脂、XLD琼脂均购自北京陆桥技术股份有限公司;沙门菌属诊断血清购自丹麦国家食品研究所;限制性内切酶XbaⅠ购自 TaKaRa公司;蛋白酶K、Gelred染液购自索莱宝公司;脉冲场凝胶电泳仪、显影仪购自Bio-Rad公司; CHNENF革兰阴性菌药敏板及配套试剂、Sensitire AIM自动菌液加样系统及分析系统均购自赛默飞公司;质谱仪鉴定仪购自布鲁克公司。
1.3方法 沙门菌血清型鉴定是根据White-Kauffmann Le Minor抗原表,利用玻片凝集法对21株沙门菌进行O抗原和H抗原血清凝集试验确定菌株的血清型别。PFGE分子分型参照美国Pulse Net PFGE标准化方法进行,将21株分离的沙门菌株用限制性内切酶XbaⅠ酶切后进行PFGE,胶块经Gelred染液染色后成像。药敏试验按照美国临床和实验室标准化协会(CLSI)推荐的微量肉汤稀释法检测沙门菌对17种抗菌药物(氯霉素、复方磺胺甲噁唑、头孢噻肟、头孢他啶、四环素、环丙沙星、萘啶酸、阿奇霉素、阿米卡星、链霉素、氨苄西林、氨苄西林/舒巴坦、多黏菌素、头孢他啶/阿维巴坦、厄他培南、美罗培南、替加环素)的药物敏感性,根据CLSI抗微生物药敏试验执行标准M100[4]的相应标准获得敏感(S)、中度敏感(I)和耐药(R)的结果,替加环素目前在M100标准里无R、S的判断标准,其R、S的判断参考文献[5]。
1.4统计学处理 采用BioNumerics软件进行聚类分析,构建聚类树。
2 结 果
2.1沙门菌血清分型 对21株沙门菌进行血清学鉴定,共鉴定出16种血清型,以C群(8株)、D群(5株)、E群(5株)为主,分别占38.10%、23.81%、23.81%,其中肯塔基沙门菌3株、德尔卑沙门菌2株、肠炎沙门菌2株、希林登沙门菌2株,其余均为1株,见表1。

表1 21株食源性沙门菌血清型分布
2.2沙门菌PFGE分子分型 沙门菌用限制性内切酶Xba Ⅰ酶切后进行PFGE试验,结果显示DNA片段得到较好的分离,可见大小不一的电泳条带,见图1。但菌株之间的相似性不高,同一血清型同源性也不高,其中2株肯塔基沙门菌同源性为62.96%,2株希林登沙门菌同源性为53.85%。
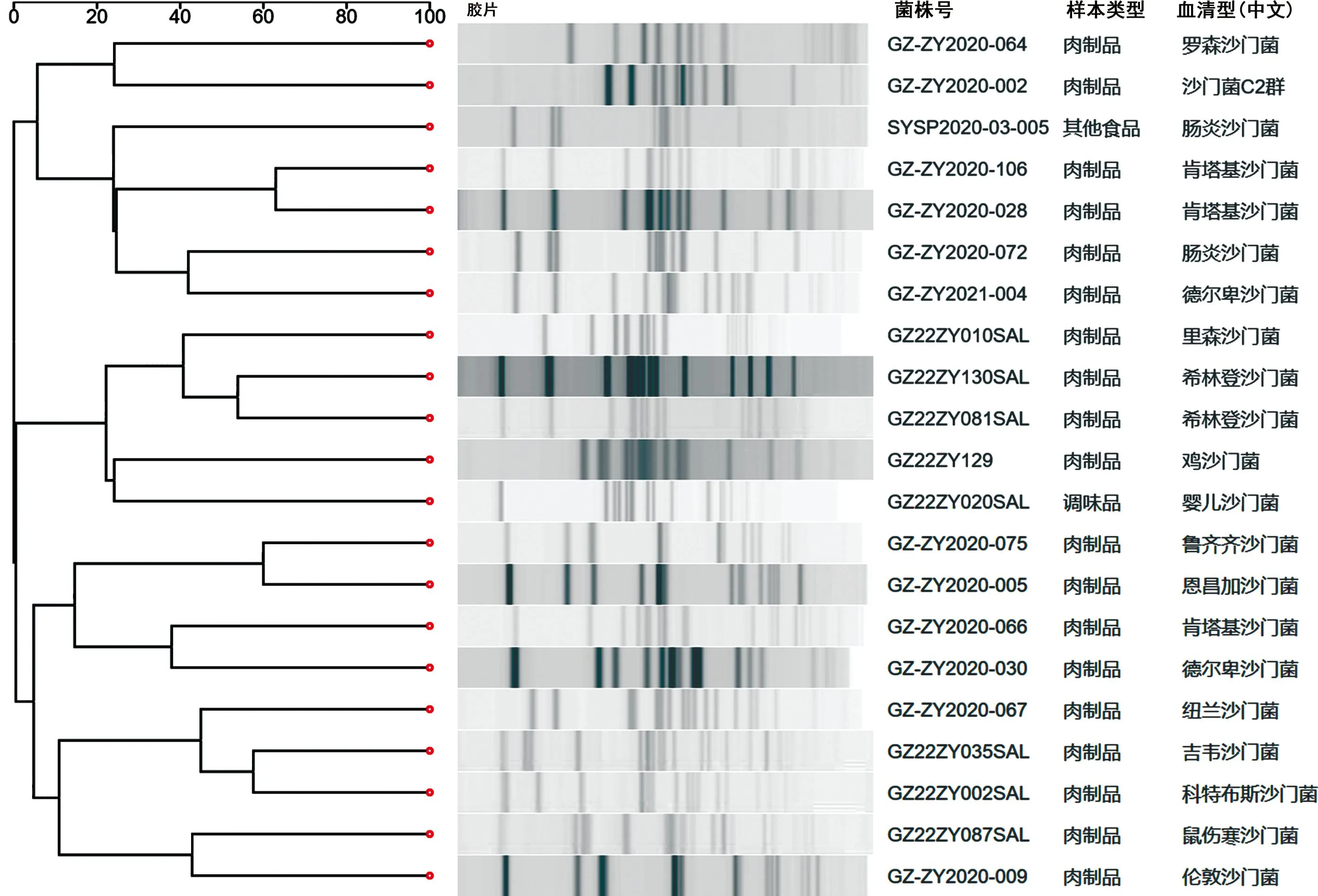
图1 21株食源性沙门菌PFGE聚类分析图谱
2.3药敏试验结果 药敏试验结果显示80.95%沙门菌对17种抗菌药物存在不同程度的耐药,见图2。多重耐药率达76.19%,其中1株吉韦沙门菌对10种抗菌药物耐药,1株希林登沙门菌对10种抗菌药物耐药,1株肯塔基沙门菌对11种抗菌药物耐药。多重耐药情况见表2。21株沙门菌对氨苄西林的耐药率最高,为71.43%,其次是四环素(61.90%)、复方磺胺甲噁唑(61.90%)、链霉素(57.14%)、氯霉素(52.38%),对头孢他啶/阿维巴坦、厄他培南、美罗培南、替加环素敏感率均为100%,对头孢噻肟和头孢他啶也表现出了一定的耐药性。

注:由于链霉素在体外可能表现为有活性,但临床治疗无效,目前M100标准里没有规定链霉素敏感耐药浓度,本文划分为S≤4,R≥3。

表2 21株沙门菌耐药谱
3 讨 论
沙门菌被列为首选控制的食源性致病菌,其引起的食源性疾病是危害人类健康的重大隐患[6]。研究显示,在世界范围内由沙门菌引起已确诊的患病人数显著增加,目前沙门菌每年导致欧洲有超过10万人患病,引起美国1 200万人感染、1.9万人住院甚至450人死亡[7],也是引发我国食物中毒的首要微生物。据资料统计,在我国细菌性食物中毒中,70%~80%是由沙门菌引起,而在引起沙门菌中毒的食品中,90%以上是肉类等动物性产品。遵义市近年来在食品中频繁检出沙门菌,且检出的沙门菌血清型复杂多样,导致遵义市近年来频繁发生一些由罕见血清型引起的腹泻病例或者食物中毒事件。因此本研究初步研究了2020-2022年分离的21株食源性沙门菌的分型及药敏试验结果,为社会防疫部门进行防疫和食物中毒患者的治疗提供理论依据。
沙门菌血清学分型种类繁多,达2 600多种血清型,在不同国家和地区的分布有差异性。在印度,鼠伤寒沙门菌、鸡沙门菌和肠炎沙门菌是最流行的血清型,占分离株的96.2%[8];在埃及,肠炎沙门菌和鼠伤寒沙门菌是最常见的血清型[9];在日本,肉鸡样本中仅存在婴儿沙门菌、曼哈顿沙门菌和胥伐成格隆沙门菌[10];在我国福建省、济南市、聊城市、成都市等地的腹泻标本中,鼠伤寒沙门菌和肠炎沙门菌均为优势血清型[11-14],而国内食源性疾病中沙门菌最常见的血清型是鼠伤寒、猪霍乱、都柏林、德尔卑、肠炎等沙门菌[15]。本研究中21株沙门菌来源于10个不同区县,共鉴定为16种血清型,分布于B、C、D、E群,种类重复率低,无地区特异性。PFGE试验结果显示,用限制性内切酶Xba Ⅰ酶切电泳后,DNA片段可得到了较好的分离,分离率达100%,但菌株之间的相似性不高,其中2株肯塔基沙门菌同源性为62.96%,2株希林登沙门菌同源性为53.85%。结果说明沙门菌PFGE型别与血清型之间的关联性并不明确,这与崔可琦等[16]报道的冰鲜鸡生产链中同种血清型沙门菌可分布在多个PFGE谱型内一致。以上结果提示遵义市食品中存在多种型别的沙门菌,食品中沙门菌污染源广泛、复杂多样,应加大对沙门菌的防治及监控力度。
虽然沙门菌病通常是一种自限性疾病[17],但该疾病可以全身性传播并退化为慢性疾病,如反应性关节炎、骨髓炎、心脏炎症或神经疾病[18]。氨苄西林、氯霉素和甲氧苄啶-磺胺甲噁唑是临床治疗沙门菌病的主要药物[3,19],但多年来由于抗菌药物的不合理使用,使得沙门菌对抗菌药物耐药现象越来越严重[20],并且存在多重耐药的问题。本研究21株沙门菌耐药率达80.95%,多重耐药率达76.19%,对青霉素类耐药率最高,对四环素和磺胺类抗菌药物耐药性强。这与我国沙门菌耐药趋势一致,现有研究数据显示其耐药机制为相关耐药基因tem、tet、sul分别通过编码β-内酰胺酶、外排泵和氢叶酸合成酶介导氨苄西林、四环素和磺胺类抗菌药物耐药。目前,临床应用头孢菌素类抗菌药物治疗细菌性感染较为普遍,本研究中部分菌株对于头孢他啶/头孢噻肟耐药现象不容忽视。针对头孢他啶/头孢噻肟的耐药研究,21世纪初美国科学家研究发现携带bla头孢菌素抗性基因的沙门菌在大洋洲、亚洲、非洲-中东和欧洲等地已经出现,其耐药机制还不明确,可能与bla基因突变诱导外排泵的过表达、外膜蛋白表达减少以及导致外膜蛋白丢失的基因突变有关[21]。除此之外本研究中存在1株吉韦沙门菌对10种抗菌药物耐药,1株希林登沙门菌对10种抗菌药物耐药,1株肯塔基沙门菌对11种抗菌药物耐药,其广泛的耐药现象需要进行深入研究。
本研究分析的沙门菌分离自2020-2022年食品风险监测项目标本,菌株量较低,还需增加菌株数才能得到更为准确的结论,为沙门菌病患者用药提供支持。但现有数据提示遵义市沙门菌污染源广泛,耐药现象严重,提示在各类食品生产和销售中都需要保持警惕和严格监管。
——贵州省遵义市绥阳县老年大学校歌
——遵义市春节联欢晚会

