不同交配型拟轮枝镰孢菌荧光蛋白标记菌株的构建*
张峰程,张 君,李 凡,郭 维
(1.云南农业大学 植物保护学院,云南 昆明 650201;2.中国农业科学院 农产品加工研究所,北京 100193;3.中国农业科学院 植物保护研究所,北京 100193)
玉米不仅是中国的主要粮食作物之一,也是重要的饲料原料和工业原料,在国民经济中发挥着重要作用。随着全球气候变暖、秸秆还田、栽培模式的改变和品种的更换,玉米病虫害在中国呈持续高发趋势,已成为制约中国玉米高产稳产的重要限制性因素之一[1]。玉米茎、穗腐病是一种在全球范围内普遍发生的病害,拟轮枝镰孢菌(Fusarium verticillioides)是引起该病害的主要病原菌之一,该菌可以在玉米整个生育期进行侵染。拟轮枝镰孢菌可以通过带菌种子或土壤中的病菌进入初生根,从地下部开始侵染,并向上进入植株茎基部[2-3];其分生孢子也可以通过气流到达花丝进而侵染玉米穗部,或落到叶鞘缝隙处侵染玉米茎节或叶鞘组织[4]。拟轮枝镰孢菌在造成玉米减产的同时还产生多种真菌毒素,在玉米生产、收获、储藏、加工和运输过程中持续为害,严重威胁粮饲安全。因此,了解拟轮枝镰孢菌侵染玉米的过程对玉米茎、穗腐病的防控具有重要意义。
绿色荧光蛋白(green fluorescent protein,GFP)和红色荧光蛋白(red fluorescent protein,RFP)是最常见的标记蛋白,RFP 变种mCherry 是一种作为示踪剂的红色荧光染料,它们均具有稳定、使用方便、无物种专一性、易于在活细胞中观察等优点。荧光蛋白标记技术已经广泛应用于生命科学研究的各个领域,如研究蛋白的定位及时空示踪、基因表达、微生物与寄主的相互作用等过程[5-7]。目前,荧光蛋白标记已经应用于研究尖孢镰孢菌(F.oxysporum)[8]、禾谷镰孢菌(F.graminearum)[9]、稻瘟菌(Magnaporthe oryzae)[10]、黄曲霉(Aspergillus flavus)[11]等病原菌的侵染过程和有性生殖等,但鲜有关于拟轮枝镰孢菌的研究。拟轮枝镰孢菌是异宗配合子囊菌,只有在2 种不同交配型(MAT-1和MAT-2)的菌株间才可以进行有性生殖[12-13]。因此,本研究通过聚乙二醇(polyethylene glycol,PEG)介导的原生质体转化法分别将eGFP和mCherry荧光蛋白基因导入到不同交配型的拟轮枝镰孢菌菌株FvLNF15-11 和Fv-SHF19-37 中,以期为研究拟轮枝镰孢菌的侵染过程、有性生殖和致病机制提供技术支持。
1 材料与方法
1.1 供试材料、试剂和仪器
1.1.1 供试材料
供试植物材料为对拟轮枝镰孢菌引起的玉米茎、穗腐病表现感病的玉米自交系B73 植株,种子由中国农业科学院作物科学研究所惠赠。供试拟轮枝镰孢菌菌株FvLNF15-11 和FvSHF19-37 分别分离自辽宁和上海采集的玉米病样;供试质粒包括pMD18T-TrpCP、pMD18T-TrpCT、pMD18-T-eGFP、pMD18T-mCherry 和pCOM;菌株和质粒均由农业农村部农产品质量安全收贮运管控重点实验室保存。
1.1.2 主要试剂
PCR 高保真DNA 聚合酶(P520-01)、胶回收试剂盒(DC301-01)、质粒小提试剂盒(DC201-01)和无缝克隆试剂盒(C113)均购自南京诺唯赞生物科技股份有限公司。供试溶菌肉汤培养基(luria-bertani medium,LB)、马铃薯葡萄糖琼脂培养基(potato dextrose agar medium,PDA)、酵母浸出粉胨葡萄糖培养基(yeast extract peptone dextrose medium,YEPD)、完全培养基(complete medium,CM)和胡萝卜琼脂培养基(carrot agar medium,CA)为微生物常用培养基,再生液体培养基(regeneration liquid medium,RLM)和再生琼脂培养基(regeneration agar medium,RAM)的配制参考RIDENOUR 等[14]的方法。试验所用引物由生工生物工程(上海)股份有限公司合成。
1.1.3 主要仪器
艾本德台式高速离心机(Eppendorf 5810 R);伯乐PCR 仪(C1000);北京六一琼脂糖水平电泳仪(DYCP-31DN);上海勤翔凝胶成像分析系统(GeneSons 2000);奥林巴斯光学显微镜(CX23);激光共聚焦显微镜(蔡司LSM 880)。
1.2 试验方法
1.2.1 拟轮枝镰孢菌交配类型鉴定
采用十六烷基三甲基溴化铵(hexadecyltrimethy ammonium bromide,CTAB)法提取菌株基因组[15],使用MAT-1基因座和MAT-2基因座特异性引物(表1)进行PCR 扩增以确定拟轮枝镰孢菌FvLNF15-11 和FvSHF19-37 的交配型[16]。

表1 本研究所使用的引物Tab.1 Primer sequences used in this study
1.2.2 重组质粒的构建和酶切
以质粒pMD18T-TrpCP 和pMD18T-TrpCT 为模板,通过引物TrpCPF/TrpCPR 和TrpCTF/Trp-CTR (表1)分别扩增构巢曲霉(A.nidulans)trpC基因启动子TrpCP 和终止子TrpCT 序列片段,利用无缝克隆的方法[17]将上述片段构建到质粒p-COM 中得到载体pCOM-TrpCP-TrpCT。以质粒pMD18T-eGFP 和pMD18T-mCherry 为模板,通过引物TeGFPF/TeGFPR 和TmCherryF/TmCherryR (表1)分别扩增eGFP和mCherry基因片段,利用无缝克隆的方法[17]将上述片段构建到pCOMTrpCP-TrpCT 载体,得到质粒pCOM-eGFP 和pCOM-mCherry,以G418 抗生素作为筛选标记。用限制性内切酶HindⅢ对质粒pCOM-eGFP 和pCOM-mCherry 进行酶切,使其线性化。
1.2.3 PEG 介导的拟轮枝镰孢菌原生质体转化
将从PDA 平板上收集到的拟轮枝镰孢菌分生孢子接种于YEPD 培养基中,摇培过夜使孢子萌发为幼殖体。2 500 r/min 离心5 min 收集幼殖体,用20 mL 0.7 mol/L NaCl 重悬和清洗幼殖体2 次,2 500 r/min 离心5 min 后弃上清;用10 mL 0.7 mol/L NaCl 重悬幼殖体,加入酶解液(0.1 g 溶壁酶和0.1 g 崩溃酶溶解于10 mL 0.7 mol/L Na-Cl 中) 10 mL,于28 ℃、150 r/min 条件下酶解3 h,然后在4 ℃、2 500 r/min 条件下离心5 min 收集原生质体;经预冷的0.7 mol/L NaCl 溶液重悬和清洗后,再用预冷的0.7 mol/L NaCl 溶液500 μL重悬原生质体。取HindⅢ线性化的质粒pCOMeGFP 和pCOM-mCherry 10 μL 分别加入100 μL FvLNF15-11 和FvSHF19-37 的原生质体中,冰上静置30 min 后加入40% PEG 溶液100 μL,室温放置20 min;加入RLM 培养基800 μL,在25 ℃、100 r/min 摇床中摇培过夜。将复壁后的溶液加到含有100 μg/mL G418 抗生素的RAM 培养基50 mL中,混匀后倒板,在25 ℃恒温培养箱培养2~4 d 后进行转化子筛选鉴定[14]。
1.2.4 转化子的验证及遗传稳定性
以转化子的基因组为模板,用eGFP基因、m-Cherry基因和抗性基因neo的特异性引物(表1)进行PCR 扩增以验证转化子,利用激光共聚焦显微镜对PCR 验证到的阳性转化子进行荧光检测;观察到荧光的转化子在无G418 抗生素的PDA 培养基上继代培养5 代,再转接到含有G418 抗生素的PDA 培养基上,观察菌株能否正常生长,以确认eGFP基因和mCherry基因在转化子中的遗传稳定性。
1.2.5 荧光标记菌株生长特性的观察
(1)菌落形态观察及生长速率测定
GFP 标记菌株FvLNF15-11-eGFP、mCherry标记菌株FvSHF19-37-mCherry 和相应的野生型菌株分别在PDA 培养基活化5 d,用直径为1 cm的吸头打边缘菌饼并转接到新的PDA 培养基上;在25 ℃培养箱黑暗培养6 d 后,在2 个垂直方向上测量菌落直径并拍照,每个处理重复3 次[18]。
(2)产孢量统计和孢子形态观察
用直径为1 cm 的吸头打1 个边缘菌落至1 mL ddH2O 中,旋涡振荡2 min,用血球计数板统计孢子数量并观察孢子形态,每个处理统计3 次[18]。
1.2.6 荧光标记菌株的致病性测定
(1)孢子悬浮液的制备
将待测菌株接种于CM 液体培养基中,于25 ℃、150 r/min 条件下摇培3 d,使用灭菌的3 层擦镜纸过滤菌液,收集分生孢子,用血球计数板计数并调节孢子悬浮液密度为1×106mL-1[18]。
(2)玉米茎秆的接种
玉米自交系B73 种子消毒后种植于温室,待玉米长到10 叶期时,挑选长势一致的玉米进行接种。用灭菌牙签在玉米第2、3 茎秆中间扎孔,用注射器接种孢子悬浮液,再用灭菌纱布包裹接种处,期间用ddH2O 保湿2 次;接种7 d 后,沿接种处纵向劈开玉米茎秆并拍照,利用ImageJ 统计病斑面积。以接种ddH2O 作为阴性对照,每个处理重复3 次[18]。
1.2.7 荧光标记菌株间的杂交及子囊壳产生情况
将菌株FvLNF15-11 和FvLNF15-11-eGFP 作为母本培养于CA 培养基,菌株SHF19-37 和SHF19-37-mCherry 作为父本培养于CM 固体培养基,于25 ℃条件下培养7 d 后,用2.5%吐温60冲洗父本菌株菌落并收集分生孢子,用血球计数板计数并调节孢子悬浮液密度为1×108mL-1。吸取父本孢子悬浮液1 mL 均匀涂布于母本菌株表面制成杂交平板,再将平板置于25 ℃、黑光灯条件下进行光照12 h/黑暗12 h 的循环诱导[13,19],培养4 周后观察子囊壳的产生情况。以FvLNF15-11 与FvSHF19-37 菌株的杂交结果作为对照,每个处理重复3 次。
2 结果与分析
2.1 拟轮枝镰孢菌的交配类型
由图1 可知:使用MAT-1基因座和MAT-2基因座特异性引物从菌株FvLNF15-11 和FvSHF19-37 的基因组中分别扩增出800 和250 bp 的片段,表明菌株FvLNF15-11 为MAT-2型,菌株FvSHF-19-37 为MAT-1型。

图1 野生型菌株FvLNF15-11 和FvSHF19-37 的交配类型Fig.1 Mating types of the wild-type strains FvLNF15-11 and FvSHF19-37
2.2 质粒的构建及转化子的筛选与鉴定
利用无缝克隆的方法成功构建了pCOM-eGFP 和pCOM-mCherry 载体(图2a)。通过PEG 介导的原生质体遗传转化后,利用eGFP基因和neo基因特异性引物从FvLNF15-11-eGFP 转化子中分别扩增出650 和795 bp 的片段(图2b~c);利用m-Cherry基因和neo基因特异性引物从FvSHF19-37-mCherry 转化子中分别扩增出711 和795 bp 的片段(图2d~e)。PCR 扩增的片段大小与预期一致,表明eGFP基因和mCherry基因已分别整合到FvLNF15-11 和FvSHF19-37 菌株的基因组中。

图2 质粒图谱及荧光标记转化子PCR 鉴定的电泳图Fig.2 Plasmid map and electrophoresis image for PCR identification of fluorescently labeled transformants
2.3 荧光标记菌株的荧光观察及遗传稳定性
荧光检测结果(图3)显示:菌株FvLNF15-11-eGFP 的分生孢子和菌丝中观察到绿色荧光,菌株FvSHF19-37-mCherry 的分生孢子和菌丝中观察到红色荧光,而野生型菌株中未观察到荧光,表明eGFP基因和mCherry基因在相应的菌株中成功表达。荧光标记菌株继代培养5 代后转接到含G418 抗生素的PDA 平板上继续培养,菌株能正常生长,表明eGFP基因和mCherry基因能够稳定遗传。
2.4 荧光标记菌株的生长特性
由图4 可知:荧光标记菌株的菌落形态、孢子形态、生长速率和产孢量与野生型菌株无明显差异,表明eGFP基因和mCherry基因的插入不影响荧光标记菌株FvLNF15-11-eGFP 和FvSHF19-37-mCherry 的生长发育。
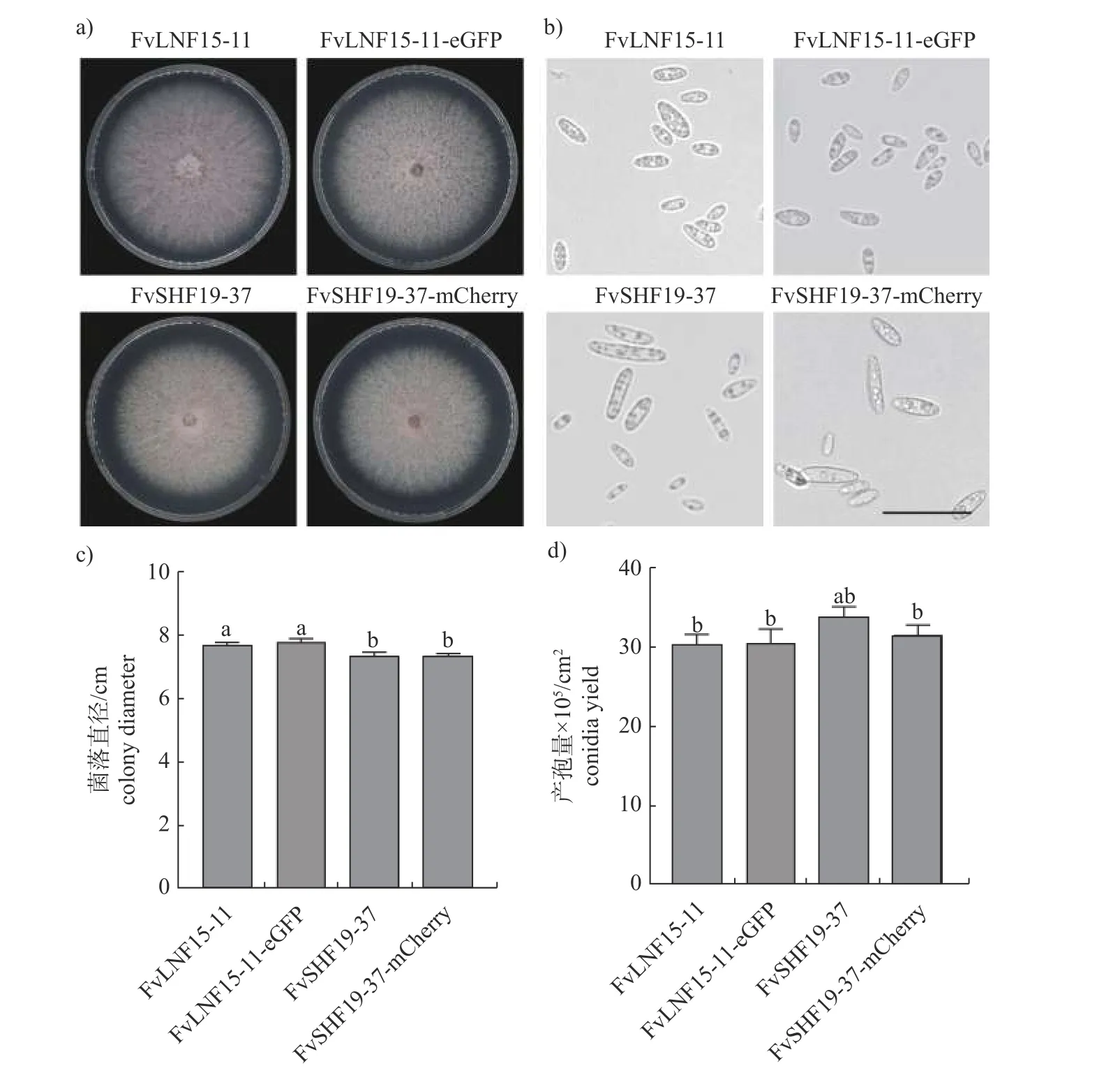
图4 荧光标记拟轮枝镰孢菌的生长特性Fig.4 Growth characteristics of fluorescently labeled F.verticillioides
2.5 荧光标记菌株的致病性
荧光标记菌株和野生型菌株接种玉米茎秆后,玉米茎秆组织均出现褐色病斑及腐烂,而接种无菌水的对照未观察到症状(图5a);荧光标记菌株的病斑面积与野生型菌株的病斑面积差异不显著(图5b),表明荧光标记菌株能侵染玉米并造成玉米茎腐病,且致病力与野生型菌株相似。

图5 荧光标记拟轮枝镰孢菌的致病性Fig.5 Pathogenicity of fluorescently labeled F.verticillioides
2.6 荧光标记菌株的有性生殖能力
由图6 可知:通过黑光灯诱导后,荧光标记菌株产生的子囊壳数量与野生型菌株相近,表明eGFP基因和mCherry基因不影响标记菌株FvLNF15-11-eGFP 和FvSHF19-37-mCherry 的有性生殖能力。

图6 荧光标记拟轮枝镰孢菌的有性生殖能力Fig.6 Sexual reproduction ability of fluorescently labeled F.verticillioides
3 讨论
荧光标记技术被广泛运用于研究病原菌的侵染过程、致病机制等[5-7],本研究通过PEG 介导的遗传转化方法成功构建了不同交配型拟轮枝镰孢菌的荧光标记菌株FvLNF15-11-eGFP 和FvSHF19-37-mCherry,eGFP和mCherry基因在相应菌株的菌丝和孢子中能稳定表达。在真菌的遗传转化中,外源基因随机整合到基因组中可能会影响真菌的生长发育[20],但本研究中荧光标记菌株的菌落形态和孢子形态与野生型菌株十分相似,且两者的生长速率和产孢量无明显差异,表明eGFP基因和mCherry基因不影响荧光标记菌株FvLNF15-11-eGFP 和FvSHF19-37-mCherry 的 生长发育,这与WU 等[21]的研究结果相似。由于镰孢菌通过有性生殖产生子囊孢子越冬完成病害循环[22],本研究对荧光标记菌株的有性生殖进行测定,结果显示荧光标记菌株产生的子囊壳数量与野生型菌株相近,表明eGFP基因和mCherry基因不影响荧光标记菌株FvLNF15-11-eGFP 和Fv-SHF19-37-mCherry 的有性生殖能力,这一结果与LUIS 等[11]的研究报道一致。本研究表明:接种拟轮枝镰孢菌后,玉米茎秆组织出现褐色病斑及腐烂的发病症状,且荧光标记菌株与野生型菌株的病斑面积差异并不显著,表明荧光标记菌株保持了与野生型菌株相似的致病力;GAI 等[23]研究显示:eGFP 标记的拟轮枝镰孢菌与野生型菌株对玉米病害病情指数的影响无明显差异,但eGFP 标记拟轮枝镰孢菌的毒力明显弱于野生型菌株,这可能是由于eGFP基因随机整合到基因组中影响某些功能基因的表达。因此,本研究构建的荧光标记菌株FvLNF15-11-eGFP 和FvSHF19-37-mCherry 可以更好地用于研究拟轮枝镰孢的侵染和有性生殖等过程。
4 结论
本研究通过PEG 介导的原生质体转化法成功将荧光蛋白基因eGFP和mCherry分别导入到不同交配型的拟轮枝镰孢菌中,获得带有荧光标记的FvLNF15-11-eGFP 和FvSHF19-37-mCherry 菌株。该荧光标记不会影响拟轮枝镰孢菌的生长发育、有性生殖以及致病力。研究结果为后续拟轮枝镰孢菌的侵染过程、有性生殖和致病机制研究提供了材料。

