葡萄汁有孢汉逊酵母与酿酒酵母共培养发酵野樱桃饮品研究
李婵媛,郑淼心,邹玉婷,贺紫涵,许碧涛,张 庆,*,秦 佳,田文强
(1.西华大学食品与生物工程学院,食品微生物四川省重点实验室,四川成都 610039;2.小金冰峰酒业有限公司,四川阿坝藏族羌族自治州 624200)
近年来,共培养发酵由于能够获得某些纯培养发酵无法获得的产物及提高产率等优点而成为研究热点[1-2],其在果汁饮品发酵中也同样受到关注,如Zhang 等[3]、易鑫等[4]利用酿酒酵母与植物乳杆菌分别共培养发酵了桑葚和柚子饮品,改善了酒体营养品质与感官特性。果酒发酵过程中发挥主要作用的是酿酒酵母(Saccharomyces cerevisiae)和非酿酒酵母(non-Saccharomyces cerevisiae)。酿酒酵母在发酵过程中主要负责酒精的生成,而非酿酒酵母在发酵过程中产生更多的单萜醇和乙酸酯等挥发性物质,对发酵饮品感官特征有积极贡献[5]。采用非酿酒酵母与酿酒酵母共培养发酵果汁,可以提高果汁发酵饮品的品质和感官。Hu 等[6]、Ge 等[7]、Li 等[8]分别利用了不同的非酿酒酵母与酿酒酵母共培养发酵果汁饮品,结果增加了饮品中挥发性物质含量,提高了感官品质等。
葡萄汁有孢汉逊酵母(Hanseniaspora uvarum)是一种非酿酒酵母,具有的高活性β-葡萄糖苷酶可以在发酵过程中产生丰富的乙酸酯类化合物,对增强产品风味特性及其复杂性方面有积极作用[9-10]。低醇果汁发酵饮品(酒精度<7% vol)因酒精含量低且含丰富的生物活性物质而备受欢迎[11],H.uvarum在生产低醇果汁发酵饮品方面有积极贡献。Mancic 等[12]利用H.uvarum与酿酒酵母共培养发酵葡萄汁,获得了酒精度5% vol 左右且香气馥郁的低醇葡萄酒;剧柠等[13]利用H.uvarum与酿酒酵母共培养发酵枸杞汁,制得酒精度7% vol 左右且感官和品质更佳的枸杞酒。
野樱桃,学名细齿樱桃(Cerasus serrulaFranch.Yu et Li),主要生长于高寒地区。野樱桃果实营养丰富,含多种生物活性成分,且不含农药残留,属于无公害果品,深受消费者喜爱。四川四姑娘山野樱桃资源丰富,但其精深加工产品少,开发发酵饮品可提高其附加值,提升川西高原特色水果发酵产业经济价值[14]。目前还未有利用葡萄汁有孢汉逊酵母与酿酒酵母共培养发酵四川四姑娘山野樱桃的研究。
本研究利用实验室前期从四川四姑娘山野樱桃发酵底泥中筛选出的一株H.uvarumYT-35,将其与商品化S.cerevisiae共培养酿造野樱桃发酵饮品,对发酵过程中的微生物数量、还原糖、乙醇等动态变化分析,利用高效液相色谱仪(HPLC)对有机酸进行动态检测,采用顶空固相微萃取/气相色谱-质谱(HSSPME/GC-MS)对发酵饮品的挥发性风味物质进行测定,以增加H.uvarum在实际生产中用于提高果汁发酵饮品品质和感官的可行性。
1 材料与方法
1.1 材料与仪器
野樱桃 采自四川省四姑娘山;葡萄汁有孢汉逊酵母YT-35(H.uvarumYT-35,NCBI 登录号为SUB12134304) 筛选于野樱桃自然发酵底泥 中国(成都)西华大学四川食品微生物学重点实验室保藏;商品化酿酒酵母(S.cerevisiae) 安琪酵母股份有限公司;柠檬酸、苹果酸、奎宁酸、冰醋酸 色谱纯,上海源叶生物科技有限公司;蛋白胨、酵母浸粉、葡萄糖、琼脂粉 分析纯,北京奥博星生物技术公司;磷酸二氢钾、氯化钙、氯化钾、硫酸镁、氯化铁、硫酸锰、溴甲酚绿 分析纯,成都化夏化学试剂有限公司。
2965 高效液相色谱仪 美国Waters 公司;GCMS2020NX 气相质谱联用仪 日本岛津公司;FluorMax20 酶标仪 中国上海闪谱生物科技有限公司;Allegra X-15R 冷冻离心机 美国贝克曼库尔特公司。
1.2 实验方法
1.2.1 野樱桃发酵饮品的酿造 参考 Hu 等[6]并加以修改,分别将酿酒酵母与H.uvarumYT-35 进行活化,再接种1×106CFU/mL 到100 mL 灭菌(巴氏灭菌法60 ℃,30 min)野樱桃汁(还原糖含量:150.3 g/L,pH=3.53)中单独发酵;将酿酒酵母与H.uvarumYT-35 以1:1 比例共接种1×106CFU/mL 到100 mL 灭菌野樱桃汁中进行共培养发酵。每组实验3 个平行,28 ℃静置发酵120 h。
培养基配制:YPD 培养基:酵母膏3 g,蛋白胨6 g,葡萄糖6 g,琼脂粉6 g 加水至300 mL,121 ℃灭菌15 min。
WL 鉴别培养基:葡萄糖15 g、蛋白胨1.5 g、酵母浸粉1.2 g、琼脂6 g,储液A(KH2PO45.5 g,KCl425 g,CaCl21.25 g,MgSO41.25 g,加水定容至400 mL,4 ℃保存)12 mL、储液B(FeCl30.25 g,MnSO40.25 g,加水定容至100 mL,4 ℃保存)0.3 mL、储液C(0.44 g 溴甲酚绿溶于10 mL 无菌水和10 mL 95%酒精中)0.3 mL,加水至300 mL,121 ℃灭菌15 min。
1.2.2 理化指标测定 菌落计数方法:采用WL 固体培养基进行平板菌落计数法[15]。
还原糖、乙醇含量的测定参照国标GB/T 15038-2006《葡萄酒、果酒通用分析方法》。
有机酸测定:参照卢倩文等[16]方法测定,并加以修改:Aminex HPX-87H 离子排阻色谱柱(300 mm×7.8 mm,9 μm),流动相:7 mmol/L 的硫酸溶液(pH=2.20),流速:0.6 mL/min,紫外检测波长:210 nm,柱温:60 ℃,进样量:20 μL。
1.2.3 挥发性物质测定 参照蔡婷等[17]对樱桃果酒挥发性物质的分析方法。样品预处理:取7.8 mL 发酵样品加入0.2 mL 稀释1×105倍的仲辛醇,置于15 mL 顶空瓶中,加入2 g NaCl,加盖密封,40 ℃恒温水浴中平衡10 min,将老化好的固相微萃取器(DVB/CAR/PDMS 三层复合自动探针,50/30 μm,1 cm)插在样品瓶上,吸附30 min 后拔出,插入气相色谱仪进样口,于220 ℃解吸3 min,进行GC-MS检测分析。气相色谱条件:色谱柱为DB-Wax(30 mm×0.25 mm×0.25 μm),进样温度为240 ℃。程序升温:初始温度50 ℃保持2 min。以3 ℃/min升至80 ℃保持10 min,以5 ℃/min 升至230 ℃保持6 min。载气为氦气,线速为1.0 mL/min,分流比5:1。质谱条件:电离方式为电子电离(Electron Ionization,EI)源,电子能量为70 eV,灯丝流量为0.20 mA,离子源温度为200 ℃,接口温度为250 ℃,扫描范围30.00~500.00 m/z。
定性:GC-MS 分析得到的质谱数据,通过NIST、Wiley 和香精香料标准谱库进行检索比对,进行定性分析(选取匹配度不低于80%的组分)。定量:采用内标法进行半定量分析,内标选用1-辛醇。
式中:CT是目标化合物T 的浓度,mg/L;AT是目标化合物T 的色谱峰面积;AI是内标物(1-辛醇)的色谱峰面积;CI是内标物(1-辛醇)的浓度,mg/L。
1.3 数据处理
利用Origin 2021、TBtools 软件进行数据处理,采用SPSS 26 软件进行数据统计分析,P<0.05 为差异显著。
2 结果与分析
2.1 发酵过程中微生物生长的变化
根据WL 鉴别培养基上菌落颜色和形态(如图1A,酿酒酵母为白色,圆形有凸起,H.uvarumYT-35 为淡绿色扁平状),可对发酵过程中微生物计数。
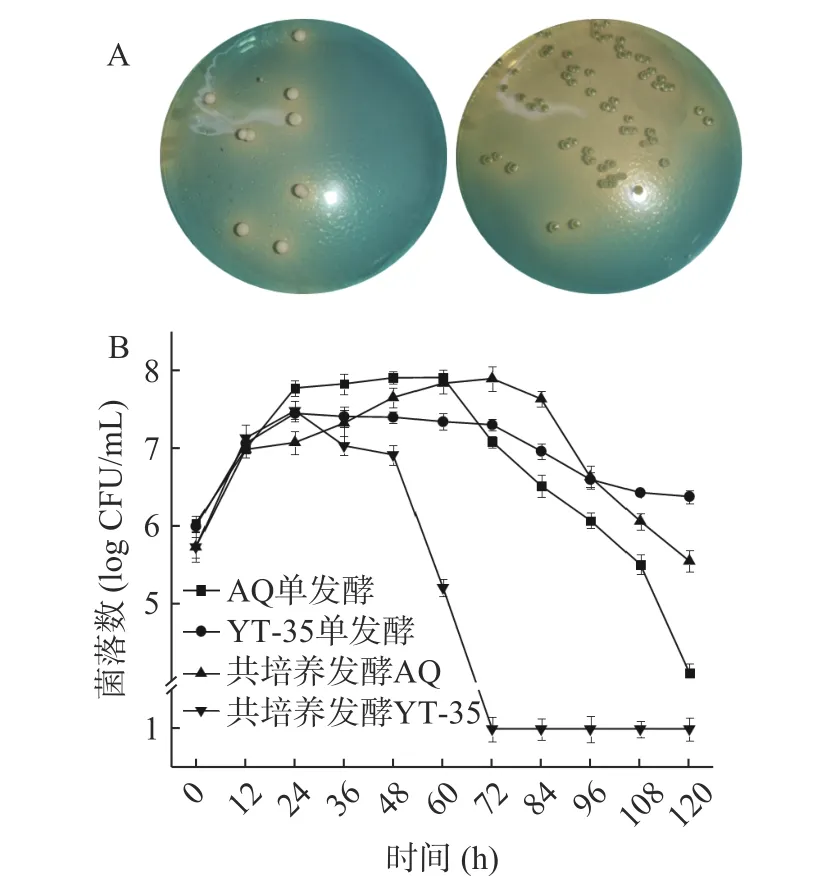
图1 商业酿酒酵母(左)和H. uvarum YT-35(右)在WL 培养基上的形态(A)及发酵过程中的菌落数变化(B)Fig.1 Morphology of commercial S. cerevisiae (left) and H.uvarum YT-35 (right) on WL medium (A) and changes in the number of colonies during fermentation (B)
发酵过程中微生物的生长变化如图1B 所示,酿酒酵母和H.uvarumYT-35 单独发酵的菌落均在24 h达到平稳期,72 h 进入衰亡期。共培养发酵中,H.uvarumYT-35 在前期占优势,在12~24 h 菌落数量超过酿酒酵母,24 h 时达到极大值3.0×107CFU/mL,48 h 之后H.uvarumYT-35 菌落数量迅速减少,在72 h 时H.uvarumYT-35 菌落数量<1×106CFU/mL;酿酒酵母菌落数量在72 h 时达到极大值约7.8×107CFU/mL,往后发酵过程中呈现快速下降趋势,直至发酵结束,种群数量约为3.6×105CFU/mL。
研究发现,在单一酵母菌发酵体系中,酵母菌菌落数量一般在48~72 h 便达到最大值,共培养体系中,非酿酒酵母在发酵前期占优势,随着发酵的进行而全部死亡,酿酒酵母活菌数变化趋势与其单独发酵趋势相似[10,18],可知共培养体系中酿酒酵母的生长受葡萄汁有孢汉逊酵母的影响较小。共培养体系中H.uvarumYT-35 在后期消失可能跟发酵过程中营养物质量减少、乙醇浓度增加和酸碱度变化有关。此外,酿酒酵母在发酵过程中会在细胞表面累积抗菌肽,通过胞间接触可能导致H.uvarumYT-35 数量急剧下降[19]。
2.2 发酵过程中还原糖和乙醇含量的变化
发酵过程中还原糖和乙醇含量的变化(图2)结果显示,3 种方式发酵过程中还原糖含量先下降后稳定而乙醇含量先增加后稳定。发酵结束后还原糖含量结果为酿酒酵母单发酵<共培养发酵<H.uvarumYT-35 单发酵,乙醇含量结果相反。共培养发酵还原糖含量减少速率和乙醇含量增加速率均介于酿酒酵母单发酵和H.uvarumYT-35 单发酵之间。研究表明[6],非酿酒酵母不能完全发酵,单菌株发酵通常导致饮品的残糖含量高、酒精度低。除此之外,非酿酒酵母菌体数量在前期大于酿酒酵母菌体数量,而前者还原糖消耗速率和乙醇积累速率低于后者[6,8],结合图1B 中共培养发酵的微生物群体演变规律及图2中还原糖变化趋势,可以发现,菌体数量的变化过程正是乙醇含量积累速率和还原糖消耗速率变化的直接原因。

图2 发酵过程中的还原糖和乙醇含量变化Fig.2 Changes in sugar and ethanol contents during fermentation
2.3 发酵过程中有机酸含量的变化
有机酸对果汁发酵饮品具有一定的抑制致病菌的作用,并能直接影响到饮品的总体品质评价[20]。通过对各组样品的有机酸含量检测(图3)可以看出,共培养发酵过程中柠檬酸、苹果酸的含量呈先上升后下降趋势,相较于酿酒酵母单发酵,共培养发酵过程中两者含量更少,这表明H.uvarumYT-35 可能在发酵体系中产生更少的柠檬酸、苹果酸,这可能是共培养发酵中柠檬酸、苹果酸含量减少的原因。降低果汁发酵饮品发酵过程中苹果酸、柠檬酸的含量有利于合成风味前体物质,可以更好地提高风味[21]。奎宁酸对果汁发酵饮品的口感有较大的影响[22],共培养的奎宁酸含量低于酿酒酵母单发酵,且H.uvarumYT-35 单发酵的奎宁酸含量在12 h 后降为0,这表明H.uvarumYT-35 对奎宁酸的生成有影响,H.uvarumYT-35 在共培养发酵体系中影响了奎宁酸的生成。冰醋酸可参与乙酸乙酯等酯类物质的生成,有利于提高成品芳香性[22],结果显示冰醋酸含量为缓慢增长,其中共培养发酵中冰醋酸含量最高。研究表明[23],部分非酿酒酵母可以有效降低果汁发酵饮品中的有机酸含量,改善产品的感官品质,H.uvarumYT-35 与酿酒酵母共培养发酵野樱桃饮品显示同样的结果。

图3 发酵过程中各有机酸含量的变化Fig.3 Changes in the content of organic acids during fermentation
2.4 发酵过程中挥发性物质含量的变化
通过对发酵结束后取得的样品进行HS-SPME/GC-MS 分析(表1),可知酿酒酵母单独发酵、H.uvarumYT-35 单独发酵、共培养发酵分别检测出36、47、44 种挥发性物质。较酿酒酵母单独发酵而言,共培养发酵可产生更多的酯类风味物质,如己酸乙酯、苯甲酸甲酯、辛酸异戊酯、肉桂酸甲酯、反式肉桂酸乙酯、十八酸乙酯、苯甲酸苄酯、乙酸异戊酯和邻苯二甲酸二异丁酯,同时可增强如月桂酸乙酯、辛酸乙酯、苯乙醇、苯甲醇、辛酸和月桂酸等风味物质的含量,赋予了野樱桃发酵饮品更丰富的香味。
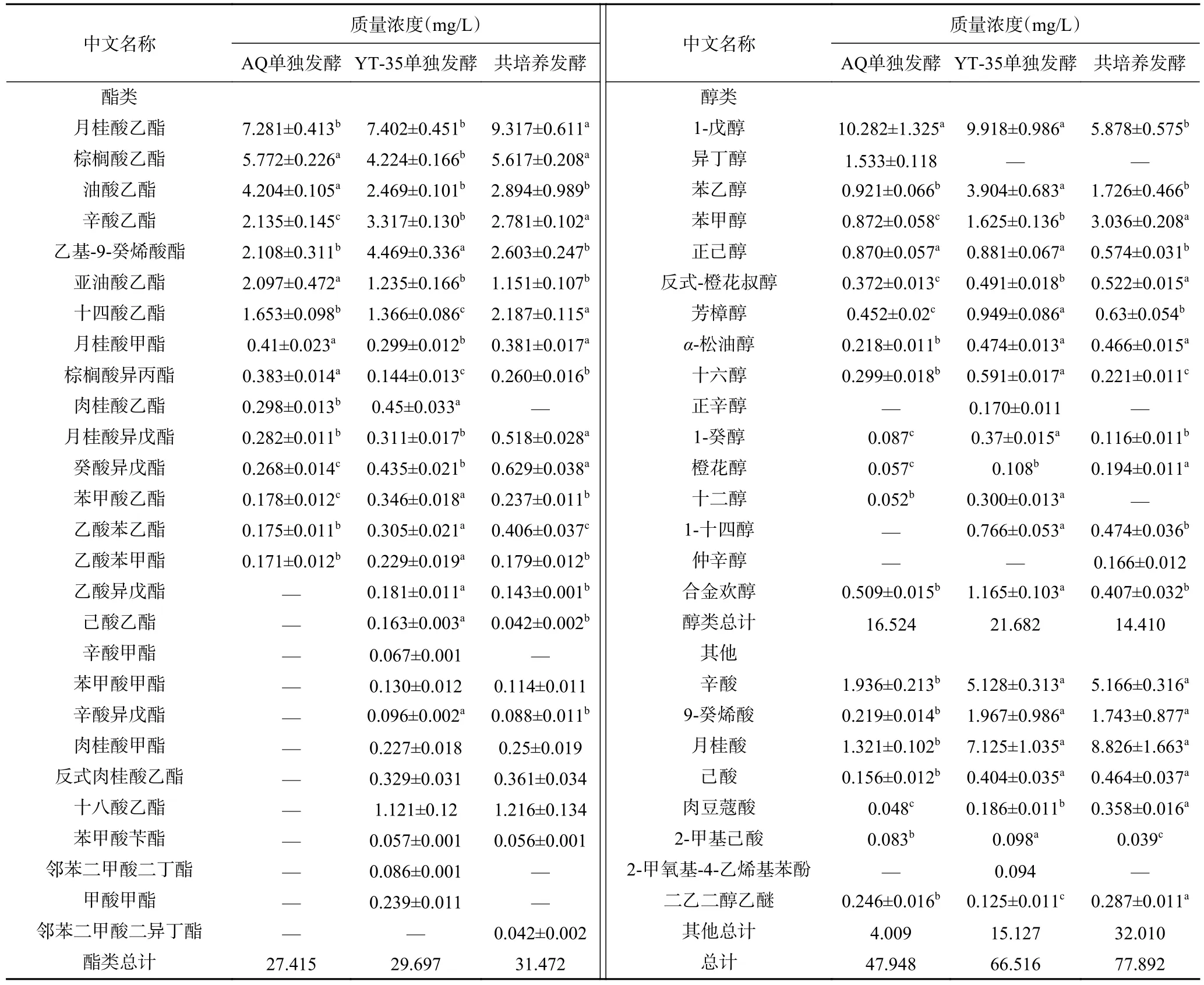
表1 樱桃发酵饮品主要挥发性酯类物质含量Table 1 Content of main volatile esters in cherry fermented beverage
2.4.1 酯类物质 酯类化合物对果酒的主体香型具有重要的作用,是构成果酒香气的重要物质[24]。酿酒酵母单独发酵对比,共培养发酵提高了月桂酸乙酯、十四酸乙酯、癸酸异戊酯等物质的含量,它们可使酒体产生水果、椰子、玫瑰等香气。甚至产生了酿酒酵母单独发酵没有的8 种酯类物质:己酸乙酯、苯甲酸甲酯、辛酸异戊酯、肉桂酸甲酯、反式肉桂酸乙酯、十八酸乙酯、苯甲酸苄酯、邻苯二甲酸二异丁酯,这些酯类大多呈现植物、水果香味,增加了产品香气的复杂性[25]。结果表明H.uvarumYT-35 的加入可以增加野樱桃发酵饮品的酯类含量,这点与Ge[7]等的研究结果类似。
2.4.2 醇类物质 较酿酒酵母单发酵而言,共培养提高了苯乙醇、苯甲醇、反式-橙花叔醇的含量。这些醇属于高级醇,是酒体重要的风味物质之一[24]。虽然高级醇能提高酒体风味,但若含量过高(>2 g/L),不仅会导致酒体风味变糟,甚至会对人体有毒害作用,其中对人体危害最大的是异戊醇和异丁醇[26-28]。酿酒酵母单发酵检出1.533 mg/L 的异丁醇,而共培养发酵中未检出异丁醇,这表明共培养发酵可以大幅度减少异丁醇的生成,降低发酵饮品对人体的伤害,此结果与Mancic 等[12]和剧柠[13]等的研究结果类似。
2.4.3 酸类、酚类、醚类 酸类、酚类、醚类挥发性风味物质含量较少,但它们对酒体的香味呈现也有重要的影响[24]。共培养发酵较酿酒酵母单发酵提高了辛酸、9-癸烯酸、月桂酸、己酸的含量,它们呈现果香、乳香等气味。仅在H.uvarumYT-35 单独发酵中检测到一种酚类,即2-甲氧基-4-乙烯基苯酚,其能散发出香辛料香。三组样品中均检测出了二乙二醇乙醚,该物质能散发令人愉快的气味,其中共培养的含量最高。
酯类物质是发酵饮品重要的香气物质,它们大多以无味的糖苷键结合态存在于水果中,包括单糖苷、双糖苷和三糖苷[29],糖苷键结合态挥发性物质在发酵过程中可通过β-葡萄糖苷酶和其他糖苷酶的共同作用释放,H.uvarum具有β-葡萄糖苷酶活性,这可能解释了H.uvarumYT-35 的加入使共培养发酵饮品酯类物质含量、种类增加的原因。结合2.2 发酵过程中还原糖和乙醇含量的变化可知,共培养体系中H.uvarumYT-35 可能将还原糖转化为其它物质,而非醇类物质[12-13],这可能是共培养发挥饮品中挥发性醇类物质含量较少的原因。
2.4.4 聚类分析 对发酵野樱桃饮品挥发性香气成分定量结果进行归一化,绘制聚类热图(图4),以展现不同发酵方式最终样品各芳香物质含量的差异及聚类过程。由图4 结果可知,H.uvarumYT-35 单独发酵和共培养发酵的挥发性香气成分总量较酿酒酵母单发酵更加丰富。聚类结果表明,H.uvarumYT-35 单发酵与共培养发酵为一类,说明两种发酵方式样品中挥发性物质较相近,酿酒酵母单发酵单独为一类,且与另两组靠近。由此可推断,共培养发酵挥发性香气成分总量更丰富与H.uvarumYT-35 相关,H.uvarumYT-35 的加入可以增加野樱桃发酵饮品的风味。
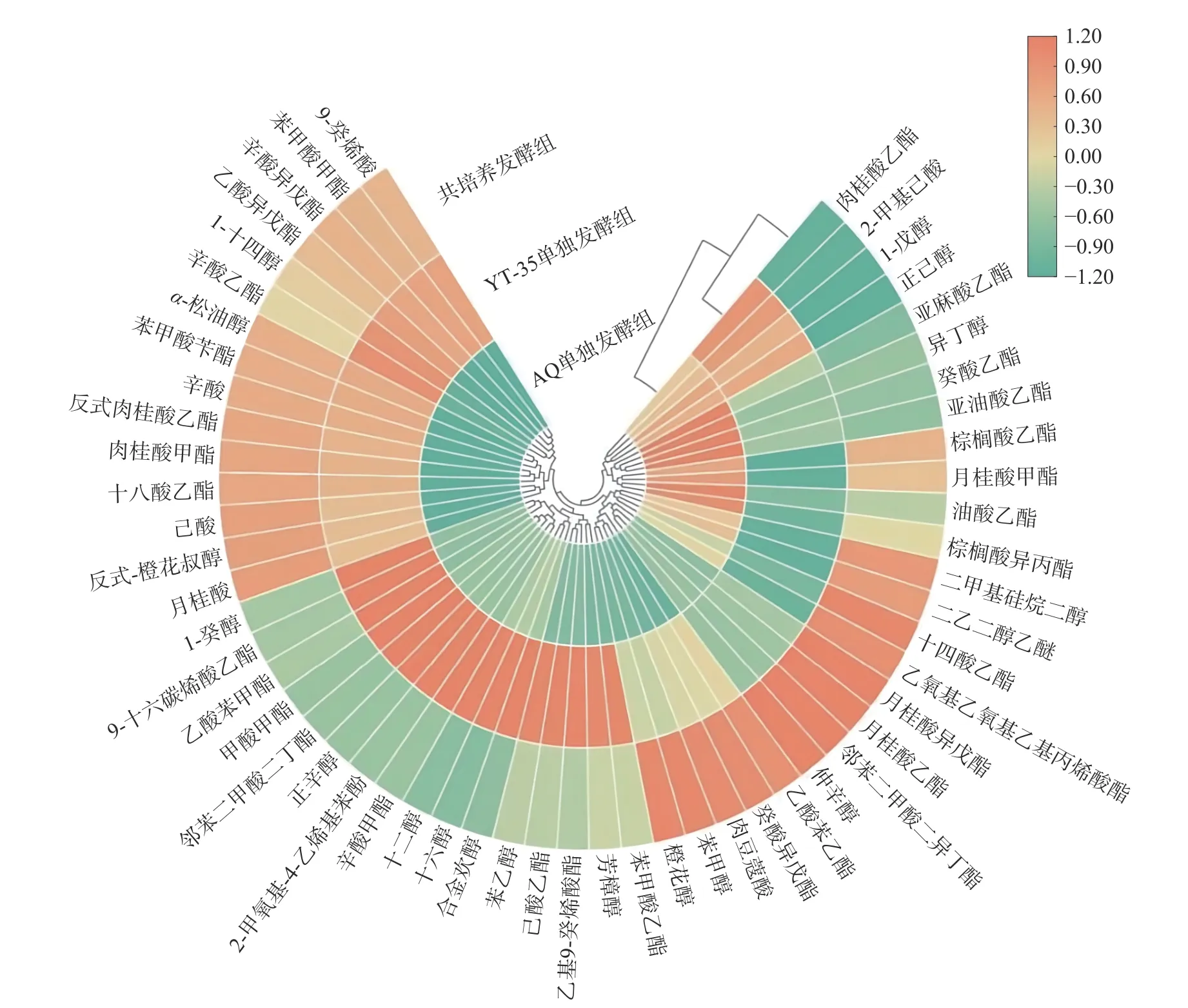
图4 樱桃发酵饮品挥发性芳香成分聚类热图Fig.4 Clustering heat map of volatile aromatic components in in cherry fermented beverage
3 结论
本研究以葡萄汁有孢汉逊酵母与商品化酿酒酵母共培养制备野樱桃发酵饮品,在共培养发酵过程中,H.uvarumYT-35 在发酵前期占优势;共培养发酵可降低乙醇含量,获得低醇发酵饮品,同时可降低柠檬酸、苹果酸和奎宁酸等有机酸含量。挥发性香气成分检测发现,共培养发酵可丰富酯类物质种类,增加如己酸乙酯、苯甲酸甲酯、辛酸异戊酯、肉桂酸甲酯、反式肉桂酸乙酯、十八酸乙酯、苯甲酸苄酯和邻苯二甲酸二异丁酯等,并可提高月桂酸乙酯、辛酸乙酯、苯乙醇、苯甲醇、辛酸和月桂酸等挥发性物质的含量。挥发性香气成分聚类分析也表明H.uvarumYT-35 可明显提升共发酵野樱桃饮品中的挥发性成分的种类及含量。研究表明H.uvarumYT-35 协同酿酒酵母可酿造出低醇且风味物质更为丰富的野樱桃饮品。后续将进一步对菌株H.uvarumYT-35 进行全基因组分析,并结合关键挥发性香气成分的代谢转变等探究其转化机理,旨在为果汁发酵饮品开发提供优质菌种资源。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).

