西洋参花多糖闪式提取工艺优化及抗氧化活性研究
康忠禹,赵大庆,姚佳婧,赵丽明,黄宝泰,刘 莉,*,齐 滨,*
(1.长春中医药大学,吉林省人参科学研究院,吉林长春 130117;2.长春中医药大学药学院,吉林长春 130117)
西洋参(Panax quinquefoliumL.)为五加科人参属多年生的草本植物,别名为花旗参、西洋人参等。具有补气养阴,清热生津的功效[1]。西洋参原产于加拿大和美国,最初是通过英法殖民地转运到东亚,之后传入中国。我国于20 世纪70 年代,在东北、华北等地引种栽培成功[2]。2020 年1 月,西洋参正式被纳入药食物质目录管理[3]。根部为西洋参药用部位,故其地上部分往往不被重视,所以研究相对较少。西洋参花为西洋参的花蕾,其主要成分包括皂苷类、黄酮类、木质素类、挥发油及多糖等[4-8]。刘雪莹等[9]研究表明西洋参花多糖具有免疫调节作用。在种植过程中,为保证其品质,往往要进行摘蕾处理,但研究表明西洋参地上部分花蕾和叶中总皂苷含量最多[10]。这表明西洋参花的研究对于西洋参产业的开发具有重要意义。
目前的报道多为对西洋参传统药用部位即根部多糖提取工艺的研究[11-14],而对于其非药用部位西洋参花多糖的提取工艺研究很少。闪式提取法是一种新型提取方法,其具有提取速度快、时间短等特点,现已广泛应用于多糖的提取[15-18]。因此本研究运用闪式提取法提取西洋参花粗多糖,利用Box-Behnken响应面试验,筛选出西洋参花多糖的最佳提取工艺。探讨其抗氧化活性,为西洋参花多糖的开发与利用提供理论基础。
1 材料与方法
1.1 材料与仪器
西洋参花 吉林省白山市西洋参种植基地,2022 年8 月份采收,批号:20220810-1;DPPH、抗坏血酸(VC)、邻二氮菲 分析纯,美国Sigma 公司;三氯乙酸、无水葡萄糖、铁氰化钾、苯酚、三氯化铁、无水乙醇、浓盐酸等 国产分析纯,北京化工厂。
FA1204B 电子天平 上海精密科学仪器有限公司;JHBE-50S 型闪式提取器 北京金鼎科技有限公司;UV-2550 紫外-可见分光光度计 日本岛津公司;Centrifuge 5804R 离心机 德国Eppendorf 公司;ALPHA 3-4 LSC basic 冻干机 德国CHRIST 公司。
1.2 实验方法
1.2.1 西洋参花粗多糖的闪式提取 西洋参花于45 ℃条件下烘干至恒重,粉碎成粉末过60 目筛,称取西洋参花粉末20 g,加入95%乙醇200 mL,于80 ℃条件下回流4 h,残渣烘干备用,取西洋参花残渣,加入闪式提取器中,以水为提取溶剂,根据单因素实验及响应面试验设计要求,设置提取电压、液料比、提取时间及提取次数。提取结束后抽滤,滤液减压浓缩至50 mL,sevage 法除蛋白三次,用无水乙醇调节至多糖溶液中乙醇体积分数为80%,4 ℃醇沉过夜,离心收集沉淀,烘干至其无醇味,适量蒸馏水溶解,冷冻干燥,即得西洋参花粗多糖[19]。
1.2.2 西洋参花多糖得率的测定
1.2.2.1 葡萄糖标准曲线的绘制 标准曲线绘制:称取无水葡萄糖10.00 mg,定容于100 mL 容量瓶中,分别移取0、0.2、0.4、0.6、0.8、1.0 mL 于玻璃试管中,分别加去离子水补足至1 mL,每个浓度重复三次。每只试管中加入0.5 mL 6%苯酚溶液及2.5 mL浓硫酸,迅速振荡,静置至室温,用紫外-可见分光光度仪检测样品在490 nm 处的吸光度,横坐标为葡萄糖浓度,纵坐标为吸光度,绘制葡萄糖标准曲线[20]。线性回归方程为:y=12.305x-0.0225,R2=0.9997。
西洋参花粗多糖含量的测定:取0.1 mg/mL 西洋参花粗多糖溶液,根据标准曲线测定步骤测定西洋参花粗多糖吸光度值,并根据标准曲线计算多糖浓度。
1.2.2.2 多糖得率的计算 多糖得率按照下式进行计算。
式中:C:样品中多糖浓度,g/mL;V:样品体积,mL;m:西洋参花质量,g。
1.2.3 单因素实验 根据1.2.1 的方法,称取西洋参花粉末20 g,以水为溶剂进行闪式提取,考察不同提取电压、液料比、提取时间及提取次数对西洋参花多糖得率的影响。进行单因素实验考察时,固定条件分别为:提取电压130 V、液料比30:1 mL/g、提取时间100 s、提取次数2 次。西洋参花多糖提取液经抽滤、减压浓缩、除蛋白、醇沉处理后得到粗多糖,采用1.2.2.1 中方法测定西洋参花多糖浓度。
1.2.4 响应面法优化西洋参花多糖提取 参考西洋参花多糖提取单因素实验结果,以西洋参花多糖得率为响应值,考察提取电压、液料比、提取时间三个因素对西洋参花多糖得率的影响,试验影响因素和水平见表1。

表1 响应面试验因素水平Table 1 Experimental factors and levels of response surface
1.2.5 西洋参花多糖抗氧化活性测定
1.2.5.1 西洋参花多糖对DPPH 自由基清除能力的测定 参照文献[21]中的方法测定西洋参花多糖对DPPH 自由基清除率:称量一定质量的西洋参花多糖样品以及水溶性VC,分别配制成0.1、0.4、0.8、1.2、1.6、2.0 mol/L 的样品溶液。准确量取1 mL 西洋参花多糖样品以及水溶性VC样品溶液于试管中,加入4.5 mL 0.1 mmol/L 的DPPH 溶液混合,避光反应30 min,515 nm 波长下测定西洋参花多糖样品以及水溶性VC的吸光度值。样品对DPPH 自由基的清除作用按以下公式计算:
式中:A0、A1、A2分别代表对照品、多糖样品、样品空白的吸光度值。
1.2.5.2 西洋参花多糖对羟基自由基清除能力的测定 西洋参花多糖对羟基自由基的清除率,采用邻二氮菲法进行测定[22]。取0.75 mmol/L 邻二氮菲溶液1 mL 和0.2 mol/L PBS 溶液(pH7.4)2 mL 于试管中,加入不同浓度样品溶液混匀,加入0.75 mmol/L FeSO4溶液1 mL 和0.025% H2O2溶液1 mL,混匀,37 ℃水浴反应1 h,536 nm 波长处测定吸光度值。1 mL 蒸馏水代替西洋参花多糖样品溶液作为空白对照组,1 mL 蒸馏水代替0.025% H2O2溶液作为样品对照组,西洋参花多糖样品对羟基自由基清除率的计算公式如下:
式中:A0、A1、A2分别代表空白对照组、多糖样品组、样品对照组的吸光度值。
1.2.5.3 西洋参花多糖总还原能力的测定 参照文献[23]中的方法,取1 mL 不同浓度的西洋参花多糖溶液,分别加入0.2 mol/L 磷酸盐缓冲溶液和1.0%铁氰化钾溶液各2.5 mL,迅速混匀,水浴50 ℃反应20 min,待溶液冷却至室温后,向试管中分别加入10%三氯乙酸溶液2.5 mL,离心取上清液2.5 mL,加入2.5 mL 蒸馏水和0.1%三氯化铁0.5 mL,混匀,测定其在700 nm 波长处吸光度值,以蒸馏水替代样品作为对照组,VC为阳性对照组,按照以下公式计算还原力:
式中:A1为样品吸光度值;A2为对照组吸光度值。
1.3 数据处理
所有西洋参花多糖的提取实验均重复三次。运用Design-Expert 8.0.6.1 软件对西洋参花多糖提取工艺数据进行分析,西洋参花多糖抗氧化活性分析绘图利用GraphPad prism 8.0.2 软件完成。
2 结果与分析
2.1 西洋参花多糖闪式提取单因素考察结果
2.1.1 提取电压对多糖得率的影响 由图1 可知,西洋参花多糖得率在提取电压为70~130 V 的范围内逐渐升高,分析其原因可能为随着电压升高,闪式提取器内剪切刀转速增快,剪切力增加,由于剪切力的影响,西洋参花多糖更易溶出[17]。但是当超过130 V时,多糖得率明显下降,可能原因为,随着电压增加,刀头转速加快,西洋参花颗粒过小,多糖被吸附在颗粒表面不易溶出,导致西洋参花多糖得率下降,因此选择110、130、150 V 电压进行后续试验[24]。

图1 提取电压对西洋参花多糖得率的影响Fig.1 Effect of extraction voltage on polysaccharides yield of American ginseng flower
2.1.2 液料比对多糖得率的影响 由图2 可知,当液料比从20:1 增加到30:1 时,西洋参花多糖得率明显增加,液料比为30:1 mL/g 时多糖得率最高。之后西洋参花多糖得率开始下降,可能是随着液料比比重的增加,影响了溶剂间的热传递,从而不利于多糖的溶出,导致西洋参花多糖得率下降,而当液料比过低时,多糖溶液的黏度过大,活性成分不易扩散,导致西洋参花多糖得率较低[25]。因此选择液料比20:1、30:1 和40:1 mL/g 作为响应面优化水平。

图2 液料比对西洋参花多糖得率的影响Fig.2 Effect of liquid to solid ratio on polysaccharides yield of American ginseng flower
2.1.3 提取时间对多糖得率的影响 由图3 可知,提取时间选择40~100 s,随着提取时间的增加,西洋参花多糖得率呈现上升趋势,提取时间为100 s 时得率最高,之后得率开始逐渐降低,分析可能原因为随着提取时间的延长,西洋参花多糖溶出增多,从而西洋参花多糖得率上升,但随着提取时间继续延长,闪式提取器内温度增加,从而使西洋参花多糖分解,因此选择80、100、120 s 进行后续试验[26]。
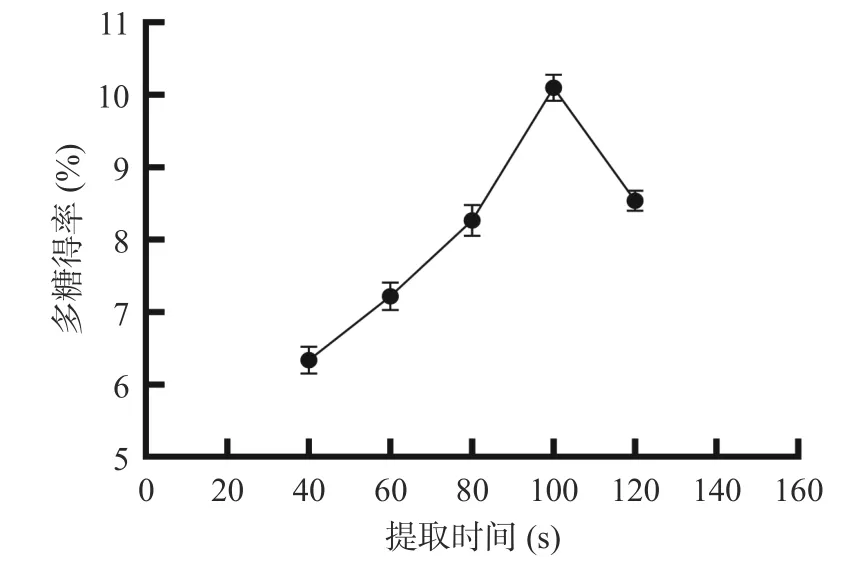
图3 提取时间对西洋参花多糖得率的影响Fig.3 Effect of extraction time on polysaccharides yield of American ginseng flower
2.1.4 提取次数对多糖得率的影响 由图4 可知,西洋参花多糖得率随提取次数增加呈上升趋势,当提取次数为2 次时西洋参花多糖得率趋于稳定。说明提取2 次时,西洋参花多糖已经基本提取完全。考虑时间及成本问题,最终选择2 次为最佳提取次数。

图4 提取次数对西洋参花多糖得率的影响Fig.4 Effect of extraction times on polysaccharides yield of American ginseng flower
2.2 响应面法优化西洋参花多糖提取工艺试验结果
2.2.1 试验设计方案及结果 参考闪式提取西洋参花多糖单因素实验结果,以闪式提取电压、液料比、提取时间为影响因素,设计Box-Behnken 试验,以西洋参花多糖得率为响应值。设计方案及结果见表2。
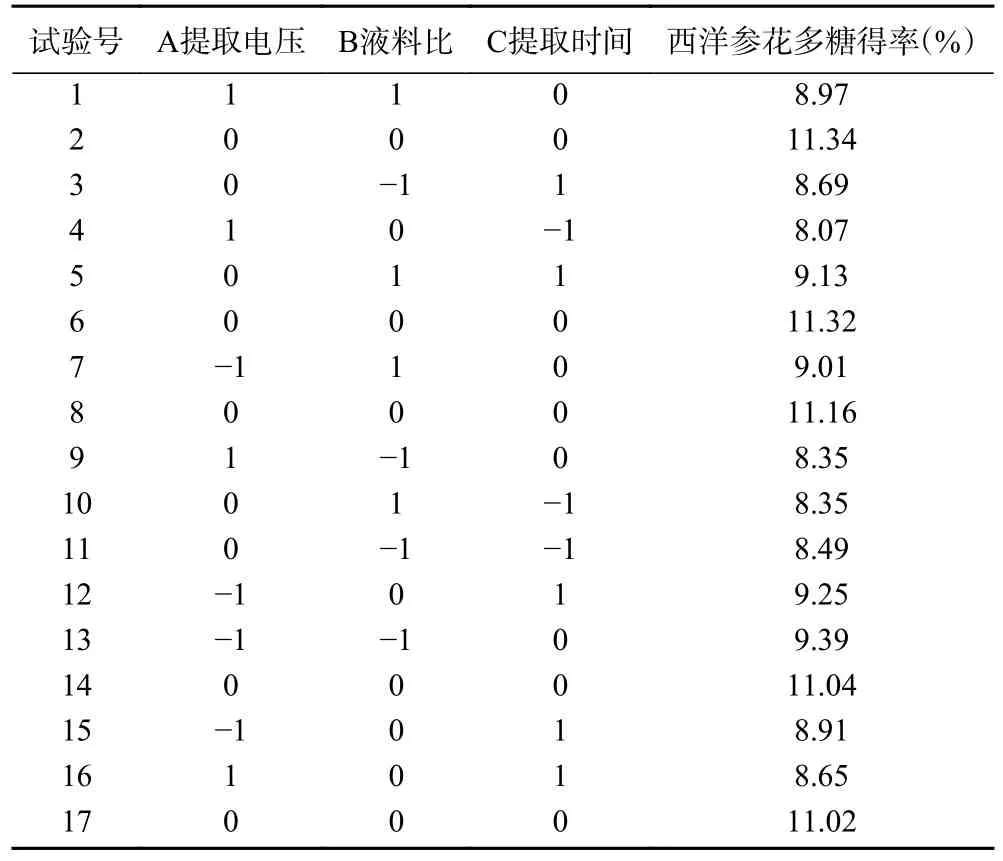
表2 响应面试验设计方案及结果Table 2 Design and test results of response surface methodology
2.2.2 回归模型的建立及分析 对表2 数据进行拟合,得到的二次多项回归方程为:多糖得率=11.18-0.27A+0.068B-0.24C+0.25AB-0.051AC-0.15BC-1.14A2-1.10B2-1.41C2。响应面回归模型方差分析结果见表3。
由表3 可以看出,该模型的P<0.01,表明响应值差异极显著,建模成功。三个考察因素对于西洋参花多糖得率的影响程度大小顺序为:提取电压>提取时间>液料比。失拟项P值为0.9906>0.05,说明模型拟合好,本试验不存在失拟因素。模型的决定系数R2=0.9933,调整决定系数R2adj=0.9874,说明所建立模型能够较好地确定关键影响因素,可以应用所建立的模型对西洋参花多糖进行提取工艺的优化,模型中一次项A、C 达到极显著(P<0.01),AB 达到显著水平(P<0.05),各因素的二次项对西洋参花多糖得率的影响均达到了极显著水平(P<0.01)。
2.2.3 响应面优化分析 由图5 可以看出,提取电压和液料比、提取电压和提取时间以及液料比和提取时间每两个因素的交互作用响应面图中曲面变化幅度均较大,且其等高线图均接近椭圆形,说明每两个因素的交互作用均对西洋参花多糖得率有影响。其中提取电压和液料比两因素的交互作用曲面幅度更大,等高线接近椭圆形更加明显,说明其对西洋参花多糖得率的影响也更加显著。
2.2.4 优化与验证实验 经响应面分析预测得到最佳提取条件为:提取电压:127.75 V,液料比:30.24:1 mL/g,提取时间:98.31 s,西洋参花多糖的得率为11.20%。根据实际情况,调整后的提取工艺条件为:提取电压:130 V,液料比:30:1 mL/g,提取时间:100 s。在调整后实验条件基础上,进行3 次工艺验证实验,得到西洋参花多糖得率为11.12%±0.23%。与预测值11.20%相差甚小,说明本模型可以较好地反映西洋参花多糖的提取过程,该工艺可靠合理。同时,与传统水煎煮提取西洋参花多糖相比较[9],多糖得率由5.72%提升至11.12%,多糖得率得到明显提升,应用闪式提取法也极大地缩短了提取时间,由此表明应用闪式提取法提取西洋参花多糖可用于指导实际生产和实验过程。
2.3 西洋参花多糖的抗氧化活性
2.3.1 DPPH 自由基清除能力 如图6 所示,当西洋参花多糖的浓度在0.1~1.6 mg/mL 范围内时,对DPPH 自由基的清除率随着西洋参花多糖浓度的增加而增强。但当西洋参花多糖浓度超过1.6 mg/mL时,曲线变缓,表明西洋参花多糖对DPPH 自由基的清除能力逐渐达到饱和。当西洋参花多糖浓度为2.0 mg/mL 时,其DPPH 自由基清除率达到最高值为61.48%。IC50值为1.34 mg/mL,与VC相比效果欠佳。但是与西洋参茎和叶相比,西洋参花多糖对DPPH 自由基的清除能力要强于西洋参茎和叶多糖对DPPH 自由基的清除能力[27]。

图6 西洋参花多糖的DPPH 自由基清除率Fig.6 DPPH free radical scavenging rate of American ginseng flower polysaccharides
2.3.2 羟基自由基清除能力 由图7 可知,西洋参花多糖对羟基自由基的清除效果随多糖浓度增加而不断增大,但随着西洋参花多糖浓度增高而逐渐变缓,当浓度为2.0 mg/mL 时,其对羟基自由基清除率达到最高值为60.01%,IC50值为1.42 mg/mL。但与VC相比效果仍欠佳。与西洋参茎和叶相比,西洋参花多糖对羟基自由基的清除能力要强于西洋参茎和叶多糖对羟基自由基的清除能力[27]。
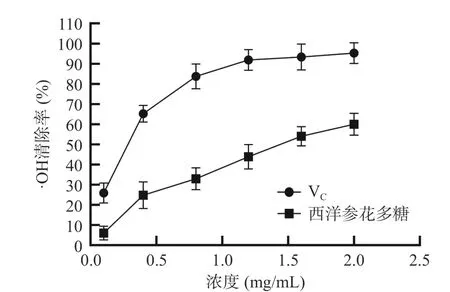
图7 西洋参花多糖的·OH 清除率Fig.7 ·OH scavenging rate of American ginseng flower polysaccharides
2.3.3 总还原能力 多糖分子中含有苷羟基,一定条件下可异变为羰基结构,因而具有一定还原性。如图8 所示,西洋参花多糖具有一定的还原力。当多糖浓度在0.1~2.0 mg/mL 时,其还原能力逐渐增强,但是仍然弱于VC。
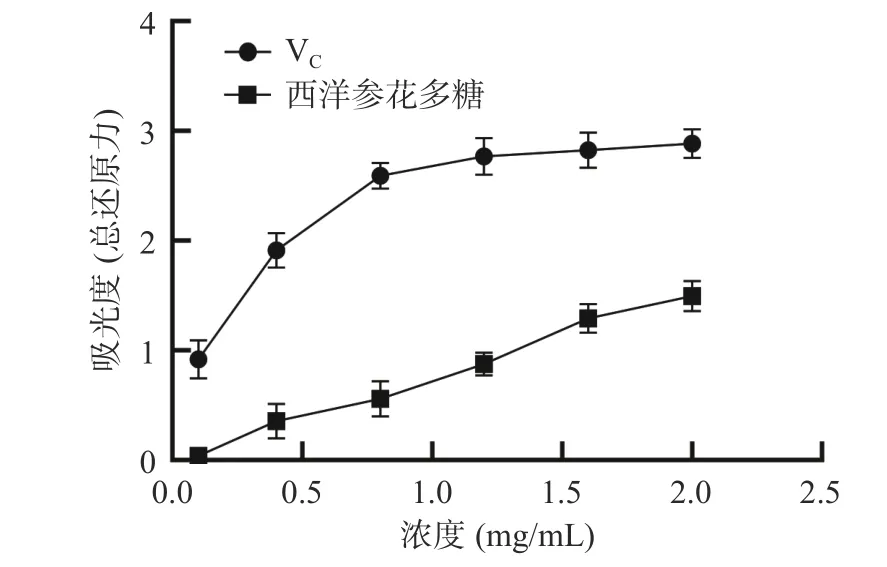
图8 西洋参花多糖总还原力的测定Fig.8 Determination of total reducing power of American ginseng flower polysaccharides
3 结论
本研究通过响应面法优化了闪式提取西洋参花多糖的最佳提取工艺,得到西洋参花多糖的最优提取工艺为:提取电压:130 V,液料比:30:1 mL/g,提取时间:100 s,同时在最优工艺的实验条件上进行了三次验证实验,最后得到多糖得率的平均值为11.12%±0.23%,与预测值接近。另外,西洋参花多糖对于DPPH 自由基、羟基自由基的清除以及总还原力都具有良好的效果,这说明西洋参花具有较好的抗氧化活性。西洋参花作为西洋参的非药用部位,对其的深入研究对于西洋参产业的开发和利用具有重要意义,本研究为西洋参花多糖的提取和活性研究提供了技术支持。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).

