桑黄总黄酮的提取、组分分析及其生物活性评价
付婷伟,周紫微,邵 颖,2,*,张 朋,宁晓雅,杨 洋,陈安徽,2
(1.徐州工程学院食品(生物)工程学院,江苏徐州 221111;2.江苏省食品资源开发与质量安全重点建设实验室,徐州工程学院,江苏徐州 221111;3.徐州天益食品科技研究院有限公司,江苏徐州 210009)
桑黄是多年生大型药用真菌,在分类学上属担子门Basidiomycota、蘑菇纲Agaricomycetes、锈革菌目Hymenochaetales、锈革菌科Hymenochaetaceae、桑黄孔菌属Sanghuangporus,俗称桑耳、胡孙眼等[1-4]。桑黄在我国的药用记载最早起源于《神农本草经》中的桑耳,与此同时桑黄的临床应用也表明其治病奇效与无毒属性。随后《药性论》、《本草纲目》、《本经逢原》中均对桑黄的活血止血、滋阴补肾等药用功效有所记载[5-7]。随着现代生物技术的不断发展,桑黄中的生物活性成分及其作用机制被深入探讨。大量研究表明,桑黄在预防或治疗肿瘤[8-9]、保护器官[10]、降血糖[11]、抑菌[12]、抗炎[13]、抗氧化[14]、提高免疫[15-17]等方面具有良好效果,因此桑黄因其天然的多重功效属性已成为国内外医药及保健领域研发的热点[18]。
桑黄中的主要活性成分包括多糖、黄酮、三萜、多酚及多种酶类等[19],而黄酮类物质防止细胞衰老、扩张血管、增强免疫及抗癌等重要的药理活性更是倍受关注[20]。目前,桑黄中黄酮的提取方式主要有超声辅助提取、微波提取、超临界萃取法等[21-24]。在不同的提取工艺及提取条件下,桑黄黄酮提取率间存在一定的偏差[25-27]。此外,桑黄种类繁多,不同种质及同种不同生长周期的桑黄中黄酮含量及组成会有不同,因此针对不同种桑黄其黄酮提取工艺也存在差别,但现有的诸多关于桑黄黄酮的提取工艺研究对象大多较为笼统。
桑黄中功能因子的提取、纯化工艺技术的发展可有效保障桑黄资源的高值化应用,促进桑黄产业发展。基于此,本研究以一年半生杨树桑黄为研究对象,对桑黄中总黄酮的提取工艺进行了优化,对提取出的总黄酮进行组分分析并对其抗氧化活性、降脂、降糖活性进行探讨,以期为桑黄资源在药品、保健品等领域的应用提供参考,也为桑黄的高值化精准开发应用提供依据。
1 材料与方法
1.1 材料与仪器
桑黄子实体 由通化承诚药业有限公司提供,为一年半生杨树桑黄;胰脂肪酶(250 U/mg) 上海麦克林生化科技有限公司;胆固醇 中国惠兴生化试剂有限公司;油酸、三油酸甘油酯 国药集团化学试剂有限公司;酚酞、水杨酸 天津市福晨化学试剂厂;聚乙烯醇 深圳市伯顺化工有限公司;芦丁 成都埃法生物科技有限公司;α-淀粉酶(10 U/mg) 山东隆科特酶制剂有限公司;DNS 显色剂 广州和为医药科技有限公司;阿卡波糖 酷尔化学科技(北京)有限公司;α-葡萄糖苷酶(50 U/mg)、对硝基苯基-α-D-吡喃葡萄糖苷 南京都莱生物技术有限公司;1,1-二苯基-2-三硝基苯肼(DPPH) 合肥巴斯夫生物科技有限公司;总胆固醇(totalcholesterol,TC)测定试剂盒 南京建成生物工程研究所;二氢杨梅素、花旗松素、香橙素、杨梅素、圣草酚、槲皮素、柚皮素、木犀草素、山奈酚、芹菜素 上海瀚香生物科技有限公司;其余试剂均为分析纯。
L550 电动离心机 湖南湘仪实验室仪器开发有限公司;TGL-16G 台式离心机 上海安亭科学仪器厂;KQ3200E 超声波清洗器 昆山市超声仪器;FA2104N 电子天平 上海精密科学仪器有限公司;BJ-400A 多功能粉碎机 永康市铂欧五金制品有限公司;SENCOR201L 旋转蒸发器 巩义市英峪予华仪器厂;TU-1810 紫外可见分光光度计 北京普析通用仪器有限责任公司。
1.2 实验方法
1.2.1 芦丁标准曲线的绘制及总黄酮含量测定 配制浓度为0.2 mg/mL 的芦丁标准溶液。分别吸取0、1.0、2.0、3.0、4.0、5.0 mL 芦丁标准溶液于试管中,各试管中分别加入30%乙醇溶液补至6 mL,摇匀。依次向试管中加入5%的亚硝酸钠溶液0.3 mL,混匀后放置5 min,再加入10%的硝酸铝溶液0.6 mL,混匀并静置5 min,再加入1 mol/L 的NaOH 溶液2 mL,混匀。最后用30%的乙醇将各管中溶液定容至10 mL,混匀。各管中溶液分别于510 nm 处测定吸光度。以标准溶液浓度(C)为横坐标,吸光度(A)为纵坐标,绘制芦丁的标准曲线。标准曲线回归方程为Y=9.95X+0.0024,决定系数R2=0.9994,说明样品浓度在0~0.10 mg/mL 范围内,浓度与吸光值间相关性良好。提取液测定吸光值后,代入回归方程,按照下式计算桑黄总黄酮的得率。
式中:C 为通过吸光值代入回归方程计算出的样品浓度(mg/mL);V 为测试样品体积(mL);N 为稀释倍数;W 为测试样品的质量(g)。
1.2.2 桑黄总黄酮提取工艺
1.2.2.1 提取时间对桑黄总黄酮得率的影响 桑黄子实体于50 ℃条件下烘干至恒重,粉碎后过80 目筛。准确称取1.0 g 桑黄子实体粉末5 份,按照1:40的固液比(质量体积比)加入70%乙醇,于50 ℃条件下分别水浴处理1、2、3、4、5 h,提取液于5000 r/min条件下离心10 min 后收集上清液,进行总黄酮得率测定。
1.2.2.2 固液比对桑黄总黄酮得率的影响 桑黄子实体于50 ℃条件下烘干至恒重,粉碎后过80 目筛。准确称取1.0 g 桑黄子实体粉末5 份,分别按照1:20、1:30、1:40、1:50、1:60 的固液比(质量体积比)加入70%乙醇,于50 ℃条件下水浴处理3 h,提取液于5000 r/min 条件下离心10 min 后收集上清液,进行总黄酮得率测定。
1.2.2.3 提取温度对桑黄总黄酮得率的影响 桑黄子实体于50 ℃条件下烘干至恒重,粉碎后过80 目筛。准确称取1.0 g 桑黄子实体粉末5 份,按照1:60的固液比(质量体积比)加入70%乙醇,分别于40、50、60、70、80 ℃条件下水浴处理3 h,提取液于5000 r/min 条件下离心10 min 后收集上清液,进行总黄酮得率测定。
1.2.2.4 Box-Behnken 试验设计及响应面分析 在单因素实验结果基础上,采用Box-Behnken 设计方案,以提取温度(A)、提取时间(B)、固液比(C)为考察因素,以桑黄总黄酮得率为响应值,使用Design-Expert 8.06 软件优化桑黄总黄酮的提取工艺参数。因素水平见表1。
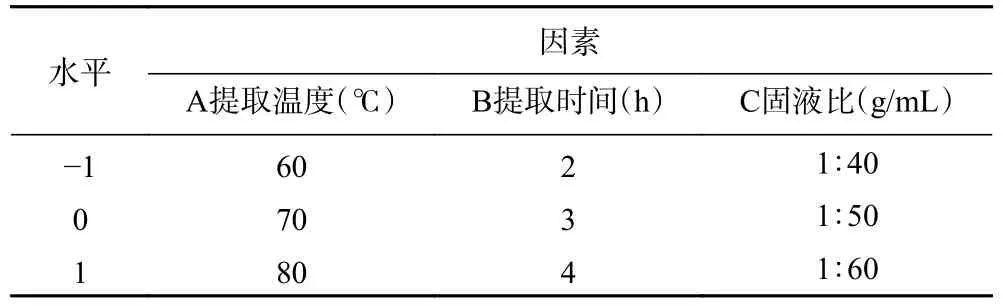
表1 响应面试验因素水平设计Table 1 Design of factor levels of response surface test
1.2.3 桑黄子实体中总黄酮的组分分析
1.2.3.1 黄酮标准品标准曲线的绘制 分别适量称取二氢杨梅素、花旗松素、香橙素、杨梅素、圣草酚、槲皮素、柚皮素、木犀草素、山奈酚、芹菜素标准品,置于10 mL 棕色容量瓶中,使用甲醇溶液溶解并摇匀使其定容配制成质量浓度为1000 mg/L 的标准储备溶液。再利用甲醇准确配制浓度为100 mg/L 的10 种标准品的中间标准储备溶液,再利用甲醇逐步稀释中间标准储备混合溶液,配制得到浓度为1、5、10、20、80 mg/L 的梯度标准溶液。
色谱条件为:色谱柱为 Thermo Syncronis C18(250×4.6 mm,5 µm);柱温35 ℃,流速1.0 mL/min,进样量5.0 μL。流动相A:甲醇;流动相B:1.0%冰乙酸溶液。梯度洗脱程序为:0~2.0 min,10%~15%A;2.0~8.5 min,15%~30% A;8.5~12.0 min,30%~85% A;12.0~14.0 min,85%~100% A;14.0~16.0 min,10% A。按照此色谱条件采用外标法进行HPLC 测定。以标准品质量浓度(mg/L)为X 轴,峰面积为Y 轴绘制10 种黄酮标准品的标准曲线。
1.2.3.2 组分分析与含量测定 称取桑黄子实体10 g,按照1:50 的质量体积比加入70%乙醇,于70 ℃条件下提取180 min 后于4000 r/min 条件下离心10 min收集上清液。上清液过0.22 μm 滤膜后进行高效液相色谱分析,以确定桑黄总黄酮中黄酮类化合物的组成及含量。
1.2.4 抗氧化活性测定
1.2.4.1 桑黄总黄酮对DPPH 自由基的清除能力测定 参照BETTY 等[28]的实验方法。准确量取2 mL不同质量浓度的待测试样于试管中,再添加2 mL 80%乙醇配制的浓度为0.1 mmol/L 的DPPH 溶液,摇匀后静置于阴凉暗处反应30 min。之后于6000 r/min 条件下离心10 min,收集上清。将上清液于517 nm 处测量吸光度。VC为阳性对照。DPPH自由基清除率按下式计算:
式中:A1为2 mL 总黄酮溶液+2 mL DPPH 的吸光值;A2为 2 mL 总黄酮溶液+2 mL 70%乙醇的吸光值;A3为 2 mL DPPH+2 mL 70%乙醇的吸光值。
1.2.4.2 桑黄总黄酮对羟基自由基(·OH)的清除能力测定 参照SMIRNOFF 等[29]的实验方法。量取不同浓度桑黄总黄酮样品各1 mL 于试管中,向其中添加6 mmol/L FeSO4溶液1 mL,充分摇匀。再加入6 mmol/L H2O2溶液1 mL,充分摇匀并放置10 min,之后再添加6 mmol/L 水杨酸1 mL,充分摇匀,于37 ℃下水浴反应30 min。反应后将反应混合液于3000 r/min 条件下离心10 min,收集上清液。上清液于510 nm 处测定吸光值。阴性对照组是以80%的乙醇代替桑黄总黄酮样品;空白对照组以蒸馏水代替水杨酸;VC作为阳性对照。羟基自由基(·OH)清除率按下式计算:
式中:Y0为阴性对照组吸光度值;Y1为桑黄总黄酮处理组吸光度值;Y2为空白对照组吸光度值。
1.2.5 桑黄总黄酮体外降脂活性
1.2.5.1 桑黄总黄酮对胰脂肪酶活性的影响 参考苏建辉[30]的方法并改进。准确吸取4 mL pH 为7.4 的磷酸缓冲液(0.025 mol/L)于烧杯中,再加入聚乙烯醇三油酸甘油酸酯乳化液4 mL 作为反应底物。烧杯于37 ℃保温10 min。之后准确吸取2 mL事先配制的不同浓度的总黄酮样品于烧杯中,再加入0.5 mg/mL 胰脂肪酶1 mL 静置反应15 min。反应结束后使用5 mL 95%的乙醇终止反应。用纯水替代样品液作为空白对照。
聚乙烯醇三油酸甘油酯乳化液:称取4 g 聚乙烯醇(PVA)于烧杯并加水80 mL 于沸水浴中溶解。冷却至室温后定容至100 mL。准确量取20 mL 并与10 mL 三油酸甘油酯混合均匀备用。
胰脂肪酶:用pH 为7.4 的磷酸缓冲液配制浓度为0.5 mg/mL 的胰脂肪酶溶液。胰脂肪酶酶活抑制率按照下式进行计算:
式中:X 为胰脂肪酶酶活抑制率;V0为空白对照组所消耗的NaOH 的体积(mL);V 为加入样品溶液的实验组所消耗的NaOH 的体积(mL)。
1.2.5.2 桑黄总黄酮对胆固醇胶束溶解度的影响参照KIRANA 等[31]的实验方法配制胆固醇胶束化溶液。称取0.0772 g 胆固醇于烧杯中,加入100 mL乙醚,搅拌至充分溶解。1 mL 胶束溶液中含有比例为10:2:5:132:15 的牛磺胆酸钠、胆固醇、油酸、NaCl、pH7.4 的磷酸缓冲液。蒸馏水替代桑黄总黄酮作为空白对照。分别向蒸馏水和桑黄总黄酮中添加胆固醇及胶束溶液,摇匀振荡并于37 ℃下反应60 min。反应结束后,于4000 r/min 条件下离心10 min,收集上清。按照总胆固醇测定试剂盒操作指南实施规范操作并计算结果。胆固醇胶束溶解度的抑制率按照下式进行计算:
式中:X 为对胆固醇胶束溶解度的抑制率;A 为空白溶液中的胆固醇溶解度(g/mL);B 为样品溶液中的胆固醇溶解度(g/mL)。
1.2.6 桑黄总黄酮降糖活性
1.2.6.1 桑黄总黄酮对α-葡萄糖苷酶的抑制活性参照赵文竹[32]的方法并改进,将5 μL 的α-葡萄糖苷酶溶液和不同浓度的桑黄总黄酮依次加入到620 μL浓度为0.1 mol/L 的磷酸钾缓冲溶液中,在37.5 ℃下预热20 min,然后向其加入10 μL 对硝基苯基葡萄糖苷(pNPG,浓度为10 mmol/L)作为反应底物,以启动反应,于37.5 ℃条件下反应30 min,最后加入650 μL 浓度为1 mol/L 的Na2CO3终止反应,并在410 nm 处测定。以阿卡波糖为阳性对照,以蒸馏水为空白对照。α-葡萄糖苷酶抑制率的计算公式如下:
式中:E1为空白对照组的吸光值;E2为总黄酮组的吸光值。
1.2.6.2 桑黄总黄酮对α-淀粉酶的抑制活性 参照於雨蝶等[33]的方法并改进。将10 μLα-淀粉酶水溶液(1 U/L)与10 μL 不同质量浓度的桑黄总黄酮混合后预热15 min,并向其加入500 μL 质量分数为1%的淀粉溶液(溶解于pH 为6.9 的磷酸钠缓冲溶液)以启动反应。反应启动后,于37.5 ℃条件下反应5 min 后,向其中滴加600 μL DNS 试剂以终止反应。反应结束后,将反应混合物置于沸水浴中保温15 min,冷却至室温后,于540 nm 处测定吸光值。以阿卡波糖为阳性对照,以蒸馏水为空白对照。α-淀粉酶抑制率的计算公式如下:
式中:L1为空白对照组的吸光值;L2为总黄酮组的吸光值。
1.3 数据处理
实验重复3 次;实验数据使用SPSS 24.0 处理软件进行分析,结果采用平均值±标准差表示;绘图采用 Origin 2023 软件绘制;IC50值为曲线增长阶段拟合线性方程后计算获得。
2 结果与分析
2.1 桑黄总黄酮提取工艺优化
2.1.1 桑黄总黄酮提取时间的确定 提取时间对桑黄总黄酮提取的影响如图1 所示。由图1 可知,随着浸提时间的延长桑黄总黄酮不断浸出,其得率逐渐升高,在提取时间为3 h 时,桑黄中总黄酮的得率最高为2.03%±0.06%,显著高于其他提取条件下的总黄酮得率(P<0.05)。但继续延长提取时间,总黄酮得率反而下降,这可能与提取溶剂挥发致使溶剂量减少有关。总黄酮的最佳提取时间选择为3 h。

图1 提取时间对桑黄总黄酮得率的影响Fig.1 Effect of extraction time on the yield of total flavonoids from Phellinus igniarius
2.1.2 提取固液比的确定 固液比会对桑黄中黄酮类物质的提取产生影响。考察了不同固液比对桑黄中总黄酮提取的影响,结果见图2。

图2 固液比对桑黄总黄酮得率的影响Fig.2 Effect of solid-to-liquid ratio on the yield of total flavonoids from Phellinus igniarius
由图2 可以看出,使用提取溶剂越多桑黄总黄酮得率越高,在固液比为1:50 时总黄酮得率达到最大值为2.44%±0.04%,随后得率呈下降趋势,可能在固液比1:50 的条件下总黄酮的溶出量达到较高的水平,当提取溶剂使用量提高后却不利于已溶出黄酮对未浸出黄酮的协同作用,反而不利于协同浸提,导致总黄酮得率降低。所以选择最佳固液比为1:50。
2.1.3 提取温度的确定 考察了提取温度对桑黄总黄酮提取的影响。结果如图3 所示。

图3 提取温度对桑黄总黄酮得率的影响Fig.3 Effect of extraction temperature on the yield of total flavonoids from Phellinus igniarius
由图3 可知,桑黄中总黄酮得率会随着提取温度的提高而增加,在提取温度为70 ℃时得率最高达到2.52%±0.04%。但当提取温度超过70 ℃后得率显著降低(P<0.05),这可能与高温引起黄酮类物质变性有一定的关系;此外,提取溶剂乙醇在提取温度过高时因为过度挥发减少也会引起得率的降低。因此,选择最优提取温度为70 ℃。
2.1.4 响应面试验设计及结果 以桑黄总黄酮得率为响应值,采用Box-Behnken 设计方案优化了桑黄总黄酮的提取工艺。试验设计及结果见表2,方差分析结果见表3。利用Design Expert 8.06 软件对表中数据进行分析,得到响应值对几个自变量的回归方程为总黄酮得率=2.61+0.14A+0.096B+0.050C-0.090 AB-0.053AC-0.032BC-0.19A2-0.25B2-0.085C2。
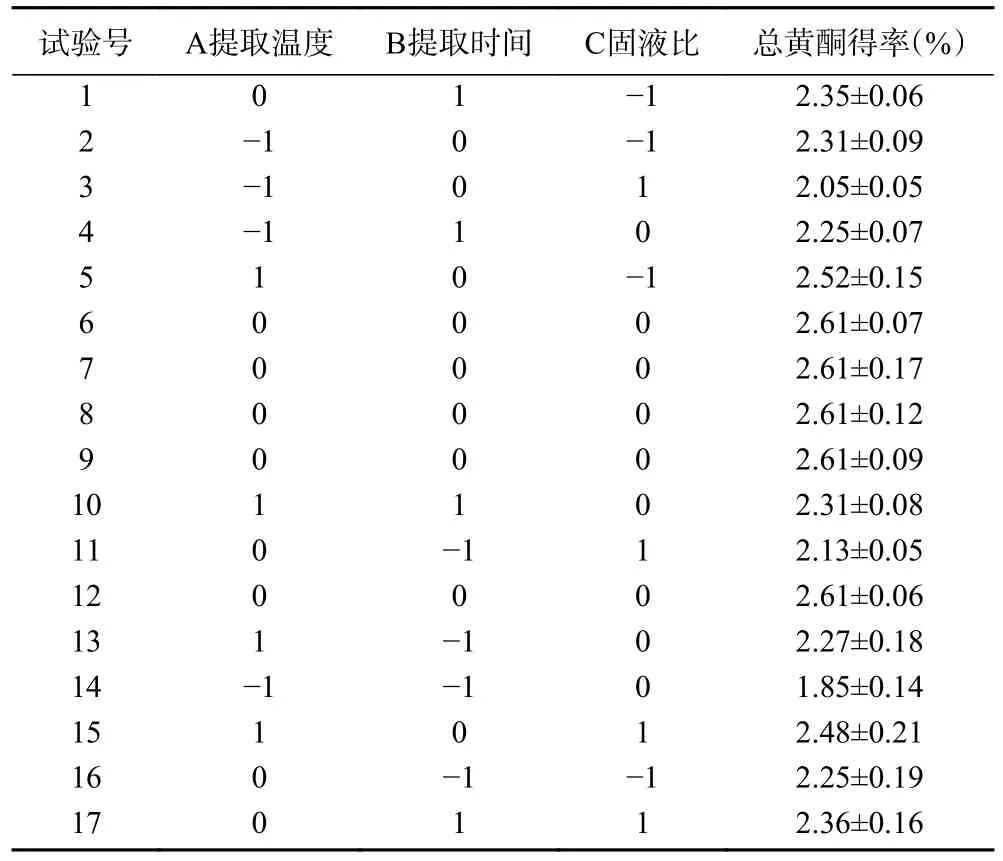
表2 Box-Behnken 响应面设计及其结果Table 2 Box-Behnken response surface design arrangement and experimental results
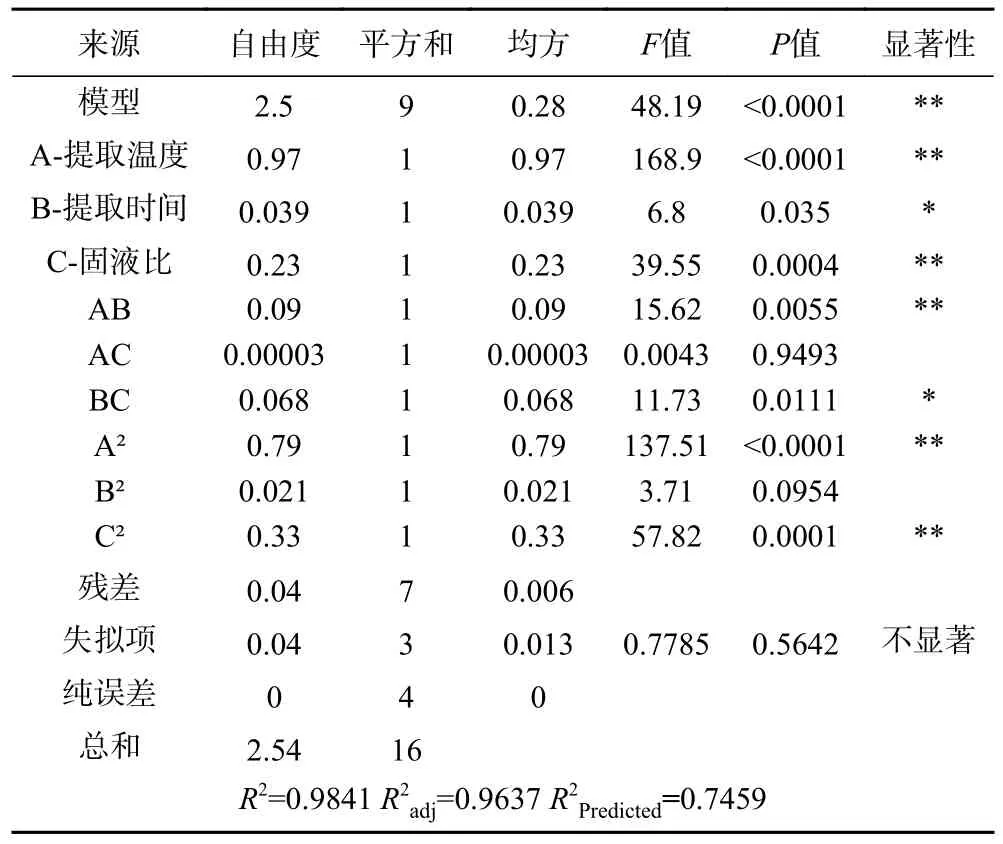
表3 方差分析Table 3 Analysis of variance
由方差分析结果可知,该回归模型极显著(P<0.01),表明试验值与预测值显著相关(R2=0.9841,R2adj=0.9637),模型与试验拟合良好,该模型可以反映桑黄总黄酮得率的预测及分析。由表3 还可以发现自变量对响应值的影响程度,其影响大小排序依次为提取温度(A)>固液比(C)>提取时间(B),其中因素A、C 和AB 间的交互作用对桑黄总黄酮得率的影响达到极显著水平(P<0.01),因素B 和BC 的交互作用对总黄酮得率的影响显著(P<0.05)。由图4可知,AB、BC 的响应曲面较为陡峭,说明提取温度和提取时间间的交互作用与提取时间与固液比的交互作用显著,而AC 曲面弯曲程度较小,因此提取温度和固液比之间的交互作用不显著,这与表3 方差分析结果一致。
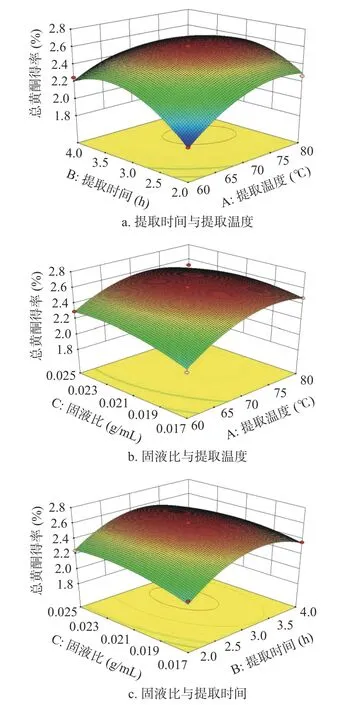
图4 两两因素交互作用对桑黄总黄酮得率影响的响应面图Fig.4 Response surface diagram of the interaction of two factors on the yield of total flavonoids from Phellinus igniarius
使用软件分析,桑黄总黄酮的最优提取参数为:提取温度73.24 ℃、固液比1:45.46 g/mL、提取时间3.12 h,此条件下桑黄总黄酮得率为2.64%。经综合考虑,修正提取参数为:提取温度73 ℃、固液比1:50 g/mL、提取时间3 h。经验证,此条件下总黄酮得率为2.68%。预测值与实际值间的相对偏差为-0.02,说明可以使用该模型预测桑黄总黄酮的得率。
2.2 桑黄总黄酮组分分析
2.2.1 黄酮标准品标准曲线的绘制 采用1.2.3.1 的方法对10 种黄酮标样进行了标准曲线绘制,混合标样色谱图如图5 所示。10 种标准品的回归方程如表4 所示。
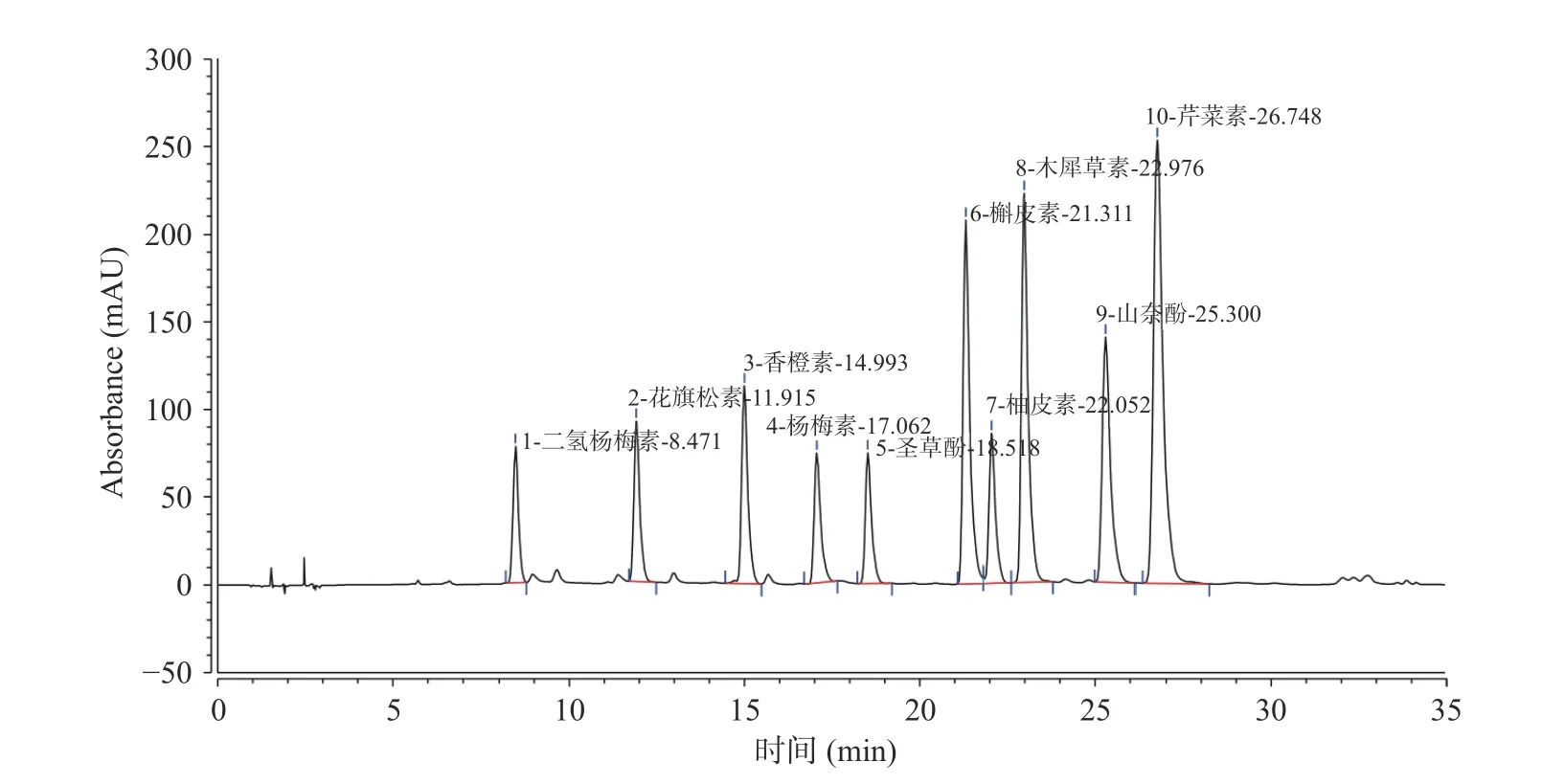
图5 黄酮混合标样色谱图Fig.5 Chromatographic diagram of flavonoids mixed standard samples
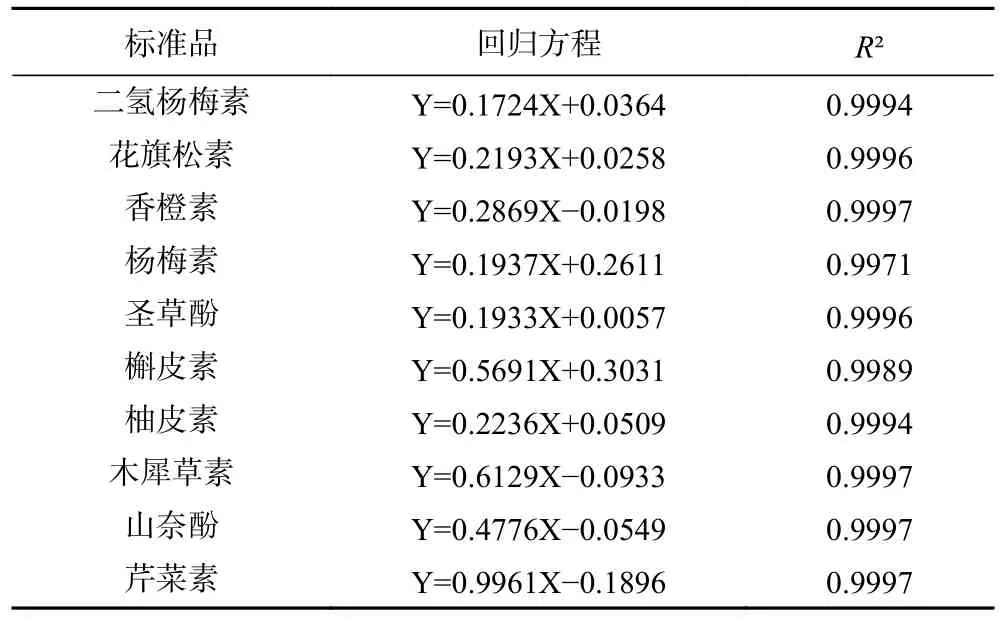
表4 黄酮标准品的回归方程Table 4 Regression equation of flavonoid standard products
图5 和表4 的结果显示,10 种黄酮标准品在该色谱条件下实现了良好分离。以标准品质量浓度为横坐标,峰面积为纵坐标得到各黄酮标准品的线性回归方程的相关系数均达到0.997 以上,标准品质量浓度与峰面积呈现良好的线性关系,因此在测定样品时即可根据峰面积通过以上关系定量分析样品中黄酮类组分的含量。
2.2.2 桑黄总黄酮组分测定 桑黄总黄酮提取液在
1.2.3.2 的色谱条件下进行高效液相色谱检测,测定结果如表5 所示。
由表5 的实验结果可知,在供试的10 种黄酮标准品中,桑黄总黄酮中仅含有花旗松素、槲皮素和山奈酚3 种组分,其中花旗松素是桑黄总黄酮中的主要成分,其含量最多达到3727.31 mg/kg,显著高于槲皮素和山奈酚的含量。
2.3 桑黄总黄酮生物学活性分析
2.3.1 桑黄总黄酮的抗氧化活性
2.3.1.1 桑黄总黄酮的DPPH 自由基清除活性 以VC为阳性对照,对桑黄总黄酮不同质量浓度的样品进行了DPPH 自由基清除活性测定。实验结果如图6 所示。
由图6 可知,桑黄总黄酮具有一定的DPPH 自由基清除活性。随着桑黄总黄酮浓度的增加,其DPPH 自由基清除活性逐渐增强,在浓度为14 μg/mL时清除率达到最大值为58.63%±0.45%,随后清除率又呈现出下降趋势。桑黄总黄酮对DPPH 自由基清除率的IC50为13.33 μg/mL,阳性对照VC的IC50为8.15 μg/mL。说明桑黄总黄酮具有较强的DPPH 自由基清除活性。
2.3.1.2 桑黄总黄酮的羟基自由基清除活性 桑黄总黄酮羟基自由基清除结果如图7 所示。
图7 的结果表明,桑黄总黄酮具有羟基自由基清除能力,且清除活性会随着黄酮浓度的提高而增强,桑黄总黄酮浓度与羟基自由基清除活性间存在一定的量效关系。在总黄酮浓度为0.08 mg/mL 时,其羟基自由基清除率达到52.51%±1.49%,经计算桑黄总黄酮对羟基自由基清除率的IC50为0.0737 mg/mL,阳性对照VC的 IC50为0.0332 mg/mL。显示桑黄总黄酮具有良好的羟基自由基清除活性。
2.3.2 桑黄总黄酮的降脂活性
2.3.2.1 桑黄总黄酮对胰脂肪酶的抑制活性 对桑黄总黄酮的胰脂肪酶抑制活性进行了测定。由图8所示的实验结果可以看出,桑黄总黄酮可以有效抑制胰脂肪酶的活性。当桑黄总黄酮的浓度在2~6 mg/mL 范围内时,胰脂肪酶抑制率随样品浓度的增加而提高,在6 mg/mL 时抑制率达到10.56%±0.06%,显著高于其他浓度下的抑制率(P<0.05)。但当浓度超过6 mg/mL 时,胰脂肪酶抑制率呈下降趋势。
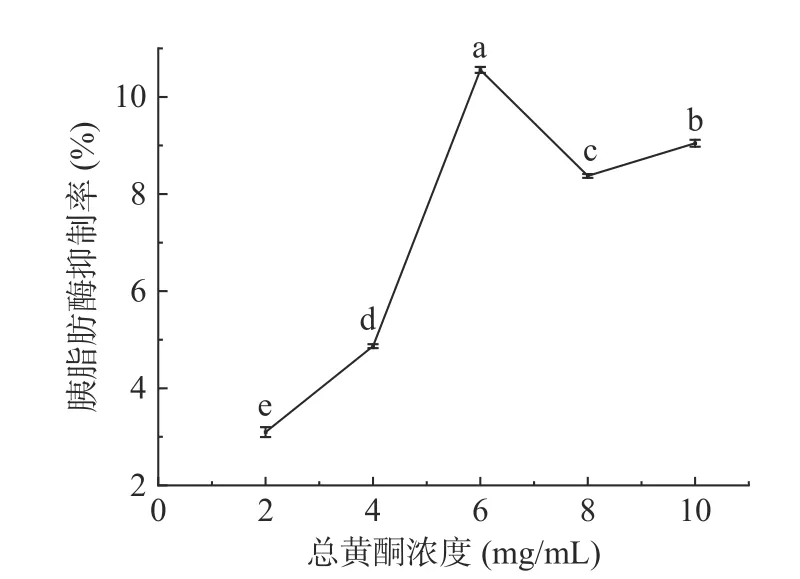
图8 桑黄总黄酮对胰脂肪酶的抑制作用Fig.8 Inhibitory effect of total flavonoids from Phellinus igniarius on pancreatic lipase
2.3.2.2 桑黄总黄酮对胆固醇胶束溶解度的抑制作用 降低胆固醇胶束的溶解度可有效抑制胆固醇的消化吸收,从而起到降脂的作用。对桑黄总黄酮的胆固醇胶束溶解度抑制活性进行了测定,结果如图9所示。
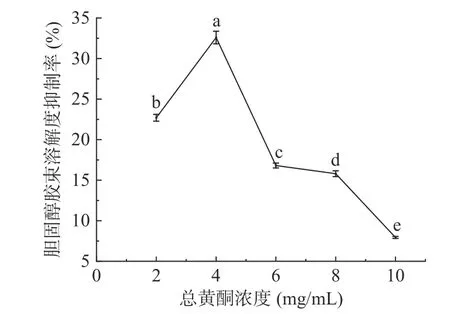
图9 桑黄总黄酮对胆固醇胶束溶解度的抑制作用Fig.9 Inhibitory effect of total flavonoids from Phellinus igniarius on solubility of cholesterol micelle
由图9 可知,桑黄总黄酮具有降低胆固醇胶束溶解度的效果。当总黄酮浓度为4 mg/mL 时对胆固醇胶束溶解度的抑制率达到了32.59%±0.78%,但之后随着总黄酮浓度的提高对胆固醇胶束溶解度的抑制效果反而下降。
随着桑黄总黄酮浓度的增加,对胰脂肪酶及胆固醇胶束溶解度的抑制作用均呈现先上升后下降的趋势,推测出现造成这种结果的原因可能是因为提取物中还同时存在对胰脂肪酶活力及胆固醇胶束溶解度具有促进作用的物质,是多种成分共同作用的结果[34-35]。
2.3.3 桑黄总黄酮的降糖活性
2.3.3.1 桑黄总黄酮对α-葡萄糖苷酶的抑制活性桑黄总黄酮对α-葡萄糖苷酶的抑制效果如图10 所示。由图可知,桑黄总黄酮具有抑制α-葡萄糖苷酶的能力,且抑制能力随着总黄酮浓度的提高而增强。经分析桑黄总黄酮对α-葡萄糖苷酶的IC50为71.42 mg/mL,阳性对照阿卡波糖的IC50为28.54 mg/mL,桑黄总黄酮具有一定的α-葡萄糖苷酶抑制活性。

图10 桑黄总黄酮对α-葡萄糖苷酶的抑制作用Fig.10 Inhibitory of α-glucosidase by total flavonoids from Phellinus igniarius
2.3.3.2 桑黄总黄酮对α-淀粉酶的抑制活性 桑黄总黄酮对α-淀粉酶的抑制作用结果如图11 所示。由图11 可以看出,桑黄总黄酮对α-淀粉酶的抑制率随其浓度的升高而增强。桑黄总黄酮对α-淀粉酶的IC50为97.28 mg/mL,阿卡波糖的IC50为32.92 mg/mL。
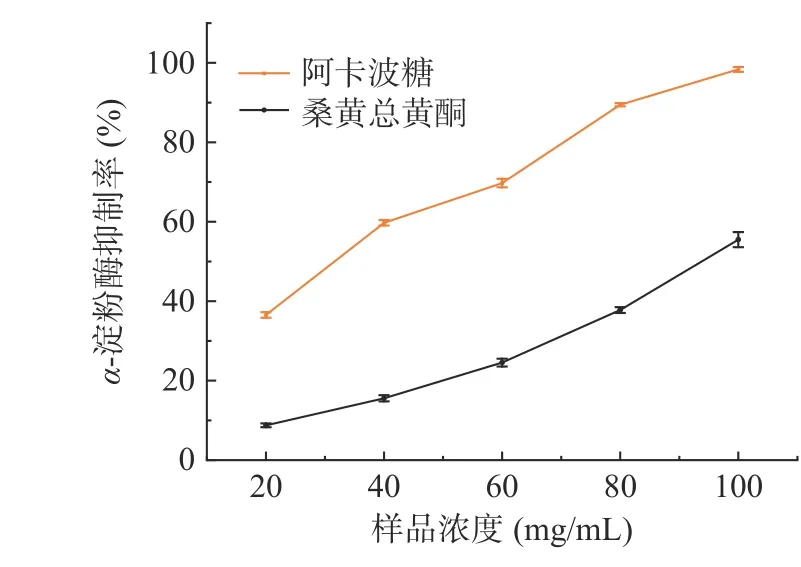
图11 桑黄总黄酮对α-淀粉酶的抑制作用Fig.11 Inhibitory of α-amylase by total flavonoids from Phellinus igniarius
3 结论
本研究采用响应面法优化了桑黄中总黄酮的提取工艺,建立的桑黄总黄酮提取得率的预测模型为Y=2.61+0.14A+0.096B+0.050C-0.090AB-0.053AC-0.032BC-0.19A2-0.25B2-0.085C2。最优提取条件为提取温度73 ℃、固液比1:50 g/mL、提取时间3 h。在该条件下桑黄总黄酮得率为2.68%。该预测模型可有效预测桑黄总黄酮的提取情况;采用高效液相色谱法对桑黄总黄酮的组分进行了分析,发现花旗松素是桑黄总黄酮中的主要成分,含量高达3727.31 mg/kg;本实验条件下,桑黄总黄酮显示出了较好的DPPH自由基和羟基自由基清除能力,对胰脂肪酶和胆固醇胶束溶解度也具有一定的抑制作用,同时对α-葡萄糖苷酶和α-淀粉酶显示了抑制作用,说明桑黄总黄酮具有体外抗氧化、降脂、降糖活性,值得将其作为多重功效因子进行深度开发利用。
桑黄种类繁多,子实体中总黄酮含量及黄酮化合物的组分间存在差异。本研究仅以杨树桑黄作为研究对象探讨了其总黄酮的传统浸提工艺及黄酮类化合物的组成,研究的开展可以为桑黄资源精深加工和高值化利用提供一定的理论参考。研究中桑黄总黄酮显示了体外抗氧化活性、降脂、降糖活性,但在实验数值上与巫永华等[36]的研究结果有偏差,这可能与桑黄种类及总黄酮的纯度有一定的关系。桑黄总黄酮的生物活性验证了桑黄及桑黄总黄酮的保健及药用功能,至于相关功效的靶向活性物质种类的确定则需要对桑黄中的化合物进行分离纯化研究,此外后续也有必要对不同种类及不同生长时间的桑黄中的活性物质种类、含量及生物活性进行系统探讨以精准开发桑黄资源。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).

