小鼠甲状腺功能减退模型的建立
兰浩淼张立毛雨谢林浚车红缨∗
(1. 四川省自贡市第一人民医院甲乳外科, 四川自贡 643000;2. 西南医科大学附属医院甲状腺外科,四川泸州 646000;3. 西南医科大学附属医院临床医学研究中心, 四川泸州 646000)
甲状腺功能减退(简称甲减)是一种甲状腺激素缺乏的病理状态,除了会引起黏液性水肿、记忆力减退和心动过缓等一系列甲状腺激素减少所带来的症状外[1],甲状腺激素的减少和促甲状腺激素的增加也是全身多个系统疾病的独立危险因素[2]。
近年来,甲减的人群数量持续上升,对于甲减及其相关并发症的研究越来越多,所以需要相应的动物模型助力研究。 通过小鼠建立甲减模型的主流方式是药物造模,但药物造模无法避免药物对于甲状腺以外组织产生的一系列作用从而影响实验结果。 甲状腺全切模型主要被应用于大鼠造模。而小鼠与大鼠相比,与人的基因同源性更高[3]。 小鼠在肿瘤学、生理学及免疫学等领域研究应用较多。 在探讨甲减与各系统疾病之间关系时,甲状腺全切后能够造成更为稳定的甲减状态。 但是对于小鼠甲状腺全切模型的建立却少有报道。 因此,在本研究中,利用C57BL/6 和KM 小鼠,进行甲状腺全切术,通过对两种小鼠甲状腺血供及周围组织进行探索,并对甲状腺手术方式进行描述,通过记录和分析手术前后小鼠的体重,检测血清甲状腺相关激素及对颈部切除物行HE 染色验证小鼠甲状腺功能减退模型是否成功,并通过对比两种术式成功率差异。
1 材料与方法
1.1 材料
1.1.1 实验动物
8 周龄SPF 级C57BL/6(体重约16 g)和KM(体重约30 g)雄性小鼠各25 只,购自北京华阜康生物科技股份有限公司【SCXK(京)2019-0008】。饲喂条件:光照时间12 h/12 h,相对湿度45% ~50%,环境温度22 ~23 ℃;所有小鼠都自由饮水和采食,饲养于西南医科大学动物实验中心【SYXK(川)2018-065】。 手术前所有小鼠均饮用纯净水和普通小鼠维持饲料,术后假手术组继续术前饮食,术式Ⅰ组和术式Ⅱ组小鼠以0.1%葡萄糖酸钙水和普通小鼠维持饲料喂养。 本实验所有涉及研究动物操作均按照西南医科大学实验动物伦理委员会伦理管理要求进行并经过审批(20210223-112)。
1.1.2 主要试剂与仪器
4%多聚甲醛(Biosharp,BL539A),小鼠三碘甲状腺原氨酸(T3)ELISA KIT(Dogesce,DG30448M-96),小鼠甲状腺素(T4) ELISA KIT(Dogesce,DG30445M-96),小鼠促甲状腺素(TSH)ELISA KIT(Dogesce,DG30463M-96)。
胰岛素注射针(FEIYUBIO,中国),数码显微镜(瑞沃德生命科技,DOM-1001,中国),眼科显微剪(辉诺,中国),眼科显微镊(辉诺,中国),小动物手术用非吸收性带线缝合针6-0(迈越生物,中国),1.5 mL Ep 管(DEWEIBIO,中国)。
1.2 方法
1.2.1 动物模型的分组及建立
将C57BL/6 雄性小鼠各分为假手术组(C-Sham组,n=5)、术式I 组(C-SⅠ,n=10)和术式Ⅱ组(C-SⅡ,n=10);将KM 雄性小鼠各分为假手术组(K-Sham 组,n=5)、术式I 组(K-SⅠ,n=10)和术式Ⅱ组(K-SⅡ,n=10),手术前所有小鼠均饮用纯净水和普通小鼠维持饲料,术后假手术组继续术前饮食,术式Ⅰ和术式Ⅱ组小鼠以0.1%葡萄糖酸钙水和普通小鼠维持饲料喂养。
由于C57BL/6 小鼠和KM 小鼠体型及甲状腺解剖结构相似,故其手术方法一致。 甲状腺的暴露:利用麻醉剂腹腔注射麻醉小鼠并固定,在小鼠对应颈后垫一块5 cm × 1 cm × 0.5 cm 纱布垫使术野更为暴露,自小鼠胸骨上窝的颈正中为起点,向上切开皮肤约1 cm,切开后可见左右两下颌腺由被膜相连,用眼科显微直剪钝性分离,分离后可见完整颈前肌,用眼科显微弯镊自切口视野正中轻轻提起颈前肌,眼科显微弯剪垂直于颈前肌正中刚好刺入肌组织,然后钝性分离约1 cm。 此时气管和甲状腺暴露于术野。 将覆盖于甲状腺外侧的带状肌钝性分离,直至甲状腺与其完全分离,并用小拉钩将带状肌及其外侧组织拉开,充分暴露甲状腺。 假手术组至此步骤后缝合。
术式Ⅰ:将甲状腺侧叶提起并轻轻翻转,暴露该侧甲状腺背侧于视野,从上极入针点结扎甲状腺上极动脉并沿线头近甲状腺侧将血管离断,注意应尽量靠近上极血管,并完全避免结扎除血管、被膜之外的任何组织。 用同样手法结扎另一侧甲状腺上动脉,紧贴结扎处,在线头靠甲状腺侧锐性离断上极血管,从一侧甲状腺上极开始沿被膜将甲状腺撕离气管,注意整个过程应保证甲状腺后被膜的完整性,并避免接触喉返神经,直至剥离至离断另一侧上极血管。 将摘除甲状腺于4%多聚甲醛中固定。
术式Ⅱ:首先提起一侧腺体,暴露上极血管,锐性离断上极血管,快速提起另一侧上极血管,并锐性离断血管,小棉签双侧轻轻按压止血30 ~120 s,出血减少后,用与术式Ⅰ同样手法剥离甲状腺组织。
最后确认气管无甲状腺组织附着、无活动性出血后(如有出血可轻按压止血),轻取纱布垫,复位气管和带状肌,逐层缝合肌肉、下颌腺和皮肤,碘伏消毒皮肤,纱布覆盖。 分别记录各组每只小鼠手术用时。
1.2.2 观察各组小鼠死亡率和体重变化
于小鼠入组开始,每日记录小鼠死亡情况;于术前第7 天、术后第7、14、21、28 天分别记录各组小鼠体重情况。
1.2.3 血清甲状腺相关激素分析
术前第7 天和术后第28 天,通过眼眶取血。 用1.5 mL Ep 管收集血液,利用酶联免疫吸附实验检测小鼠血清中TT3、TT4 及TSH 含量。
1.2.4 组织学分析
术中摘除小鼠甲状腺组织,离体后用4%多聚甲醛溶液固定,脱水,石蜡包埋。 进行常规2 μm 切片后,进行HE 染色。
1.3 统计学分析
使用SPSS 25.0 统计软件(IBM,Armonk,NY,USA)进行统计分析。 采用W检验分析各指标的正态性。 符合正态分布的数据用平均值± 标准差(¯x±s)描述,两组比较采用T检验,多组间独立数据比较采用方差分析(ANOVA)。 两组模型组间生存率采用校正χ2检验,P<0.05 为异具有显著性差。
2 结果
2.1 各组小鼠术后28 d 内存活情况
假手术组:C57BL/6 小鼠(C-Sham):术中死亡1 只,术后28 d 内死亡总计1 只;KM 小鼠(KSham):无。 术式Ⅰ组:C57BL/6 小鼠(C-SⅠ):术中死亡1 只,术后第1 天死亡2 只,术后第3 天死亡2 只, 术后第4 天死亡1 只,术后28 d 内死亡总计6 只; KM 小鼠(K-SⅠ):术中死亡0 只,术后第1 天死亡3 只,术后第3 天死亡2 只,术后28 d 内死亡总计5 只。 术式Ⅱ组:C57BL/6 小鼠(C-SⅡ):术中死亡2 只,术后第3 死亡2 只,术后28 d 内死亡总计4 只; KM 小鼠(K-SⅡ):术中死亡1 只,术后第3 天死亡4 只,术后第9 天死亡1 只,术后28 d 内死亡总计6 只。 术式Ⅰ组和术式Ⅱ组小鼠术后28 d 内存活率分别为C57BL/6 小鼠:40%和60%(图1A);KM 小鼠:50%和40%(图1B),不同术式及不同品种小鼠同种手术方式组间存活率均无显著性差异。

图1 C57BL/6 和KM 小鼠术后28 d 生存率Note. A. C57BL/6 mice survival rate. B. KM mice survival rate.Figure 1 Survival rate at 28 days after operation in C57BL/6 mice and KM mice
2.2 两种小鼠甲状腺解剖及血管结扎点
两种小鼠甲状腺均呈淡红色,形似“U”,由左、右侧叶和中间的峡部组成,上极位于甲状软骨中部两侧,下极至甲状软骨下方第3 ~4 气管软骨,峡部与两侧甲状腺叶下极相连,位于气管正前方,两界达气管中后方(图2A,2F)。 小鼠甲状腺供血主要来源于颈外动脉发出的甲状腺上动脉,甲状腺静脉位于双侧甲状腺下极下方,紧邻喉返神经走行,小鼠喉返神经走行于甲状腺侧叶后方。 气管与甲状腺上动脉所形成交叉“三角地带”为甲状腺上动脉结扎入针点(图2B,2G)。 术式Ⅱ时,应暴露该三角后,紧贴甲状腺上极锐性离断甲状腺上极血管,并用无菌小棉签按压止血。 术式Ⅰ结扎甲状腺上极血管后,两种属小鼠甲状腺均充血,略变大(图2C,2H)。 将甲状腺钝性剥离气管后,可见喉返神经完整走行与气管食管沟内,在甲状软骨下方入喉(图2D,2I)。 两种属小鼠剥离下的甲状腺形状类似,峡部将甲状腺两侧叶下极连接,呈“U”型,且甲状腺表面背膜完整(图2E,2J)。 图3 为两不同种属小鼠的甲状腺模拟图。

图3 C57BL/6 和KM 小鼠甲状腺解剖模拟图Figure 3 Thyroid anatomic simulation of C57BL/6 mice and KM mice
2.3 各组小鼠体重变化情况
在术前第7 天时,各组间体重变化无显著性差异(表1)。 在术后第28 天时,C57BL/6 小鼠中,术式Ⅰ组和术式Ⅱ组小鼠的体重较对照组均较高,但仅术式Ⅱ组与对照组间差异具有显著性(P<0.05)。 在KM 小鼠中,手术组小鼠体重均数也较对照组高,其中术式Ⅰ组与对照组间差异具有显著性(P<0.001)(表1)。
2.4 各组小鼠血清甲状腺相关激素变化
分别于术前第7 天和术后第28 天对6 组小鼠进行血清TT3、TT4、TSH 检测。 术前7 d 相同品系小鼠三组血清各项指标差异均无显著性(图4A ~4C)。术后第28 天,模型组大鼠TT3 和TT4 均明显降低,且与假手术组相比,差异具有显著性(P<0.05)(图4D,4E),模型组大鼠TSH 水平与假手术组相比明显上升,且差异具有显著性(P<0.001)(图4F)。
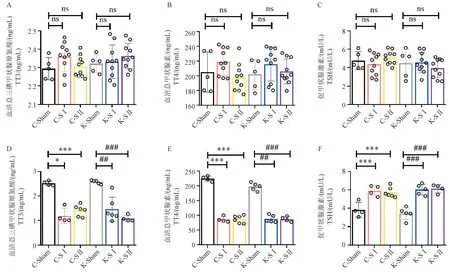
图4 C57BL/6 和KM 小鼠术前第7 天及术后第28 天血清TT3、TT4 及TSH 水平Note. A ~C. Serum TT3, TT4 and TSH levels of mice in 2 groups on the 7th day before surgery. D ~F. Serum TT3, TT4 and TSH levels of mice in 2 groups on the 28th day after surgery. Compared with C-Sham group, ∗∗∗P <0.001. Compared with K-Sham group, ##P <0.01.Figure 4 Serum TT3, TT4 and TSH levels of C57BL/6 and KM mice on the 7th day before surgery and the 28th day after surgery
2.5 HE 染色
将C57BL/6 和KM 小鼠术中剥离的颈部组织行HE 染色观察发现,发现大量类圆形滤泡结构,绝大多数滤泡内含丰富胶质,滤泡间可见毛细血管和散在的滤泡旁细胞(图5),该组织学特点符合甲状腺组织学特征。

图5 C57BL/6 和KM 小鼠颈部剥离组织HE 染色Figure 5 HE staining of C57BL/6 mice and KM mice
3 讨论
甲状腺功能减退症是指体内甲状腺激素缺乏而表现的一种疾病。 甲状腺功能减退所引起的症状常常是非特异性的,最常见的包括疲劳、耐寒和便秘。 未经治疗的甲状腺功能减退,特别是临床显性的甲状腺功能减退,无论是短期或是长期,均可导致多个器官系统的严重不良影响,甚至死亡[1]。作为人体内十分重要的内分泌器官,所分泌的甲状腺激素与机体各个系统、器官所发生的许多疾病都有着密切联系。 为了研究甲状腺功能减退症以及该疾病与其他疾病的联系,甲状腺功能减退的动物模型是必不可少的研究工具和手段[4-7]。
在动物模型中,诱导甲状腺功能减退的方法较多。 通过敲除特异性甲状腺受体或去碘酶等基因[8-9],可构建稳定的甲状腺功能减退动物模型,但是基因敲除造模程序复杂,需要耗费大量人力和时间,通常获取一个基因剔除的纯合子小鼠需要大约1 年时间,且基因敲除纯合小鼠很难通过自身繁殖获得纯合敲除的后代[10],所以,很难将基因敲除所造甲状腺功能减退模型小鼠进行大面积推广,但基因敲除造成甲状腺功能减退模型对于研究中枢性甲状腺功能减退或去碘酶缺乏等特殊类型的甲状腺功能减退具有不可替代的优势。 除此之外,抗甲状腺药物、放射性碘或低碘饮食均可造成实验动物甲状腺功能减退。 抗甲状腺药物主要包括用丙硫氧嘧啶或甲巯咪唑喂养实验动物,造成动物血清TT3、TT4 下降,TSH 升高[11-12],该方法的优点是造模方法简单、成功率高,但该方法造模所需时间较长,且一旦停止喂药,甲状腺激素水平极为不稳定,甲状腺功能减退状态很快会消失,更为重要的是,无法排除抗甲状腺药物对于动物机体其他器官及组织所产生的干扰性影响。 放射性碘注入实验动物体内后,被甲状腺所凝聚,造成甲状腺细胞坏死,从而引起甲状腺功能的减退[13],但该方法对于造模设备要求较高,且存在放射性物质污染风险,在一般实验中应用较少。 低碘饮食造模,主要通过喂食实验动物低碘饮食实现,造模方法简单,但可控性较差,且用时较长,主要被用于研究碘缺乏相关疾病。
手术切除甲状腺可以快速造成实验动物甲状腺功能减退,且甲状腺功能减退状态较为稳定,该方法在许多实验中被应用,其中Wistar 大鼠或SD大鼠被应用最多,甲状腺全切模型的建立不仅要求尽可能完整的将甲状腺切除,而且要求在手术同时,要尽可能的保护甲状腺周围的重要器官、组织,如气管、喉返神经、甲状旁腺及食管等,损伤这些重要器官或组织,将大大增加实验动物的致死率,甲状腺全切的小鼠模型报道较少也可能与其手术高死亡率有关。 在本实验中,术式Ⅰ小鼠在术中死亡1 只,而术式Ⅱ小鼠在术中死亡3 只。 术式Ⅰ通过先结扎小鼠甲状腺动脉,在钝性剥离甲状腺组织,其操作步骤中,易引起小鼠死亡因素较少,而术式Ⅱ,通过先锐性离断甲状腺动脉,再迅速锐性离断另一侧血管,首先该过程,出血对于术区视野干扰较大,易造成甲状腺周围脏器的损伤,其次,压迫止血所需时间较长,术中死亡3 只小鼠均系止血过程中死亡,不能排除止血时对于气道的压迫减少了麻醉中小鼠的潮气量所造成。 另外,在成功止血并剥离甲状腺后,残端血管再次出血风险也极高,研究人员在对术式Ⅱ组小鼠术后3 d 内死亡小鼠进行解剖时发现,43%的小鼠气管周围布满血凝块。 术式Ⅱ手术时间长、出血和再出血风险是造成其高死亡率的主要原因,术式Ⅰ的手术时间较术式Ⅱ没有明显优势,但其出血和再出血风险极小。 在本研究中,两种术式的小鼠最终存活率并没有明显差异,这可能与本研究使用小鼠样数量偏少有关。 在本研究中,术后第9 天,KM 小鼠术式Ⅱ组仍有手术组小鼠死亡,考虑可能系术后感染所致,小鼠因其术后依从性极差,应在术中特别注意无菌操作,在术后尽量将手术小鼠单独或少量同笼饲养,避免斗殴等引起的术后感染发生。 在不影响实验者研究目的的情况下,可考虑予以术后小鼠饮水中添加适量抗生素预防感染[14]。
小鼠99%的基因能在人类基因组中找到同源基因[3,15],在内分泌、免疫等疾病研究中具有难以替代的地位。 而小鼠甲状腺较小,手术完整切除具有一定难度,手术切除后死亡率较高等一系列问题也造成了小鼠甲状腺全切模型难以大面积推广。 熟悉小鼠甲状腺解剖情况及手术操作步骤,有利于提高造模成功率和降低死亡率。 本研究中,主要对于C57BL/6 小鼠和KM 小鼠两种不同品系的小鼠进行了甲状腺全切的操作。 研究发现,两种不同品系小鼠甲状腺解剖结构基本相似,均由颈内动脉发出的甲状腺上动脉供血,甲状腺上动脉是C57BL/6 小鼠和KM 小鼠甲状腺的最重要的供应血管,对其结扎或锐性离断后再沿着气管表面钝性剥离,剥离过程中尽量保证甲状腺背膜的完整性,以避免甲状腺组织的残留。 在剥离过程中,将甲状腺背膜外组织尽量原位保留,避免损伤甲状旁腺等重要器官。 小鼠喉返神经紧贴于甲状腺后方,在钝性剥离甲状腺时要轻提甲状腺组织,尽量暴露位于后方的喉返神经,从而减少操作中损伤机会。 由于小鼠甲状旁腺过小,无法确切保留,但之前有研究表明,C57BL/6小鼠甲状旁腺一般有2 ~3 枚,主要位于甲状腺上缘附近,其次位于甲状腺下缘附近,以上两个位置甲状旁腺均贴近甲状腺,少部分甲状旁腺远离甲状腺[16],故手术中较难避免损伤甲状旁腺,故术后通过饮水中加入葡萄糖酸钙(水中浓度为0.1%)预防小鼠发生严重性低钙血症,从而降低了低钙造成的死亡风险[5]。
对于手术后的模型验证,主要选择利用酶联免疫吸附法(ELISA 法)对小鼠术前第7 天及术后第28 天血清TT3、TT4 及TSH 进行检测。 在其他研究中,甲状腺全切后检测实验动物血清激素的方法还有化学发光法、放射性免疫法等[17-18],而ELISA 法具有的优势在于设备易获得,对于血清激素检测的特异度和灵敏度均较高,检测结果较为稳定等优点[19]。 在本研究中,两种属小鼠术前验血中,TT3、TT4 及TSH 差距较小且组间均没有统计学意义。而在术后,两种属小鼠无论是术式Ⅰ或术式Ⅱ组,较Sham 组小鼠TT3 和TT4 均明显下降(P<0.05),而TSH 则较Sham 组明显上升(P<0.001)。根据甲状腺功能减退的定义,可以认为造模成功。另外,根据对于两种属小鼠术前及术后体重的记录,本研究发现,在C57BL/6 和KM 小鼠中,两手术组在术后28 d 后体重均数都较假手术组上升,但CSⅠ组较C-Sham 组和K-SⅡ组较K-Sham 组体重差异无统计学意义,统计学无意义可能是由于该组体重标准差较大造成,而造成组内体重差异较大的原因可能是小鼠在术后斗殴或取食不均所造成。 最后,将从两种属小鼠体颈部取出组织行HE 染色后发现其符合甲状腺组织的细胞、组织形态学特征,且将刚离体的甲状腺组织置于显微镜下,可看到完整的甲状腺背膜附着于其上,进一步验证了造模的成功。
4 结论
综上,通过两种手术方式均可造成C57BL/6 和KM 小鼠甲状腺功能减退。 本研究小鼠死亡率相比大鼠甲状腺全切死亡率明显较高[20],降低小鼠死亡率是推广该造模方法的重点。 术式Ⅱ较术式Ⅰ相比,止血时需要按压甲状腺游离血管断端,增加手术时间的同时,加大了小鼠术中窒息死亡的风险。而术式Ⅰ的手术方式,需要操作者熟练的掌握小鼠甲状腺解剖及操作步骤,从而避免误伤结扎血管以外组织并缩短手术时间,有望进一步降低模型小鼠死亡率。

