脱水过程中无核白葡萄转录组测序及膜脂降解代谢中关键基因的筛选
马紫荆,马金花,常晨光,加依娜·牙森,黄文书
(新疆农业大学食品科学与药学学院,新疆乌鲁木齐 830052)
无核白葡萄(Vitis viniferaL. cv. Thompson Seedless)是新疆葡萄干的主要原料,新疆是我国葡萄干的主产区,2018 年新疆葡萄干产量达20 万t,占全国产量95%以上[1],而吐鲁番葡萄干产量占全疆葡萄干总产量的90%[2],对于消费者而言颜色和口感是食品的重要品质,绿葡萄干售价是褐色葡萄干的2~3倍[3]。吐鲁番地区一直以来都把无核白绿葡萄干作为当地重要经济支柱。
在吐鲁番地区绿葡萄干一直沿用自然阴干的加工方式,这种加工方式干燥周期偏长,生产的葡萄干褐变严重,卫生品质较差[4],故其经济价值难以充分实现,已成为制约吐鲁番葡萄干产业健康持续发展的关键性问题。近几年吐鲁番地区发展的热风烘房设备大幅度缩短了干燥周期且干燥环境清洁。刘峰娟等[5]研究表明将无核白葡萄放入40 ℃、风速1.5 m/s 的烘箱内处理,与传统阴干方式相比,热风烘箱设备可以减少无核白脱水褐变现象的发生,提高无核白葡萄干的绿品级。多数研究者认为,无核白葡萄干褐变的主要原因是由于干制过程中多酚氧化酶(Polyphenol Oxidase,PPO)和酚类物质反应发生酶促褐变[6]。在健康完好的鲜果粒中,细胞结构完整,分布于液泡中的底物酚类物质和细胞质中的PPO 是分离的,当细胞受到逆境胁迫时,膜系统破坏,细胞区室化作用打破,使得二者接触发生褐变[7]。可见维持细胞膜稳定性和完整性对无核白在脱水过程中是否褐变有着重要的作用。在脱水过程中膜脂代谢对维持细胞膜稳定性起着关键作用[8],膜脂代谢受一系列酶基因的调节。PLD 是膜脂代谢过程中的第一个基因,PLD 作用于磷脂产生磷脂酸(Phosphatidic Acid,PA)[9]。此外NPC 通过分解磷脂酰胆碱(Phosphatidyl Choline,PC)、磷脂酰乙醇胺(Phosphatidyl Ethanolamine,PE)产生二酰基甘油(Diacylglycerol,DAG),DGK 作用于DAG 也产生PA[10]。LPP 可以催化PA 生成DAG[11]。DAG可在单半乳糖甘油二酯合成酶(Monogalactose Diglycerol Synthetase,MGD)和DGD 作用下相继形成单半乳糖甘油二酯(Monogalactose Diglycerol,MGDG)和双半乳糖甘油二酯(Digalactose Diglycerol,DGDG)[12]。DAG 的酰基可被脂酶去酯化,释放游离脂肪酸。LOX 可以催化亚油酸、亚麻酸等多元不饱和脂肪酸,其分解代谢产物脂肪醛类被ALDH 氧化成羧酸[13]。
目前有关于不同脱水方式下无核白褐变现象的发生与膜脂代谢相关酶基因的关系鲜少报道,本研究以新疆吐鲁番无核白为试验材料,使用快、慢两种脱水方式,利用转录组测序技术筛选出与膜脂降解代谢相关的关键基因,再用实时荧光定量验证。旨在阐明两种不同脱水方式下无核白褐变与膜脂降解代谢的关系。为提高新疆吐鲁番无核白葡萄干绿品级率提供科学依据和生产指导。
1 材料与方法
1.1 材料与试剂
本文试验所有处理组样品均选用新疆吐鲁番地区的8 月中旬采收的同一批无核白葡萄,要求采自同一葡萄园,成熟度和大小基本一致,糖度达到(20±1) ° Brix,色泽碧绿。
1.2 仪器与设备
电热恒温鼓风干燥箱,上海申贤恒温设备厂;JEA202 型电子天平,上海浦春计量仪器有限公司产品。
1.3 试验方法
1.3.1 样品处理
将无核白葡萄,用果蔬剪剔除霉烂、变色、有损伤的果粒,剪成带蒂的单颗葡萄。将处理好的试验样品均匀放在不同框架筛网里,如表1 所示随机分为两组,快速脱水处理组:置于小型热风烘箱,控制温度(30±1)℃空气流速1.5 m/s;慢速脱水处理组:置于自然环境下,温度(25±1)℃自然空气流动;空白对照组:果蔬剪处理好未进行脱水的新鲜样品。在失水25%、50%时,对完全褐变和完全未褐变葡萄取样。选取整颗葡萄,然后立即放入液氮中冷冻,于-80 ℃超低温冰箱保存,每组试验进行四次生物学重复,送至上海派森诺生物科技有限公司对28 个样品进行后续转录组测序分析。
1.3.2 RNA提取及mRNA-seq文库构建
将以上样本委托上海派诺森基因科技有限公司完成RNA 提取、文库构建和转录组测序,以A25%b、A50%a、A50%b、B25%b、B50%a、B50%b、CK 为转录组分析材料,利用IlluminaHi SeqTM 测序平台进行转录组测序分析,以Vitis-vinifera.12X.dna.toplevel.fa 为参考基因组进行序列比对,对获得的差异基因进行GO 富集分析、KEGG 富集分析和差异基因功能分析筛选出与膜脂降解代谢相关基因。
采用天根(TIANGEN)柱式植物RNA 提取试剂盒提取整颗葡萄的总RNA,采用nanodrop(Thermo Scientific NanoDrop 2000)检测总RNA 的浓度及纯度,使用Agilent 2100 Bioanalyzer 精确检测总RNA 完整性,RNA 质检合格满足建库要求后,通过mRNA 特有的polyA 结构来纯化总RNA 中的信使RNA。通过离子打断的方式将得到的mRNA,打断到200~300 bp 片段。通过随机引物和逆转录酶的作用合成第一链cDNA,以其为模板合成第二链cDNA。对双链cDNA 进行末端修复补平,再在链接酶的作用下加上测序接头,通过磁珠的方式去除多余接头序列。然后进行PCR 扩增富集文库片段,文库大小在300~400 bp。文库构建所有的步骤完成后,采用Agilent 2100 检测文库大小,采用荧光定量检测文库总浓度,为了确保所构建文库的质量,利用QR-PCR 法检测使文库的有效浓度高于2 nmol/L。
1.3.3 测序结果的质量控制本次测序为有参考基因组测序,RNA-seq 测序完成后,对测序结果的原始数据进行处理,过滤掉一些带接头、低质量的Reads、有未知碱基的序列获得高质量的Clean reads,然后开展后续分析,保证最终所得数据的准确性及可靠性。
1.3.4 关键基因qRT-PCR验证
为了验证转录组测序数据的准确性,选择与膜脂降解代谢相关的7 个关键差异基因进行qRTPCR 验证。使用测序同批次的RNA 样本,按照PrimeScript TM1st stand cDNA Synthesis Kit 反转录试剂盒合成cDNA。利用Primer 5 设计qRT-PCR引物,引物合成由上海派森诺生物科技有限公司完成如表2,GAPDH基因为内参基因,使用Light Cycler 480II,384 实时荧光定量进行定量检测,反应程序为95 ℃变性5 min;95 ℃ 15 s;60 ℃ 30 s,40 个循环所有试验均设置3 个生物学重复。

表2 qRT-PCR引物序列表Table 2 Primer sequence of qRT-PCR
1.3.5 RNA-seq数据处理及分析
使用HISAT2(http://ccb.jhu.edu/software/hisat2/index.shtml)软件将得到的Clean Reads 比对到参考基因组上,使用HTSeq 统计比对到每一个基因上Read Count 值,作为基因的原始表达量,采用FPKM 计算基因的表达水平,我们采用DESeq 对基因表达进行差异分析,筛选差异表达基因条件为:表达差异倍数|log2FoldChange|>1,显著性P<0.05。差异表达基因使用topGO 进行GO 富集分析,使用clusterprofiler 进行KEGG 富集分析,原始数据已上传到NCBI(未释放)。qRT-PCR 检测的差异倍数使用-ΔΔCt 进行计算分析并使用Excel 做图。
2 结果与分析
2.1 转录组测序结果分析
对不同脱水方式处理下的两个失水程度褐变以及未褐变的无核白进行转录组测序,本试验共检测了28 个样本,本次测序共获得了1263553006条原始序列(Raw reads),为了得到高质量的测序数据,去除带有接头的,低质量的reads 后得到1163001026 条过滤后序列(Clean reads),后续的分析都基于Clean reads。所有样品的Q20%均在97.43%以上,Q30%均在93.2%,比对效率在77.67%~90.26%之间。
2.2 差异表达基因分析
通过将鲜果和不同脱水方式处理过的无核白转录组数据进行比较分析,以|log2FoldChange| >1,P<0.05 为判断标准初步筛选差异基因。由图1a可见空白对照CK 组与B25%b、A25%b、B50%b、B50%a、A50%b、A50%a 六个处理组相比差异基因数分别有1 708、1 955、6 437、6 990、8 060、8 209 个。从差异表达基因数量可以看出,随着失水程度加深,差异表达基因数目逐渐增多,快速脱水组的差异基因数多于慢速脱水处理组,这表明脱水胁迫诱导了大量基因表达;且相较于慢速脱水,快速脱水更能诱导基因表达。为进一步了解这些差异基因,绘制了花瓣图,由图1b 可见与CK 组相比特有的基因数208、252、907、461、547、730 个;各比较组共有的基因数为300 个。以上结果表明,脱水会诱导大量的基因表达。由于本研究主要发掘无核白褐变过程中膜脂降解代谢相关的关键基因,为了排除其他干扰因素,因此本研究后续主要针对A50%a vs A50%b、B50%a vs B50%b 这2 个比较组产生的差异基因的信息和功能进行深度的挖掘与数据分析,并且通过上述结果可以看出,这两个比较组有较为丰富的差异基因,利于后续分析。

图1 (a)差异基因花瓣图;(b)差异基因情况Fig.1 (a) differential gene petal diagram; (b) differential gene situation
差异基因火山图可以清晰的看出两种不同脱水方式下失水50%时褐变与未褐变的无核白转录组中基因差异表达分布情况。图2 中红色代表A50%a vs A50%b、B50%a vs B50%b 比较组中log2FoldChange ≥1的上调基因,绿色代表log2FoldChange≤-1 的下调基因。通过火山图可以看出A50%a vs A50%b、B50%a vs B50%b 两个比较组差异基因数较丰富,下调基因的表达差异倍数多数在1~4;上调的表达差异倍数多数在1~3,并且下调表达基因数大于上调表达基因数。A50%a vs A50%b 比较组中,差异表达基因数为718,其中上调基因215 个,下调基因503 个。B50%a vs B50%b 比较组中,差异表达的基因数为2 259 个,其中上调基因727 个,下调基因 1 532 个。慢速脱水组的褐变相关的差异表达基因数大于快速脱水组。

图2 快速脱水组(a)和慢速脱水组(b)差异基因火山图Fig.2 Volcano map of differentially expressed genes in rapid dehydration group (a) and slow dehydration group (b)
2.3 褐变相关差异表达基因GO富集分析
为了探究与无核白脱水褐变相关的基因的生物学过程和重要功能分类,本文对无核白的差异基因进行了GO Term 富集分析。GO 涵盖三个方面,分别描述基因的分子功能(Molecular Function)、细胞的组件作用(Cellular Component)、参与的生物学过程(Biological Process)。本次GO 富集分析中,显著富集的标准为P<0.05,在本研究中P<0.05的GO Term 数目较多,选择极显著富集的前30 条Term 进行分析。
在A50%a vs A50%b 比较组中共富集了21 077 个差异基因,分别被注释在1 991 个Terms。如图3,极显著富集的前30 条Term 中,MF:15 terms,BP:13 terms;CC:2 terms;其中差异基因最多的GO Term分别是氧化还原过程(GO:0055114)、氧化还原酶活性(GO:0016491)、辅因子结合(GO:0048037),分别富集了116、112、73 个差异基因。与褐变可能相关的GO Term 是氧化还原过程、氧化还原酶活性。
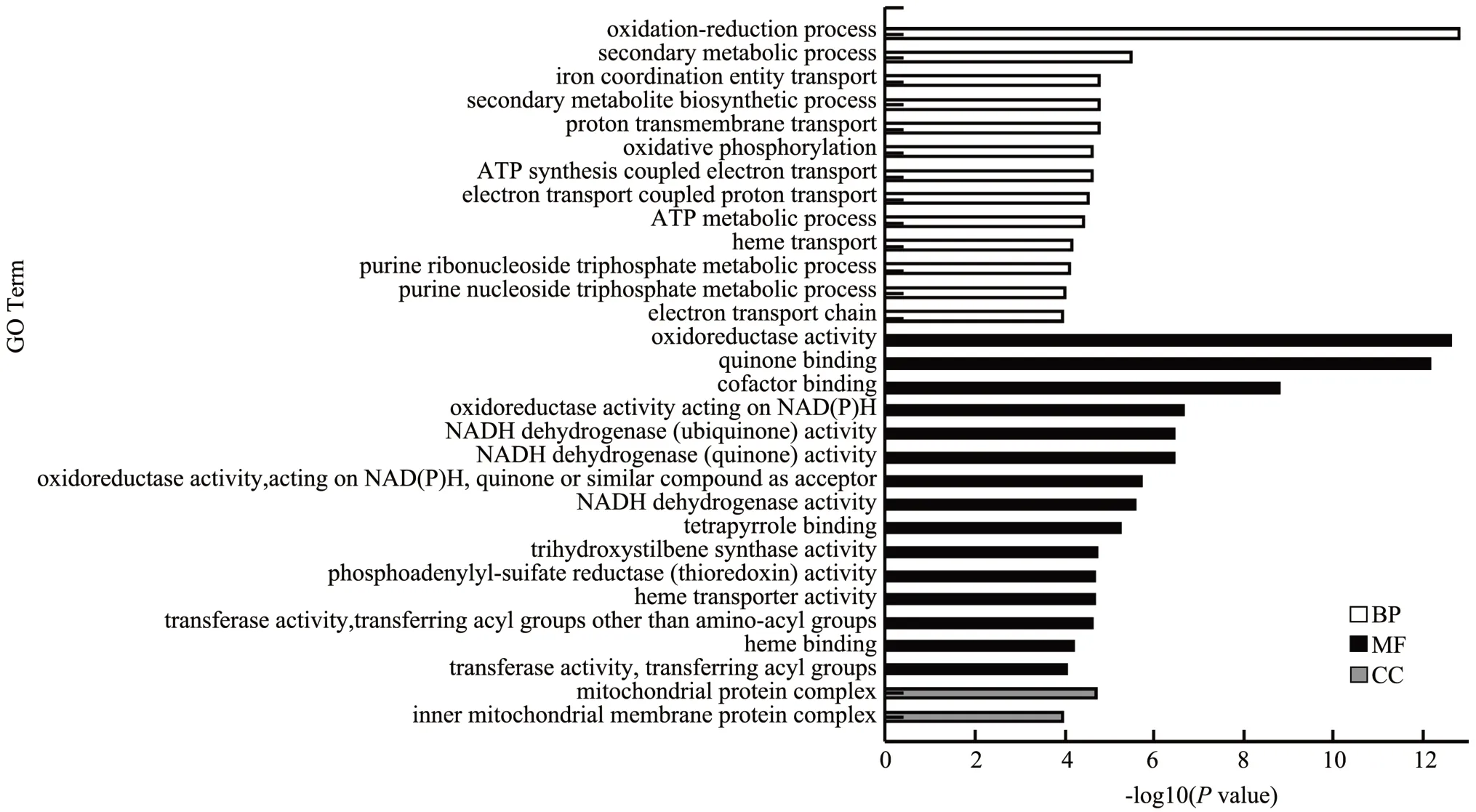
图3 A50%a vs A50%b 比较组差异基因GO 富集图Fig.3 GO enrichment map of A50%a vs A50%b differential genes
在B50%a vs B50%b 比较组中共富集了73 864 个差异基因,分别被注释在3 861 个Terms。如图4,极显著富集的前30 条Term 中,MF:13 terms;BP:10 terms;CC:7 terms;其中差异基因最多的GO Term 分别是细胞外围(GO:0071944)、质膜(GO:0005886)、氧化还原酶活性(GO:0016491)、分别富集了317、264、252 个差异基因。与褐变可能相关的GO Term 是细胞外围、质膜、氧化还原酶活性。

图4 B50%a vs B50%b比较组差异基因GO富集图Fig.4 GO enrichment map of B50%a vs B50%b differential genes
综上所述,在不同脱水方式下的两个比较组中,均有差异基因大量富集在氧化还原酶活性、质膜等terms 中,说明其相关基因可能在无核白脱水褐变过程中起着重要的作用。
2.4 褐变相关差异表达基因KEGG富集分析
为了进一步了解A50%a vs A50%b、B50%a vs B50%b 两个比较组差异基因主要的生物学功能,筛选出膜脂降解代谢相关的基因,对差异基因进行KEGG 富集分析。A50%a vs A50%b 比较组中共有187 个差异基因注释到KEGG 通路中,显著差异通路如图5a 所示。在P<0.05 的条件下,A50%a vs A50%b 有9 条通路被显著富集,其中与膜脂降解代谢相关的通路有1 条为甘油脂代谢(Glycerolipid Metabolism)此通路富集到1 个上调基因,4 个下调基因。B50%a vs B50%b 比较组中共有580 个差异基因注释到KEGG 通路中,显著差异通路图5b 所示,B50%a vs B50%b 有17 条通路被显著富集,其中与膜脂降解代谢相关的通路有5 条,分别为亚油酸代谢(Linoleic Acid Metabolism)、类固醇生物合成(Steroid Biosynthesis)、甘油磷脂的新陈代谢(Glycerophospholipid Metabolism)、甘油脂代谢(Glycerolipid Metabolism)、α-亚麻酸新陈代谢(Alpha-Linolenic Acid Metabolism)。亚油酸代谢富集到1 个上调基因,4 个下调基因;类固醇生物合成富集到2 个上调基因,6 个下调基因;甘油磷脂的新陈代谢富集到1 个上调基因,13 个下调基因;甘油脂代谢富集到6 个上调基因,6 个下调基因;α-亚麻酸新陈代谢富集到1 个上调基因,9 个下调基因。可以看出在不同的脱水方式下,下调的基因数均大于或者等于上调的基因数,且快速脱水方式膜脂降解代谢相关的差异基因数目小于慢速脱水,在慢速脱水中甘油磷脂的新陈代谢通路富集到的差异基因最多。
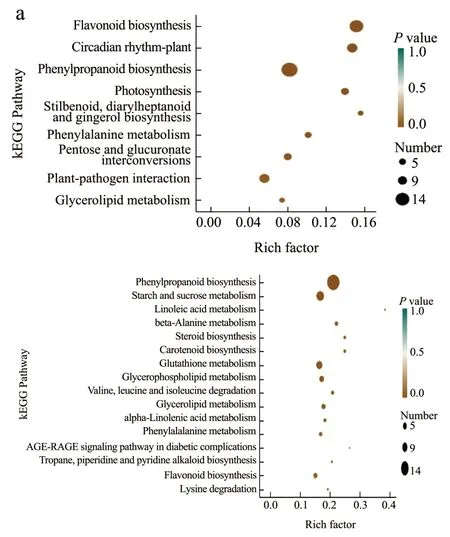
图5 A50%a vs A50%b 比较组(a)和B50%a vs B50%b比较组(b)差异基因KEGG 富集因子图Fig.5 KEGG enrichment factor diagram of differential genes in A50%a vs A50%b (a) and B50%a vs B50%b (b)comparison group
2.5 膜脂降解代谢相关关键基因筛选
脱水过程会引起无核白中膜脂降解代谢,破坏细胞膜完整性,导致褐变,膜脂降解代谢在无核白脱水过程中是否褐变起着重要作用。本研究进一步筛选出了无核白在脱水褐变过程中膜脂降解代谢相关的关键基因。综合上述测序结果,差异基因的筛选获得了2 977 个与褐变相关的差异基因。接着通过GO 富集分析验证了与膜,氧化还原相关的基因在无核白褐变过程中有着重要的影响作用。通过KEGG 富集分析,查询到5 个与膜脂降解代谢相关的pathway。从中富集到的43 个基因里,根据在各个组的FPKM 值(FPKM≥1)、差异倍数(|log2FoldChange|≥1)、差异显著性(P<0.05),再结合文献最终筛选出7 个无核白脱水褐变过程中膜脂降解代谢相关的关键基因,见表3。

表3 关键基因信息表Table 3 Key gene information table
当细胞膜中的PA 含量增大导致累积时,过量积累的PA 会破坏细胞膜稳定性导致褐变。当植物受到非生物胁迫时,PA 主要通过两种不同代谢途径产生:(1)磷脂酶途径,PLD 作用于PC、PE 等磷脂,产生PA。(2)在PLC/DGK 通路中,NPC 可以通过分解PC 或PE 产生DAG,DAG 则留在细胞膜内,被DGK 迅速地磷酸化生成PA[14]。可以看出PLD、DGK、NPC这三个基因是控制PA 信号生成的关键[15]。孙华军[16]研究发现冷藏120 d 后南国梨会发生褐变且PLD 活性及基因表达与短期冷藏(期间未发生褐变)相比显著上调。盛蕾[17]研究表明冷藏后果皮褐变发生期间,果皮中PuPLD基因表达水平显著上调,促使了褐变的发生。上述研究结果表明高温,低温处理后会诱导PLD基因上调表达,并且PLD基因表达量的变化和果实褐变有着密切的联系。在本试验中不同脱水方式下,PLD表达水平随着失水程度的加深逐渐上调,褐变的无核白与未褐变相比也上调表达,未褐变的无核白在慢速脱水组中的表达量大于快速脱水组,说明当PLD表达量上调时,加速了膜脂降解的作用,PA 累积量不断增大,最终破坏细胞膜稳定性和完整性,PPO 和酚类物质接触,导致褐变;慢速脱水方式相较于快速脱水方式可能更能加速膜脂降解的作用。
Singh 等[18]研究发现水稻NPC4 在干旱胁迫下表达量上调。Gu 等[19]研究发现玉米DGK基因在干旱处理下的表达量也显著上调。从以上结果中可以看出NPC、DGK基因可以响应干旱等非生物胁迫,并且被诱导上调。与本试验结果相似,本试验中随着失水程度的加深,NPC4与DGK5基因的表达量上调。说明脱水胁迫同样也会使NPC4与DGK5基因表达量上调。张馨媛[20]利用Ca2+拮抗剂对采后的青椒果实进行处理后发现,Ca2+拮抗剂促进PLC/DGK基因表达时,会积累更多的PA,从而加重了青椒果实的冷害,而氯化钙处理后抑制PLC/DGK基因表达时,会抑制PA 的产生,从而减轻冷害。NPC4 会水解倾向于形成双分子层结构的PC 且水解活性远远大于形成非片层结构的PE[21]。在本试验中发现不同脱水方式下,褐变的无核白相较于未褐变的NPC4与DGK5表达水平上调。褐变的无核白在慢速脱水组中的表达量高于快速脱水组。结合本试验结果与上述研究,可以说明当NPC4与DGK5基因表达量上调时,PC 水解导致细胞膜中累积PA,这可能是细胞膜稳定性被破坏,导致无核白褐变的原因之一;且慢速脱水方式相较于快速脱水方式可能更容易加速膜脂降解的作用。
LOX 是膜脂降解下游反应的关键酶,LOX 对亚油酸和亚麻酸等进行氧化,生成膜脂过氧化产物丙二醛(Malondialdehyde,MDA),引起细胞膜降解,破坏细胞膜的完整性,促进褐变[22]。盛蕾[17]研究表明程序降温或间歇升温处理会使PuLOX 表达量下调,缓解了南果梨褐变。韩云云[23]研究表明,与急速降温相比,缓慢降温处理后可以抑制中采鸭梨果实中LOX 基因的表达量,从而减少果心褐变的产生。本研究中发现,不同脱水方式下,褐变的无核白相较于未褐变的LOX 表达水平上调,褐变的无核白在慢速脱水组中的表达量高于快速脱水组。说明当LOX 表达量上调时,促使了膜脂过氧化的发生,最终破坏细胞膜完整性,可能是导致无核白褐变的原因之一;慢速脱水组相较于快速脱水组可能更易发生膜脂过氧化。
LPP2 是Ⅱ型PAP 可以催化PA 生成DAG,其基因表达量的变化较大的影响着植物体PA 和DAG的含量,进而调控植物脂类代谢、胁迫响应等过程。其中DAG 可以被脂肪酶去酯化释放出游离脂肪酸,释放的脂肪酸可被LOX 作用导致膜脂过氧化,破坏细胞膜稳定性和细胞膜结构,从而发生酶促褐变[24]。张今杰[25]研究发现玉米LPP2基因在干旱、冷热等胁迫下会被诱导表达呈现上调,与本研究结果相似。本研究中发现,不同处理组中,随着失水程度的加深LPP2基因表达量上调,褐变的无核白相较于未褐变的LPP2 表达水平上调,褐变的无核白在慢速脱水组中的表达量高于快速脱水组。说明当LPP2 的表达量上调时,可能加速了膜脂过氧化,破坏了细胞膜完整性,使PPO 和酚类物质接触,导致无核白在脱水过程中褐变;慢速脱水处理组相较于快速脱水处理组可能更容易促使膜脂过氧化的发生。
DAG 可在MGD 酶和DGD 酶作用下相继形成MGDG和DGDG[26]。DGD1是合成DGDG的主要酶,植物体中DGDG 含量的变化会受到DGD 基因变化的影响[27,28]。MGDG 分子呈圆锥形,倾向于形成六角形Ⅱ结构,会导致膜泄露。DGDG 倾向于形成双分子层结构,有利于细胞膜稳定性[29]。彭澎[30]研究发现当水稻DGD1 基因在受到干旱和热胁迫后表达量呈现下调趋势,与本研究结果一致。本研究结果显示,在不同脱水处理组中,未褐变的无核白相较于褐变的DGD1 表达水平上调,说明DGD 表达量上调,可能利于细胞膜的稳定性,减少无核白在脱水过程中的褐变。
在不利环境中,膜脂过氧化过程中会产生分解产物醛类,这些醛类在细胞膜堆积后,会破坏其稳定性。ALDH 可将有细胞毒性的醛类氧化成无毒的羧酸,降低膜脂过氧化,提高植物对不利环境耐受,是植物体内重要解毒机制[31]。Kishitani 等[32]研究发现水稻胚乳中ALDH 基因功能丧失时会导致种子在干燥和贮藏过程中褐变。Kotchoni 等[33]研究得出ALDH7B4 过表达能减少植物体内细胞脂质过氧化产物MDA 的含量,且ALDH7B4 的缺失突变体在脱水胁迫后,其在胁迫中对植物体的保护作用也被削弱。本研究结果显示,在不同脱水组中,未褐变的无核白相较于褐变的ALDH7B4表达水平上调,褐变的无核白在慢速脱水组中的表达量小于快速脱水组。说明ALDH7B4表达量上调时解除了无核白醛中毒,有利于细胞膜稳定性,减少了无核白干制褐变;快速脱水组相较于慢速脱水组可能会促进ALDH7B4 基因解除醛中毒和抑制脂质过氧化的功能。
2.6 荧光定量验证转录组数据准确性
利用转录组测序筛选出7 个与膜脂降解代谢相关的基因,对这些基因进行实时荧光定量验证。如图6 所示这7 个基因转录组测序和实时荧光定量二者的相关系数R2为0.78,并且从差异倍数分析出7 个基因的表达趋势与转录组测序的结果具有高度的相似性。因此,可以说明转录组测序数据与qRTPCR 数据基本一致,表明本试验转录组的测序数据具有较高的可靠性。

图6 关键基因的转录组表达量与qRT-PCR 验证Fig.6 Key genes in membrane lipid metabolism pathway and qRT-PCR verification
3 结论
为了更全面的了解无核白脱水褐变与膜脂降解代谢的相关性,提高无核白绿品级,本研究利用转录组测序技术筛选膜脂降解代谢相关的关键基因,试验中共检测了28 个样本,所有样品的Q20均在97.43%以上,Q30 均在93.2%以上,满足后续分析要求。本研究重点对两个不同脱水方式下失水50%时未褐变与褐变无核白的比较组中产生的差异基因进行研究分析,旨在排除其他干扰因素,尽可能筛选出因脱水褐变而引起差异的基因。在快速脱水组筛选出718 个差异基因,慢速脱水组2 259个。将上述基因进行GO 功能富集和KEGG 富集分析,筛选出43 个膜脂代谢相关的差异基因,归类于5 种膜脂代谢相关途径。这些都是潜在的与无核白脱水褐变相关的关键基因。从这些候选基因中最终筛选出7 个无核白脱水褐变过程中膜脂降解代谢相关关键基因,分别为ALDH7B4、LOX、LPP2、DGK5、NPC4、PLDα1、DGD1。经qRT-PCR 验证发现本次转录组测序数据具有较高的可靠性。通过对相对表达量在不同处理组的差异性分析发现,在两种不同脱水方式中,未褐变的无核白相较于褐变的ALDH7B4、DGD1基因水平均上调,上述基因上调表达有可能会抑制膜脂代谢,有利于细胞膜的完整性,阻碍了PPO 和酚类物质接触,减少了无核白脱水褐变;褐变的无核白相较于未褐变的LOX、LPP2、DGK5、NPC4、PLDα1基因水平均上调,上述基因上调表达可能会促进膜脂代谢,不利于细胞膜完整性,加速了无核白褐变。并且相较于慢速脱水方式,快速脱水方式有可能会抑制无核白在脱水过程中的膜脂代谢作用,保持细胞膜完整性,从而抑制褐变。
根据本研究可以肯定与新鲜果实相比,失水50%的未褐变果实的膜脂是发生了显著变化,因此可以推论膜脂代谢是影响褐变的重要因素之一,但一定还有除膜脂代谢以外的因素共同起着作用影响着无核白褐变,故膜脂代谢在无核白脱水褐变的过程中的具体功能和作用需进一步深入研究。

