九蒸九制对鸡头黄精理化性质及抗氧化性的影响
王俊楠,卢琪,薛淑静,陈晓春,张春兰,杨德*
(1.湖北省农业科学院农产品加工与核农技术研究所,湖北武汉 430064)
(2.塔里木大学食品科学与工程学院,新疆阿拉尔 843300)
(3.恩施州源惠科技开发有限公司,湖北恩施 445000)
黄精为百合科植物,广泛分布于南方热带外的地区,资源丰富。经研究发现黄精中含有多糖、总酚、黄酮、皂苷、木脂素、氨基酸等多种对人体有益的化学成分。中医认为,黄精味甘、平,补气益肾、耐寒暑、助筋骨,可作久服补养之品,并且无大补温燥之品可能带来的副作用。现代药理研究也证明,黄精具有抗自由基、延缓衰老、提高自身免疫力、改善记忆力、降血糖、降血脂、防止动脉粥样硬化等功效[1,2],在保健食品中被广泛应用[3],具有广阔的市场前景。生黄精具有麻舌感、咽喉刺激性,不宜直接食用,通过炮制可消除其原有刺激性和致敏性,减轻其毒副作用,使有效成分积累,增强药效[4,5]。黄精炮制方法众多,有单蒸、酒制、九蒸九制、重蒸、发酵等,主要以“九蒸九制”为代表,这些炮制方法对黄精有效成分均有一定影响,但对炮制过程中功效成分变化的研究较少。
代谢组学是继基因组学、转录组学、蛋白质组学之后又一重要研究方向,可对生物体或细胞中的所有小分子量代谢物进行定量、定性的分析研究。可以利用代谢组技术迅速获取生物体代谢组信息,并对样本进行分类,在食品加工理化特性方面应用广泛。利用非靶代谢组对黄精细胞内外的全部代谢物进行了定性和半定量的研究,得到了其体内和体外的全部代谢物的信息。
本文采用常压蒸制结合热泵干燥法进行炮制,并探究随着蒸制次数增加其黄精中有效成分含量变化规律,并利用非靶向代谢组学的方法及高效液相色谱串联质谱技术,检测分析始末蒸次黄精代谢物组分及变化规律,为深入挖掘黄精功能成分及药理作用机制,提高黄精利用率和开发功能性黄精产品提供新思路。
1 材料与方法
1.1 材料与试剂
黄精:取自四年生鸡头黄精块茎;果糖、葡萄糖、蔗糖、Vc、芦丁(标准品>98%),上海源叶生物科技有限公司;ABTS+· 试剂盒,上海碧云天生物技术有限公司;Folin-Ciocalteu 试剂、2,2-二苯基-1-苦基肼基(DPPH)、1,3,5-三(2-吡啶基)-2.4.6-三嗪(TPTZ),上海源叶生物科技有限公司;DNS试剂,索莱宝生物科技有限公司;香草醛、冰醋酸、碳酸钠、盐酸、高氯酸、浓硫酸、无水乙醇、福林酚、六水合三氯化铁等均分析纯试剂,国药化学试剂有限公司。
1.2 仪器与设备
Multiskan GO 酶标仪,美国Thermo Fisher 公司;XHF-DY 高速均质机,宁波新芝生物科技有限公司;KQ5200DE 超声波清洗仪,昆山市超声仪器有限公司;CR-400 色差仪,日本Minolta Camera公司;LC-20AT 高效液相色谱仪,日本岛津公司;DHG-9140 热泵干燥机,上海一恒科学仪器有限公司;Thermo Vanquish UHPLC 超高效液相色谱仪、Q-Exactive HF 高分辨质谱,美国Thermo Fisher 公司;Zorbax Eclipse C18(1.8 μm×2.1 mm×100 mm)色谱柱,Agilent technologies 公司;TGL-16M 离心机,长沙高新技术产业开发区湘仪离心机仪器有限公司;JXFSTPRP-48 全自动样品快速研磨仪,上海净信实业发展有限公司;FD-IA-50 冷冻干燥机,上海比朗仪器制造有限公司;NMI20-025V-1 核磁共振成像仪,苏州纽迈分析仪器股份有限公司。
1.3 试验方法
1.3.1 样品制备及感官评价
选取品质良好、无霉变的鸡头黄精生品,洗净、去除根须,100 ℃常压蒸制2 h 后于60 ℃热泵干燥机中干燥使其水分含量达到20%左右,即得一蒸一制黄精,如此反复九次即得九蒸九制次黄精样品,记录并描述其感官特征[6]。
1.3.2 色度分析
将制得的黄精样品用多功能粉碎机粉碎,过40目筛,备用。色差仪[7]测定黄精粉条件:光源D65,口径30 mm,标准观察角10°,使用前用黑白比色板校准,取一定量样品平铺于培养皿进行测定,记录L*(颜色亮度)、a*(红绿色值)、b*(黄蓝色值)相应值,测量5 次,取其平均值,计算总色差值E*ab。
1.3.3 水分形态
将九蒸九制后的黄精切成长宽1 cm 左右的厚片,采用低场核磁共振成像仪对黄精样品中水分形态进行分析,CPMG 序列参数如下:SW(kHz)=100,SF(MHz)=20,P1(us)=8.00,P2(us)=15.52,DRG1=3,PRG=1,TW(ms)=1 500.000,TE(ms)=0.300,NECH=5 000,NS=4,重复三次扫描,弛豫时间范围为0.001~10 000 ms,反演个数=200,迭代次数=1 000 000,根据弛豫时间(T2)和振幅面积(S)进行分析。
1.3.4 还原糖含量测定
参照吴丰鹏等[8]的方法制备黄精还原糖、多糖待测液。配置葡萄糖标准溶液(1.00 mg/mL),参考文献[9]的方法测定,得线性回归方程为:Y=2.519X-0.041 6(R2=0.999 3),在0.1~0.6 mg/mL范围内线性关系关系良好。
1.3.5 多糖含量测定
配置葡萄糖标准溶液(1.00 mg/mL),参照潘东梅[10]方法测定,得标准曲线为:Y=3.459 1X+0.033 3(R2=0.998 8),在0.0~0.7 mg/mL 范围内线性关系关系良好。
1.3.6 单糖组分分析
1.3.6.1 色谱条件
色谱柱:Shodex NH2P-50-4E(4.6 mm×250 mm,5 µm),保护柱:NH2P-50G 4A(4.6 mm×10 mm),流动相为水(A 相)和乙腈(B 相),A:B=25:75,流速:0.8 mL/min,柱温:30 ℃,进样量5 µL,ELSD 参数:雾化管温度=40 ℃,载气流速=2.5 L/min。
1.3.6.2 标准溶液的配制
精密称取D-果糖、D-葡萄糖、D-蔗糖标准品用超纯水定容于2 mL 容量瓶中,得混合标准溶液(果糖2.0 mg/mL、葡萄糖2.5 mg/mL、蔗糖2.4 mg/mL)。
1.3.6.3 供试样品的制备
精密称取0.1 g 黄精粉,加2 mL 超纯水,涡旋混匀后用细胞破碎机8 000 r/min,破碎1 min,离心,取上清液,经0.45 µm 微孔水相滤膜过滤,作为黄精粉中单糖待测液。
1.3.7 水提液pH值测定
参照徐明锋等[1]的方法略作修改,取九蒸九制后的黄精粉0.5 g,加12.5 mL 蒸馏水,沸水浴回流2.5 h,冷却至室温,抽滤,补足所失水分,测定各个水提液pH 值,重复测定三次,取其平均值。
1.3.8 总酚含量(TPC)测定
总酚含量的测定采用Folin-Ciocalten 法[11],样品总酚含量以每克干样品中没食子酸毫克数表示(mg GAE/g DW)。所得标准曲线:Y=0.007 9X+0.075 9(R2=0.999 1),在10~200 mg/L范围内线性关系良好。
1.3.9 总黄酮含量(TFC)测定
参照文献[12]的最优方案,并略作修改。称取一定量的黄精粉末,加入20 倍体积的φ=80%乙醇溶液,于70 ℃下超声1 h,提取2 次,合并滤液。按照文献[10]的测定方法进行黄酮含量的测定并计算含量,得标准曲线Y=0.864 3X+0.002 7(R2=0.998 3)。
1.3.10 抗氧化性研究
ABTS 自由基清除能力参照试剂盒说明书进行操作[13-15],样品抗氧化能力(Trolox-Equivalent Antioxidant Capacity,TEAC)来表示,结果表示为mmol/L。所得标准曲线:Y=0.779 3X-0.003 5(R2=0.999 5),在0.15~1.5 mmol/L 浓度范围内线性关系良好。
DPPH 自由基清除能力测定参照王若男等[16]的方法测定。
FRAP 铁离子还原/ 抗氧化能力测定参照Tang 等[17]和Wang 等[18]的方法,略作修改,结果用Vc 标品浓度(mmol/L)定义FRAP 值。得线性回归方程为:Y=0.002 8X+0.261(R2=0.999 1),在0.12~0.6 mmol/L 浓度范围内线性关系关系良好。
1.3.11 色谱-质谱分析
1.3.11.1 样品提取
分别称取一制(对照)和九制(九蒸)的样品100 mg 置于2 mL 离心管中加入1.0 mLφ=70%甲醇和3 mm 规格钢珠,用全自动样品快速研磨仪(JXFSTPRP-48,70 Hz)震荡破碎3 min,冷却后低温超声(40 kHZ)10 min。4 ℃低温下12 000 r/min离心10 min,取上层清液稀释2~100 倍,过0.22 μm PTFE 滤头上机检测。
1.3.11.2 色谱-质谱分析条件
色谱柱:C18 色谱柱(Zorbax Eclipse C18 ,1.8 μm×2.1 mm×100 mm),流动相组成为0.1%甲酸水溶液(A)和乙腈(B),流动相洗脱程序:0~2 min,5% B;2~7 min,30% B;7~14 min,78%B;14~20 min,95% B;20~ 25 min,5% B,柱温:30 ℃;流速:0.3 mL/min;进样量:2 µL,自动进样器温度4 ℃。
正、负模式:加热器温度325 ℃;鞘气流速:45 arb;辅助气流速:15 arb;吹扫气流速:1 arb;电喷雾电压:3.5 kV;毛细管温度:330 ℃;S-Lens RF Level:55%。
1.3.12 数据统计分析
2 结果与讨论
2.1 感官评价
由图1 可以看出,黄精在九蒸九制过程中色泽逐渐变深,并且伴有一定的焦香、香甜味。麻舌感逐渐降低,苦味上升,质地变软,内部孔隙逐渐变大。表1 从色泽、气味、口感和组织状态对黄精蒸制过程中的变化进行记录,发现蒸制5~6 次黄精开始无麻口,口感微甜,蒸制6 次后焦糊味和苦味增强。《实用中药炮制学》中也曾提到黄精蒸制终点“蒸至药物黑透或蒸至药物质地变软”[19],并没有对黄精蒸制次数的要求,因此建议黄精炮制6 次即可。

表1 1~9 次蒸制黄精感官性状描述Table 1 Sensory characteristics of Polygonatum steamed for 1~9 times

图1 1~9 蒸制黄精Fig.1 Polygonatums steamed for 1~9 times
2.2 色泽变化
实验测得1~9 蒸次黄精的a*(红绿值)、b*(黄蓝值)、L*(颜色亮度)及E*ab(总色差值)见表2。从测定结果可以看出,随着蒸制次数的增加,a*从一制到七制逐渐增加,八九制略有下降,呈显著上升趋势(P<0.05)与蒸制过程中样品颜色由淡黄色转变为黑褐色外观变化基本保持一致。L*整体呈现递减趋势,从一制49.67 到九制10.97,四制和七制明度值相较于前一制有所提高分别为40.12 和28.61,从二制开始各个蒸制品的明度有明显差异,呈显著下降趋势(P<0.05)。总色差有着明显的差异,总体大小的趋势逐渐降低(P<0.05)。蒸制次数对黄精a*、b*、L*及E*ab 值均有显著性差异(P<0.05)。黄精颜色随着蒸制时间的增加逐渐加深,可能与炮制过程中美拉德反应有关,致使黄精内部类黑精含量增加,该结论与Jin 等[20]研究结果相似。

表2 1~9次蒸制黄精色度值Table 2 The chroma value of Polygonatum for 1~9 times
2.3 水分形态分析
核磁中弛豫时间(T2)反映了样品内氢质子的约束力和自由度,与食品中的自由水含量有着密切关系,即弛豫时间越长,水分活度越高,自由水含量也随之增加[21,22]。如图2 所示,经多次蒸制后弛豫时间(T2)向左偏移,表明蒸制后黄精水分自由度降低;并且随着蒸制次数的增加,黄精横向弛豫时间缩短,信号振幅也显著性降低,说明在干燥初期黄精中游离水流动性较大,大分子物质束缚作用较低,弛豫时间较长,后期蒸制次数增加,水流动性降低,黄精中水分子与蛋白质、多糖等结合,使其弛豫时间缩短。表明随着蒸制次数的增加,黄精样品中水分活度和含量显著降低,这种变化可能和蒸制过程中大分子变化有关,这与李芷芊等[23]研究的微波干燥过程中黄精切片水态和组织结构变化结论一致。

图2 1~9 次蒸制黄精水态分析Fig.2 Water status of Polygonatum for 1~9 times
2.4 还原糖含量变化
如图3 所示,随着蒸制次数的增加,还原糖含量总体呈现递增趋势,还原糖含量由1.99%增加到28.69%,还原糖含量增加了约14 倍,可能是由于黄精经炮制后黏多糖大量水解成低聚糖、单糖。马灵珍等[24]也研究发现熟地黄还原糖含量随着蒸制次数增加呈波动式上升,与本研究得到的结果类似。因此还原糖可以作为黄精质量控制指标之一。

图3 1~9 制黄精还原糖含量变化Fig.3 Reducing sugar content changes of Polygonatum steamed for 1~9 times
2.5 多糖含量变化
如图4 所示,多糖的含量随蒸制次数的增加而降低,三制后多糖的含量趋于稳定,从六制到九制中间有所起落。多糖含量增加可能是由于黄精经多次蒸制后质量下降,且黄精多糖分子中含有大量羟基,分子间相互作用形成不同程度聚集体,进而导致多糖含量增加。多糖含量的逐渐递减是由于在蒸制过程中黄精处于高温高湿状态下,使其水解成单糖和低聚糖,这与吴丰鹏等[8]和陈瑞瑞等[10]对九蒸九制多糖含量变化研究结果一致。且部分糖类成分随着蒸制溶于水中,造成一定量损失。单佳乐[25]研究表明在蒸制过程中黄精多糖不仅发生降解还有聚集。

图4 1~9 制黄精多糖含量变化Fig.4 Polysaccharide content Changes of Polygonatum steamed for 1~9 times
2.6 单糖分析
2.6.1 线性回归方程和相关系数
吸取5、10、15、20 μL 混合标准品,分别进样分析,得到以峰面积对数(Y)为纵坐标,进样质量对数(X)为横坐标的线性回归方程(表3),色谱图见图5。

表3 4 种单糖线性回归方程、相关系数和线性范围Table 3 Regression equation,correlation coefficient and linear range for four monosaccharides

图5 混合标准溶液的HPLC-ELSD 分离色谱图Fig.5 HPLC-ELSD separation chromatogram of mixed standard solution
2.6.2 样品含量检测
取待测样液5 μL,重复测定2 次,按照1.3.6.1色谱条件测定并记录相应峰面积,代入标准回归方程得出各种糖含量,结果见表4,色谱图见图6。

表4 1~9制水溶性糖分析结果Table 4 Analysis results of 1~9 water-soluble sugars (n=2, mg/g)

图6 1~9 制黄精HPLC-ELSD 分离色谱图Fig.6 HPLC-ELSD separation chromatogram of Polygonatum for 1~9times
在蒸制过程中,随着蒸制次数增加,果糖含量逐渐增加,在七制时达到峰值247.72 mg/g,随后果糖含量小幅度起伏,黄精中葡萄糖含量大体呈现逐步递增趋势,在四制时有小幅度下降约为0.12 mg/g,此现象说明在高温条件下,黄精细胞壁遭到破坏,使其糖类物质释放。并且随着时间延长,黄精中的多糖组分经过水解,变成果糖、葡萄糖等一系列的单糖。果糖和葡萄糖含量在蒸制过程中出现小幅度下降可能是由于单糖成分与氨基酸类成分发生美拉德反应所导致[26],使其发生异构化和降解,吴丰鹏等[8]也研究时发现葡萄糖含量在前两次蒸制出现降低,但随着蒸制次数的增加其含量也逐步提高,与本实验结果相似。另外黄精中蔗糖含量随着蒸制次数的增加呈现先增大后降低的趋势[25]。詹慧慧等[27]也在对黄精、滇黄精和多花黄精中游离糖含量测定动态中发现黄精在炆制不同时间后发现蔗糖含量也出现先增加后降低的现象,表明蔗糖含量因水解作用降低,而作为水解产物的葡萄糖和果糖含量随之增大。
2.7 水提液pH值变化
如图7 所示,随着蒸制次数的增加,黄精水提液pH 值不断减小,从一制的5.26 到九制4.07,在八制时水提液pH 值达到最低值4.03。研究表明美拉德反应过程中pH 值的大小与碱性氨基酸含量及甲酸、乙酸等有关[28,29]。

图7 1~9 次蒸制黄精水提液pH 值Fig.7 pH value of extract of Polygonatum steamed for 1~9 times
2.8 总酚含量变化
如图8 所示,随着蒸制次数的增加,总酚提取量呈波动式上升。在第八次蒸制后总酚含量达到最大为12.16 mg/g,九制达到10.02 mg/g,其中在第七次和第九次蒸制后总酚提取量较前一次有小幅度的降低,但总体上仍呈现上升趋势。这是因为在热处理工艺中,某些细胞成分和细胞壁组分发生,或通过高温作用而降解,从而加速了游离态多酚的释放。李芷芊等[23]研究表明,适当的提高蒸制时间并对样品进行热风干燥处理有利于提高黄精切片中多酚含量的结果一致。张忠义等[30]研究表明大蒜经蒸汽热处理后会提高TPC 含量。

图8 1~9 次蒸制黄精总酚含量Fig.8 Total phenolic content of Polygonatum steamed for 1~9 times
2.9 黄酮含量变化
如图9 所示,随着蒸制次数的增加,黄酮含量呈现波动式增长,变化范围为0.10%~0.82%,在第八制时达到最大含量0.82%。可能是由于高温条件下,黄精细胞壁被破坏,使内部黄酮类物质溶解释放。郭旭琴[31]研究表明温度调节因子是影响黄酮类化合物合成的首要因子,且与样品处理时间有很大关系。

图9 1~9 次蒸制黄精黄酮含量Fig.9 Flavonid content of Polygonatum steamed for 1~9 times
2.10 抗氧化性与总酚、黄酮等的相关性分析
ABTS 在适当的氧化剂作用下氧化成绿色的ABTS+,并能在一定程度上抑制其生成。如图10a所示,蒸制次数越多,清除ABTS+的能力越强,总抗氧化能力范围在0.38~0.73 mmol/L。从一制到五制样品总抗氧化能力呈跨越式增长,五制之后总抗氧化能力趋于平缓,小幅度增长,在七制时抗氧化能力最强为0.73 mmol/L。

图10 1~9 次蒸制黄精抗氧化活性Fig.10 Antioxidant activity of Polygonatum steamed for 1~9 times
DPPH 自由基与抗氧化剂发生反应,使其被还原成非自由基,可以通过吸光度变化范围来定量[32]。如图10b 所示,不同蒸制次数均有清除DPPH 自由基的作用,且清除效率呈现显著性量效关系,即随着蒸制次数的增加,对DPPH 自由基清除的能力越强,清除率变化范围在31.03%~81.95%,在八制时清除率达到最大为81.95%。
FRAP 体现了抗氧化剂的还原性,利用单电子转移(SET)的原理[33]。如图10c 所示,经不同蒸制次数处理得到的黄精样品FRAP 值,蒸制次数大体上与FRAP 值呈现正相关关系,FRAP 结果变化范围为0.25~1.97 mmol/L,在第七制时相较于前一制略有下降达到1.18 mmol/L,在第八制时达到最大值为1.97 mmol/L。
综上可以看出随着蒸制次数的增加,黄精中总酚与总黄酮含量成正相关,且其含量与抗氧化能力也呈正比,在Tang 等[17]和Wang 等[18]的研究中结论相似 。此外,已有研究显示,有研究表明黄精经过炮制后得到的类黑精成分具有较好的抗氧化性、抗自由基、补肾健脾的功效[34]。
2.11 色谱-质谱分析
2.11.1 代谢物定量分析
2.11.1.1 QC 样本TIC 总离子流图重叠分析
使用Compound Discoverer 3.3 进行保留时间校正、峰识别、峰提取、峰积分、峰对齐等,并通过Thermo mzCloud 在线数据库,Thermo mzValut 当地数据库,Chem Spider 数据库等来完成样品的鉴别对待测样品进行定量分析得出在正离子模式下共检测到1 310 种代谢物;在负离子模式下共检测到1 841 种代谢物。
质控样本(QC)是将样本提取物混合配制,以保证样品在同一工艺条件下的重现性,混样质控QC 样本的总离子流图(Total Ions Current,TIC),横坐标为代谢物检测的保留时间(Retention Time,Rt),纵坐标为离子检测的离子流强度。图11 依次为正、负离子模式下的质控样本TIC 重叠图。发现不同时间下的QC 样本TIC 重叠效果比较好,说明机器的稳定性比较好。
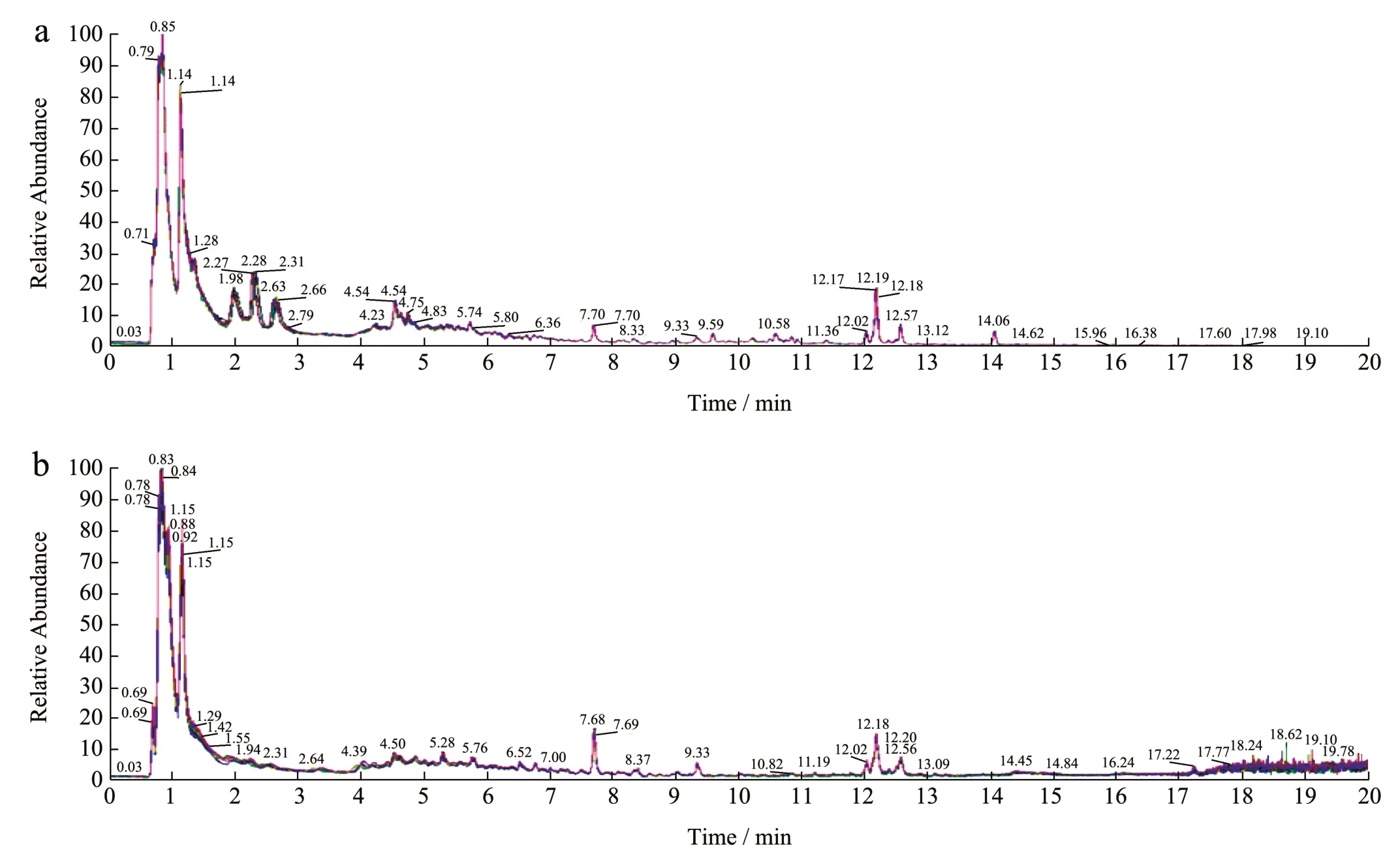
图11 质控样本TIC 重叠图Fig.11 TIC overlap chart of QC samples
2.11.1.2 主成分分析(PCA)
通过观察质控样本间的离散度,可以得知仪器分析的稳定性和可靠性,所有样本的主成分分析结果如图12 所示,分别为黄精一制样品与九制样品正、负离子模式下PCA 分析图,累计R2X >0.5,说明PCA 模型拟合效果好,可用于数据主成分分析。质控样本QC 组数据点较为集中,所有样品数据点均处于95%置信区内,一制样品与九制样品完全分离,差异性明显,且每组样品组内差异性小,说明仪器和方法稳定性和准确性较好。
2.11.2 多元统计分析
2.11.2.1 差异代谢物筛选
采取将差异倍数(Fold Change)和P值相结合的方法来筛选差异代谢物。代谢物在对照组和实验组中差异为2 倍以上或0.5 以下,则认为差异显著;VIP 值表示对应代谢物的组间差异在模型中各组样本分类判别中的影响强度。在上述的基础上,使用t-Test 假设检验选取P-value≤0.05,表示显著性差异。
利用火山图(Volcano Plot),可以迅速查看两组代谢物的表达水平和差异的统计学意义,从而更好地筛选出不同的代谢物。
火山图中每个点代表一个代谢物,横坐标代表该组对比各物质的倍数变化,纵坐标表示student’st检验的P-value,散点大小代表OPLS-DA 模型的VIP值,散点越大VIP 值越大,所筛选出的差异表达代谢物也就更可信。图13 中绿色、红色、黑色点分别代表下调差异表达代谢物、上调差异表达代谢物和差异不显著的代谢物[35]。
筛选得到差异代谢产物如下表5、表6 所示,在正离子模式下共有176 个显著差异代谢物,其中有5 个上调表达代谢物,分别为苯及其取代衍生物(1)、吡咯烷(1)、羧酸及其衍生物(2)、其它类(1),171 个下调表达代谢物主要有羧酸及其衍生物(44)、吡啶及其衍生物(9)、苯及其取代衍生物(8)、有机氮化合物(8)、吲哚及其衍生物(6)、有机氧化合物(5)、其它类(45)等。负离子模式下共有148 个显著差异代谢物,其中有15个上调表达代谢物,羧酸及其衍生物(4)、苯及其取代衍生物(2)、有机氧化合物(2)、脂肪酰类(1)、黄酮类化合物(1)、吡咯烷(1)、其它类(4),133 个下调表达代谢物主要有羧酸及其衍生物(19)、有机氧化合物(12)、苯及其取代衍生物(7)、脂肪酰类(5)、甘油磷脂(3)、吡啶及其衍生物(2)、黄酮类化合物(2)、拟肽类(2)、咪唑嘧啶类(2)、肉桂酸及其衍生物(2)、其它类(63)等。

表5 正离子模式下差异代谢产物统计表Table 5 Statistical table of metabolite quantity in positive ion mode
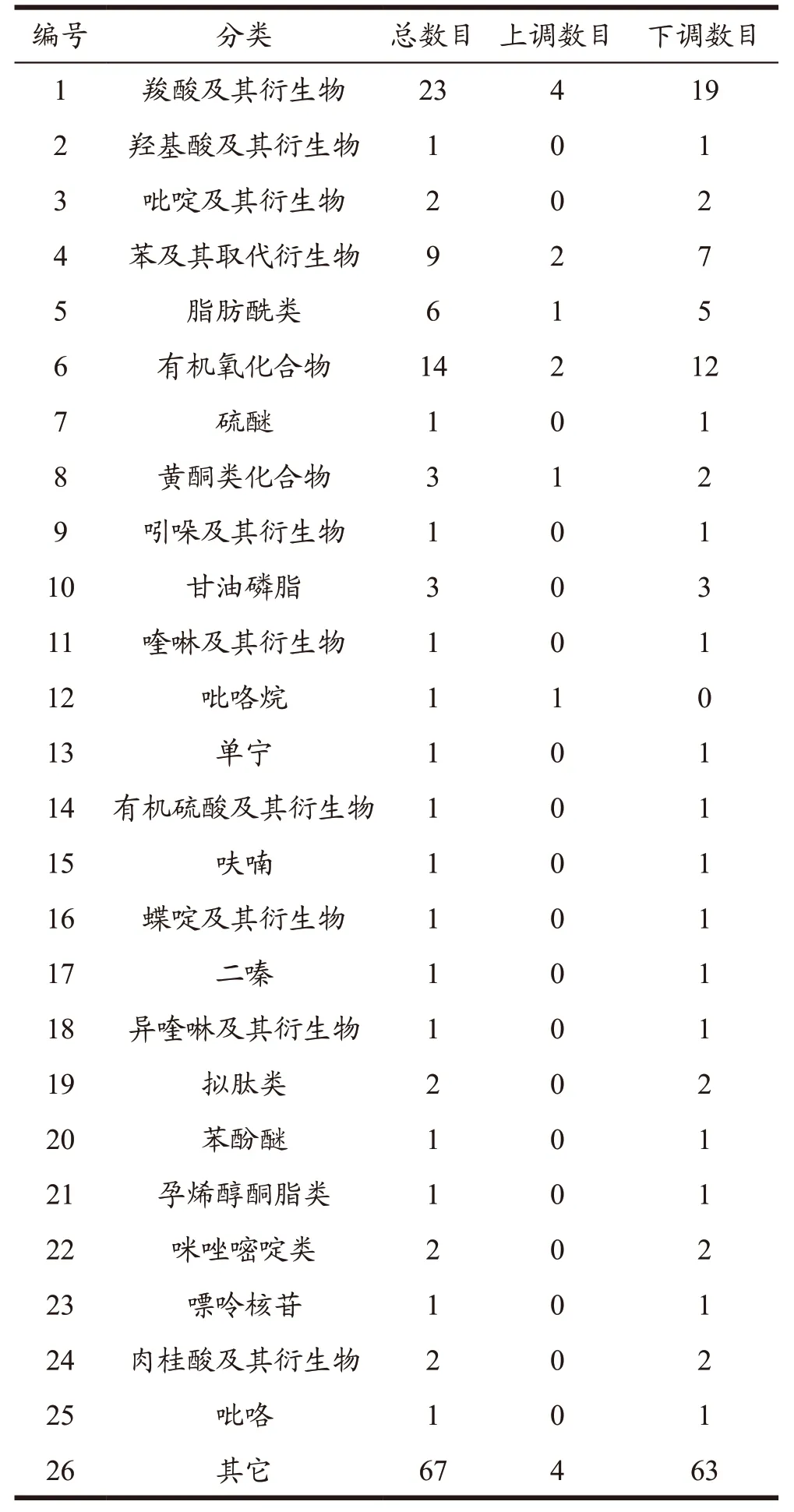
表6 负离子模式下差异代谢产物统计表Table 6 Statistical table of metabolite quantity in negative ion mode

表7 组间差异代谢物数量统计表Table 7 Statistical table of metabolite quantity between groups
2.11.2.2 聚类热图分析
聚类分析(Cluster Analysis)是对样品或指标进行分类的一种多元统计分析方法,通常能简单、直观的观察数据特征[36,37]。图14 中右侧区域代表表达量较高的差异代谢物,左侧区域代表表达量较低的差异代谢物,通过进一步筛选对两组样本进行聚类分析,由图14 所示对照组样品主要集中在右侧高表达区域,九制样品主要集中在左侧低表达区域,即对照组样品中差异代谢物含量远远高于九制样品。

图14 差异代谢物聚类热图Fig.14 The clustering heat map of differential metabolities
2.11.3 代谢通路分析
2.11.3.1 差异代谢物KEGG 功能注释
利用KEGG 数据库对差异代谢物进行注释,部分结果如表8 所示。

表8 样本差异代谢物KEGG功能注释正离子模式统计表Table 8 Statistical table of KEGG pathway informtion of sample in positive ion mode
2.11.3.2 差异代谢物富集分析
根据注释结果,利用Metabo Analyst R 进行KEGG 通路富集[38,39],结果展示如下:其中正离子模式下差异代谢物共有29 条通路(表8),在筛选出来的176 个显著差异代谢物中被KEGG 注释到的有75个,且全部显著下调,主要分布在30 条代谢途径中(图15a)。负离子模式下差异代谢物共有25 条通路(表9),在筛选出来的148 个显著差异代谢物中被KEGG 注释到的有44 个,其中43 个显著下调,1 个显著上调(苯丙氨酸、酪氨酸和色氨酸的生物合成:预酪氨酸),主要分布在26 条代谢途径中(图15b)。图中Fold enrichment 值越大表示富集程度越大,P-value 值其越接近于0,表示富集越显著,图中点的大小代表富集到相应通路上的差异显著代谢物个数。

图15 样本差异代谢物KEGG 富集图Fig.15 KEGG enrichment analysis of differentially expressed metabolites sample
3 结论
结果表明随着蒸制次数增加,黄精外观颜色由浅黄色转变为黑褐色,质地柔韧,麻舌感逐渐消失,多糖含量减少,还原糖、总酚、黄酮等成分富集含量增加,抗氧化活性增强,多糖分子量发生变化,改变单糖组成比例,果糖、葡萄糖含量逐渐增加,蔗糖水解,经过九次蒸制后黄精水提液呈现弱酸性pH 值由5.26 下降到4.03。这可能是由于高温高湿条件下,发生Maillard 和焦糖化反应,引起糖的异构化和降解,使其在炮制过程中多糖和还原糖发生转化分解作用,产生的甲酸和乙酸等物质使水提液酸性增强,且该反应涉及羰基化合物和氨基化合物间反应,对黄精色泽和风味产生决定性作用。
采用LF-NMR 分析黄精水分迁移状况,蒸制后的黄精水分形态主要以结合水形式存在,以氢键形式与蛋白质分子紧密结合,蒸制时间越长水分与大分子物质结合越紧密,并于6、7 制时水分相态趋于稳定,选取一制和九制黄精进行全面代谢组学分析,结果发现,用PCA 和OPLS-DA 均可显著区分两组样品差异性。筛选其差异代谢物发现苯及其取代衍生物、吡啶及其衍生物、羧酸及其衍生物、有机氮化合物、有机氧化合物、脂肪酰类等物质差异性较为显著,为黄精活性成分的筛选与品质评价奠定了基础。
根据黄精蒸制色泽、风味、水分含量、还原糖等指标发现鸡头黄精蒸制次数达到第7 次即可达到最佳,由于炮制方法不同,对黄精最佳蒸次也不尽相同。本文针对湖北四年生鸡头黄精进行代谢组学分析,对其他不同产地、品种、生长年限黄精蒸制前后差异代谢物是否不同及其炮制过程中有效成分含量的变化与其功效性是否存在相关性有待实验验证。本研究对鸡头黄精进行炮制处理,为黄精最佳功效蒸制次数提供新思路,为研究鸡头黄精炮制工艺、作用机制具有参考性意义。

