CLK2 mRNA 在早期鸡胚中的表达及定位分析
房烨虹,齐 川,周发亮,赵 鹏,张若仪,赵海莉,任丽莉,刘 超,肖建英,刘乙蒙*
(1.锦州医科大学,辽宁 锦州 121000;2.锦州市妇婴医院遗传科,辽宁 锦州 121000;3.山东省滨州市中心医院口腔科,山东 滨州 251700 4.锦州医科大学基础医学院,辽宁 锦州 121000)
CLK基因编码的双特异性蛋白激酶CLK(CDK-like kinase)家族有四个成员:CLK1,CLK2,CLK3和CLK4。这四种激酶蛋白的C端均有一段高度保守的序列,对应着一个相同的氨基酸基序EHLAMMERILG,因此这些蛋白激酶又被称为LAMMER蛋白激酶[1]。其中,CLK2可使剪接体复合物的SR蛋白磷酸化从而调节RNA的选择性剪接[2]。这种调节机制广泛存在于生物体内,参与细胞周期进程、基因表达、细胞凋亡、胚胎发育、和端粒长度调节等生理过程。
CLK2在众多真核生物都有表达[3],近年来被发现在乳腺癌、肺癌、胃肠道肿瘤、肝癌等肿瘤组织中呈高表达,提示其可能是一种促癌激酶。除此之外,一些研究发现CLK2表达的抑制,可促使早期软骨的形成[11];对CLK2的抑制同时能抑制Wnt通路,从而促进细胞的分化,减轻炎症反应,促使大鼠肌腱损伤的修复[12];而CLK2在早期胚胎中的表达及其对发育的影响还未见报道。前期研究表明,CLK家族的另一成员CLK1在早期鸡胚发育过程中存在一定的表达特点[4]。为了进一步研究CLK家族在早期胚胎中表达及其作用,本研究构建相关质粒及探针,利用qPCR和原位杂交检测CLK2 mRNA在早期鸡胚发育中的表达及定位,为进一步研究CLK2及其整个家族在鸡胚中的功能和作用机制奠定基础。
1 材料与方法
1.1 材料与试剂
锦州医科大学畜牧兽医学院提供受精鸡蛋;pMD18-T Cloning Kit试剂盒、限制性内切酶Hind III 和Xba I购自Takera公司;从罗氏公司购得地高辛标记试剂盒;从invitrogen公司购得Platinum实时定量PCR试剂盒;从TransGen公司购得感受态细胞DH5α菌株。
1.2 鸡胚胎的制备
将受精鸡蛋放于37 ℃孵育箱中孵育到相应的阶段,根据汉伯格及汉密尔顿[5](Hamburger V,Hamilton HL)分期,孵化时间:4期12~13 h,6期23~25 h,8期26~29 h,10期33~38 h。敲除小部分蛋壳并用无菌注射器抽出大部分蛋清,以干燥洁净滤纸覆盖鸡的胚胎,随后小心沿边缘剪下胚胎并放入PBS缓冲液中,待用。
1.3 qPCR

qPCR结果利用SPSS 17.0进行统计分析,以 qPCR结果的2-△△CT做柱状图。组间比较采用t检验,P<0.01为差异有显著统计学意义。
1.4 CLK2重组质粒的构建
以早期鸡胚cDNA为模板,在反应体系中加入特异性引物,通过PCR实现目的片段扩增,其长度为574 bp。PCR扩增条件如下:95 ℃ 5 min;95 ℃ 30 s,58 ℃ 45 s,72 ℃ 1 min,30个循环;72 ℃ 10 min。上述步骤结束后进行电泳,以鉴定PCR产物。收集产物并进行纯化。连接目的基因与载体、转化、选取阳性克隆进行扩增培养,继而提取质粒,分别以HindIII和XbaI进行双酶切,随后送测序分析以进一步检验。
1.5 正、反义探针的合成
扩增测序后正确的质粒,采用XbaI和HindIII 进行酶切,使其线性化。以上一步得到的酶切片段为模板,通过T7体外转录,合成正、反义探针,并用地高辛标记探针;随后进行电泳,以明确反义探针的浓度及大小。若电泳条带清晰,且与预期大小一致,则将被用于后续操作。
1.6 原位杂交
使用PBS缓冲液洗涤先前待用的鸡胚胎2次,每5 min 1次;将蛋白酶K加入洗涤过的鸡胚5 min,使之分解;随后再次清洗1次,PBS 5 min;将鸡胚放入4%多聚甲醛溶液中固定10 min;以含有0.25%乙酸酐的DPEC去离子水处理10 min;加入预杂交液反应1 h,条件65 ℃,加入新杂交液过夜,反应条件70 ℃。上述步骤结束后在65 ℃下使用Hyb wash清洗两次以回收探针,每次5 min;洗涤后用含有2%的BBR和20%的FBS的MABT抗体稀释液封闭液室温封闭2 h,anti-DIG经1∶2000稀释,4 ℃摇床过夜;将处理好的鸡胚用MABT充分洗涤两次,每次各30 min;加入染料显色,拍照。
2 结果与分析
2.1 qPCR检测CLK2 mRNA的表达
根据Hamburger-Hamilton(HH)分期法[5]制备了4种发育阶段的鸡胚,分别为4期、6期、8期和10期,提取各早期鸡胚总RNA,通过逆转录分别得到各个时期的cDNA,并进行验证。结果显示(见图1),CLK2 mRNA在早期鸡胚中的4、6、8、10期中均有表达且程度不同,其中在6、10期表达明显高于4、8期(P<0.01)。
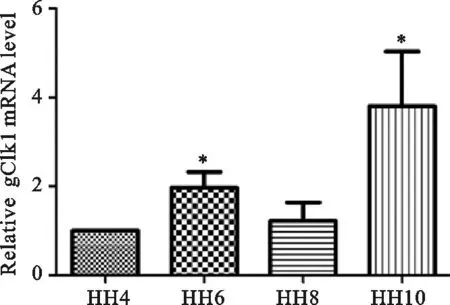
图1 qPCR检查CLK2 mRNA在早期鸡胚中的表达
2.2 重组质粒的构建及鉴定
按预先设计的PCR体系进行PCR扩增获得大小为571 bp的CLK2片段(见图2A)。收集此片段并克隆到PMD18-T Vector上,用XbaI 和HindIII进行双酶切鉴定(见图2B),将酶切鉴定正确的阳性克隆进行DNA测序分析,经比对后正确。
2.3 原位杂交检测CLK2 mRNA的表达
为进一步验证CLK2 mRNA在早期鸡胚中的表达定位,分别选取4、8、11期鸡胚,利用原位杂交检测CLK2 mRNA的表达定位。原位杂交结果表明,4期(原肠胚时期)鸡胚的CLK2 mRNA在上胚层与下胚层均有不同程度表达,其集中分布于亨氏节附近,此外,在原条等部位也有少量表达。8期时,CLK2 mRNA分布于内、中、外三个胚层的不同部位,主要表达在头部、神经板和神经褶处,而在亨氏节、脊索、原条、体节处表达不那么强烈(图3B);在11期中,CLK2的mRNA主要表达于眼泡和头部部位,其他的部位例如神经管、脊索、体节处表达稍弱(图3C)。

图3 原位杂交检测CLK2 mRNA在4、8、11期鸡胚中的表达
3 讨 论
CLK2在多种真核生物的组织中均有广泛表达,然而在鸡胚中是否存在还未有定论。之前的研究证实了与CLK2同家族的另外一个成员CLK1的 mRNA在鸡胚中存在且表达[4],本研究通过qPCR检测到CLK2 mRNA在4期鸡胚中就开始表达,在6期表达上升(P<0.01),在8期较先前表达水平略有下降,到10期,其表达水平出现显著增高(P<0.01)。10期时某些细胞增殖活跃,CLK2 mRNA表达水平的明显升高有可能预示着其与这些细胞的发育有密切联系。
研究发现,在肝脏进行糖异生与脂肪酸的氧化过程中,CLK2的参与是必不可少的[6-7]。对秀丽隐杆线虫的研究表明,其CLK2基因突变会导致多种生理指标的变化,包括胚胎生长发育与繁殖的速度改变等[8]。本试验制备了CLK2 mRNA探针并以地高辛标记,成功构建CLK2/pMD18-T质粒,并从鸡早期胚胎发育的三个阶段-原肠胚形成期(HH3-5),体节形成期(HH7-8)和神经胚形成期(HH9+)中各挑选一个时期,通过原位杂交,检测CLK2蛋白激酶在鸡胚早期发育过程中的表达及定位。原位杂交结果显示,CLK2 mRNA在4期(原肠胚时期)于亨氏节的表达最为明显,之前的研究表明[4],此期CLK1 mRNA主要集中于原条周围均匀表达,而在8期(体节形成期)和11期(神经胚形成期)时,二者的表达模式十分相似-都呈现一种头尾丰富表达的模式,其中CLK1[9]和CLK2[9]在头部的表达总是最为强烈,这也许预示着二者的表达与神经上皮细胞的增殖有关,比如眼等某些头部器官;在胚胎中部,神经管及周围,二者含量稍少;另外,在胚胎尾部,神经沟、神经板等部位,CLK1与CLK2均呈现为高表达。DOA是CLK家族在果蝇中的同源蛋白[1],有研究结果显示,缺乏DOA可以导致胚胎致死和分化缺陷,可造成果蝇眼部发育畸形和神经元发育畸形。亦有研究发现,下丘脑神经元中CLK1和CLK2的表达活跃,且其在很大程度上影响着神经元功能的发挥[10]。而本研究结果也提示,在鸡胚早期神经系统发育过程中,CLK1和CLK2也扮演着不可或缺的角色。
4 结 论
早期鸡胚发育过程中,CLK2 mRNA存在且其表达呈现随发育阶段变化而改变的特点,其表达部位显示CLK2可能是影响神经系统及头部发育的重要因素之一,但其在胚胎发育中的具体作用及作用机制仍需更深层次的探究。

