小鼠卵巢组织冷冻保存和自体移植技术的研究
李茗薇,黄 茹,严青秀,李可悦,王丽滢,王 飞
(1.安徽理工大学第一附属医院/淮南市第一人民医院妇产科,安徽 淮南 232007;2.安徽理工大学医学院,安徽 淮南 232063)
我国每年新发恶性肿瘤数超400 万,但随着抗肿瘤治疗的不断发展,恶性肿瘤患者的生存率也在不断提高,越来越多女性在肿瘤治愈后有了更加迫切的生育需求,特别是对于年轻女性患者来说,70%以上有期待生育的愿望[1,2],因此恶性肿瘤患者的生育力保护愈加受到重视。生育力保护的技术主要包括卵母细胞冻存、胚胎冻存和卵巢组织冻存移植。目前,卵母细胞冻存与胚胎冻存技术已趋于成熟,但对适用人群有诸多限制,而卵巢组织冻存移植技术为保护生育力开辟了一条新途径,也是急需治疗的恶性肿瘤患者保存生育力的最佳选项[3,4]。冷冻保存技术不仅可以节约超促排卵的高昂费用,同时还可以储备大量原始卵泡。由于卵巢组织内包含着多种类型的细胞,并有着独特和复杂的结构,原始卵泡和初级卵泡被大量单层颗粒细胞所围绕,因此其冻融是一项困难的任务。卵巢组织常用的冷冻方法有玻璃化冷冻法和程序化冷冻法两类[4,5]。本研究采用程序化冷冻法,通过对小鼠卵巢组织进行体外冷冻保存和原位移植技术,建立小鼠生育力保护和内分泌重构的模型,进一步验证卵巢冷冻保存技术和原位移植技术的安全性和有效性,为保护女性生育能力提供临床基础。
1 材料与方法
1.1 实验动物 选取8 周龄SPF 级C57BL/6J 成熟雌鼠30 只,体重16.6~18.8 g,均由安徽理工大学实验动物中心提供。小鼠饲养温度为(21±2)℃,相对湿度30%~70%,光照明暗交替周期为12 h/d。本实验方案由安徽理工大学第一附属医院伦理委员会批准,并通过动物实验伦理审查。将小鼠随机分为3 组:研究A 组10 只、研究B 组10 只和对照组10 只。
1.2 实验试剂与设备 试剂:3%水合氯醛、M2 培养基、HAS(人血清白蛋白)、DMSO、PBS、4%的多聚甲醛、瑞氏染液。冷冻基础液为含20%HAS 的M2 培养基。冷冻保护液为用冷冻基础液配制的1.5M 的DMSO(即1 mlDMSO,基础液定容至10 ml)。设备:显微剪、平台镊、手术直剪、带线缝合针、持针器、1 ml 注射器、1.8 ml 冷冻管、35 mm 一次性培养皿、程序降温盒、解剖镜。
1.3 方法 研究组小鼠进行卵巢体外冷冻保存、复苏和自体原位移植手术。将小鼠麻醉后完整取出其右侧卵巢,将冷冻复苏后的卵巢组织移植于小鼠左侧卵巢原位。对照组小鼠卵巢不进行冷冻复苏而直接行原位移植手术,术后精心饲养。移植术后第5 天起每日对3 组小鼠进行阴道细胞学检测,观察动情周期。术后第10 天研究A 组小鼠、对照组小鼠与同品系雄鼠进行合笼,观察产仔情况。合笼后第25 天,处死合笼小鼠,取出移植卵巢组织,进行组织形态学观察,判断移植后卵巢的功能恢复情况。研究B 组小鼠在移植第15 天取卵巢进行组织学观察。
1.3.1 冷冻保存 将取出的新鲜卵巢组织在冷冻基础液中缓冲,再将卵巢组织转移至装有冷冻保护液的1.8 ml 冷冻管中,4 ℃平衡30 min,使冷冻保护液完全渗透整个卵巢。-20 ℃放置20 min,使内容物结晶。将冷冻管迅速放入程序降温盒中,-80 ℃冰箱梯度降温保存7 d。
1.3.2 复苏和自体原位移植 从-80 ℃冰箱中取出冷冻管,室温静置1 min,迅速放入37 ℃水浴锅中1~2 min 解冻。解冻后将卵巢转移到冷冻基础液中缓冲,移植手术开始前将卵巢转移到放有PBS 的35 mm 小培养皿中等待移植。以小鼠右侧切口为对照,在对称部位开口将左侧卵巢完整取出。取卵巢时,沿卵巢外缘小心地剪开卵巢包膜的1/2,不要将包膜中间剪破,沿着开口翻开包膜。用显微剪剪断卵巢蒂(确保卵巢完全摘除,无残留),摘除左侧卵巢。将解冻后的卵巢植入左侧卵巢原位,卵巢包膜下翻,覆盖刚植入的卵巢。后将子宫与输卵管轻轻塞入腹腔原位后,缝合肌肉与皮肤。
1.3.3 小鼠阴道脱落细胞检测 从移植术后第5 天起,对3 组小鼠每日下午4∶00 时进行阴道脱落细胞涂片,观察其动情周期。用移液枪吸取20 μl 生理盐水于小鼠阴道内反复抽吸5 次,涂片并自然干燥,瑞氏染液染色后光镜下观察,判断其动情周期分期。
1.3.4 卵巢组织切片制作 冻融的卵巢组织放入4%的多聚甲醛固定24 h。之后依次放入75%乙醇、95%乙醇、100%乙醇中分别脱水30、20、8 min。再放入二甲苯中透明15 min。最后浸蜡将组织包埋,制成石蜡组织块。切片前先将组织块放入-20 ℃冰箱冷冻5 min。厚度以5~7 μm 为宜。将切下的组织片置于43 ℃温水中,直至组织片完全展开将其用载玻片捞出。摊片1 h,用吹风机热风对准玻片上的卵巢组织,将其周围的蜡吹散。烘片5 h,将卵巢组织固定在玻璃片上,最后进行苏木素-伊红染色。
2 结果
2.1 小鼠阴道脱落细胞学观察 对照组全部小鼠阴道细胞呈持续规律的动情周期性变化(图1),平均周期持续天数为4~5 d。研究A 组10 只小鼠中8 只出现动情周期,研究B 组10 只小鼠中7 只出现动情周期。对照组小鼠首次恢复动情周期时间稍早于研究组小鼠,但对照组及研究组小鼠动情周期持续天数无差异。

图1 小鼠正常动情周期变化
2.2 移植后卵巢形态学观察 新鲜卵巢呈蚕豆形,肉色,表面有丰富的血管通过。冻融后卵巢形状无变化,白里透粉色。移植后卵巢形状不规则,肉眼可见大部分长成淡黄色圆形或椭圆体,表面有重建的血管通过,这为卵巢恢复功能创造了条件(图2)。移植后,小鼠卵巢体积部分发生变化。10%的卵巢消失、40%的卵巢萎缩、50%的卵巢体积无变化。消失的卵巢可能由于包膜碎裂,无法将其固定于卵巢原位,在小鼠活动过程中,卵巢从原位滑脱所致。而血供不足则可能是导致卵巢萎缩的原因。在操作过程中,冷冻与复苏过程操作不当会引起卵巢发生部分或整体坏死。整个实验里,几乎一半的卵巢都有坏死的部分。

图2 卵巢组织形态学观察
2.3 卵巢组织学观察 正常卵巢卵泡丰富,同时可见各个时期的卵泡出现。冻存过程操作不当则会导致卵巢坏死(图3)。研究组卵巢在移植后第15 天,卵巢切片可见大量原始卵泡,无次级卵泡与成熟卵泡。移植后第35 天,卵泡数减少,原始卵泡难寻,可见次级卵泡、成熟卵泡以及黄体。这些结果直接表明成熟卵泡是由原始细胞发育而来,并且这些卵泡可以实现自发排卵。成熟卵泡的出现表明实验的成功,能够为小鼠保存生育力。但是移植体上的卵泡密度均低于正常卵巢,并且许多卵泡的形态和组织结构发生了改变,卵泡内卵母细胞发生了退化。
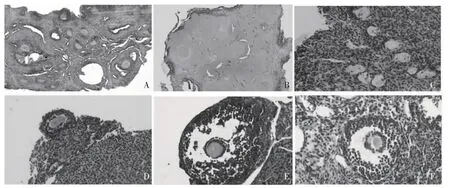
图3 卵巢组织切片观察
2.4 产仔情况 研究A 组小鼠在移植后第10 天与同品系雄鼠合笼,在合笼第22 天,共有2 只鼠怀孕并分别产下3 只和1 只小鼠。而对照组小鼠怀孕能产6~10 只小鼠。
3 讨论
育龄期的性腺毒性化疗和盆腔照射会损害卵巢,导致卵巢储备过早耗竭和内分泌功能障碍,存在不孕的风险。因此,癌症缓解后保留生育能力是这些女性面临的一项关键挑战。相较于胚胎冻存与卵母细胞冻存,卵巢组织冷冻保存发展历史虽短,但有着独特的优势。此项技术可以冷冻卵巢皮质中未成熟的原始卵泡,原始卵泡数量多、体积小、缺乏透明带及皮质颗粒,更耐受冻存过程中造成的损伤,并且具有生存活力及发育能力[6,7]。成功的卵巢组织冻存技术,不仅可以为患者保存生育力,而且还能恢复患者的内分泌功能[8]。据研究[9],卵巢组织冷冻保存和原位移植后95%的患者内分泌功能恢复。卵巢功能常在移植后60~240 d 恢复,功能的平均持续时间为4~5 年,最长维持时间可超过10 年[10]。2020 年美国生殖医学会指出,卵巢组织冷冻保存不再是一种实验性方法,而是一种能有效应用于于人类的合法技术。阮祥燕等[11]研究在2016 年也实现了该项技术的成功应用,并于2021 年达到成功妊娠的目标。
卵巢组织冷冻保存结合原位移植技术可以成功保存大量原始卵泡,并且在卵巢移植回体内后原始卵泡可以继续发育为成熟卵泡,实现了卵泡的自发排卵,小鼠的生育力因此得到保存。但不可避免的是,冻存后的卵巢活力不能恢复到原本水平,仍有部分卵泡在操作过程中丢失。Christianson MS 等[12]研究表明,卵巢组织冷冻保存后年轻女性癌症患者的卵泡密度显著降低,冻存后卵巢组织的卵泡密度是新鲜卵巢组织卵泡密度的89%。本研究结果显示,在卵巢移植第15 天,卵巢内仅剩原始卵泡,次级卵泡与成熟卵泡丢失,卵泡总数减少。合笼小鼠产仔数骤减,不足原本数目的一半,其中的原因除了卵泡数减少,还可能是卵巢排卵速度减慢共同导致的。
虽然卵巢组织冷冻保存取得了进展,但操作过程中卵巢组织的冷冻损伤与缺血再灌注损伤仍会影响生育力的恢复[13]。冷冻损伤主要包括冷冻保护液对卵巢的毒性作用以及冷冻过程中细胞中电解质直接转变为冰晶结构而导致细胞机械损伤[14,15]。针对冷冻损伤的措施是应用低浓度的冷冻保护液完全渗透卵巢组织,再通过一系列的逐步降温过程使冷冻过程产生的冰晶数大大减少,同时解冻卵巢时应快速升温,以避免在解冻循环中水的重结晶,三者相配合可有效减小冷冻对卵巢组织造成的损伤。而缺血再灌注损伤是影响生育力恢复最重要的因素。冻融后卵巢移植未行血管移植,本身无血供,新生血管的建立需要时间,卵巢复氧大概4~5 d[16]。在早期移植的48 h 内,缺血再灌注产生的氧代谢物大约使70%的卵泡丢失[17]。卵泡的大量丢失导致移植物体积明显缩小,也会影响卵泡的动态变化、激素环境和生育力恢复的潜能[18]。本研究将小鼠左侧新鲜卵巢取出,在左侧卵巢原位植入冻融后的右侧卵巢,用包膜将其覆盖,为移植卵巢提供即时血供。卵巢体外保存技术可以实现生殖能力的保存,但不能实现卵巢功能的完全恢复。除卵巢功能会影响小鼠受孕外,输卵管异常也会致小鼠不孕。在移植过程中,若手术器械夹到输卵管,会使输卵管管腔狭窄或水肿,且手术操作不当也可致输卵管黏连等。卵巢组织冷冻保存为生育力保护注入了新的生命力,但目前我国肿瘤患者生育力保存仍存在许多问题,如医生和患者缺乏对生育力的保护意识;患者不信任新技术;缺少多学科专家对治疗过程的讨论等[19]。我国生育力保护起步较晚,开展受限,但发展潜力巨大。为受益于更多女性,首先应加强医生对生育力保存的了解,对于需要生育力保护的患者,应充分评估其生育力保护指征,选择合适的治疗方法,遵循规范化的同时给予个体化的治疗方案。
综上所述,小鼠卵巢组织冷冻保存和自体原位移植技术可行。相信随着研究的不断深入,冷冻移植技术会愈加完善,我国生殖医学能得到较大发展,越来越多女性也会因此受益。

