乌头不同叶片中化学成分的变化特征及打顶对根的影响
毛柳英 陈灵丽 田 梅 马 青 周晓春 马丽娜 崔光红 曹俊岭
1.北京中医药大学东方医院药学部,北京 100078;2.安徽省食品药品检验研究院中药所,安徽合肥 230051;3.中国中医科学院中药资源中心,北京 100700;4.北京中医药大学东直门医院洛阳医院,河南洛阳 471002
乌头是乌头属植物中最具代表性的药用植物,药用历史悠久,中药川乌和附子来源分别为其干燥母根及子根的加工品,具有回阳救逆、补火助阳及祛风止痛的功效[1]。二萜生物碱是其发挥临床作用的物质基础,尤其以良好的镇痛、祛风湿、抗心律失常及局部麻醉、降血压、抗菌、抗癌等活性备受关注[2-7]。在我国,乌头的人工栽培历史约有1 000 年,乌头栽培时保留摘尖(打顶)、掰芽、修根等工序,是主产地四川江油延续千年传统生产工艺。乌头打顶工艺减少了开花对植株的养分争夺,利于根部生长[8-9]。课题组前期研究发现,乌头不同部位二萜生物碱类成分存在组织特异性,尤其是乌头非药用部位顶叶蕴含丰富的特异性二萜生物碱[10]。然而,乌头顶叶及不同叶片中次生代谢产物如何分布?打顶的工艺对乌头的次级代谢产物又产生哪些影响?这些问题鲜见报道。
本研究采用UPLC-Q-TOF-MS 技术,对乌头顶叶及不同部位的叶片(前6 片叶),顶叶摘除前后根进行检测,阐述乌头的物质基础及不同部位中次生代谢产物的分布情况,为阐述乌头打顶工艺的科学内涵提供重要的依据。同时,结合不同二萜生物碱在不同部位的变化情况为乌头顶叶资源的可持续利用提供物种基础。
1 仪器与材料
1.1 仪器与试液
Acquity UPLCTMsystem,Waters Xevo G2-S Q-TOF质谱仪(美国,Waters);使用的Q-TOF 质谱仪是Synapt质谱系统(美国,Waters);XS105 型十万分之一电子天平(瑞士METTLER TOLEDO 公司);Centrifuge5415D型离心机(德国,Eppendorf 公司);Millipore 纯水系统(美国millipore 公司)。MM400 球磨仪(Retsch 公司);粉碎机(天津市泰斯特仪器有限公司);FDU-1110 真空干燥机(东京理化器械株式会社);SB-800-DTD 型超声清洗机(超声功率500 W,宁波新芝生物科技股份有限公司);甲醇(色谱纯,美国Fisher 公司);甲酸(色谱纯,美国Acros 公司);小檗碱(上海源叶生物科技有限公司,纯度>98%)。
1.2 材料
本研究所用样品地上部分及地下部分分别于2021 年5 月和7 月采自四川绵阳乌头种植基地。所有样品经中国中医科学院崔光红研究员鉴定为乌头属植物乌头Aconitum carmichaelii Debx.。将乌头地上部分采集,其叶子由上至下分别收割,分别标为L-DY、L-1、L-2、L-3、L-4、L-5、L-6;各样品重复3 份。将顶叶摘除和不摘除的植株下的根,分别记为Z1~Z6 及R1~R6。
2 方法与结果
2.1 实验方法
2.1.1 供试品溶液的制备 将上述所有样品置于真空干燥器中干燥至恒重,并用组织破碎仪破碎。精密称定不同样品约10 mg,置于2 ml EP 管中。使用50%甲醇将小檗碱对照品配制2 μg/ml 的提取液,分别取1.5 ml 含内标物小檗碱的提取液加入各样品中,称重。经超声处理30 min,放冷,补足失重,摇匀,0.22 μm微孔滤膜过滤,取续滤液,置入2 ml 样品瓶中,即得。
2.1.2 色谱条件 采用Waters Acquity UPLC CSH C18色谱柱(100 mm×2.1 mm,1.8 μm,Wates,USA)。柱温45 ℃,进样量0.4 μl,流速0.4 ml/min。流动相A 为0.1%甲酸水溶液,流动相B 为乙腈溶液,梯度洗脱:0~0.1 min,95%~95%A;0.1~3.0 min,95%~88%A;3.0~5.0 min,88%~82%A;5.0~8.0 min,82%~82%;8.0~9.5 min,82%~78%;9.5~15.5 min,78%~72%;15.5~16.0 min,72%~70%;16.0-17.0 min,70%~50%;17.0~18.0 min,50%~20%;18.0~20.0 min,20%~2%;20.0~25.0 min,2%~2%;25.0~25.1 min,2%~95%;25.1~28.0 min,95%~95%。
2.1.3 质谱条件 采用正离子模式扫描模式,电喷雾电离离子源,扫描范围为m/z 50~12 00,扫描时间为0.15 s,检测时间28 min,低能量碰撞电压为6 V,高能量碰撞电压40~60 V,锥孔电压为40 V,除溶剂气体为氮气,锥孔电压为40 V,氮气流速为6 L/min,使用leucine enkephalin(200 pg/L)进行实时校正。
2.1.4 数据处理 Progenesis QI 软件(Waters 公司)软件对质谱原始数据进行基线过滤、峰比对和归一化等处理,并结合EZinfo 对数据进行主成分分析(principal component analysis,PCA)来实现数据降维处理及特征提取。使用正交偏最小平方判别分析来生成VIP 值(VIP>1),并结合差异倍数筛选阈值(|FC|>2)筛选差异代谢物。
2.2 结果
2.2.1 乌头不同位置叶片的二萜生物碱的分布与含量通过MassLynx 4.1 分析软件,在28 min 内,共有60 个主要化合物被在乌头不同位置叶片中被检测出来,其基峰离子流显示在图1 中,对应的化学成分显示见表1。通过对每个化合物主峰的断裂方式进行分析,以丢失最明显的碎片离子H2O-(18 Da)、CO-(28 Da)、CH3OH-(32 Da)、HCOOH-(46 Da)、CH3COOH-(60 Da)为特征推断共有58 个二萜生物碱化合物。首先通过分子量、保留时间、离子碎片与文献对比确定了35 个色谱峰的归属(其中包含3 个C20型生物碱)[4,6,10-16]。另有25个化合物为未知的二萜生物碱成分。
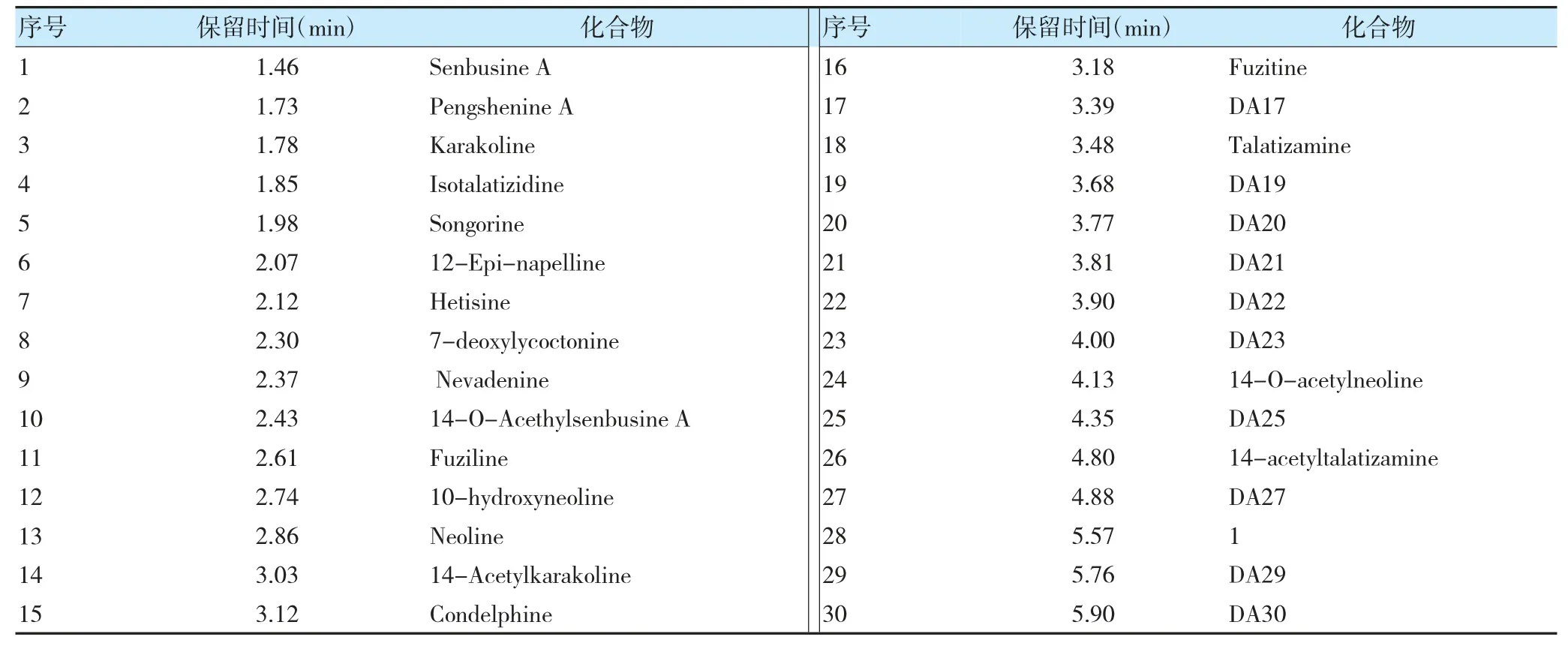
表1 60 个主要化合物对应化学成分表
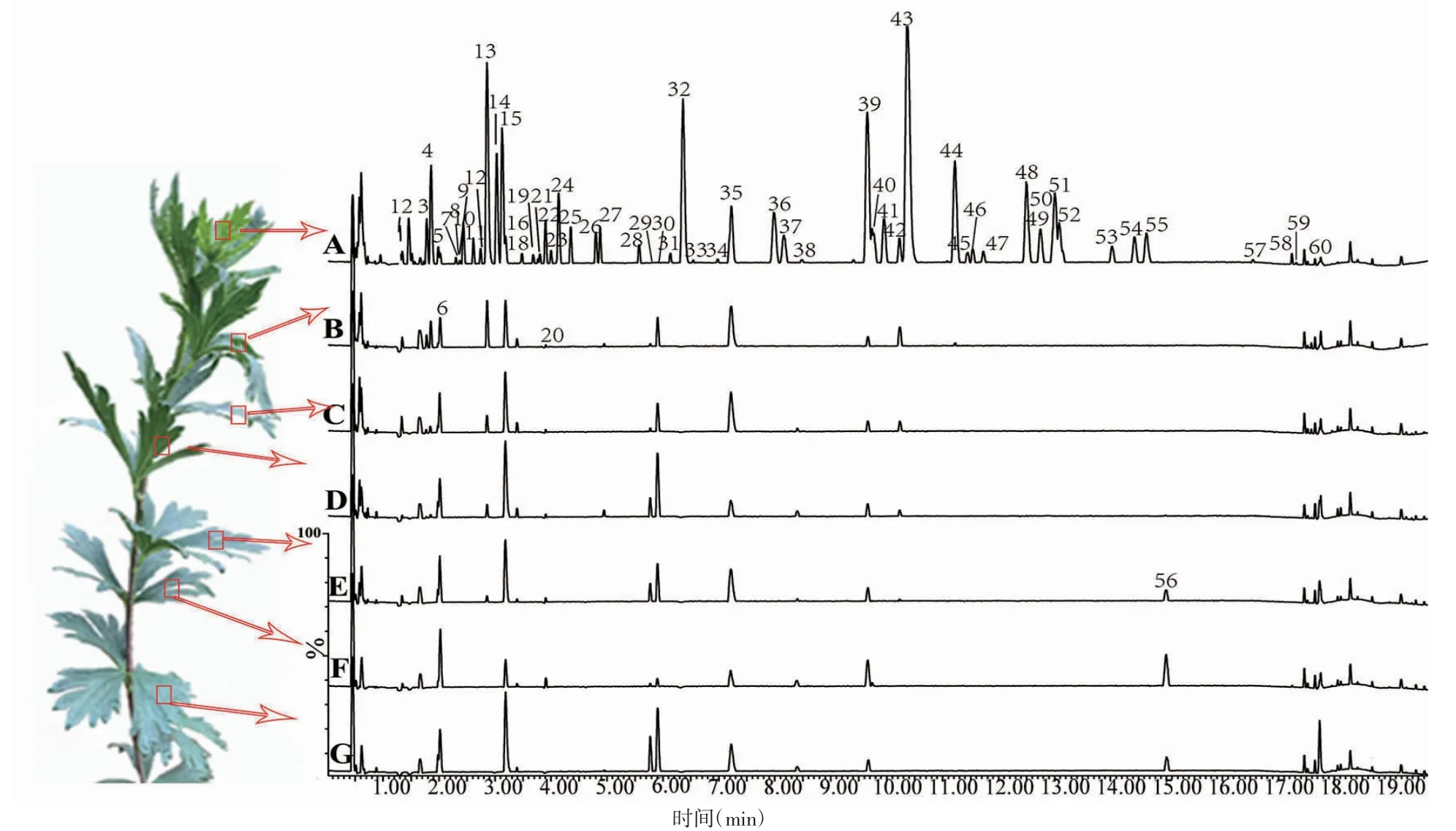
图1 乌头不同位置叶片的基峰离子流图(A:L-DY,B~G:L-1~L-6)
乌头植物顶叶部分(L-DY)富集了大量的二萜生物碱类成分,见图1。而相对成熟的叶片(包括L1~L6,图1B~G)二萜生物碱类成分种类明显降低,见图1A。neoline(#13)、carmichaenine C(#32)、DA39(#39)、carmichaenine A(#43)、mesaconitine(#44)是顶叶中主峰,尤其是DA19(#19)、DA20(#20)、DA21(#21)、DA36(#36)、DA38(#38)、DA57(#57)、DA59(#59)基本除顶叶外,其他叶片中基本检测不出,可以认为这些成分是顶叶的特征性成分,共有25 个。
将化合物按不同的类型划分,不同类型化合物分布降低的数目依次为醇胺型(1~6 min)<单脂型(5~11 min)<双酯型(11~18 min)。提示随着叶片的成熟,双酯型生物碱(包括2 种三酯型化合物3-acetylmesaconitine 和3-O-acetylacontine)会在叶片中快速消失。
通过对化合物进行聚类分析及各叶片进行相关性分析(图2A~B),结果发现全株的叶片可聚成3类,分别是L-DY、L-1~L-3、L-4~L-6。相比于顶叶,在代谢物的分布上L-1~L-3 片之间与L-4~L-6 片之间的化合物相关性更强。这说明,顶叶与1~6 片叶片中的次级代谢产物存在差距。对顶叶中的主要成分做PCA 分析,结果显示顶叶可以与其他叶片完全分离,见图2C,但是之间的差异并不明显,基本不能分开,显示了顶叶的特异性。

图2 不同位置叶片成分分布及变化趋势
通过内标物小檗碱进行统一处理,获得乌头不同二萜生物碱的相对含量。根据叶片中生物碱成分的相对含量,初步将叶片中次级代谢产物的积累特征分为3 种情况,如图2D~F 所示。随着叶片逐渐长大,一些化合物如Songorine(#5)、12-epi-napelline(#6)、Fuzitine(#16)、DA29(#29)、DA30(#30)等8 个次级代谢物在叶片中逐渐积累,见图2D。相对的另外一些化合物如Pengshenine A(#2)、karakoline(#3)、isotalatizidine(#4)、neoline(#13)、carmichaenine A(#43)、aconitine(#50)等11 个成分在叶片中逐渐消失,不再分布,见图2E。但更多的成分是在顶叶中生成后几乎不会在其余叶片中检测出(图2F),这些成分在顶叶与第6 片相对含量平均相差约350 000 倍。
2.2.2 打顶工艺对地下部分的影响 为探究打顶工艺对根的影响,首先对比了打顶前后根重量的差异。为防止个体差异,随机选择50 个鲜样为一组样品称重,分别称取打顶前后的鲜样各6 组(每组50 个)。计算得到摘除顶叶和不摘顶叶根的鲜重平均值为9.93 g/个和9.02 g/个,结果发现,摘除顶叶后,每个根增重约为0.91 g(10%)。
此外,通过Progenesis QI 软件导出的质谱数据,分别对地上部分在打顶前后做PCA 主成分分析图(图3A),橙色点和绿色点分别表示摘除顶叶前后的样品,结果显示两类样品可以分开,说明打顶前后代谢物存在差异。为了进一步分析摘除前后代谢物的差异,对两组样品进行正交偏最小二乘法判别分析(图3B~3C),R2Y=0.998,Q2=0.707,提示所获得的模型具有比较好的拟合。所有样本的S-Plot 得分散点图如图3D,获得两组样品的离群化合物,并结合正交偏最小二乘法判别分析模型获得的变量权重(VIP)值,以VIP 值>1.0 的代谢物为标准筛选差异代谢物,主要的差异成分包括Songorine、7-deoxylycoctonine、Fuzi line、chasmanine、14-acetyltalatizamine、10-OH-Mesaconi tine、Mesaconitine 等。

图3 打顶前后地下部分的多元统计分析
3 讨论
3.1 叶中次级代谢产物的动态分布
根据不同位置叶片的成分研究,得到以下结果:①乌头顶叶中的化学成分的数量及相对含量绝对高于其他别的部位;②乌头叶片中的二萜生物碱类成分随着叶片的生长会急速减少,仅个别成分会增加;③顶叶中产生了某些特异成分,如DA19(#19)、DA20(#20)、DA21(#21)、DA36(#36)、DA38(#38)、DA57(#57)、DA59(#59)仅在顶叶中被检测到,carmichaenine C(#32)和carmichaenine A(#43)相对含量远超其他部位。推测顶叶中之所以产生出丰富的二萜生物碱成分(包括数量及含量),可能与随着叶片的生长,特异成分如carmichaenine C(#32)和carmichaenine A(#43)等重新汇聚于新的顶叶中,用于新的顶叶的生长发育相关。
3.2 打顶对乌头产量及质量的影响
打顶是指掐掉顶端的叶片,控制植物加高和抽长生长,促进加粗生长和加速果实发育的重要手段。从实验结果来看,打顶对乌头的产量及质量存在影响。一方面,顶叶储存大量的二萜生物碱成分,需要大量的营养和能量用以维持生长。打顶之后多余的营养物质重新分配,用于根部生长,导致产量增加。另一方面,植物的地上部或地下部受到损伤,植物的所有组织都会产生防御反应,远端的组织也不例外,因此顶部损伤后会引起根部的初级和次生代谢反应,使得打顶前后检测出一些差异代谢物[20]。同时考虑植物体内调控的因素,与根部发育有关生长素基因积极响应,促进根系发育,而打顶时间及打顶方式对乌头的质量有一定的影响,推测参与代谢物形成的基因及转录因子调控时间较生长素响应时间长,故对质量产生的影响较产量弱[21-25]。
利益冲突声明:本文所有作者均声明不存在利益冲突。

