微流控技术在生物膜研究中的应用
王珊珊 殷敏 张凤娟 余紫英 陈楠 吕敏
DOI: 10.3969/J.ISSN.1000-5137.2024.01.015
收稿日期: 2023-11-01
基金项目: 国家自然科学基金(31971310, 32371439)
作者简介: 王珊珊(2000—), 女, 硕士研究生, 主要从事单细胞水平分析生物膜行为等方面的研究. E-mail:wss3185660968@163.com
* 通信作者: 吕 敏(1984—), 女, 研究员, 主要从事纳米抗菌材料与微生物群体感应等方面的研究. E-mail:lvmin@shnu.edu.cn
引用格式: 王珊珊, 殷敏, 張凤娟, 等. 微流控技术在生物膜研究中的应用 [J]. 上海师范大学学报 (自然科学版中英文),2024,53(1):113?119.
Citation format: WANG S S, YIN M, ZHANG F J, et al. Application of microfluidic technology in biofilm research [J].Journal of Shanghai Normal University (Natural Sciences), 2024,53(1):113?119.
摘 要: 生物膜是由细菌及其分泌的胞外聚合物组成的微生物簇. 目前,生物膜培养和研究多采用静态培养平台(如培养皿和孔板),这种方式缺乏精准模拟理化微环境、高通量以及原位分析细菌行为的能力. 近年来,微流控技术作为一种在微米尺度处理和操纵流体的新技术,在生物膜研究中的应用不断增加,且取得了一系列突破性进展. 文章系统综述了最新的基于微流控技术的生物膜研究成果,总结并展望了微流控技术辅助生物膜研究的优缺点及未来方向,以期为全面了解和拓展微流控技术在生物膜研究中的应用提供帮助.
关键词: 微流控技术; 生物膜; 高通量; 可视化分析; 单细胞水平
中图分类号: Q 939 文献标志码: A 文章编号: 1000-5137(2024)01-0113-07
Abstract: Biofilm is a microbial community composed of bacteria and their secreted extracellular polymers. Currently, biofilm culture and research mainly use static culture platforms(such as Petri dishes and well-plate), which lack the ability to accurately simulate physicochemical microenvironments and perform high-throughput in situ analysis of bacterial behavior. Microfluidics, a new technique for processing or manipulating fluids at the micron scale, has been used in biofilm research in recent years and several breakthroughs have been achieved. This paper systematically reviews recent research on the application of microfluidic technology to biofilms and summarizes the advantages, disadvantages, and future directions of microfluidic technology-assisted biofilm research to provide assistance for a comprehensive understanding and extension of the application of microfluidic technology in biofilm research.
Key words: microfluidic technology; biofilm; high-throughput; visual analysis; single cell level
0 引 言
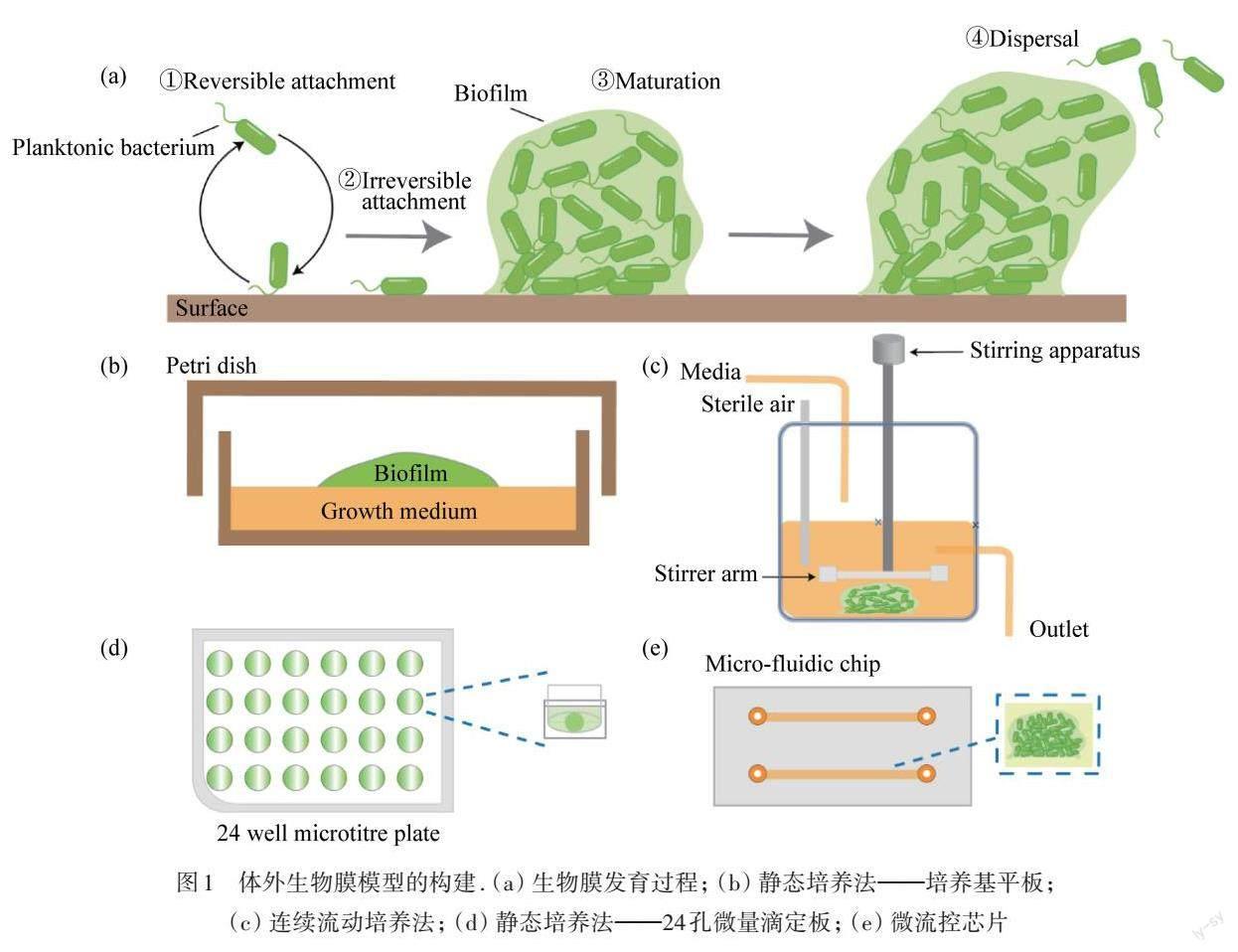
生物膜(Biofilm)存在于地球上几乎所有的栖息地,它是微生物群体及其分泌的胞外聚合物(EPS)组成的三维类水凝胶结构群落[1]. EPS主要是由多糖、蛋白质、核酸和脂质等生物大分子交联而成的网络结构,它介导细菌黏附于表面,连接生物膜细胞并瞬时固定,为生物膜提供瞬时稳定性[2]. 生物膜发育是一个动态的过程,如图1(a)所示,包括以下几个阶段[3]:(1) 细胞通过范德华力和疏水相互作用可逆地附着在表面[4];(2) 细胞由表面结构如IV型菌毛介导的不可逆附着[5];(3) 细胞快速增殖和分泌EPS形成成熟的微菌落;(4) 生物膜中的细菌扩散出去进入新的生长周期. 生物膜对自然环境和人类健康有利亦有害. 一方面,生物膜作为细菌的普遍存在形式,在地球物质的分解和循环利用、生态环境平衡等方面起着积极作用;另一方面,生物膜对食品加工和存储运输等领域造成严重的生物污染,全球每年需要花费数十亿美元应对生物膜污染问题[6]. 生物膜能造成临床80%以上的感染疾病[7],特别是定植于可植入医疗设备上[8-9]. 因此,深入研究生物膜行为,趋利避害,发展生物膜应对策略成为当前生物医学、生物材料以及环境治理等领域的前沿热点.
目前,生物膜主要是浮游细菌通过静态培养而成的,即在平板或孔板上培养细菌,使其发展为成熟生物膜结构,如图1(b)和(d)所示. 培养器皿内液体或固体培养基与空气形成气液或气固交界面,这些相对固定的界面环境,微生态条件的变化较少,存在培养液无法持续更新、生物膜生长环境单一的缺点. 因此,利用流动反应器或恒化器动态培养生物膜成为研究者关注的焦点,如图1(c)所示. 流动培养的优势在于能够在生物膜的形成过程中施加流体剪切力并持续更新培养液和刺激物. 然而,恒化器等设备的设计制作较为复杂,培养液消耗量较大.

图1 体外生物膜模型的构建. (a) 生物膜发育过程; (b) 静态培养法——培养基平板; (c) 连续流动培养法; (d) 静态培养法——24孔微量滴定板; (e) 微流控芯片
微流控技术(Microfluidic technology)作为一种在微米尺度上处理和控制液体的技术,在生物传感、分析检测和生物成像方面有着广泛的应用. 尤其是,微流控技术对时间和空间的精确可控、多路复用和高通量监测,在单细胞和单分子等生物研究中扮演重要的工具角色[10-11]. 近年来,研究者将微流控装置用于生物膜的培养和研究,如图1(e)所示,其三维微通道可以模拟生物膜生长的理化微环境,精准控制流体剪切力、温度、氧含量、pH值和药物浓度等微环境参数. 同时,微流控技术与高分辨显微成像技术相结合,成为实时、原位、高通量观察和分析生物膜行为的最佳技术[12]. 本文综述了微流控技术用于生物膜研究的最新进展,包括模拟生物膜生长微环境以及高通量、可视化分析生物膜行为,分析了微流控技术在生物膜研究中的优势和局限性,并讨论了其在未来的可能发展方向,为全面了解和拓展微流控技术在生物膜研究中的应用提供综合解读.
1 微流控技术用于模拟生物膜的生长微环境
生物膜被视为是微生物群体组成的小型“社会”. 当外界物理、化学环境发生改变时,生物膜的群落结构、形态、致病性、耐药性等特性都会发生变化[13]. 为了更好地分析环境因素对生物膜的影响,研究者将微流控芯片的通道底面作为生物膜生长的基底,通过设计不同的通道几何形状,来创造三维的生长平台,并且通过调控流体流动剪切力、效应物或溶解氧浓度梯度等多种理化因素,探究影响生物膜生长的关键微环境因素[14]. 微流体的发展使对环境条件的控制更加精确,并提供了前所未有的优势.
1.1 微流控技术模拟物理环境对生物膜的作用
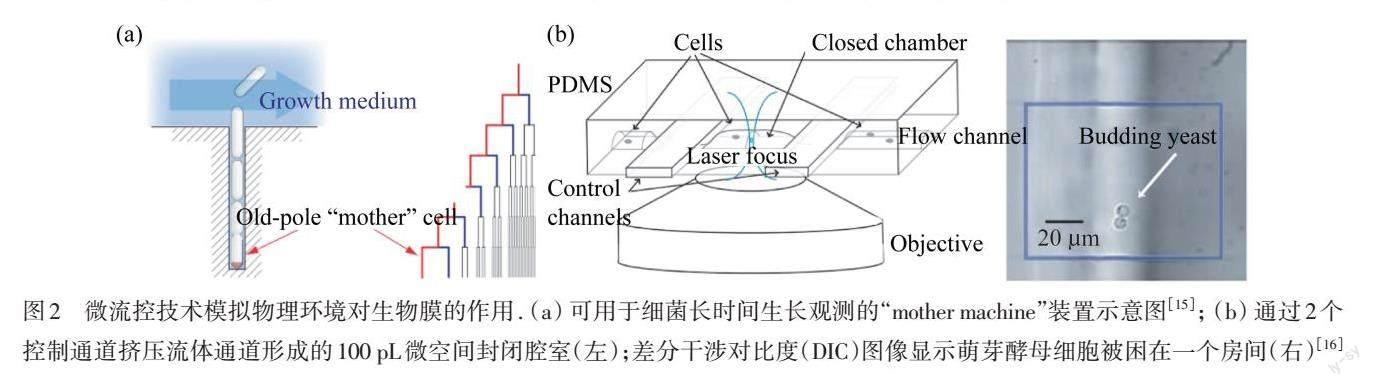
微流控技术可以为细菌提供微尺度的生长空间,这有利于长时间、原位观察某一个或某一处生物膜形成. WANG等[15]设计并构建了“mother machine”微流控装置,如图2(a)所示,实现了对单个细菌在均匀营养环境中长达数周的生长观测,这在宏观实验中是不可能实现的. CAI等[16]将细菌“困”在一个100 pL腔室的微流控装置中,如图2(b)所示,实现了对单细胞水平上的蛋白表达随机性的观测. 这些结果为深入理解流体动力环境下生物膜的生长提供了便利的、参数精确可控的实验模型.

图2 微流控技术模拟物理环境对生物膜的作用. (a) 可用于细菌长时间生长观测的“mother machine”装置示意图[15]; (b) 通过2个控制通道挤压流体通道形成的100 pL微空间封闭腔室(左);差分干涉对比度(DIC)图像显示萌芽酵母细胞被困在一个房间(右)[16]
在单相体系中考察流体流速对生物膜生命进程的作用是一项非常重要的研究. 利用聚二甲基硅氧烷(PDMS)微通道可以考察微环境中流体力学因素(流体剪切力和流动条件)对生物膜结构的影响. ZHANG等[17]利用微流控装置产生的强剪切力,研究了细菌在极端剪切环境下的黏附行为. 结果显示:与对抗生素高度耐受的普通持久性细胞不同,强剪切流持续细胞(SSP)可以抵抗各种聚合物材料表面的机械冲洗,并可以形成对高剂量氨基糖苷类抗生素耐受的独特生物膜. 随后,制备了双面玻璃型微流控流动样品池[18],实现了细菌生物膜的在线培养,结合全内反射显微成像技术原位观察黏附细菌的生长行为,直接观察到细菌细胞通过一个最近的接触点附着在表面,随着细胞分裂,逐渐变为2个接触点. KIM等[19]通过调节微通道宽窄来控制流速,并利用雷诺数(Re)和通道的宽高比(r)表征了铜绿假单胞菌生物膜的空间结构,结果显示:在低Re时,较高的流速刺激生物膜的生长;而在高Re时,较高的流速却抑制生物膜的生长. 同时,不同的流体环境还可以影响生物膜内细菌的群体感应特性(QS),进而改变生物膜的构成与致病性. BASSLER等[20]的研究发现,利用微流控技术,在流动条件下,相同基因型细菌由于QS在时间和空间上的差异而出现不同的表型,表现出不同程度的定殖和致病能力. 这些结果显示:相比传统的静态培养方法,微流控芯片上的生物膜培养显示出更好的生长可控性,对生物膜的流体动力学及其相关影响因素的研究也有了更精确的定量.
1.2 微流控技术分析化学效应物浓度对生物膜的影响
在复杂生态环境中,微生物(特别是细菌)能够感知周围环境中的化学物质及氧气的變化,并沿着化学物质的浓度梯度产生定向的趋化行为,这种趋化行为在生物膜的形成、分散与致病等生命活动中起着至关重要的作用.

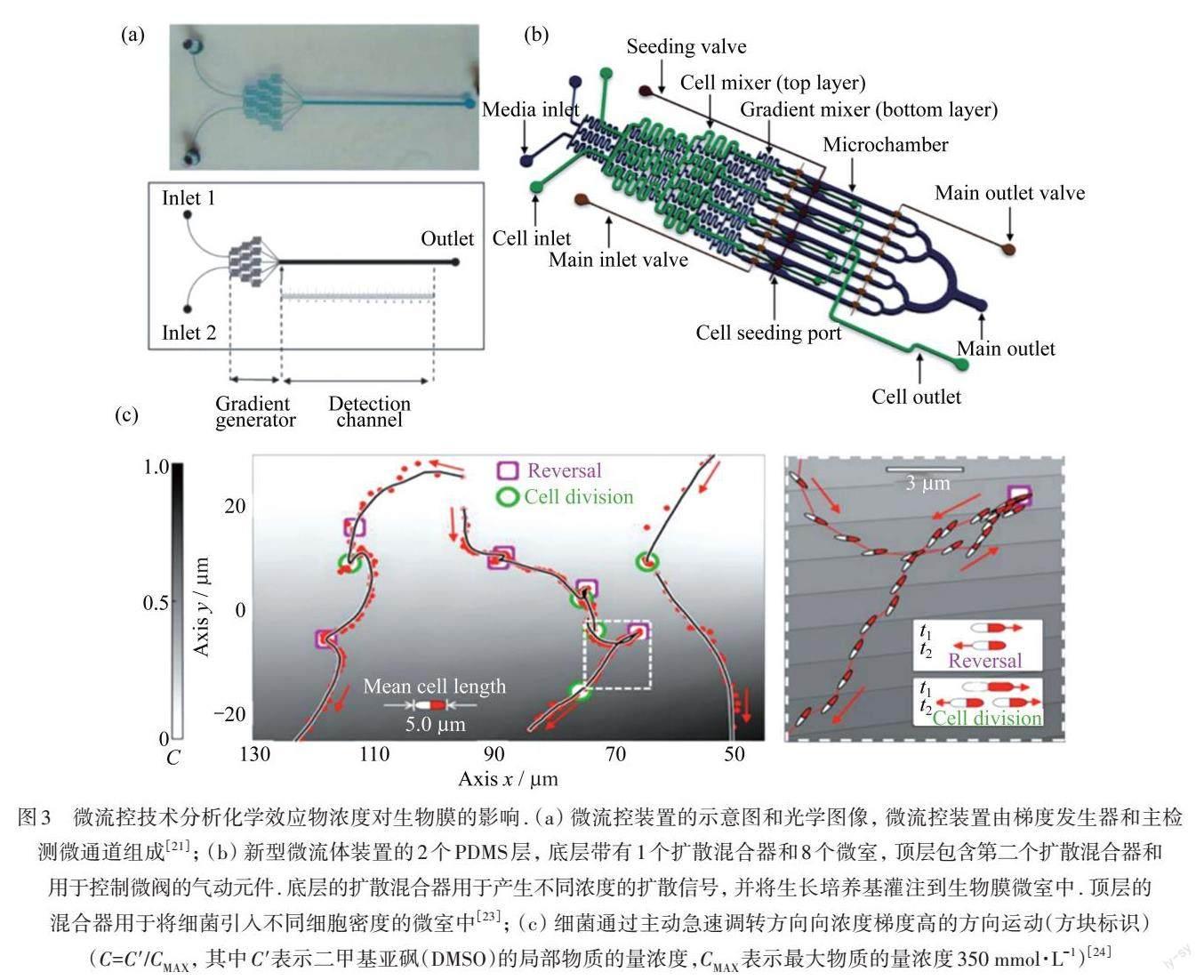
图3 微流控技术分析化学效应物浓度对生物膜的影响. (a) 微流控装置的示意图和光学图像, 微流控装置由梯度发生器和主检测微通道组成[21]; (b) 新型微流体装置的2个PDMS层, 底层带有1个扩散混合器和8个微室, 顶层包含第二个扩散混合器和用于控制微阀的气动元件. 底层的扩散混合器用于产生不同浓度的扩散信号, 并将生长培养基灌注到生物膜微室中. 顶层的混合器用于将细菌引入不同细胞密度的微室中[23]; (c) 细菌通过主动急速调转方向向浓度梯度高的方向运动(方块标识)(C=C'/CMAX, 其中C'表示二甲基亚砜(DMSO)的局部物质的量浓度,CMAX表示最大物质的量浓度350 mmol·L-1)[24]
利用分子在水凝胶中的扩散特性,微流控芯片可以设计为可精准调控物质浓度梯度的装置,用于研究效应物及氧气对生物膜的影响. KIM等[21]构筑的浓度梯度微流控芯片可用于原位监测抗生素对生物膜的最小去除浓度(MBEC),如图3(a)所示,发现铜绿假单胞菌生物膜的MBEC远高于其在临床中使用的最小抑制浓度(MIC),该方法更加精确、快捷,对于临床用药具有重要的指导意义. SKOLIMOWSKI等[22]设计了一种可以产生不同溶解氧浓度梯度的微流控芯片,用于观察铜绿假单胞菌生物膜在不同氧浓度下的生长形态,为微需氧或厌氧条件下生物膜的研究提供新技术支撑. HONG等[23]设计了集成了多个阀门的多层PDMS微流控芯片,如图3(b)所示,通过精确的程序化添加效应物分子来控制大肠杆菌生物膜的生长,使改造的工程菌株成功取代已存在的生物膜,为临床清除生物膜提供了新策略. OLIVEIRA等[24]将微流控技术和大规模并行自动跟踪技术相结合,研究铜绿假单胞菌早期生物膜发育行为,该研究证明了单附着细菌可以对化学梯度作出反应,如图3(c)所示. 运动的细菌就像蚂蚁穿过巢穴一样,能够在化学和生物环境中为自己导航,这对认识细菌群落的生物行为以及操纵它们的发育有重要意义.
2 微流控技术用于高通量、原位示踪研究生物膜
生物膜会引发多种慢性感染疾病,如中耳炎、囊性纤维化和心内膜炎等. 为了及时控制或去除致病生物膜感染,临床需要快速确定防治生物膜的有效药物,并鉴定生物膜耐药的抗性基因. 微流控芯片的高通量特点,结合化学修饰方法和可视化技术能够很好地满足这一需求. BENOIT等[25]使用Bioflux公司的商品化微流控芯片结合绿色荧光蛋白示踪技术,鉴定了铜绿假单胞菌生物膜对抗生素的敏感性,如图4(a)所示. 该芯片可以同时对96个生物被膜进行培养与鉴定,极大地提高了通量与效率. 利用3D显微打印技术,CONNELL等[26]用明胶打印出相邻的或镶嵌的十几至几十微米大小的微菌落,并利用明胶的通透性研究不同菌株间的抗药交互作用,如图4(b)所示.

图4 微流控技术用于高通量、可视化研究生物膜. (a) 生物通量微流体通道的特写(黑线). 每个通道都有一个蛇形区域(一个蛇形区域封闭在一个盒子中)以提供足够的背压和一个用于显微镜观察的腔室(箭头)[25]; (b) 剖面3D掩模重建(上)和明场图像(下)描绘了不同几何形状和细胞密度的嵌套多微生物群落的示例[26]; (c) 使用Biorender创建的用于生物膜原位连续监测的微流体系统示意图[27]
细菌生物膜的实时原位连续监测是筛选新型抗生物膜试剂的基础. 2023年,SONG等[27]提出了一种利用石墨烯修饰微电极阵列传感器的微流控系统,通过电化学阻抗实现细菌生物膜的动态监测,如图4(c)所示. 结果表明:由于传感界面上细菌细胞负荷的增加,生物膜状态的观察窗口期显著延长,从而大大提高了传感信号质量. PAULA等[28]构建了微流控系统、高分辨率延时共焦成像以及3D标量映射算法相结合的分析系统,多尺度、长时程呈现了变形链球菌从单细胞到多细胞群落的生长动力学. 发现生物膜类似城市化的空间和结构模式,其中一些“定居者”保持静止,而另一些则成长为聚集物(村庄),这些聚集物进一步扩展为人口稠密的微殖民地,这些微殖民地被封闭在明确的边界(城市)中,反过来又相互融合,形成更大的生物膜上层建筑(特大城市). 微流控技术为长时间、原位连续监测生物膜种群增长和扩张的空间和结构研究提供了有力工具.
3 结论与展望
经典的静态培养皿或平板培养是过去几十年培养和研究生物膜的重要平台. 但是,随着微流控技术的飞速发展和在生物医学领域的应用,目前,微流控技术已成为一种重要的生物膜培养和研究技术. 微流控芯片在精准控制和研究环境参数(例如物理空间、化学物质梯度以及流体剪切力等)对生物膜发育的影响方面起到举足轻重的作用. 但是,微流控技术用于生物膜长期培养时存在高污染的风险,特别是在富含高营养的培养介质中. 因此,微流控芯片培养生物膜时,需要对其管道、微流体通道和培养介质进行彻底无菌处理. 此外,细菌不仅黏附在微通道底部,而且会相互黏附在低流速区域形成大的细菌团簇,特别容易发生微流体系统堵塞问题. 因此,设计不同结构的微流控芯片以适应生物膜培养需求是未来发展的方向之一. 例如,设计有3个入口通道,合并成1个单独的腔室,然后是1个出口通道的微流控系統,它能够控制来自3个不同液体储存器的流速,层流状态不同可导致不同介质在空间上分离流动,避免发生堵塞,如图5所示[29].

圖5 微流体平台的设计和微流体室的特写示意图[29]
同时,微流控技术与多种成像技术相结合,已成为高通量、实时动态追踪细菌发展为生物膜的有力工具. 目前,基于微流控技术的成像分析平台在单细菌水平上研究细菌的演化、营养适应性、分裂不对称性、与宿主相互作用和抗生素耐受性等方面取得的进展,为深入认识和理解细菌及生物膜行为奠定了理论基础. 可以预见,随着显微镜技术及图像识别和分析技术的升级,基于微流控技术的细菌研究平台必将在解析生物膜行为方面获得新理论,为临床和生产实践防治生物膜感染和利用有益生物膜提供理论指导.
参考文献:
[1] VAN WOLFEREN M, ORELL A, ALBERS S V. Archaeal biofilm formation [J]. Nature Reviews Microbiology, 2018,16(11):699-713.
[2] FLEMMING H C, WINGENDER J. The biofilm matrix [J]. Nature Reviews Microbiology, 2010,8(9):623-633.
[3] FLEMMING H C, WINGENDER J, SZEWZYK U, et al. Biofilms: an emergent form of bacterial life [J]. Nature Reviews Microbiology, 2016,14(9):563-575.
[4] GARRETT T R, BHAKOO M, ZHANG Z. Bacterial adhesion and biofilms on surfaces [J]. Progress in Natural Science,2008,18(9):1049-1056.
[5] MAIER B, WONG G C L. How Bacteria use type Ⅳ pili machinery on surfaces [J]. Trends in Microbiology, 2015,23(12):775-788.
[6] MACFARLANE S, DILLON J F. Microbial biofilms in the human gastrointestinal tract [J]. Journal of Applied Microbiology, 2007,102(5):1187-1196.
[7] LEWIS K. Riddle of biofilm resistance [J]. Antimicrobial Agents and Chemotherapy, 2001,45(4):999-1007.
[8] COSTERTON J W, STEWART P S, GREENBERG E P. Bacterial biofilms: a common cause of persistent infections [J].Science, 1999,284(5418):1318-1322.
[9] WI Y M, PATEL R. Understanding biofilms and novel approaches to the diagnosis, prevention, and treatment of medical device-associated infections [J]. Infectious Disease Clinics of North America, 2018,32(4):915-929.
[10] CONVERY N, GADEGAARD N. 30 years of microfluidics [J]. Micro and Nano Engineering, 2019,2(7):76-91.
[11] DITTRICH P S, MANZ A. Lab-on-a-chip: microfluidics in drug discovery [J]. Nature Reviews Drug Discovery, 2006,5(3):210-218.
[12] VERTES A, HITCHINS V, PHILLIPS K S. Analytical challenges of microbial biofilms on medical devices [J]. Analytical Chemistry, 2012,84(9):3858-3866.
[13] BOWEN W H, BURNE R A, WU H, et al. Oral biofilms: pathogens, matrix, and polymicrobial interactions in microenvironments [J]. Trends in Microbiology, 2018,26(3):229-242.
[14] DRESCHER K, SHEN Y, BASSLER B L, et al. Biofilm streamers cause catastrophic disruption of flow with consequences for environmental and medical systems [J]. Proceedings of the National Academy of Sciences of the United States of America, 2013,110(11):4345-4350.
[15] WANG P, ROBERT L, PELLETIER J, et al. Robust growth of escherichia coli [J]. Current Biology, 2010,20(12):1099-1103.
[16] CAI L, FRIEDMAN N, XIE X S. Stochastic protein expression in individual cells at the single molecule level [J].Nature, 2006,440(7082):358-362.
[17] ZHANG R, XIA A, NI L, et al. Strong shear flow persister bacteria resist mechanical washings on the surfaces of various polymer materials [J]. Advanced Biosystems, 2017,1(12):1700161.
[18] XIA A, YANG S, ZHANG R, et al. Imaging the separation distance between the attached bacterial cells and the surface with a total internal reflection dark-field microscope [J]. Langmuir, 2019,35(26):8860-8866.
[19] KIM J, KIM H S, HAN S, et al. Hydrodynamic effects on bacterial biofilm development in a microfluidic environment [J].Lab on a Chip, 2013,13:1846-1849.
[20] KIM M K, INGREMEAU F, ZHAO A, et al. Local and global consequences of flow on bacterial quorum sensing [J].Nature Microbiology, 2016,1(1):15005.
[21] KIM K P, KIM Y G, CHOI C H, et al. In situ monitoring of antibiotic susceptibility of bacterial biofilms in a microfluidic device [J]. Lab on a Chip, 2010,10(23):3296-3299.
[22] SKOLIMOWSKI M, NIELSEN M W, EMN?US J, et al. Microfluidic dissolved oxygen gradient generator biochip as a useful tool in bacterial biofilm studies [J]. Lab on a Chip, 2010,10(16):2162-2169.
[23] HONG S H, HEGDE M, KIM J, et al. Synthetic quorum-sensing circuit to control consortial biofilm formation and dispersal in a microfluidic device [J]. Nature Communications, 2012,3(1):613.
[24] OLIVEIRA N M, FOSTER K R, DURHAM W M. Single-cell twitching chemotaxis in developing biofilms [J]. Proceedings of the National Academy of Sciences, 2016,113(23):6532-6537.
[25] BENOIT M R, CONANT C G, IONESCU-ZANETTI C, et al. New device for high-throughput viability screening of flow biofilms [J]. Applied and Environmental Microbiology, 2010,76(13):4136-4142.
[26] CONNELL J L, RITSCHDORFF E T, WHITELEY M, et al. 3D printing of microscopic bacterial communities [J]. Proceedings of the National Academy of Sciences of the United States of America, 2013,110(46):18380-18385.
[27] SONG J, ALI A, MA Y, et al. A graphene microelectrode array based microfluidic device for in situ continuous monitoring of biofilms [J]. Nanoscale Advances, 2023,5(18):4681-4686.
[28] PAULA A J, HWANG G, KOO H. Dynamics of bacterial population growth in biofilms resemble spatial and structural aspects of urbanization [J]. Nature Communications, 2020,11(1):1354.
[29] STRAUB H, EBERL L, ZINN M, et al. A microfluidic platform for in situ investigation of biofilm formation and its treatment under controlled conditions [J]. Journal of Nanobiotechnology, 2020,18(1):166.
(責任编辑:郁慧,顾浩然)

