响应面法优化三孢布拉氏霉菌发酵产番茄红素工艺
丁长河 樊俊敏 尹萌 李亚丽 魏书音 高军

摘要:番茄红素除了呈现鲜艳的颜色外,还具有比较强的抗氧化等功能性作用,因而广泛应用于食品、饮料等行业,与化学合成法相比,微生物发酵法生产的番茄红素因为安全性更易于被消费者接受,因此提高天然番茄红素产量意义重大。文章以三孢布拉氏霉菌为发酵菌种,通过响应面法对发酵培养基的组成及发酵条件进行优化,从而提高番茄红素的产量与纯度。经过单因素分析和响应面优化后的培养基组成及培养条件为玉米粉20 g/L、黄豆粉25 g/L、磷酸二氢钾0.6 g/L、硫酸镁0.9 g/L、玉米油12 g/L、发酵液初始pH 6.5、接种量6%、装液量40 mL/250 mL、正菌和负菌接种比例1∶15、培养温度26 ℃、转速180 r/min、振荡培养144 h,在42 h时加入0.4 g/L的2-氨基-6-甲基吡啶作为环化酶阻断剂,在此条件下番茄红素的产量为626.25 mg/L,比优化前提高了25.6%,该研究结果可为番茄红素工业化生产提供参考,有助于更好地应用于肉品、饮料、保健品等行业。
关键词:三孢布拉氏霉菌;番茄红素;发酵工艺;响应面法
中图分类号:TS201.3 文献标志码:A 文章编号:1000-9973(2024)02-0102-08
Optimization of Lycopene Produced by Fermentation of Blakeslea trispora by Response Surface Method
Abstract: Lycopene not only presents bright color, but also has strong antioxidation and other functional effects, making it widely used in food and beverage industries. Compared with chemical synthesis, lycopene produced by microbial fermentation is more easily accepted by consumers because of its safety, so it is of great significance to improve the yield of natural lycopene. In this paper, with Blakeslea trispora as the fermentation strain, the composition of the fermentation medium and the fermentation conditions are optimized by response surface methodology, so as to improve the yield and purity of lycopene. After single factor analysis and response surface optimization, the medium composition and culture conditions are as follows: corn flour is 20 g/L, soybean flour is 25 g/L, potassium dihydrogen phosphate is 0.6 g/L, magnesium sulfate is 0.9 g/L, corn oil is 12 g/L, initial pH of the fermentation broth is 6.5, inoculation amount is 6%, loading volume is 40 mL/250 mL, inoculation ratio of positive bacteria and negative bacteria is 1∶15, culture temperature is 26 ℃, rotational speed is 180 r/min, shaking culture for 144 h, and 0.4 g/L 2-amino-6-methylpyridine is added as a cyclase blocker at 42 h. Under such conditions, the yield of lycopene is 626.25 mg/L, which is 25.6% higher than that before optimization. The results of this study can provide references for the industrial production of lycopene, which is helpful for better application in meat, beverage and health care product industries.
Key words: Blakeslea trispora; lycopene; fermentation process; response surface method
番茄红素分子式为C40H56,相对分子质量为536.88,熔點为176 ℃,含有11个共轭键和2个非共轭键,是脂溶性类胡萝卜素[1]。番茄红素主要存在于番茄、西瓜、番石榴、木瓜、葡萄柚等红色果蔬中[2],是目前自然界中抗氧化能力极强的类胡萝卜素,其单重态氧猝灭率是β-胡萝卜素的2倍、α-生育酚的100倍[3]。一些报道表明,番茄红素在抗癌[4-6]、抗炎[7-8]、预防心血管疾病[9—11]方面发挥着重要作用。
番茄红素在肉制品、饮料、保健品等行业也有广泛应用。番茄红素通过添加乳化剂、抗氧化剂等辅料可以制成水溶性番茄红素乳液,改善番茄红素的色调,将其应用于肉制品中可以使生鲜肉的色泽鲜艳,同时能保鲜保湿,延长产品的货架期[12]。将番茄红素作为食品添加剂添加到腌肉制品中,不仅能很好地起到护色作用,而且能在一定程度上代替亚硝酸盐,减轻其对人体的伤害[13]。番茄红素的添加能够帮助降低大豆油的过氧化值,缓解油脂劣变[14]。李长滨等[15]对比了添加番茄红素前后饮料的酸价和过氧化值,发现添加番茄红素可有效降低饮料的酸价和过氧化值。
番茄红素在植物中的含量较低、提取过程复杂、提取成本高昂、提取率较低,并易受到地理、气候、时间和空间的限制,无法大规模生产使用。而采用微生物发酵的方法生产番茄红素不受季节控制、操作工艺简便、用时少、生产成本较低,并且因为发酵过程中不使用大量有毒有害化学品,使得生产出的番茄红素更加安全,消费者接受度高,对环境的危害更小[16]。目前生产番茄红素的菌株主要有红酵母[17]、三孢布拉氏霉菌、粗糙脉孢菌等,但红酵母产量比三孢布拉氏霉菌低[18],而粗糙脉孢菌产番茄红素优化后的产量仅为9.64 mg/L[19]。
三孢布拉氏霉菌是目前胡萝卜素工业化发酵生产的主要菌株,分为正菌和负菌,其中负菌是主要的色素生产菌[20],合成机理为正、负菌种混合培养后产生大量性激素类物质——三孢酸,进而转化合成终产物β-胡萝卜素,而番茄红素是中间产物,通常在发酵过程中加入番茄红素环化酶阻断剂使合成过程停止在番茄红素积累阶段[21]。该研究使用三孢布拉霉菌作为菌种,根据实验室前人的研究,以2-氨基-6-甲基吡啶作为环化酶阻断剂,添加量为0.4 g/L、添加时间为发酵42 h时,研究发酵培养基中成分和发酵条件对番茄红素产量和纯度的影响,并选择出对番茄红素产量影响最大的3个因素进行响应面优化,以期得到高产量的番茄红素。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
三孢布拉霉正菌(CCTCC AF 97006)、负菌(CCTCC AF 96002):购于中国典型培养物保藏中心;葵花籽油、玉米油:中粮福临门股份有限公司;大豆油、低芥酸菜籽油、芝麻香油、花生油:益海嘉里金龙鱼粮油食品股份有限公司;棕榈油:天津聚龙嘉华投资集团有限公司;玉米粉、黄豆:永辉超市。
1.1.2 主要试剂
石油醚、硫酸镁、磷酸二氢钾、甲醇、乙腈、二氯甲烷:天津科密欧化学试剂厂;2-氨基-6-甲基吡啶:上海麦克林生化科技有限公司。
1.1.3 培养基
活化培养基:PDA培养基,北京奥博星生物技术有限公司。
种子培养基:玉米粉44 g/L,黄豆粉19 g/L,KH2PO4 0.5 g/L,VB1 0.004 g/L,pH 6.5,121 ℃灭菌20 min。
发酵培养基:玉米粉20 g/L,黄豆粉45 g/L,大豆油16 g/L,KH2PO4 1.5 g/L,MgSO4 0.6 g/L,VB1 0.004 g/L,pH 6.5,121 ℃灭菌20 min。
1.2 仪器与设备
FA2004N电子天平 上海菁海仪器有限公司;LDZX-75KBS立式高压蒸汽灭菌器 上海申安医疗器械厂;MVS-1漩涡混合器 北京金北德工贸有限公司;SW-CJ-1F无菌操作台 苏州安泰空气技术有限公司;SHZ-2AGA數显气浴恒温振荡器 金坛华峰仪器有限公司;LRH-250生化培养箱 上海一恒科学仪器有限公司;ZKXF-2电热真空干燥箱 上海树立仪器仪表有限公司;EL20-K pH计 梅特勒-托利多仪器有限公司;90-2型定时恒温磁力搅拌器 上海沪西分析仪器厂;101型电热鼓风干燥箱 北京市永光明医疗仪器有限公司;1-14型离心机 Sigma-Aldrich公司;KQ-250超声波清洗器 昆山市超声仪器有限公司;UV-6000PC紫外可见分光光度计 上海元析仪器有限公司;Agilent 1260高效液相色谱仪 安捷伦科技有限公司。
1.3 实验方法
1.3.1 三孢布拉氏霉菌发酵工艺优化
菌种活化:将斜面保藏的菌种用划线的方式接种到新的培养基上,然后将其放入26 ℃的生化培养箱中培养5 d。
种子培养:在250 mL的锥形瓶中加入50 mL的种子培养基,并将其与生理盐水一起进行高压灭菌处理。将经过灭菌处理的种子培养基和生理盐水放置在无菌操作台上进行冷却。在无菌环境下,采用5 mL生理盐水进行反复抽吸和冲洗,将B. trispora正菌和负菌接种在斜面培养基上。随后,将正、负菌孢子悬浮液振荡混匀,并各取1 mL加入到种子培养基中,在26 ℃、180 r/min的振荡条件下培养48 h。
发酵培养:在250 mL锥形瓶中装入50 mL发酵培养基,高压灭菌后放置在无菌操作台上冷却。根据实验室前人的研究结果,将B. trispora正菌和负菌种子培养基以1∶5(体积比)进行混合,混合均匀,在26 ℃、180 r/min条件下,需振荡培养144 h,在42 h时加入0.4 g/L的2-氨基-6-甲基吡啶。
在发酵培养基的基础上,分别考察不同玉米粉添加量(10,20,30,40,50 g/L)、黄豆粉添加量(15,25,35,45,55 g/L)、磷酸二氢钾添加量(0.3,0.6,0.9,1.2,1.5 g/L)、硫酸镁添加量(0.3,0.6,0.9,1.2,1.5 g/L)、不同种类植物油及其添加量(4,8,12,16,20 g/L)、发酵液初始pH(5.0,5.5,6.0,6.5,7.0)、接种量(4%、6%、8%、10%、12%、14%)、装液量(30,40,50,60,70 mL/250 mL)、接种比例(1∶1、1∶5、1∶10、1∶15、1∶20)对番茄红素产量、纯度及发酵生物量的影响。采用单因素实验筛选出对番茄红素产量影响最大的3个因素。采用Box-Behnken设计三因素三水平响应面实验,响应面实验因素与水平见表1。
1.3.2 测定方法
参考文献[22]的方法提取番茄红素:称取10 mL发酵液,以3 500 r/min离心10 min,弃去上清液后用蒸馏水冲洗菌体沉淀物,洗涤3次,在同样条件下离心后弃去上清液。在45 ℃真空干燥箱中干燥至恒重。在黑暗环境下,称取一定量干燥后的菌体在研钵中加入石英砂快速研磨成粉,转移到棕色具塞锥形瓶中,加入20 mL石油醚,置于振荡器中,在室温下以180 r/min振荡提取1 h,从研磨至振荡过程需避光。
参考文献[23]的方法测定番茄红素产量:通过高效液相色谱法对番茄红素的含量进行定性定量分析,采用Agilent 1260高效液相色谱仪,色谱柱C18(250 mm×4.6 mm,5 μm);高效液相色谱条件:流动相A:5%超纯水;流动相B:12%甲醇;流动相C:60%乙腈;流动相D:23%二氯甲烷;流速1 mL/min;进样量10 μL;检测波长469 nm,柱温28 ℃。
参考文献[24]的方法测定番茄红素纯度:
式中:S1为番茄红素峰面积,mAU;S2为总色素峰面积,mAU。
参考文献[25]的方法测定菌体生物量:菌体在45 ℃真空干燥箱中干燥至恒重。
式中:w为菌体干重,g;v为发酵液体积,mL。
1.3.3 数据统计与分析
采用Origin 2018作图,采用SPSS 24.0软件中的LSD、Duncan进行显著性分析,采用Design Expert Box-Behnken法进行响应面实验设计。所有实验均重复3次,数据为平均值±标准差。
2 结果与分析
2.1 单因素实验结果与分析
2.1.1 玉米粉添加量对B. trispora番茄红素产量的影响
据报道,以B. trispora为菌种生产类胡萝卜素的培养基成分中,从碳源的选择来判断,玉米粉优于葡萄糖、蔗糖、乳糖等[9],故选择玉米粉作为碳源。选定黄豆粉添加量为45 g/L,大豆油添加量为16 g/L,KH2PO4 添加量为1.5 g/L,MgSO4添加量为0.6 g/L,VB1添加量为0.004 g/L,发酵液初始pH为6.5,装液量为50 mL/250 mL,接种比例为正菌∶负菌为1∶5(体积比),接种量为10%,考察不同玉米粉添加量对番茄红素产量的影响,结果见图1。
由图1可知,随着玉米粉添加量的逐渐增加,番茄红素产量呈现先增加后减少的趋势,当玉米粉添加量为20 g/L时,番茄红素产量达到最大值350.27 mg/L。随着玉米粉添加量的继续增加,番茄红素产量、生物量和纯度均下降,可能是因为玉米粉中含有大量淀粉和固形物颗粒,煮沸后淀粉糊化导致培养基黏稠度增加[26],溶氧不足不利于菌体生长,从而影响了番茄红素的合成。
2.1.2 黄豆粉添加量对B. trispora番茄红素产量的影响
大量研究发现,在B. trispora生产类胡萝卜素中选择有机氮源更有利于产量的提高[27],而黄豆是最常见易得的有机氮源,故以黄豆粉作为氮源。选定玉米粉添加量为20 g/L,大豆油添加量为16 g/L,KH2PO4添加量为1.5 g/L,MgSO4添加量为0.6 g/L,VB1添加量为0.004 g/L,发酵液初始pH为6.5,装液量为50 mL/250 mL,接种比例为正菌∶負菌为1∶5(体积比),接种量为10%,考察不同黄豆粉添加量对番茄红素产量的影响,结果见图2。
由图2可知,随着黄豆粉添加量的逐渐增加,番茄红素产量呈先增加后减少的趋势,当黄豆粉添加量为25 g/L时,番茄红素产量、纯度和菌体生物量均达到最大值,番茄红素产量达358.13 mg/L。有文献报道,当碳源添加量一定时,限制氮源可以提高类胡萝卜素在细胞内的积累[25],但随着黄豆粉添加量的继续增加,菌体生物量和番茄红素产量均呈下降趋势,可能是过量的黄豆粉导致溶氧不足从而影响菌体生长,使番茄红素产量下降。
2.1.3 KH2PO4添加量对B. trispora番茄红素产量的影响
磷酸二氢钾为微生物生长提供K和P两种营养元素,并且磷酸盐在发酵过程中对发酵液起到缓冲作用,选定玉米粉添加量为20 g/L,黄豆粉添加量为25 g/L,大豆油添加量为16 g/L,MgSO4添加量为0.6 g/L,VB1添加量为0.004 g/L,发酵液初始pH为6.5,装液量为50 mL/250 mL,接种比例为正菌∶负菌为1∶5(体积比),接种量为10%,考察不同磷酸二氢钾添加量对番茄红素产量的影响,结果见图3。
由图3可知,随着磷酸二氢钾添加量的逐渐增加,番茄红素产量呈现先增加后减少的趋势,当磷酸二氢钾添加量为0.6 g/L时,菌体生物量和番茄红素产量最高,番茄红素产量为301.75 mg/L。随着磷酸二氢钾添加量的继续增加,番茄红素产量和生物量逐渐下降,说明其添加量的增加使发酵液偏碱性[23],影响了三孢布拉氏霉菌的生长和代谢。
2.1.4 MgSO4添加量对B. trispora番茄红素产量的影响
镁元素不参与任何细胞结构物质的组成,但镁离子是许多酶的激活剂,能参与菌体的生长代谢[28],对番茄红素合成起着重要作用,故选定玉米粉添加量为20 g/L,黄豆粉添加量为25 g/L,大豆油添加量为16 g/L,KH2PO4 添加量为0.6 g/L,VB1添加量为0.004 g/L,发酵液初始pH为6.5,装液量为50 mL/250 mL,接种比例为正菌∶负菌为1∶5(体积比),接种量为10%,考察不同MgSO4添加量对番茄红素产量的影响,结果见图4。
由图4可知,随着硫酸镁添加量的逐渐增加,番茄红素产量总体上呈先增加后减少的趋势,当MgSO4添加量为0.9 g/L时,番茄红素产量最高,为269.82 mg/L。随着MgSO4添加量的继续增加,番茄红素产量缓慢下降,番茄红素的纯度和生物量变化不大。
2.1.5 不同植物油对B. trispora番茄红素产量的影响
在B. trispora的发酵过程中,外源性植物油被菌体分泌的胞外脂肪酶水解,水解产物为脂肪酸和甘油,脂肪酸通过氧化后成为乙酰辅酶A,乙酰辅酶A不仅可以进入三羧酸循环,为细胞生长代谢提供能量,而且可以作为番茄红素和脂质的共同前体物质[24]。细胞内脂质去饱和度的增加有利于番茄红素的溶解,添加外源性植物油,特别是亚油酸和亚麻酸含量较高的植物油,可以提高酰基甘油脂肪酸的去饱和度,从而增加番茄红素的溶解度,而且脂肪酸组成与真菌相似的油脂在改变细胞内脂肪酸组成和提高番茄红素产量方面更具优势[29-31]。选定玉米粉添加量为20 g/L,黄豆粉添加量为25 g/L,植物油添加量为16 g/L,KH2PO4添加量为0.6 g/L,MgSO4添加量为0.9 g/L,VB1添加量为0.004 g/L,发酵液初始pH为6.5,装液量为50 mL/250 mL,接种比例为正菌∶负菌为1∶5(体积比),接种量为10%,考察不同植物油种类对番茄红素产量的影响,结果见表2。
由表2可知, 添加大豆油、葵花籽油、玉米油时,菌体生物量、番茄红素产量和纯度高于其他植物油,可能是因为这3种植物油中亚油酸、亞麻酸和油酸含量较高。当添加玉米油时,番茄红素产量最高,所以选择玉米油作为外源性植物油,考察其添加量对番茄红素产量的影响,结果见图5。
由图5可知,随着玉米油添加量的逐渐增加,番茄红素产量逐渐增加,当玉米油添加量为12 g/L时,番茄红素产量达到最高,为361.50 mg/L,随着玉米油添加量的继续增加,番茄红素的产量逐渐下降,这可能是过量的植物油改变了细胞膜的通透性,使部分色素溶出[32]。
2.1.6 发酵液初始pH对B. trispora番茄红素产量的影响
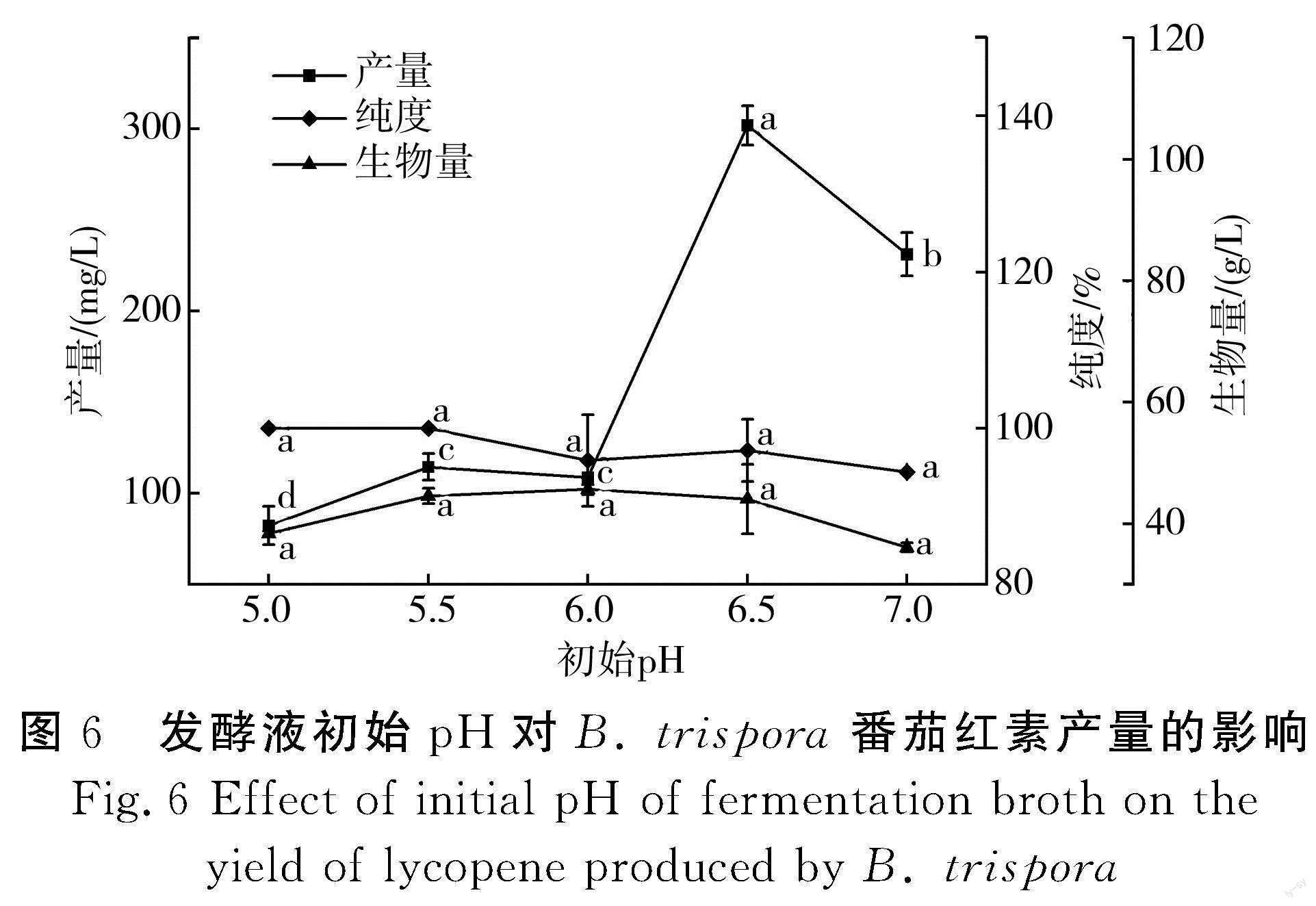
pH值对微生物生长和产物生成的影响是不可忽视的。pH值的变化会影响菌体内部酶活、细胞结构以及对培养基的利用速率[33],从而影响菌体的生长和产物的合成,故选定玉米粉添加量为20 g/L,黄豆粉添加量为25 g/L,玉米油添加量为12 g/L,KH2PO4添加量为0.6 g/L,MgSO4添加量为0.9 g/L,VB1添加量为0.004 g/L,装液量为50 mL/250 mL,接种比例为正菌∶负菌为1∶5(体积比),接种量为10%,考察不同发酵液初始pH对番茄红素产量的影响,结果见图6。
由图6可知,当发酵液初始pH为5.0~6.0时,番茄红素产量偏低,pH为6.5时,番茄红素产量最高,为301.98 mg/L,而菌体生物量也在发酵液初始pH为6.5时达到最大值,可能是pH值的变化影响了菌体生长,从而影响番茄红素的产量和纯度,所以要严格控制发酵液初始pH。
2.1.7 接种量对B. trispora番茄红素产量的影响
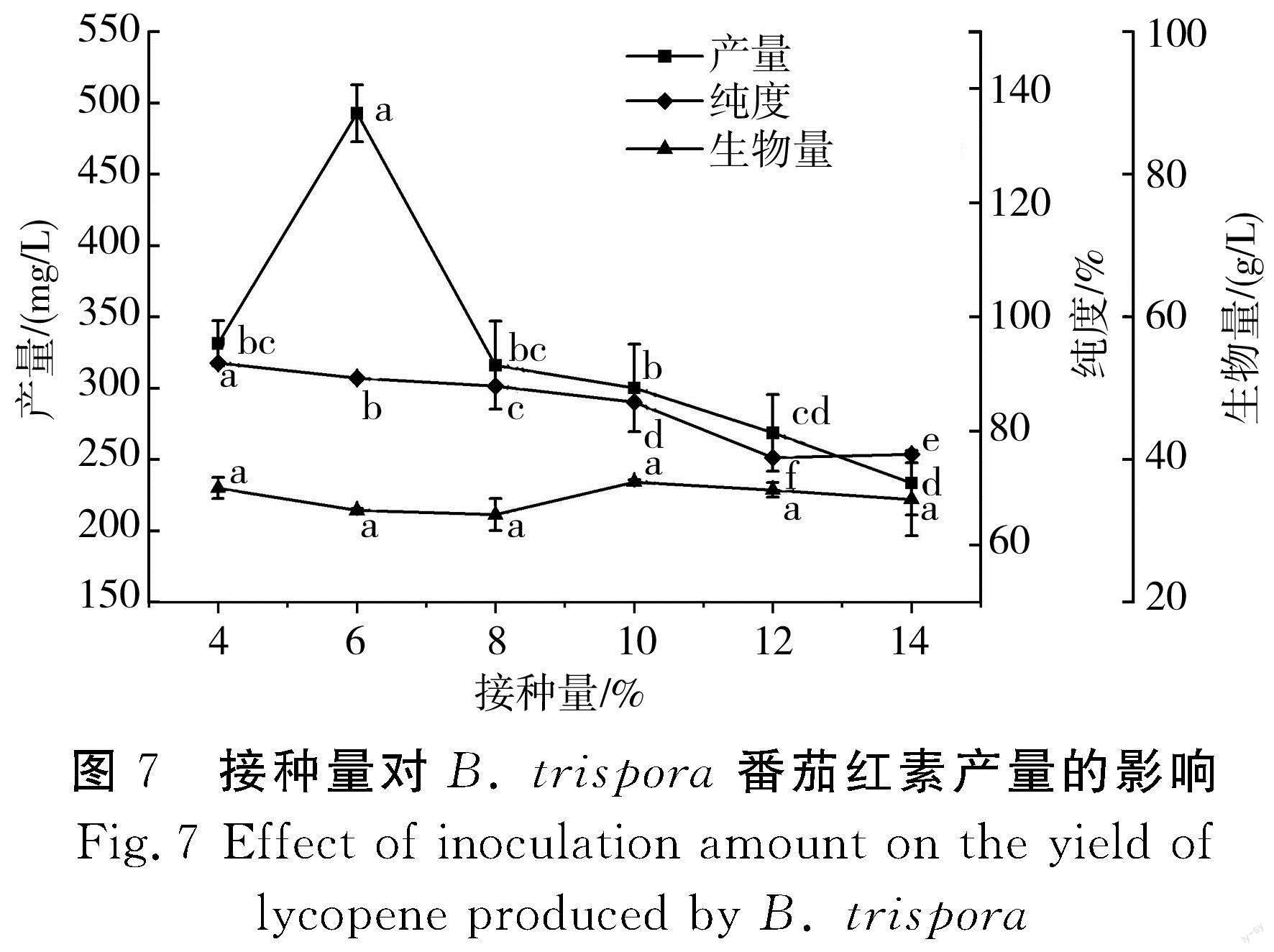
接种量的大小决定了生产菌种在发酵过程中生长繁殖的速度,较大的接种量可以缩短菌丝繁殖达到高峰的时间,提前合成产物,并可减少杂菌的生长,故选定玉米粉添加量为20 g/L,黄豆粉添加量为25 g/L,玉米油添加量为12 g/L,KH2PO4添加量为0.6 g/L,MgSO4添加量为0.9 g/L,VB1添加量为0.004 g/L,装液量为50 mL/250 mL,接种比例为正菌∶负菌为1∶5(体积比),发酵液初始pH为6.5,考察不同接种量对番茄红素产量的影响,结果见图7。
由图7可知,随着接种量的增加,番茄红素产量呈先增加后减少的趋势,当接种量为6%时,番茄红素产量最高,为492.85 mg/L。当接种量超过6%时,番茄红素产量和纯度持续下降,而生物量增加,说明接种量过大使锥形瓶中菌丝生长过快、数量过多,导致发酵液的黏度增大,影响发酵基质的传氧速率,从而造成溶氧不足,影响番茄红素的合成[34]。
2.1.8 装液量对B. trispora番茄红素产量的影响
B. trispora是高度嗜氧菌,在发酵过程中对溶氧的要求很高。故选定玉米粉添加量为20 g/L,黄豆粉添加量为25 g/L,玉米油添加量为12 g/L,KH2PO4添加量为0.6 g/L,MgSO4添加量为0.9 g/L,VB1添加量为0.004 g/L,接种量为6%,接种比例为正菌∶负菌为1∶5(体积比),发酵液初始pH为6.5,考察不同装液量对番茄红素产量的影响,结果见图8。
由图8可知,随着装液量逐渐增加,番茄红素产量呈先增加后减少的趋势,当装液量为40 mL/250 mL时,番茄红素产量最高,达424.58 mg/L,装液量继续增加,番茄红素产量和生物量呈下降趋势,说明发酵培养基在一定转速下,装液量过多会造成发酵液溶氧不足,进而影响菌体生长和番茄红素的合成。
2.1.9 接种比例对B. trispora番茄红素产量的影响
类胡萝卜素在三孢布拉氏霉菌正、负菌最适接种比例下才能大量积累,因此以何种比例将正、负菌接入到发酵培养基中是关乎类胡萝卜素产量的又一关键控制点[19],故选定玉米粉添加量为20 g/L,黄豆粉添加量为25 g/L,玉米油添加量为12 g/L,KH2PO4添加量为0.6 g/L,MgSO4添加量为0.9 g/L,VB1添加量为0.004 g/L,接种量为6%,装液量为40 mL/250 mL,发酵液初始pH为6.5,考察不同正、负菌接种比例对番茄红素产量的影响,结果见图9。
由图9可知,随着负菌接种比例的增加,番茄红素产量逐渐增加,当正菌∶负菌为1∶15时,番茄红素产量最高,为397.75 mg/L,负菌比例继续增加,番茄红素产量下降。这是因为B. trispora正菌主要诱导产生三孢酸刺激负菌色素的合成,负菌是类胡萝卜素的主要生产者[33]。在发酵生产类胡萝卜素时,为了提高负菌比例使其在混合培养中成为优势菌株,负菌数量通常高于正菌。当正、负菌接种比例大于1∶15时,番茄红素产量下降,这可能是负菌比例过大导致正菌数量逐渐减少[34]。
2.2 响应面法优化发酵条件
在单因素实验的基础上,根据番茄红素产量选择接种量(A)、装液量(B)、接种比例(C)进行响应面实验优化。响应面实验设计及结果见表3。
对实验数据进行分析,得到二次多项回归方程:R1=567.15-99.86A-32.87B-13.52C-51.01AB-3.50AC-20.30BC-60.24A2-146.15B2-173.48C2。此模型可用来预测B. trispora发酵生产番茄红素的最大产量。
2.2.1 番茄红素产量响应面实验结果及方差分析
由表4可知,模型的F值为67.41且其P值小于0.000 1,表明此模型极显著。失拟项的P值为0.321 2,表示失拟项相对于纯误差不显著。决定系数R2为0.988 6,表明该模型与实验值拟合较好,有98.86%的变化可以由该模型解释,调整后R2为0.973 9,说明该模型不能解释2.61%的响应值变化。较低的C.V.(6.24%)表示该模型的实验数据具有高度可靠性。由表4可知,A、B、AB、A2、B2、C2对番茄红素产量有极显著影响(P<0.01)。
接种量、装液量和接种比例的交互作用对番茄红素产量的影响见图10~图12。
由图10可知,A(接种量)与B(装液量)之间有极显著的交互作用,而接种量与接种比例、装液量与接种比例之间的交互作用对番茄红素的产量影响较小。
2.2.2 响应面最优条件的确定与验证
响应面回归方程模型预测最佳发酵条件为接种量4.31%、装液量40.36 mL/250 mL、正、负菌接种比例1∶14.84,在此条件下番茄红素的理论产量为608.885 mg/L。根据上述分析并结合实际实验操作条件,将发酵条件改为接种量4.3%、装液量40.4 mL/250 mL、正、负菌接种比例1∶14.8。在此发酵条件下进行验证实验,番茄红素的产量为626.25 mg/L,与理论值接近,结果较理想。
3 结论
经过单因素实验和响应面分析优化,确定B.trispora生产番茄红素的最佳条件为玉米粉20 g/L、黄豆粉25 g/L、磷酸二氢钾0.6 g/L、硫酸镁0.9 g/L、玉米油12 g/L、发酵液初始pH 6.5、接种量6%、裝液量40 mL/250 mL、正、负菌接种比例1∶15。接种量和装液量之间有极显著交互作用;接种量对番茄红素产量的影响最显著,其次是装液量,接种比例不显著。最佳发酵条件为接种量4.31%、装液量40.36 mL/250 mL、正、负菌接种比例1∶14.84,在此条件下,验证实验得到番茄红素的产量为626.25 mg/L,比未优化时番茄红素产量提高了25.6%,说明此回归模型可靠,优化效果良好,能为番茄红素的工业化生产提供参数借鉴,从而更好地应用于肉制品、饮料、保健食品等行业中。
参考文献:
[1]CHOUDHARI S M, ANANTHANARAYAN L, SINGHAL R S. Purification of lycopene by reverse phase chromatography[J].Food and Bioprocess Technology,2008,2(4):391-399.
[2]PRIYADARSANI S, KAR A, PATEL A S, et al. Process optimization for the supercritical carbon dioxide extraction of lycopene from ripe grapefruit (Citrus paradisi) endocarp[J].Scientific Reports,2021,11(1):236.
[3]MASCIO P D, KAISER S, SIES H. Lycopene as the most efficient biological carotenoid singlet oxygen quencher[J]. Archives of Biochemistry and Biophysics,1989,274(2):532-538.
[4]HAN H, LIM J W, KIM H.Lycopene inhibits activation of epidermal growth factor receptor and expression of cyclooxygenase-2 in gastric cancer cells[J].Nutrients,2019,11(9):132-156.
[5]NIVISON M, VANDERWILDE A, BALIJEPALLI P, et al. Effects of lycopene on growth factor response in prostate cancer cells[J].The FASEB Journal,2020,34(1):289-307.
[6]AKTEPE O H, SAHIN T K, GUNER G, et al. Lycopene sensitizes the cervical cancer cells to cisplatin via targeting nuclear factor-kappa b (nf-κb) pathway[J].Turkish Journal of Medical Sciences,2021,51(1):368-374.
[7]EL-ASHMAWY N E, KHEDR N F, EL-BAHRAWY H A, et al. Suppression of inducible nitric oxide synthase and tumor necrosis factor-alpha level by lycopene is comparable to methylprednisolone in acute pancreatitis[J].Digestive and Liver Disease,2018,50(6):601-607.
[8]MOIA V M, PORTILHO F L, PADUA T A, et al. Lycopene used as anti-inflammatory nanodrug for the treatment of rheumathoid arthritis: animal assay, pharmacokinetics, ABC transporter and tissue deposition[J].Colloids and Surfaces B: Biointerfaces,2020,188:110814.
[9]LI X N, LIN J, XIA J, et al.Lycopene mitigates atrazine-induced cardiac inflammation via blocking the nf-κb pathway and no production[J].Journal of Functional Foods,2017,29:208-216.
[10]PETYAEV I M, DOVGALEVSKY P Y, KLOCHKOV V A, et al. Effect of lycopene supplementation on cardiovascular parameters and markers of inflammation and oxidation in patients with coronary vascular disease[J].Food Science & Nutrition,2018,6(6):1770-1777.
[11]CHIVA-BLANCH G, JIMNEZ C, PINYOL M, et al. 5-cis-, trans-and total lycopene plasma concentrations inversely relate to atherosclerotic plaque burden in newly diagnosed type 2 diabetes subjects[J].Nutrients,2020,12(6):1696.
[12]贾新超,焦丽娟,田洪,等.番茄红素乳液稳定性研究[J].中国调味品,2019,44(3):161-164.
[13]黄明亮,孙颖,王雪莹,等.番茄红素的提取工艺及在食品中的应用[J].中国调味品,2012,37(6):106-110.
[14]周丹红,史铁钧,曹金燕,等.番茄红素的提取及其在大豆油中稳定性、抗氧化性的研究[J].中国油脂,2007(1):65-67.
[15]李长滨,王钊.胡萝卜中番茄红素的提取、测定和应用研究[J].中国调味品,2021,46(12):172-175.
[16]刘蕊.番茄红素高产菌株选育及发酵優化研究[D].济南:山东大学,2013.
[17]陈瑶.番茄红素生产工艺研究进展[J].化工设计通讯,2016,42(12):58,62.
[18]王岁楼,张平之.利用红酵母发酵生产β-胡萝卜素的研究进展[J].微生物学杂志,2000(2):41-43.
[19]郭月山,陈钢,王瑞琪,等.大豆蛋白胨对粗糙脉孢菌3.1607产番茄红素的影响及其发酵条件优化[J].中国酿造,2020,39(9):126-130.
[20]TORRES F A E, ZACCARIM B R, NOVAES L C L, et al. Natural colorants from filamentous fungi[J].Applied Microbiology and Biotechnology,2016,100(6):2511-2521.
[21]SEVGILI A, ERKMEN O. Improved lycopene production from different substrates by mated fermentation of Blakeslea trispora[J].Foods,2019,8(4):120.
[22]丁长河,白璐佳,尹萌.环化酶阻断剂对三孢布拉氏霉菌发酵生产番茄红素的影响[J].河南工业大学学报(自然科学版),2023,44(4):67-73,83.
[23]尹萌.三孢布拉氏霉菌发酵生产番茄红素的工艺优化及应用[D].郑州:河南工业大学,2021.
[24]PAPAIOANNOU E H, LIAKOPOULOU-KYRIAKIDES M. Substrate contribution on carotenoids production in Blakeslea trispora cultivations[J].Food and Bioproducts Processing,2010,88(2):305-311.
[25]SHARIATI S, ZARE D, MIRDAMADI S. Screening of carbon and nitrogen sources using mixture analysis designs for carotenoid production by Blakeslea trispora[J].Food Science and Biotechnology,2019,28(2):469-479.
[26]张丽霞,杨帆,娄恺,等.硫酸镁对枯草芽胞杆菌发酵的影响[J].微生物学杂志,2020,40(6):53-58.
[27]王强,余晓斌.三孢布拉霉发酵产番茄红素的研究进展[J].微生物学通报,2015,42(2):420-426.
[28]FENG L R, WANG Q, YU X B ,et al. Effects of exogenous lipids and cold acclimation on lycopene production and fatty acid composition in Blakeslea trispora[J].AMB Express,2019,9(1):1-9.
[29]VERESCHAGINA O A, MEMORSKAYA A S, TERESHINA V M.The role of exogenous lipids in lycopene synthesis in the mucoraceous fungus Blakeslea trispora[J].Microbiology,2010,79(5):605-613.
[30]闫兴,向梦雄,王常高,等.代谢调节剂对三孢布拉氏霉菌发酵的影响[J].湖北工业大学学报,2016,31(1):85-88.
[31]戴德慧,胡伟莲,吕圭源,等.生物合成法生产β-胡萝卜素发酵条件研究[J].食品科学,2008,339(2):247-251.
[32]熊力.三孢布拉霉发酵生产番茄红素的代谢调控研究[D].武汉:华中科技大学,2012.
[33]王见冬,袁其朋,钱忠明.β-胡萝卜素发酵过程中关键的代谢产物——三孢酸[J].微生物学通报,2004(3):147-150.
[34]LI M J, XIA Q Q, ZHANG H B, et al. Metabolic engineering of different microbial hosts for lycopene production[J].Journal of Agricultural and Food Chemistry,2020,68(48):14104-14122.

